Относительная плотность по… задачи
24-Фев-2013 | комментариев 26 | Лолита Окольнова
В ЕГЭ иногда встречаются задачи (часть С последнее задание), где в условии дана относительная плотность вещества по… водороду, кислороду, воздуху, азоту и т.д.
Например:

Относительная плотность вещества – отношение плотности вещества Б к плотности вещества А
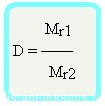
Относительная плотность — величина безразмерная
Формула достаточно простая, и из нее вытекает другая формула —
Формула молярной массы вещества
Mr1 = D•Mr2
- Если дана относительная плотность паров по водороду, то Mr (вещества)=Mr(H2)•D=2 гмоль • D;
- если дана относительная плотность по воздуху, то Mr (вещества)=Mr(воздуха)•D=29 гмоль • D (обратите внимание, Mr(воздуха) принята равной 29 гмоль);
и т.д.
В условии задачи может быть полная формулировка — «относительная плотность (паров)…», а может быть просто «плотность вещества по…»
Давайте решим нашу задачу:

Дана плотность паров вещества по воздуху, значит, нам подходит формула молярной массы вещества —
Mr (вещества)=Mr(воздуха)•D=29 гмоль • D
Mr(вещества)=29 гмоль • 1.448 = 42 гмоль
Нам дан углеводород — СхHy, значит, мы можем найти Mr(Cx и Mr(Hy). Обратите внимание, именно молярные массы, т.к.у нас несколько атомов углерода и водорода.
Для этого надо молярную массу вещества умножить на процентное содержание элемента:
Mr(Cx)=Mr(вещества)•ω
Mr(Cx)= 42 гмоль · 0.8571=36 гмоль
x=Mr(Cx)Ar(C)=36 гмоль ÷ 12 гмоль =3.
Точно так же находим все данные для водорода:
Mr(Hy)=Mr(вещества)•ω
Mr(Hy)= 42 гмоль · 0.1429=6 гмоль
x=Mr(Hy)Ar(H)=6 гмоль ÷ 1 гмоль =6.
Искомое вещество — C3H6 — пропен.
Еще раз повторим определение —
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа.

Дана относительная плотность по аргону.
Mr (вещества)=Ar(Ar)•D
Mr (CxHy)=40 гмоль ·1.05=42 гмоль
Запишем уравнение горения:
СхHy + O2 = xCO2 + y2H2O
Найдем количество углекислого газа и воды:
n(CO2)=V22,4 лмоль = 33.622.4=1.5
n(H2O)=mMr=2718=1.5
Соотношение х : y2 как 1.5 : 1.5, т.е. y=2x, что соответствует общей формуле алкенов: CnH2n
Выражаем в общем виде молярную массу: Mr=Mr(C) + Mr(H)
12n +2n=42
n=3
Наше вещество — C3H6 — пропен
- pадание ЕГЭ по этой теме — задачи С5
Обсуждение: “Относительная плотность по… задачи”
(Правила комментирования)
При сгорании 3,78 г органического вещества, в молекуле которого содержится один третичный атом углерода, получили 6,05 л (н. у.) углекислого газа и 4,86 г воды. Относительная плотность паров этого вещества по аргону равна 2,1. Известно, что это вещество не взаимодействует с водой, но реагирует с бромом на свету.
На основании данных условия задания:
1) произведите вычисления, необходимые для установления молекулярной формулы органического вещества и запишите молекулярную формулу исходного органического вещества;
2) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
3) напишите уравнение взаимодействия данного вещества с бромом.
Данную задачу проверяют не автоматически, а вручную.
Ознакомьтесь с критериями оценки, правильным решением и сами себе поставьте оценку от 0 до 3 баллов.
Даже если вы ошиблись в цифровом ответе, можно получить несколько баллов за правильный ход решения.
Форма для оценки находится внизу страницы.
Критерии оценки вопроса
| Содержание верного ответа и указания по оцениванию (допускаются иные формулировки ответа, не искажающие его смысла) |
Баллы |
|---|---|
| Ответ правильный и полный, содержит следующие элементы: 1) правильно произведены вычисления, необходимые для установления молекулярной формулы вещества, и записана молекулярная формула вещества; 2) записана структурная формула органического вещества, которая отражает порядок связи и взаимное расположение заместителей и функциональных групп в молекуле в соответствии с условием задания; 3) с использованием структурной формулы органического вещества записано уравнение реакции, на которую даётся указание в условии задания |
3 |
| Правильно записаны два элемента ответа | 2 |
| Правильно записан один элемент ответа | 1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Подробное решение
1. Формула вещества и реакция горения:
CXxHXyOXz+n OX2→x COX2+12y HX2O{ce{C_xH_yO_z + nO2 -> xCO2 + 1/2yH2O} }
Исходя из условий задачи, найдем соотношение числа атомов углерода и водорода (возможно, и кислорода) в сгоревшем веществе:
n(CO2)=6,0522,4=0,27 мольdisplaystyle {n(CO_2) =frac {6,05} {22,4} = 0,27 моль}
Следовательно, количество моль углерода так же равно 0,27 моль: n(C) = 0,27 моль
n(H2O)=4,8618=0.27 мольdisplaystyle {n(H_2O) =frac {4,86} {18} = 0.27 моль}
В молекуле воды два атома водорода, по реакции из 1 моль органического вещества получается 0,5 моль воды. Значит в самом веществе количество водорода в 2 раза больше чем количество полученной воды. Умножаем число молей воды на 2.
n(H) = 0,27 моль * 2 = 0,54 моль
Теперь, когда мы знаем количество моль водорода и углерода, можем найти их массы, которые понадобятся нам при дальнейшем расчете:
m(C) = 0,27 * 12 = 3,24 грамм, где Mr(C) = 12 грамм/моль
m(H) = 0,54 * 1 = 0,54 грамм, где Mr(H) = 1 грамм/моль
Сложим массы веществ, чтобы понять, есть ли кислород:
m(вещества) = m(C) + m(H) = 3,24 + 0,54 = 3,78 грамм
Исходя из этого, видим, что сумма масс углерода и водорода равна массе исходного вещества, данной в условии. Значит, кислород отсутствует.
Теперь нужно найти соотношение углерода и кислорода, и, соответственно, коэффициенты реакции:
n(C) : n(H) = 0,27 : 0,54 = 1 : 2
Простейшая формула – CH2
Молярную массу вещества найдём исходя из плотности паров этого вещества по аргону:
M(вещества) = 40 * 2,1 = 84 грамм/моль ,где Mr(Ar) = 40 грамм/моль
M(CH2) = 12 + 2 = 14 грамм/моль
Чтобы получить молярную массу 84 грамм/моль, нужно 14 * 6, значит формула нашего вещества приобретает вид: C6H12 (так как соотношение углерода и водорода стало равным 6 : 12)
Вещество с такой формулой может относиться к классу алкенов или циклоалканов, потому что их общая формула CnH2n.
В условии нам дана подсказка: вещество не взаимодействует с водой, но реагирует с бромом на свету. Мы знаем, что алкены реагируют с водой (это реакция присоединения), образуя одноатомные предельные спирты. Так как это условие не выполняется, однозначно выбираем циклоалканы.
Уравнение реакции:
CX6HX12+9 OX2=6 COX2+6 HX2Oce{C6H12 + 9O2 = 6CO2 + 6H2O}
2. Далее, в условии есть еще одна подсказка: содержит один третичный атом углерода. Третичный атом углерода, это атом углерода который связан с тремя другими атомами углерода. Это позволяет отказаться от циклогексана (так как в его структуре все атомы углерода вторичные), и выбрать циклопентан с метильным заместителем у атома углерода:
C
H
3
3. Уравнение реакции бромирования:
C
H
3
+
Br
2
hv
C
H
3
Br
+
H
Br
Обязательным условием реакции является свет.
Оцените своё решение
0
1
2
3
1. Формула вещества и реакция горения:
CXxHXyOXz+n OX2→x COX2+12y HX2O{ce{C_xH_yO_z + nO2 -> xCO2 + 1/2yH2O} }
Исходя из условий задачи, найдем соотношение числа атомов углерода и водорода (возможно, и кислорода) в сгоревшем веществе:
n(CO2)=6,0522,4=0,27 мольdisplaystyle {n(CO_2) =frac {6,05} {22,4} = 0,27 моль}
Следовательно, количество моль углерода так же равно 0,27 моль: n(C) = 0,27 моль
n(H2O)=4,8618=0.27 мольdisplaystyle {n(H_2O) =frac {4,86} {18} = 0.27 моль}
В молекуле воды два атома водорода, по реакции из 1 моль органического вещества получается 0,5 моль воды. Значит в самом веществе количество водорода в 2 раза больше чем количество полученной воды. Умножаем число молей воды на 2.
n(H) = 0,27 моль * 2 = 0,54 моль
Теперь, когда мы знаем количество моль водорода и углерода, можем найти их массы, которые понадобятся нам при дальнейшем расчете:
m(C) = 0,27 * 12 = 3,24 грамм, где Mr(C) = 12 грамм/моль
m(H) = 0,54 * 1 = 0,54 грамм, где Mr(H) = 1 грамм/моль
Сложим массы веществ, чтобы понять, есть ли кислород:
m(вещества) = m(C) + m(H) = 3,24 + 0,54 = 3,78 грамм
Исходя из этого, видим, что сумма масс углерода и водорода равна массе исходного вещества, данной в условии. Значит, кислород отсутствует.
Теперь нужно найти соотношение углерода и кислорода, и, соответственно, коэффициенты реакции:
n(C) : n(H) = 0,27 : 0,54 = 1 : 2
Простейшая формула – CH2
Молярную массу вещества найдём исходя из плотности паров этого вещества по аргону:
M(вещества) = 40 * 2,1 = 84 грамм/моль ,где Mr(Ar) = 40 грамм/моль
M(CH2) = 12 + 2 = 14 грамм/моль
Чтобы получить молярную массу 84 грамм/моль, нужно 14 * 6, значит формула нашего вещества приобретает вид: C6H12 (так как соотношение углерода и водорода стало равным 6 : 12)
Вещество с такой формулой может относиться к классу алкенов или циклоалканов, потому что их общая формула CnH2n.
В условии нам дана подсказка: вещество не взаимодействует с водой, но реагирует с бромом на свету. Мы знаем, что алкены реагируют с водой (это реакция присоединения), образуя одноатомные предельные спирты. Так как это условие не выполняется, однозначно выбираем циклоалканы.
Уравнение реакции:
CX6HX12+9 OX2=6 COX2+6 HX2Oce{C6H12 + 9O2 = 6CO2 + 6H2O}
2. Далее, в условии есть еще одна подсказка: содержит один третичный атом углерода. Третичный атом углерода, это атом углерода который связан с тремя другими атомами углерода. Это позволяет отказаться от циклогексана (так как в его структуре все атомы углерода вторичные), и выбрать циклопентан с метильным заместителем у атома углерода:
C
H
3
3. Уравнение реакции бромирования:
C
H
3
+
Br
2
hv
C
H
3
Br
+
H
Br
Обязательным условием реакции является свет.
Простейшие расчетные задачи в органической химии.
Задание №1
Определите плотность метана по водороду. В поле ответа введите число. Ответ округлите до целых.
Решение
Ответ: 8
Задание №2
Определите плотность пропена по гелию. В поле ответа введите число. Ответ округлите до десятых.
Решение
Ответ: 10,5
Задание №3
Определите плотность пропина по фтороводороду. В поле ответа введите число. Ответ округлите до целых.
Решение
Ответ: 2
Задание №4
Определите плотность паров бензола по аргону. В поле ответа введите число. Ответ округлите до сотых.
Решение
Ответ: 1,95
Задание №5
Определите плотность паров 1,2-дибромэтана по кислороду. В поле ответа введите число. Ответ округлите до сотых.
Решение
Ответ: 5,88
Задание №6
Определите плотность паров этанола по воздуху. В поле ответа введите число. Ответ округлите до сотых.
Решение
Ответ: 1,59
Задание №7
Определите плотность диметилового эфира по угарному газу. В поле ответа введите число. Ответ округлите до сотых.
Решение
Ответ: 1,64
Задание №8
Определите плотность паров этаналя по водороду. В поле ответа введите число. Ответ округлите до целых.
Решение
Ответ: 22
Задание №9
Определите плотность паров метановой кислоты по воздуху. В поле ответа введите число. Ответ округлите до сотых.
Решение
Ответ: 1,59
Задание №10
Определите плотность паров диизопропиламина по гелию. В поле ответа введите число. Ответ округлите до сотых.
Решение
Ответ: 25,25
[adsp-pro-3]
Задание №11
Плотность паров неизвестного соединения по воздуху равна 2. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 58
Задание №12
Плотность паров неизвестного соединения по водороду равна 22. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 44
Задание №13
Плотность паров неизвестного соединения по гелию равна 19,5. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 78
Задание №14
Плотность паров неизвестного соединения по хлору равна 1,183. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 84
Задание №15
Плотность паров неизвестного соединения по воздуху равна 1,517. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 44
Задание №16
Плотность паров неизвестного соединения по водороду равна 29. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 58
Задание №17
Плотность паров неизвестного соединения по гелию равна 16,125. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Решение
Ответ: 64,5
Задание №18
Плотность паров неизвестного соединения по азоту равна 2,107. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 59
Задание №19
Плотность паров неизвестного соединения по аргону равна 1,8. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 72
Задание №20
Плотность паров неизвестного соединения по воздуху равна 2,897. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 84
[adsp-pro-3]
Задание №21
Плотность неизвестного соединения при нормальных условиях равна 1,25 г/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 28
Задание №22
Плотность неизвестного соединения при нормальных условиях равна 1,875 г/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 42
Задание №23
Плотность неизвестного соединения при нормальных условиях равна 714 мг/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 16
Задание №24
Плотность неизвестного соединения при нормальных условиях равна 1,339 г/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 30
Задание №25
Плотность паров неизвестного соединения при нормальных условиях равна 2,589 г/л. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 58
Задание №26
Массовая доля углерода в неизвестном углеводороде равна 80%. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 30
Задание №27
Массовая доля водорода в неизвестном углеводороде равна 16,67 %. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 72
Задание №28
Массовая доля углерода в неизвестном углеводороде равна 90 %. Определите его молярную массу, считая простейшую формулу эмпирической. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 40
Задание №29
Массовые доли углерода и азота в неизвестном амине равны 53,33 % и 31,11 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 45
Задание №30
Массовые доли углерода и хлора в неизвестном галогеналкане равны 17,98 % и 79,78 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Решение
Ответ: 133,5
[adsp-pro-3]
Задание №31
Массовые доли углерода и кислорода в неизвестном спирте равны 52,17 % и 34,78 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 46
Задание №32
Массовые доли углерода и брома в неизвестном галогеналкане равны 12,63 % и 84,21 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 95
Задание №33
Массовые доли углерода и азота в неизвестном мононитроалкане равны 40,45 % и 15,73 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 89
Задание №34
Массовые доли углерода и кислорода в неизвестном кетоне равны 62,07 % и 27,59 % соответственно. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 58
Задание №35
Массовая доля углерода в неизвестном углеводороде равна 82,76 %. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 58
Задание №36
При сгорании органического вещества, не содержащего кислород, образовалось 22 г углекислого газа и 18 г воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 16
Задание №37
При сгорании органического вещества, не содержащего кислород, образовалось 6,72 л углекислого газа и 7,2 г воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 44
Задание №38
При сгорании органического вещества, не содержащего кислород, образовалось 11 г углекислого газа и 6,72 л паров воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 72
Задание №39
При сгорании органического вещества, не содержащего кислород, образовалось 4,4 г углекислого газа и 2,057 г воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 100
Задание №40
При сгорании органического вещества, не содержащего кислород, образовалось 22,4 л углекислого газа и 20 г воды. Определите его молярную массу. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 128
[adsp-pro-3]
Задание №41
При взаимодействии навески вещества состава С3Н6 массой 4,2 г с бромом образовалось 19,8 г продукта реакции состава C3H6Br2. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 98
Задание №42
При взаимодействии навески вещества состава С4Н10 массой 2,9 г с хлором образовалось 4,0 г продукта реакции состава C4H9Сl. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Решение
Ответ: 86,5
Задание №43
При взаимодействии навески вещества состава С3Н4 массой 8,0 г с водой образовалось 10,0 г продукта реакции состава C3H6О. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Решение
Ответ: 86,2
Задание №44
При нагревании навески вещества состава С2Н2 массой 2,6 г с активированным углем образовалось 2,1 г продукта реакции состава C6H6. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Решение
Ответ: 80,8
Задание №45
При окислении навески вещества состава С6Н10 массой 8,2 г водным раствором перманганата калия образовалось 10,6 г продукта реакции состава C6H12О2. Определите выход продукта реакции в процентах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Решение
Ответ: 91,4
Задание №46
При взаимодействии навески вещества состава С2Н6 массой 3,0 г с бромом образовался продукт реакции состава C2Н5Br с выходом 85%. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до сотых.
Решение
Ответ: 9,27
Задание №47
При взаимодействии навески вещества состава С4Н8 массой 5,6 г с хлороводороом образовался продукт реакции состава C4Н9Cl с выходом 80 %. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до десятых.
Решение
Ответ: 7,4
Задание №48
При взаимодействии навески вещества состава С4Н8О массой 3,6 г с водородом образовался продукт реакции состава C4Н10О с выходом 96 %. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до сотых.
Решение
Ответ: 3,55
Задание №49
При взаимодействии навески вещества состава С2Н7N массой 9,0 г с азотистой кислотой образовался продукт реакции состава C2Н6О с выходом 75 %. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до сотых.
Решение
Ответ: 6,9
Задание №50
При взаимодействии навески вещества состава С3Н4О2 массой 3,6 г с бромом образовался продукт реакции состава C3Н4Br2О2 с выходом 95%. Определите массу продукта реакции в граммах. В поле ответа введите число без единиц измерения. Ответ округлите до целых.
Решение
Ответ: 11
[adsp-pro-10]
1) на 3 атома O приходится 2 атома C (смесь CO и CO2);Ответ: 0,9
Пусть общее количество газов = 1 моль, тогда количество СO — x моль, а СO2 —
(1-х)моль.
Подсчитаем общее количество атомов nС= (x + (1-x)) и атомов nО = (x + 2(1-x)).
Запишем соотношение количеств атомов согласно условию nС/ nО=2/3;
(x + (1-x))/ (x + 2(1-x))=2/3.
1/(2-x)=2/3. Воспользовавшись правилом пропорции, получим: 4-2x=3;2x=1; х=0,5моль СО, тогда и 0,5 моль СО2 .
Найдем среднюю молярную массу смеси Mсм=ϕ(CO)*M(CO)+ ϕ(CO2)*M(CO2)= 0,5*28+0,5*44=36 г/моль
Найдем относительную плотность по аргону смеси D(Ar)=Mсм/M(Ar)=36/39.9=0.9
в) на 2 атома N приходится 3 атома O (смесь N2O и NO2).Ответ: 1,14
Пусть общее количество газов = 1 моль, тогда количество N2O — x моль, а NO2 —
(1-х)моль.
Подсчитаем общее количество атомов nN= (2x + (1-x)) и атомов nО = (x + 2(1-x)).
Запишем соотношение количеств атомов согласно условию nN/ nО =2/3,
(x + (1-x))/ (x + 2(1-x))=2/3.
(х+1)/(2-x)=2/3. Воспользовавшись правилом пропорции, получим: 3х+3=4-2х;5x=1; х=0,2моль N2О, тогда и 0,8 моль NО2 .
Найдем среднюю молярную массу смеси Mсм=ϕ(N2O)*M(N2O)+ ϕ(NO2)*M(NO2)= 0,2*44+0,8*46=8,8+36,8=45,6 г/моль
Найдем относительную плотность по аргону смеси D(Ar)=Mсм/M(Ar)=45,6/39.9=1,143
-

V (CO) = (3.01*10 в25) / (6.02*10 в23) = 50 моль m (CO) = 50*28=1400 г
v (CH4) = 96/16=6 моль
Mr = (1400+96) / (6+50) = 26,7143 26,7143/40=0,668 Ответ – 0,668
- Комментировать
- Жалоба
- Ссылка
Найдите правильный ответ на вопрос ✅ «Чему равна относительная плотность По аргону газовой смеси, содержащей 3.01*10 в25 молекул СО и метана массой 96 г? …» по предмету 📘 Химия, а если вы сомневаетесь в правильности ответов или ответ отсутствует, то попробуйте воспользоваться умным поиском на сайте и найти ответы на похожие вопросы.
Смотреть другие ответы
Главная » Химия » Чему равна относительная плотность По аргону газовой смеси, содержащей 3.01*10 в25 молекул СО и метана массой 96 г?
