Для
определения плотности существует
множество способов: пикнометрия,
гидростатическое взвешивание,
дилатометрия. Плотность ρ
выражает массу единицы объема вещества
и определяется уравнением
ρ
= m/υ.
Поскольку
при изменении температуры объем,
занимаемый данной массой вещества,
изменяется, при обозначении абсолютной
плотности обычно указывают в виде
верхнего индекса температуру, при
которой плотность измерена – ρt.
За единицу плотности принимается
плотность такого однородного вещества,
единица объема которого содержит единицу
массы.
На
практике часто используют относительную
плотность – плотность вещества,
отнесенную к плотности воды. Относительная
плотность определяется как масса
вещества m
при температуре t
оС,
отнесенная к массе m0
равного объема воды при t
оС.
В этом случае вода является стандартным
веществом, а за стандарт принимается
ее плотность при 4 оС.
Относительная плотность растворителей
обычно определяется при 20 оС
и обозначается как ρ420.
При определении плотности пикнометрическим
способом растворитель помещают в
пикнометр с выверенным по воде объемом
и путем взвешивания определяют массу
данного объема.
7.3. Определение вязкости растворителей
В качестве методов
измерения вязкости жидкостей существуют
капиллярная и ротационная вискозиметрия,
метод падающего шарика и метод сдвига
параллельных плоскостей. Для определения
вязкости растворителей, являющихся
ньютоновскими жидкостями, чаще всего
используют метод капиллярной вискозиметрии.
В основе метода лежит уравнение Пуазейля
о вязкой жидкости, описывающий
закономерности движения жидкости в
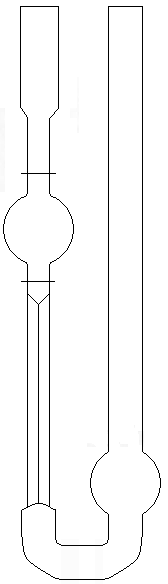
капилляре (рис. 5).
|
Рис. |
Уравнение
Q
Для
υ
Геометрические |
7.4. Определение давления насыщенного пара и энтальпии испарения
Важным
физико-химическим свойством растворителя
является его летучесть. Строго говоря,
летучесть определяется как отношение
парциального давления вещества к его
мольной доле в жидкой фазе при данной
температуре. Для идеальных растворителей
летучесть при постоянной температуре
не зависит от состава раствора и равна
давлению пара чистого растворителя при
данной температуре. Летучесть зависит
не от температуры кипения, а от теплоты
испарения ΔНисп
жидкостей.
Рассчитать
теплоту испарения жидкости возможно
из температурной зависимости давления
ее насыщенного пара. К веществам высокой
и средней летучести применяют динамический
метод определения давления насыщенного
пара, основанный на том, что давление
насыщенного пара при температуре кипения
равно внешнему давлению. Зависимость
между давлением р
и температурой Т
получают, доводя жидкость до кипения
при различных внешних давлениях и
определяя температуры кипения. В этом
случае независимой переменной является
внешнее давление, а зависимой –
температура кипения жидкости. Полученная
в ходе эксперимента зависимость давления
насыщенного пара от температуры в
координатах lg
p
– 1/T
используется для расчета теплоты
испарения жидкости ΔНисп:
Hисп
= 19,15T1T2
lg
(p2/p1)/(T2
– T1),
где
р1
и р2
– давление в замкнутой системе при
температурах кипения Т1
и Т2.
Установка для измерения давления
насыщенного пара приведена в методических
указаниях к выполнению лабораторных
работ «Химия растворителей» Михайловская
А. П., Сашина Е. С., Голубихин А. Ю. – СПб.,
2009.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить плотность раствора
Раствор характеризуется объемом, концентрацией, температурой, плотностью и другими параметрами. Плотность раствора меняется в зависимости от массы и концентрации растворенного вещества.

Инструкция
Ключевой формулой для плотности является ρ=m/V, где ρ – плотность, m – масса раствора, V – его объем. Плотность может выражаться, например, в килограммах на литр, или в граммах на миллилитр. В любом случае, она показывает, сколько вещества по массе приходится на единицу объема.
Масса раствора складывается из массы жидкости и массы растворенного в ней вещества: m(раствора)=m(жидкости)+m(растворенного вещества). Масса растворенного вещества и объем раствора могут быть найдены из известного значения концентрации и молярной массы.
Пусть, например, в задаче дана молярная концентрация раствора. Она обозначается химической формулой соединения в квадратных скобках. Так, запись [KOH]=15 моль/л означает, что в одном литре раствора содержится 15 моль вещества гидроксида калия.
Молярная масса KOH составляет 39+16+1=56 г/моль. Молярные массы элементов можно посмотреть в таблице Менделеева, они указываются обычно снизу от наименования элемента. Количество вещества, масса вещества и его молярная масса связаны соотношением ν=m/M, где ν – количество вещества (моль), m – масса (г), M – молярная масса (г/моль).
Растворы, помимо жидкостных, бывают еще и газовыми. В этом случае необходимо понимать, что в равных объемах газа, близкого к идеальному, при одних и тех же условиях содержится одно и то же число молей. К примеру, при нормальных условиях один моль любого газа занимает объем Vm=22,4 л/моль, который назван молярным объемом.
В решении задачи на плотность газового раствора может понадобиться соотношение, устанавливающее связь между количеством вещества и объемом: ν=V/Vm, где ν – количество вещества, V – объем раствора, Vm – молярный объем, постоянная величина для данных условий. Как правило, в подобных задачах обговаривается, что условия являются нормальными (н.у.).
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Плотность определяется как масса единицы объема вещества, и это определение верно для каждого растворителя, включая и многокомпонентный растворитель 646, плотность которого 0,87 г/куб.см. Результаты измерений плотности зачастую выражаются в граммах на миллиметр и обозначаются буквой d4t. Это одна из наиболее важных физических характеристик растворителя. Ею пользуются в ходе расчета множества других свойств, а также широко применяют для точной характеристики как однокомпонентных, так и многокомпонентных веществ.
Более подробно рассмотреть вопросы, связанные с определением плотности, можно найти в обзорах Бауэра. Очень часто плотность выражают как безразмерную величину dtt, которая называется относительной плотностью.
Относительная плотность – это отношение истинного значения плотности, к плотности стандартного вещества, в качестве которого для жидкостей принято брать воду с температурой 4 °C, а для газов при давлении 0,1 Мпа – 0 °C.
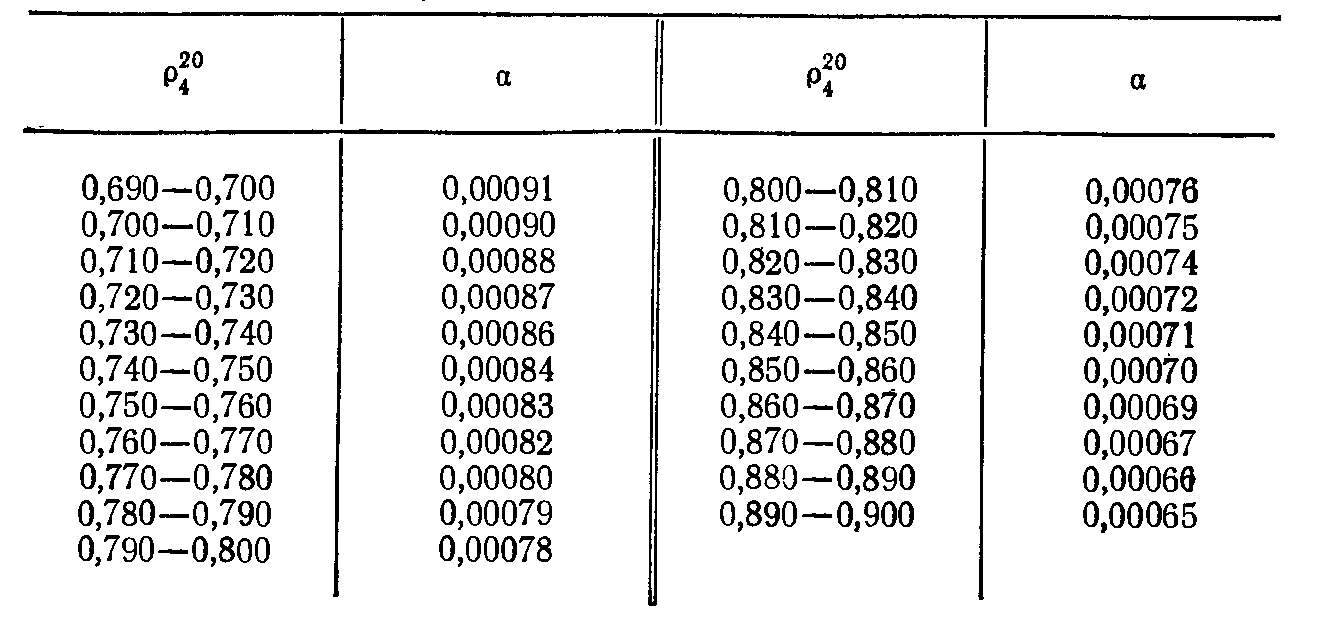
Обычно относительная плотность растворителя 646 определяется при температуре 20 °C, согласно ГОСТу 3900-75. Чтобы определить относительную плотность при другой температуре (интервал 0-150 °C) можно применить формулу:
pt4=p204-a(t-20)
Известный химик Дрейсбах разработал уникальный метод расчета плотсноти при любой температуре и диапазоне от 0 до 40 °C на основании значений относительной плотности 25°/25° для коэффициента теплового расширения. Спенсер и Дрейсбах также показали, что плотность растворителей в интервале в диапазоне 0-40°C можно рассчитать при помощи закона прямолинейных диаметров, конечно если известна температура кипения при любом давлении и плотности жидкости при 2-х температурах.
Если рассматривать растворитель 646, то он является многокомпонентным растворителем, который состоит из летучих органических растворителей. Используется для эффективного и быстрого разбавления нитролаков, нитроэмалей, а также нитрошпатлевок общего назначения.
Производители растворителя 646 правильно подобрали плотность вещества, и благодаря этому он очень качественно, быстро, а главное без повреждения разбавляет лакокрасочные составы.
Этанол и ацетон, широко применяемые в качестве растворителей
Растворитель — вещество, способное растворять другие твёрдые, жидкие или газообразные вещества, не изменяя их химически. Как правило, при атмосферном давлении и комнатной температуре растворитель является жидким веществом. Соответственно, в растворах, представляющих собой смеси жидкого и твёрдого либо жидкого и газообразного вещества, растворителем считается жидкий компонент. В смесях жидких веществ растворителем считается тот компонент, который присутствует в значительно большем количестве, либо произвольным образом[1][2].
Считается, что растворители, применяемые в промышленных масштабах, должны обладать следующими свойствами: быть бесцветными и прозрачными, испаряться без остатка, иметь устойчивость к химическим веществам, проявлять нейтральную реакцию, иметь слабый либо приятный запах, быть безводными, иметь постоянные физические свойства и низкую токсичность, разлагаться в окружающей среде, быть по возможности недорогими[3].
Теория растворения[править | править код]
При растворении вещества А в растворителе Б происходит разрушение межмолекулярных взаимодействий типа А-А и Б-Б и возникновение межмолекулярных взаимодействий типа А-Б. Вещество хорошо растворяется в растворителе, если в чистом веществе и чистом растворителе силы межмолекулярного взаимодействия имеют примерно одинаковый порядок. Напротив, если межмолекулярное взаимодействие в чистом веществе значительно сильнее или слабее, чем межмолекулярное взаимодействие в чистом растворителе, то вещество в таком растворителе растворяется плохо. Кратко этот принцип формулируется выражением «подобное растворяется в подобном» (лат. similia similibus solvuntur)[4].
Выделяют следующие типы межмолекулярного взаимодействия:
- ионное (взаимодействие между ионами);
- ион-дипольное (между ионами и диполями);
- направленное (между постоянными диполями);
- индуцированное (между постоянными и индуцированными диполями);
- дисперсионное (между атомными диполями);
- водородные связи (между группами, имеющими полярные связи типа X-H)[4].
Межмолекулярное взаимодействие в чистых компонентах А и Б может быть слабее, чем взаимодействие типа А-Б в растворе. В этом случае при растворении происходит понижение внутренней энергии системы, а сам процесс растворения является экзотермическим. Если же межмолекулярное взаимодействие в чистых компонентах А и Б сильнее, чем в растворе, то внутренняя энергия в ходе растворения повышается за счёт поглощения теплоты извне, то есть растворение является эндотермическим. Большинство процессов растворения являются эндотермическими, и их протеканию способствует повышение температуры[4].
Классификация[править | править код]
Растворители классифицируют по принадлежности к тем или иным классам химических веществ[2]:
- органические растворители (алифатические углеводороды, ароматические углеводороды, галогенуглеводороды, нитросоединения, спирты, карбоновые кислоты, простые и сложные эфиры, амиды, нитрилы, кетоны, сульфоксиды и др.);
- неорганические растворители (вода, легкоплавкие галогениды, оксогалогениды, азотсодержащие растворители, SO2, HF, легкоплавкие металлы, расплавы солей, расплавы оксидов)[2].
Характеристики молекул растворителей[править | править код]
Дипольный момент[править | править код]
Разделение зарядов в молекуле воды (отрицательный заряд показан красным, положительный — синим)
Растворители принято классифицировать по растворяющей способности на полярные и неполярные. Однако, поскольку полярность растворителя нельзя выразить в конкретных физических величинах, предпринимаются попытки выразить полярность через другое физическое свойство. Одним из таких свойств является дипольный момент молекулы растворителя. Дипольный момент является суммой дипольных моментов отдельных связей молекулы, поэтому симметричные растворители (четырёххлористый углерод, бензол, циклогексан) имеют нулевой дипольный момент. Другие ароматические растворители, а также диоксан имеют низкий дипольный момент. Менее симметричные молекулы с полярными связями (спирты, сложные эфиры) имеют более высокий дипольный момент (1,6-1,9 Д); гликоли и кетоны имеют ещё более высокий дипольный момент (2,3-2,9 Д); нитропропан, ДМФА и ДМСО имеют очень высокий дипольный момент (3,7-5,0 Д). Однако диоксан и ДМСО имеют сильно отличающиеся дипольные моменты, но схожую растворяющую способность, поэтому дипольный момент не вполне эту способность отражает[5].
Поляризуемость[править | править код]
Диполь-дипольные и индукционные взаимодействия в растворах зависят от молекулярной массы растворителя. Поскольку этот параметр не учитывается в дипольном моменте, растворяющую способность растворителя связывают с другим параметром — поляризуемостью. Чем выше поляризуемость, тем более полярные диполи возникают под действием внешнего электрического поля. Следовательно, и межмолекулярные взаимодействия возрастают[5].
Способность к образованию водородных связей[править | править код]
По прочности образуемых водородных связей растворители делят на три класса:
- растворители со слабыми водородными связями (углеводороды, хлорированные углеводороды, нитросоединения, нитрилы);
- растворители с умеренно сильными водородными связями (кетоны, сложные эфиры, простые эфиры, анилин);
- растворители с сильными водородными связями (спирты, карбоновые кислоты, амины, пиридин, гликоли, вода)[5].
Количественно способность растворителя к образованию водородных связей оценивают по параметру γ. Этот параметр получают, растворяя в исследуемом растворителе дейтерометанол и наблюдая смещение полосы колебания связи O-D в инфракрасном спектре[5].
Также растворители делят по их роли в образовании водородной связи:
- доноры протона (хлороформ);
- акцепторы протона (кетоны, простые эфиры, сложные эфиры, ароматические углеводороды);
- доноры и акцепторы протона (спирты, карбоновые кислоты, первичные и вторичные амины, вода);
- не образующие водородной связи (алифатические углеводороды)[5].
Соответственно, если в растворе присутствуют только акцепторы протона, водородная связь образоваться не может. Если в растворе есть доноры водородной связи, то такая связь образуется, что приводит к увеличению растворимости[5].
Сольватирующая способность[править | править код]
При растворении вещества в растворителе происходит разрыв межмолекулярных связей в веществе, и отдельные молекулы растворённого вещества оказываются окружёнными слоем молекул растворителя. Этот процесс сольватации оценивается величиной степени сольватации β — числом молекул растворителя, которые приходятся на одну молекулу растворённого вещества в сольватационном комплексе. Степень сольватации зависит от размера молекул растворителя, а также от всех перечисленных выше параметров[5].
Протонные и апротонные растворители[править | править код]
Среди растворителей некоторые могут являться донорами или акцепторами протонов или электронов. По этому признаку выделяют четыре группы:
- протонные растворители (вода, спирты, карбоновые кислоты и др.) — могут выступать донорами протонов и, как правило, обладают высокой диэлектрической проницаемостью (ε > 15);
- апротонные диполярные растворители (диметилформамид, диметилсульфоксид, кетоны и др.) — имеют высокую диэлектрическую проницаемость, но не являются донорами протонов и не обладают донорно-акцепторными свойствами;
- донорные растворители (эфиры);
- неполярные растворители (углеводороды, сероуглерод) — имеют низкую диэлектрическую проницаемость и не обладают донорно-акцепторными свойствами[2].
Физические и химические свойства[править | править код]
Испарение[править | править код]
По температуре кипения растворители принято делить на низкокипящие (<100 °C), среднекипящие (100—150 °С) и высококипящие (>150 °C)[2]. Для практических целей интерес представляет также летучесть растворителя ниже температуры кипения. В этих условиях жидкий растворитель находится в равновесии со своим паром, давление которого зависит от молярной энтальпии испарения ΔНV и температуры Т и выражается уравнением Клапейрона — Клаузиуса[6].
Скорость испарения не связана напрямую с температурой кипения. Эти величины можно сравнивать только в том случае, если растворители схожи по химической природе. Обычно растворители, образующие водородные связи, менее летучи, чем другие растворители с той же температурой кипения. Это связано с дополнительными затратами энергии на разрушение водородных связей. Поскольку летучесть растворителя связана с многими параметрами, её определяют экспериментально при стандартных внешних условиях и сравнивают с летучестью диэтилового эфира. Выражается летучесть в виде безразмерных чисел испарения (англ. evaporation numbers), которые относятся к значению для диэтилового эфира, равному 1. По этому признаку выделяют растворители:
- с высокой летучестью (<10);
- со средней летучестью (10-35);
- с низкой летучестью (35-50);
- с очень низкой летучестью (>50)[6].
В США принята похожая классификация, основанная на летучести бутилацетата, которая принята за единицу: быстро испаряющиеся (>3,0), умеренно испаряющиеся (0,8-3,0), медленно испаряющиеся растворители (<0,8)[6].
Гигроскопичность[править | править код]
Некоторые растворители, особенно содержащие гидроксильные группы (спирты и гликоли), поглощают воду из воздуха до установления равновесного состояния, которое зависит от температуры и влажности воздуха[6].
Плотность[править | править код]
Обычно плотность растворителя измеряется при 20 °С и выражается в виде безразмерной величины d20
4, которая является отношением этой плотности к плотности воды при 4 °С т.е. 
4 ниже единицы и она уменьшается при нагревании. Исключение составляют галогенуглеводороды, которые тяжелее воды. В гомологическом ряду сложных эфиров и целлозольвов плотность уменьшается с ростом молекулярной массы, а у спиртов и кетонов увеличивается[6].
| Сложный эфир | d20 4 |
Целлозольв | d20 4 |
Спирт | d20 4 |
Кетон | d20 4 |
|---|---|---|---|---|---|---|---|
| Метилацетат | 0,934 | Метилцеллозольв | 0,966 | Метанол | 0,791 | Ацетон | 0,792 |
| Этилацетат | 0,901 | Этилцеллозольв | 0,931 | Этанол | 0,789 | Метилэтилкетон | 0,805 |
| Пропилацетат | 0,886 | Пропилцеллозольв | 0,911 | Пропанол-1 | 0,804 | Метилпропилкетон | 0,807 |
| Бутилацетат | 0,876 | Бутилцеллозольв | 0,902 | Бутанол-1 | 0,810 | Амилметилкетон | 0,816 |
Вязкость[править | править код]
В гомологических рядах растворителей вязкость увеличивается с ростом молекулярной массы. Наличие гидроксильных групп в молекулах увеличивает вязкость благодаря образованию водородных связей. При уменьшении температуры вязкость уменьшается. Вязкость растворителя важна, поскольку в основном она определяет вязкость раствора[6]. Маловязкие растворители имеют вязкость ниже 2 мПа·с при 20 °С, растворители средней вязкости — от 2 до 10 мПа·с, а высоковязкие — выше 10 мПа·с[2].
Воспламенение[править | править код]
Растворители классифицируют по их параметрам воспламеняемости на основании температуры вспышки — температуры, при которой смесь паров растворителя с воздухом воспламеняется открытым пламенем. Температура вспышки снижается при увеличении давления насыщенного пара растворителя, то есть при уменьшении его молекулярной массы и температуры кипения. Температура вспышки связана с температурой кипения эмпирическим уравнением, которое даёт довольно точные значения для углеводородов, кетонов и сложных эфиров, но не подходит для спиртов, гликолей и эфиров гликолей[6]:
.
| Сложный эфир | Температура вспышки, °С | Кетон | Температура вспышки, °С |
|---|---|---|---|
| Метилацетат | -13 | Ацетон | -19 |
| Этилацетат | -12 | Метилэтилкетон | -14 |
| Пропилацетат | 12 | Метилпропилкетон | 22 |
| Бутилацетат | 22 | Бутилметилкетон | 23 |
Из соображений безопасности температуру вспышки стараются повысить. Азеотропные смеси растворителей, однако, имеют более низкую температуру вспышки, чем отдельные компоненты этой смеси, поэтому их использовать для этой цели проблематично. Температуру вспышки толуола можно повысить добавлением хлоралканов. Температуры вспышки смесей не обязательно равны температуре вспышки более воспламеняемого компонента. Если смешиваются растворители разной химической природы (например, алкан и спирт), точка вспышки сильно понижается. Если компоненты имеют сходную природу, то температура вспышки лежит между значениями чистых компонентов[6].
Пары растворителя могут воспламеняться не только от открытого пламени, но и самопроизвольно при достижении температуры воспламенения. По этому параметру растворители классифицируют на пять групп: T5 (100—135 °С), T4 (135—200 °С), T3 (200—300 °С), T2 (300—450 °С) и T1 (>450 °С)[6].
Взрыв растворителя представляет собой очень быстрый процесс сгорания, который инициируется возгоранием и протекает без поглощения энергии или воздуха извне. Взрыв может произойти только в том случае, если пары растворителя и воздух находятся в определённом соотношении, которое определяется верхним и нижним пределом воспламенения[6].
Химические свойства[править | править код]
Химическая инертность является одним из важных условий для того, чтобы жидкость могла использоваться в качестве растворителя. Алифатические и ароматические углеводороды хорошо отвечают этому условию. Спирты также весьма устойчивы, однако они реагируют с щелочными, щелочноземельными металлами и алюминием, превращаются в карбоновые кислоты под действием сильных окислителей, а также реагируют с изоцианатами (поэтому их не используют для растворения полиуретановых красителей)[6].
Простые эфиры, в том числе эфиры гликолей, при длительном стоянии на воздухе и на свету образуют пероксиды. Сложные эфиры и кетоны достаточно устойчивы, хотя сложные эфиры могут гидролизоваться до карбоновых кислот и спиртов, особенно в кислой или щелочной среде. В нейтральной среде этот процесс происходит гораздо медленнее: за 130 дней при 20 °С из 44 г этилацетата в 1 л воды гидролизуется около 15 г[6].
Хлорированные растворители в присутствии оснований и металлов выделяют хлороводород, хотя в них обычно добавляют стабилизаторы, чтобы этого избежать[6].
Применение[править | править код]
Краски[править | править код]
В красках используются сложные композиции растворителей, которые меняются в зависимости от назначения краски, температуры и времени высыхания. Краска, высыхающая при комнатной температуре, содержит примерно 45 % легкокипящих, 45 % среднекипящих и 10 % высококипящих растворителей. Легкокипящие растворители обеспечивают быстрое высыхание краски, а высококипящие — ровную поверхность слоя. Если покрытие будет высыхать при повышенной температуре, то краска, напротив, не содержит легкокипящих растворителей, потому что при нагревании они будут вспучивать поверхность слоя. Также важную роль при формулировании состава растворителей играет связующее вещество[9].
Также при создании композиции учитывают вязкость растворителя, его влияние на механические свойства лакокрасочного покрытия и другие параметры, включая особенности использования[9]. Например, в чернилах для печати нужно использовать растворители, которые легко растворяют связующее вещество, однако в то же время растворитель не должен взаимодействовать с медными роликами или резиной в системе печати[10].
Составы для удаления краски[править | править код]
Для удаления слоя краски используют растворители, которые либо хорошо растворяют, либо способны приводить к существенному набуханию связующих компонентов краски. Особенно часто применяется смесь дихлорметана с низкокипящими кетонами или сложными эфирами. В эти составы добавляют небольшое количество высококипящих растворителей (тетрагидронафталин, лигроин, бензиловый спирт и др.), чтобы замедлить испарение. Современные составы не содержат хлоралканов: их готовят из высококипящих растворителей (ДМФА, ДМСО, карбоната пропилена и N-метилпирролидона) с добавлением спиртов либо ароматических веществ[10].
Производство волокон[править | править код]
При производстве волокон растворы готовят с использованием таких растворителей, которые являются недорогими, летучими, хорошо регенерируемыми и имеют по возможности минимальную вязкость. Так, для триацетата целлюлозы применяют дихлорметан и метанол, для поливинилхлорида — ацетон, для полиакрилонитрила — диметилсульфоксид или пропиленкарбонат[10].
Обезжиривание[править | править код]
Для обезжиривания металлов используют кетоны и хлоруглеводороды (трихлорэтилен, тетрахлорэтилен, дихлорметан). При этом последние стабилизируют, чтобы при контакте с металлами не происходило выделение хлороводорода. Постепенно органические растворители заменяются водными составами, что связано с охраной окружающей среды[10].
Экстракция[править | править код]
Растворители широко применяются в экстракционных процессах для промышленного разделения, выделения или очистки веществ. Например, ненасыщенные компоненты из растительных масел удаляют метанолом или фурфуролом. Также растворители находят применение в экстракционной дистилляции: в этом случае к разделяемой смеси добавляют высококипящий растворитель, который избирательно взаимодействует с одним из компонентов, понижая его летучесть. Так, например, циклогексан (темп. кип. 80,8 °С) и бензол (темп. кип. 80,1 °С) удаётся разделить дистилляцией после добавления анилина, поскольку он сильнее взаимодействует с бензолом, чем с циклогексаном[10].
Хроматография[править | править код]
Растворитель в хроматографии выполняет роль подвижной фазы и конкурирует за растворённое вещество с твёрдым сорбентом. Распределение веществ между этими фазами зависит не только от природы сорбента, но и от особенностей растворителя. Растворители группируют в элюотропные ряды, которые отражают элюирующую способность растворителя (которая в случае полярных сорбентов возрастает с полярностью растворителя)[10].
Проведение химических реакций[править | править код]
Растворители служат реакционной средой при проведении органического синтеза. Они обеспечивают контакт между реагирующими веществами, создавая гомогенную среду, а также влияют на равновесие, скорость и порядок реакции, взаимодействуя с исходными веществами, продуктами, а также промежуточными частицами[2]. В зависимости от типа реакции необходимы разные растворители. С накоплением опыта для некоторых реакций были подобраны подходящие растворители:
- гидрирование: спирты, ледяная уксусная кислота, углеводороды, диоксан;
- окисление: ледяная уксусная кислота, пиридин, нитробензол;
- галогенирование: четырёххлористый углерод, тетрахлорэтан, ксилол, нитробензол, ледяная уксусная кислота;
- этерификация: бензол, толуол, ксилол, дибутиловый эфир;
- нитрование: ледяная уксусная кислота, дихлорбензол, нитробензол;
- диазотирование: этанол, ледяная уксусная кислота, бензол, диметилформамид;
- азосочетание: метанол, этанол, ледяная уксусная кислота, пиридин;
- реакция Гриньяра: диэтиловый эфир;
- реакции Фриделя — Крафста: нитробензол, бензол, дисульфид углерода, четырёххлориствый углерод, тетрахлорэтан, 1,2-дихлорэтан;
- дегидратация: бензол, толуол, ксилол;
- сульфирование: нитробензол, диоксан;
- дегидрогалогенирование: хинолин;
- декарбоксилирование: хинолин;
- образование ацеталей: гексан, бензол;
- конденсации кетена: диэтиловый эфир, ацетон, бензол, ксилол[10].
Токсическое действие[править | править код]
Острая и хроническая токсичность[править | править код]
Растворители оказывают разное действие на человека, животных и растения. Это действие зависит как от количества растворителя, так и от времени действия. Воздействие большого количества растворителя в течение короткого времени может привести к острым нарушениям здоровья, а продолжительное воздействие малых доз может привести к хроническим последствиям и сенситизации, а также аллергии[11].
Токсичность растворителей количественно выражают в виде полулетальной дозы LD50 либо, поскольку воздействие растворителя часто происходит при вдыхании, в виде полулетальной концентрации LC50. При вдыхании растворители всасываются через лёгкие и попадают в кровоток, а затем накапливаются в тканях с высоким содержанием липидов (нервах, головном мозге, спинном мозге, жировой ткани, печени и почках). Также растворители могут оказывать вредное действие на клетки. В некоторых случаях растворители попадают в организм через кожу или — реже — через пищеварительный тракт[11].
При остром отравлении растворителями возникает головокружение, сонливость, головная боль, потеря сознания и признаки наркотического действия. Хроническое действие трудно обнаружить на начальных стадиях, но впоследствии из-за него происходит повреждение тех или иных органов в зависимости от конкретного растворителя[11].
При действии растворителей на кожу может происходить либо растворение жирового слоя, которое приводит к возникновению трещин и повышению риска инфекции, либо непосредственно возникает воспаление и образование волдырей. Очень легко через кожу всасываются анилин, бензол, диметилацетамид, диметилформамид, диоксан, метанол, нитробензол, четырёххлористый углерод и некоторые другие растворители[11].
Канцерогенность[править | править код]
В Германии, согласно техническим инструкциям, касающимся опасных веществ (нем. Technische Regeln für Gefahrstoffe TRG 900), некоторые растворители классифицируются как канцерогены. Они попадают в раздел А (вещества, для которых канцерогенный эффект однозначно продемонстрирован) и раздел B (вещества, которые оправданно считаются подозрительными на канцерогенность). Раздел А включает в себя подраздел А1 (вещества, которые, согласно опыту, могут вызывать злокачественные опухоли у человека) и подраздел А2 (вещества, канцерогенный эффект которых был ясно показан в экспериментах с животными). В этих списках находятся следующие растворители:
- А1: бензол;
- А2: 1,2-дихлорэтан, гексаметапол, 2-нитропропан;
- B: анилин, хлорэтан, дихлорметан, диоксан, 1,1,2,2-тетрахлорэтан, тетрахлорэтилен, четырёххлористый углерод, 1,1,2-трихлорэтан, трихлорэтилен и хлороформ[11].
Тератогенность и эмбриотоксичность[править | править код]
В Германии потенциально тератогенные и эмбриотоксичные вещества делят на четыре группы: с показанными эффектами (группа А), с вероятными эффектами (группа B), без эффектов при условии соблюдения ПДК (группа C), вещества, для которых оценка пока невозможна (группа D). В соответствии с этой классификацией, в группе B находятся диметилформамид, этилцеллозольв, ацетат этилцеллозольва, метилцеллозольв, ацетат метилцеллозольва, 2-метоксипропанол-1, ацетат 2-метоксипропанола-1, дисульфид углерода, толуол и хлороформ. Ряд растворителей также находится в группах C и D[11].
Экономические аспекты[править | править код]
Вагон-цистерна для метанола
Растворители широко используются в различных сферах промышленности, однако ожидается сокращение их использования в связи с введением законодательства, направленного на охрану окружающей среды[12].
| Растворители | 1980 | 1986 | 1990 | 1995 | 2000* |
|---|---|---|---|---|---|
| Кислородсодержащие растворители | 36,5 | 45 | 51 | 58 | 65 |
| Алифатические углеводороды | 28,5 | 22 | 20,5 | 19 | 18 |
| Ароматические углеводороды | 20,5 | 20 | 19 | 17 | 15,5 |
| Хлоруглеводороды | 14,5 | 13 | 9,5 | 6 | 1,5 |
| Общее потребление, млн тонн | 5,1 | 4,75 | 4,7 | 4,15 | 3,3 |
* прогнозируемые значения
См. также[править | править код]
- Универсальный растворитель
- Многокомпонентные растворители
Примечания[править | править код]
- ↑ Ullmann, 2000, p. 619.
- ↑ 1 2 3 4 5 6 7 Химическая энциклопедия, 1995.
- ↑ Ullmann, 2000, p. 620.
- ↑ 1 2 3 Ullmann, 2000, p. 620–624.
- ↑ 1 2 3 4 5 6 7 Ullmann, 2000, p. 624–630.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 Ullmann, 2000, p. 630–637.
- ↑ Ullmann, 2000, p. 632.
- ↑ Ullmann, 2000, p. 634.
- ↑ 1 2 Ullmann, 2000, p. 645–648.
- ↑ 1 2 3 4 5 6 7 Ullmann, 2000, p. 648–650.
- ↑ 1 2 3 4 5 6 Ullmann, 2000, p. 637–640.
- ↑ 1 2 Ullmann, 2000, p. 650.
Литература[править | править код]
- Трегер Ю. А. Растворители // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 183–184. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Stoye D. Solvents (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2000. — doi:10.1002/14356007.a24_437.