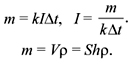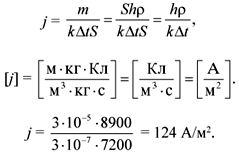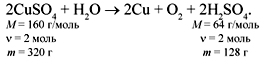Подробно о плотности электрического тока
Содержание
- 1 Что называют плотностью тока
- 2 Чем отличается плотность от силы тока
- 3 Физический смысл
- 4 Связь с законом Ома
- 5 Особенности
- 5.1 Плотность тока насыщения
- 5.2 Высокая частота
- 6 Применение
- 7 Видео по теме
При наличии электрополя в проводящей среде и свободных носителей заряда в данной среде возникает электрический ток. Именно он является мерой измерения количества зарядов одного типа, которые протекают в проводнике за определенное время. Как известно из школьного курса физики, сила тока определяется величиной напряжения (разности потенциалов) и сопротивления данного участка цепи, что отражает закон Ома. Можно заметить, если в рассматриваемой электроцепи проводник имеет различное сечение, то в одно время на различных участках через единичный элемент площади будет проходить различное количество носителей электрозаряда.
Что называют плотностью тока
Плотность тока — это физическая величина, которая определяет количество носителей электрозаряда в конкретной точке. Она является векторной величиной, поскольку прямо пропорциональна концентрации носителей заряда и их скорости, а скорость — величина направленная (векторная).
Обозначается плотность электротока латинской буквой j. Допускается также обозначение большой буквой J. Раннее плотность обозначалась греческой буквой дельта δ.
Формула плотности тока выглядит следующим образом:
Плотность электрического тока измеряется в Кл/кв. м/с или А/кв. м. Обе единицы равноправны, но наиболее широкое применение в электротехнике нашла единица измерения плотности ампер на метр в квадрате. На практике обычно используется не метр в квадрате, а более малая величина — миллиметр (А/кв. мм). Единицы измерения электрозаряда и силы электротока связаны уравнением 1 Кл = 1 А*1 с.
Чем отличается плотность от силы тока
Сила и плотность тока — величины взаимосвязанные. Согласно определению, силой тока является поток вектора плотности тока через заданную фиксированную поверхность (в частном случае — через поперечное сечение проводника). Понятия электрический ток, сила и плотность электрического тока используются в теоретических и практических разделах физики, но, как правило, в области электротехники более удобно использовать силу элетротока, а при анализе движения носителей электрозаряда — плотность электротока (плотность тока проводимости).
Следует заметить, что существует большое количество типов приборов, позволяющих определить силу электротока, в то время как проводить прямые измерения плотности невозможно, поэтому это чисто теоретическая (расчетная) величина.
Физический смысл
В физическом понятии плотность тока — это мера измерения силы тока, протекающего через единицу площади сечения проводника. Самая простая аналогия для понимания понятия плотности тока — водопровод. Представьте, что участок водопровода от точки А до точки Б состоит из труб различного сечения. Поскольку в каждый момент времени через трубопровод протекает одинаковое количество жидкости, то, чем меньше диаметр трубы, соответственно, ее сечение, то тем больше проходит воды через единицу пощади.
Соответственно, можно рассматривать электрическую цепь, которая состоит из проводников различного поперечного сечения. Так как электроток в цепи имеет одинаковую величину, то через участки с малым и большим сечением за единицу времени проходит одинаковое количество носителей заряда. Следовательно, в более тонком проводнике на единицу площади припадает большее количество носителей.
Связь с законом Ома
Как было сказано выше, закон Ома гласит: сила тока прямо пропорциональна разности потенциалов и обратно пропорциональна сопротивлению. Это только частный случай. Для большей полноты необходимо рассматривать закон Ома в дифференциальной форме. Здесь он напрямую связан с плотностью тока:
Особенности
Поскольку подвижные электрозаряды могут возникать не только в проводящей среде, то понятие плотности электротока используется в ряде иных случаев.
Плотность тока насыщения
Принцип работы электровакуумных и газоразрядных приборов (электронных ламп, рентгеновских трубок, электронных микроскопов) основан на движении электронов в вакууме или газе. В данном контексте плотность электротока характеризует эмиссионную способность катода, то есть, его способность испускать электроны в нагретом состоянии.
Высокая частота
Если рассматривается не постоянный электрический ток, а переменный, то следует учитывать скин-эффект. Суть эффекта в том, что переменный электроток высокой частоты распределяется не равномерно по сечению проводника, а преимущественно в наружном (поверхностном) слое. При этом, чем выше частота, тем тоньше слой, по которому происходит распространение носителей электрозаряда.
Таким образом, если рассматривать проводники одинакового сечения при работе на постоянном электротоке или высокочастотном, то во втором случае плотность электротока будет тем больше, чем выше частота, поскольку в передаче электротока будет использоваться лишь тонкий поверхностный слой проводника. В связи с этим производят покрытие высокочастотных элементов электрических цепей металлом с малым электрическим сопротивлением — серебром.
Применение
Плотность тока в проводнике имеет большое практическое значение. Прохождение электротока вызывает нагрев проводника. Величину нагрева можно найти в зависимости от силы протекающего электротока и сопротивления провода. Поскольку на всех участках линейной цепи сила электротока одинакова, то более тонкий проводник имеет большее сопротивление и на нем выделяется большее количество теплоты.
Существуют предельные нормы допустимой плотности электротока в зависимости от условий работы проводников и их материала. Превышение норм вызывает недопустимый нагрев вплоть до расплавления материала. Данное свойство используется в плавких электрических предохранителях, в которых материал и его сечение подобраны таким образом, что превышение плотности электротока сверх нормы вызывает практически мгновенное перегорание и размыкание электрической цепи.
Также плотность тока используется в электролизе. Так называют процесс выделения составляющих веществ из раствора электролита при прохождении через него электрического тока или нанесение металлических покрытий. Увеличение плотности тока повышает коэффициент полезного действия электролизных установок при разложении электролита, но снижает качество металлического покрытия.
Разные проводники имеют разную плотность электротока. Сейчас преимущественно используются медные провода, для которых этот параметр составляет 6-10 А/кв. мм. Об этом следует помнить, создавая электроцепи для длительной эксплуатации.
Видео по теме
чем больше размер площади электродов,тем на большей площади будет происходить реакция восстановления или окисления
Логично.
если мы имеем анод и катод площадью к примеру 5 см2 и плотность тока 2 А, то за одну и ту же еденицу времени,в первом случае, больше вещества будет восстанавливаться или окисляться, чем предположим при аноде и катоде площадью 1 см2 и плотностью тока в 2 Ампера,правильно ли я думаю?
Плотность тока – в А/м2. если вы имеете в виду именно плотность тока (предположим, что в А/см2), а не силу, то в первом случае величина пропускаемого тока составляет: 2 • 5 = 10 А, а во втором: 2 • 1 = 2 А. Количество восстанавливающегося (окисляющегося) на электродах вещества пропорционально силе тока, то есть в первом случае – да, восстановится (окислится) большее количество вещества.
Есть ли какая то формула соотношения площади электрода к выделяемой массе вещества за еденицу времени?
Преобразуйте закон Фарадея: m = I • M • t • Вт / (z • F) = i • S • M • t • Вт / (z • F) → …
На что влияет плотность тока?
На величину выхода по току, на структуру восстанавливаемого металла, на электродный процесс в целом (например, при плотностях тока менее 1000 А/м2 из растворов хромовой кислоты будет восстанавливаться только водород, а восстановления хрома не будет).
Изменено 26 Сентября, 2010 в 09:16 пользователем sharpneedles
Электрохимическая поляризация не зависит от плотности тока и возникает, когда на электродах выделяются продукты электролиза, отличные от материала самого электрода. Ее можно заметно уменьшить, прибавляя так называемые деполяризаторы, т. е. веще-< тва, разряжающиеся прежде, чем те ионы, которые разряжались бы в их отсутствие. Например, если на электроде выделяется кислород или хлор, в качестве деполяризатора употребляется [c.427]
Значение плотности тока при электролизе. [c.436]
Нужно отметить, что при электролизе интересна не абсолютная величина силы тока, а плотность тока. Она представляет собой отношение силы тока (в а) к поверхности электрода (в см ), на котором происходит выделение данного элемента. Так, если сила тока 1,0 а, а поверхность катода 100 лi , то катодная плотность тока равняется 1,0 100 = 0,01 а/см . [c.436]
В качестве источника тока лучше пользоваться свинцовым аккумулятором с напряжением около 2 в. Пользуются и другими источниками тока, например щелочными аккумуляторами, сухими батареями или сетью постоянного тока, но тогда нужное напряжение 2 в устанавливают по вольтметру 5 с помощью включенного в цепь реостата 3 (см. рис. 61). Можно также пользоваться переменным током, но в этом случае применяют выпрямители (например, селеновые или купроксные). При обычной площади катода (около 100 сл 2) и указанных ниже количествах реактивов при напряжении – 2,0 в создается необходимая для нормального течения процесса плотность тока. [c.442]
Приступая к подготовке прибора, нужно помнить, что с электродами необходимо обраш аться очень бережно и осторожно. Ни в коем случае не разрешается касаться рабочей части электродов руками, так как при этом электроды обязательно загрязняются жиром, а на загрязненной поверхности катода медь не осаждается. Вследствие этого плотность тока на других участках поверхности может возрасти выше допустимсзй величины. Брать электроды следует за самый верх их стержней. Нельзя также при закреплении стержней в клеммах слишком сильно завинчивать винты. [c.440]
Напряжение на объекте, достаточное дл соддеряаиия устойчивого пассивного состояния при минимальной плотности тока, соста влявт [c.75]
Значение плотности тока при электролизе. Ускоренный электролиз 439 [c.439]
Перенапряжение наблюдается и при выделении металлов. Однако при небольщих плотностях тока оно обычно так мало, что его можно во внимание не принимать. [c.431]
Нужно, однако, иметь в виду, что при слишком большой плотности тока осадок получается рыхлым (губчатым) н плохо держится на электроде, и потому часть его легко потерять. Кроме того, такие осадки, имея огромную поверхность, легче окисляются кислородом воздуха, что также является источником погрешности анализа. [c.437]
Чем больше плотность тока, тем больше в единицу времени отлагается на поверхности электрода определяемого металла и тем быстрее закончится электролиз. [c.437]
Плотность тока, переносимая г-м видом ионов, составит (предполагается, что напряженность поля изменяется по оси х) [c.105]
Итак, вследствие медленности процесса диффузии ионов для получения хороших осадков приходится проводить электролиз при малых плотностях тока, что значительно замедляет электро- [c.437]
Таким образом, для определения плотности тока нужно знать величину поверхности электрода. Если электрод имеет форму прямоугольной пластинки или сплошного цилиндра, поверхность его, очевидно, будет равна удвоенной площади прямоугольника или удвоенной боковой поверхности цилиндра. Поверхность сетчатых электродов с достаточной для практических целей точностью можно вычислить, принимая электроды за сплошные. [c.436]
Из (15.15) можно найти концентрацию Си вблизи катода лри силе тока I или при плотности тока / [c.305]
Значение плотности тока при электрошзе. Ускоренный электролиз 437 [c.437]
ЛИЗ. При перемешивании можво работать со значительно большими плотностями тока, поэтому перемешивание весьма заметно ускоряет процесс электролиза. [c.438]
Плотностью тока называется сила тока, приходящаяся на единицу поверх- остч электрода. [c.427]
Потенциал пары 2Н+/Н2 при [Н+] = 1 равен нулю. Но поскольку в процессе электролиза катод окажется покрытым слоем меди, нужно учесть перенапряжение водорода на меди. Это перенапряжение равно —0,58 в (при плотности тока 0,01 aj M ). Таким образом, выделению водорода соответствует потенциал катода, равный —0,58 в, а выделению меди потенциал -f0,31 в. Следовательно, кислая среда не будет мешать выделению меди на катоде. Водород может начать выделяться только тогда, когда концентрация Си +-ионов понизится до величины, соответствующей потенциалу —0,58 в. Величину этой концентрации легко найти из уравнения [c.434]
В стакан опускают взвешенный сетчатый электрод и закрепляют его в одной из клемм штатива так, чтобы он не соприкасался ни с дном, ни со стенками стакана и находился везде на одинаковом расстоянии от них. Платиновую спираль (анод) закрепляют в другой клемме так, чтобы анод находился в центре сетчатого катода. Это важно потому, что иначе медь будет оседать преимущественно в тех точках поверхности катода, которые находятся ближе всего к аноду, плотность тока в этих точках будет значительно больше, чем в других следовательно, здесь может образоваться губчатый, легко осыпающийся осадок меди. Коичик спирали должен немного выступать из-под сетки и на несколько миллиметров не доходить до дна стакана. [c.442]
Губчатая структура осадков металлов объясняется тем, что при большей плотности тока на катоде в единицу времени разряжается больше ионов металла, чем их успевает подходить к катоду из раствора. Поэтому раствор около катода обедняется определяемыми ионами настолько, что начинают разряжаться также Н+-Н0НЫ. Образующийся при этом газообразный водород покрывает поверхность катода пузырьками, которые при дальнейшем осаждении металла разрыхляют его слой. Металл оказывается при этом пронизанным огромным количеством мелких пор, и связь его с электродом становится непрочной. [c.437]
Кроме природы металла и состояния его поверхности перенапряжение зависит также от плотности тока и температуры. По-иышение температуры уменьшает перенапряжение. Наоборот, с увеличением плотности тока оно увеличивается. Так, при плотности тока 0,1 а см перенапряжение водорода на меди составляет —0,85 в, тогда как при 0,01 а см оно равно —0,58 в. [c.430]
Первое предположение о причинах данного явления сводится к тому, что различие между обратимой э.д.с. и напряжением возникает как результат омических потерь напряжения. В этом случае напряжение, необходимое для проведения какой-либо реакции в электролитической ванне, будет слагаться из обратимой э.д.с. Е (определяемой изменением изобарно-изотермического потенциала) и падения напряжения в электролите и в электродах Еом (зависящего от плотности тока). Такое предположение объясняет причину увеличения напряжения на аание при прохождении через нее тока по сравнению с обратимой э.д.с. той же системы. Точно так же уменьшение напряжения гальванического элемента при отборе от него тока можно отнести за счет того, что часть э.д.с. расходуется на преодоление сопротивления в утри самого элемента. Омические потери напряжения являются, таким образом, одной из причин различия между обратимой э.д.с. и рабочим напряжением. Опыт показывает, однако, чго [c.287]
Что такое плотность тока Какую роль она играет при электролизе В чем заключаются преимущества и недостатки применения электролиза при сравн 1тельно большой плотности тока [c.457]
Плотность тока у, т. е. сила тока, отнесенная к еднннце иоверхности сечения системы, представляет собой алгебраическую сумму произведений потоков на заряды ионов [c.104]
При меньшнх плотностях тока убыль определяемых ионов у катода успевает пополняться в результате диффузии их из других частей раствора. Вследствие этого потенциал, образующийся на (атоде окислительно-восстановительной пары, например Си +Л и, все время поддерживается на необходимом уровне вплоть до практически полного осаждения Си +-ионов. Таким образом выделение водорода предотвращается, и на катоде образуется плотный блестящий слой меди, который держится на нем очень прочно и имеет меньшую поверхность. Ошибки, зависящие от потери части осадка и его окисления, при этом устраняются, и определение дает точный результат. [c.437]
Термодинамика электрохимических систем не может объяснить причины изменения э.д.с. при нх иероходе к необратимому состоянию и установить, как это изменение связано со скоростью протекания электрохимической реакции, т. е. с силой (или плотностью) тока, проходящего через электрохимическую систему. Поэтому ириходится прибегать к некоторым предположениям нетермодинамического характера. [c.287]
Основную причину изменения напряжения на электрохимической системе при подаче (или отборе) тока следует искать поэтому ие в омических потерях, а в иомепеиии электродных потенциалов с силой (или плотностью) тока. При наложении тока потенциал каждого нз двух электродов, входящих в электрохимическую систему, изменяется в направлеии]г, которое увеличивает напряжение иа ванне и снижает его на элементе. Суммарное изменение электродных иотеициалов под то1<ом называется э.д.с. поляризации Сп. Если наряду с омическим ладением напряжения учитывать также и э.д.с. поляризации, то можно написать уравнения для напряжения иа ванне и на элементе [c.288]
При увеличении катодной плотности тока диффузионное перенапряжение будет плавно возрастать до тех пор, пока произведение кл не станет близким к единице. В этих условиях даже незначн-тельное повышение плотности тока вызывает заметный сдвиг потенциала в сторону отрицательного значения и при йд/ = 1 катодное дифiфyзиoннoe перенапряжение должно сделаться бесконечно большой отрицательной величиной г д==—оо (рис. 15.3). Плотность тока, отвечающая этим условиям, называется предельной катодной диффузионной плотностью тока [c.306]
Характерной особенностью электр1зхимических реакций является то, что все они совершаются на 1 ран1ще раздела электрод — электролит и поэтому их скорость зависит от площади поверхности раздела 5. В связи с этим принято относить скорость электрохимической реакции к единице поверхности раздела и определять ее как плотность тока [c.283]
Из (15.15) можно также определить плотность тока /, которая отвечает ко1щентрации Ск в прикатодном слое [c.305]
Используя электродные балансы, можно вывести уравнения, передающие связь между диффузионным перенапряжением и плотностью тока и для более сложных электродных реакций. Для каждого -го участника электродной реакции получается выражение, аналогичное (15.22), причем, как следует нз общего уравнения диф-фЗ зионного перенапряжения (15.8), подлотарифмическое выражение будет входить в искомое уравнение в степени Vi, отвечающей стехиометрическому множителю данного вида частиц, т. е. в общем случае [c.306]
Прп равновесном потенциале такое соотношение достигается благодаря тому, что одни и те же частицы с одинаковой частотой переходят из электрода в раствор и из раствора на электрод. Для цинкового электрода такими частицами являются ионы цинка. Устойчивость подобного динамического равновесия определяется интенсивностью обмена, т. е. плотностью тока в двух противоположных иаиравлениях [c.290]
МОЖНО пренебречь лишь при малых скоростях электрохимической реакции, т. е. при малых плотностях тока. При высоких плотностях тока, напротив, стадии доставки могут определять скорость всего суммарного электродного прощ сса. [c.299]
Если учесть, что во втором слагаемом подлогарифмического выражения множитель перед плотностью тока не зависит от ес значения и для данной электродной реак г,ии и температуры является [c.305]
Теоретические основы аналитической химии 1987 (1987) — [
c.274
]
Введение в электрохимическую кинетику 1983 (1983) — [
c.143
]
Лабораторный практикум по теоретической электрохимии (1979) — [
c.23
,
c.101
]
Каталитические, фотохимические и электролитические реакции (1960) — [
c.0
]
Двойной слой и кинетика электродных процессов (1967) — [
c.169
,
c.172
,
c.173
]
Электрохимическая кинетика (1967) — [
c.0
,
c.29
]
Электрохимические системы (1977) — [
c.21
,
c.194
,
c.196
,
c.206
,
c.215
,
c.220
,
c.246
,
c.249
,
c.250
,
c.281
,
c.289
]
Электрохимический синтез органических веществ (1976) — [
c.42
,
c.44
]
Теоретическая электрохимия (1965) — [
c.289
]
Теоретическая электрохимия Издание 2 (1969) — [
c.284
]
Теоретическая электрохимия Издание 3 (1975) — [
c.0
]
Курс теоретической электрохимии (1951) — [
c.260
]
Технология содопродуктов (1972) — [
c.189
,
c.192
,
c.195
,
c.199
,
c.204
,
c.214
,
c.218
,
c.222
,
c.231
,
c.233
,
c.241
,
c.243
,
c.246
]
Физические и химические методы обработки воды на ТЭС (1991) — [
c.134
,
c.137
,
c.138
]
Электрохимический синтез органических веществ (1976) — [
c.42
,
c.44
]
Химико-технические методы исследования Том 1 (0) — [
c.434
]
Краткий справочник химика Издание 6 (1963) — [
c.437
]
Теоретическая электрохимия (1981) — [
c.244
]
Квантовая механика молекул (1972) — [
c.289
]
Основы общей химической технологии (1963) — [
c.124
]
Учебник физической химии (0) — [
c.334
]
Общая химия Изд2 (2000) — [
c.279
]
Краткий справочник химика Издание 4 (1955) — [
c.390
]
Краткий справочник химика Издание 7 (1964) — [
c.437
]
Курс общей химии (0) — [
c.203
]
Курс общей химии (0) — [
c.203
]
Предмет химии (0) — [
c.203
]
ЭЛЕКТРОЛИЗ
ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ
№ 3 г. Норильска. Совместно с учителями
физики и биологии мы работаем над проектом
«Естественные науки в школьном образовании» и
часто ведем интегрированные уроки. Одним из
таких уроков был урок по теме «Электрический ток
в жидкостях. Электролиз», который я провела
совместно с учителем физики.
Эту тему мы выбрали
еще и потому, что в нашем городе основными
предприятиями являются медный и никелевый
заводы, на которых с помощью электролиза
проходит очистка меди и никеля. Наши выпускники,
идя работать на эти заводы, уже на практике
сталкиваются с процессом электролиза.
Работая над программами по физике и химии, мы
пришли к выводу о том, что многие вопросы
изучаются этими дисциплинами параллельно.
Причем на уроках физики уделяется больше
внимания физической сущности изучаемых явлений
и процессов, а на химии – особенностям и условиям
протекания реакций, отражающих данный процесс.
Примером может служить изучение темы
«Электрический ток в жидкостях. Электролиз».
Часть вопросов рассматривается в 9-м, 11-м классах
на уроках химии, другая часть – в 10-м, 11-м классах
на уроках физики.
Учитывая особенности данной темы, ее
актуальность для нашего города и
металлургического комбината «Норильский
никель», целесообразно провести интегрированный
урок.
При таком подходе к изучению вопросов учащиеся
получают ту научно-обоснованную информацию,
которая помогает им глубже изучить данный
вопрос, детально разобраться в сущности
изучаемых процессов и явлений.
Пока люди не узнают сил
природы,
они слепо подчиняют себя им,
а раз они узнали их, тогда силы
природы служат людям.
Г.Плеханов
Цели и задачи.
П о в т о р и т ь:
механизм проводимости среды;
природу носителей зарядов;
процессы, происходящие на электродах;
область применения электролиза.
У м е т ь:
составлять уравнения реакций, протекающих на
электродах;собирать цепи, пользоваться простейшими
приборами, производить расчеты;вычислять массы веществ, выделяемых на
электродах при электролизе.
Оборудование и реактивы. Источник тока,
амперметр, ключ, реостат, соединительные провода,
стакан, электроды, весы, часы, видеомагнитофон;
раствор соли CuSO4.
ХОД УРОКА
Теоретическая часть
Учитель. Физика и химия –
необыкновенные науки. Их законы универсальны.
Они с успехом объясняют свойства кристаллов и
живых клеток, помогают производить стыковку
космических кораблей и выполнять сложнейшие
операции. Благодаря им сегодня можно направить
ракету в любую точку пространства и играть в
шахматы на расстоянии.
Эти законы неизменны. Нашим потомкам не
придется их пересматривать, открывать заново.
Физика влияет на многие науки – биологию
(биофизика), химию (физическая химия). Но и они
влияют на нее: обогащают, двигают вперед. Сегодня
мы рассмотрим связь между физикой и химией на
примере одного процесса. Для этого проводим
обобщающий урок.
Электролиз – под таким названием объединяются
физико-химические процессы, происходящие на
электродах, когда через растворы или расплавы
электролитов проходит электрический ток.
Процессы электролиза меди и никеля – одни из
основных процессов, происходящих на заводах
нашего города, позволяющие получать в чистом
виде медь и никель и попутно извлекать ценные
продукты: кобальт, платину, золото, серебро,
селен, теллур. Итак, начнем работу.
Повторение ранее изученного
1. Назовите носители зарядов, как они
образуются?
2. Что представляет собой электрический ток в
электролитах?
3. Условия его возникновения?
4. Почему электролиты называют проводниками
второго рода?
5. Расскажите о явлениях, происходящих при
прохождении электрического тока через водные
растворы: CuCl2, HCl; Na2SO4.
6. Что такое электролиз?
7. Что такое электролит? католит? анолит?
8. Что такое матрица?
9. Записать и прочитать: первый закон Фарадея
(объяснить его физический смысл), второй закон
Фарадея.
Сегодня мы в ходе урока проведем эксперимент, в
процессе которого получим чистую медь.
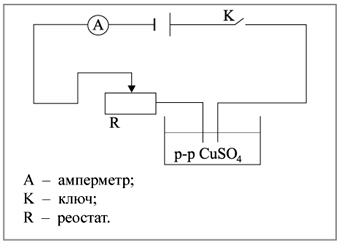
Для этого сейчас соберем электрическую цепь,
предварительно взвесив электроды.
А – амперметр;
K – ключ;
R – реостат.
Засекаем время, записываем начальную массу
катода и, пока идет процесс электролиза,
продолжаем урок.
Какие же процессы протекают на катоде и на
аноде, как определить продукты электролиза
водных растворов электролитов?
1-й ученик. Процесс на катоде зависит
не от материала катода, из которого он сделан, а
от положения металла (катиона электролита) в
электрохимическом ряду напряжений.
Если катион электролита расположен в ряду
напряжений в начале ряда (по Al включительно),
то на катоде идет процесс восстановления воды
(выделяется водород Н2). Катионы металла не восстанавливаются,
они остаются в растворе.
Если катион электролита находится в ряду
напряжений между алюминием и водородом, то на
катоде восстанавливаются одновременно и ионы
металла, и молекулы воды.
Если катион электролита находится в ряду
напряжений после водорода, то на катоде
восстанавливаются катионы металла.
Если в растворе содержатся катионы разных
металлов, то сначала восстанавливается катион
металла, стоящего в ряду напряжений правее.
2-й ученик. Процесс на аноде зависит
от материала анода и от природы аниона.
Если анод растворяется (железо, цинк, медь,
серебро и все металлы, которые окисляются в
процессе электролиза), то окисляется металл
анода, несмотря на природу аниона.
Если анод не растворяется (его называют
инертным – графит, золото, платина), то:
а) при электролизе растворов солей
бескислородных кислот (кроме фторидов) на аноде
идет процесс окисления аниона;
б) при электролизе растворов солей
кислородсодержащих кислот и фторидов на аноде
идет процесс окисления воды (выделяется О2). Анионы не окисляются,
они остаются в растворе.
Учитель. Сегодня мы коснемся лишь
некоторых применений электролиза, в которых
наиболее ярко выражена связь науки и техники.
3-й ученик. Кто не мечтает покрыть
изделие слоем (пленкой) благородного металла,
защитить изделие от коррозии, повысить стойкость
на износ, произвести декоративную отделку?
Гальванические цеха существуют либо при
металлургических заводах, либо отдельно.
Получение электролитическим способом более
толстых отложений (до 2–3 мм) называется
гальванопластикой.
В 1838 г. Б.С.Якоби открыл способ получения
абсолютно точных рельефных копий предмета.
Для этого с предмета делают слепок из
пластичного материала (гипс, воск). Затем слепок
помещают в электролитическую ванну, делая ее
катодом. Пропускают через ванну электрический
ток, слепок покрывается слоем металла и
отделяется, после чего его можно использовать
снова.
Гальванопластика обладает тремя
преимуществами:
• быстрота изготовления копий;
• получение слепка из металлов:
• возможность воспроизведения копий.
Таким же путем изготавливают медали, монеты,
произведения искусства.
В 1845 г. в Петербурге было организовано
предприятие герцога Лихтенбергского, которое
подобным образом изготавливало барельефы статуй
Исаакиевского и Петропавловского соборов,
Эрмитажа, Зимнего дворца, Большого театра.
В 1888 г. немецкий инженер Э.Берлинер предложил
использовать в качестве носителя звука цинковый
диск, покрытый тонким слоем воска. С диска
снимали металлическую копию – матрицу, с которой
путем штамповки из целлулоида, эбонита, каучука
получали грампластинки. Первая такая пластинка
хранится в Национальном музее США.
В 1957–1958 гг. в США начался выпуск
стереофонических пластинок. Матрицу
изготавливают способом прессования из листов
винипласта (непластифицированный
поливинилхлорид). Чтобы получить точную копию
оригинала, надо получить копию с матрицы.
Для этого матрицу покрывают тонким слоем
порошка, который проводит ток (графит), и помещают
в электролитическую ванну. На матрице
осаждают слой металла (обычно Cu). Потом этот
слой отделяют и используют для штамповки.
С помощью матрицы можно изготовить большое
число пластинок, сходных с оригиналом.
Методом гальванопластики изготавливают медные
клише для типографии, позволяющие делать до 40
тыс. оттисков, а после дополнительного
хромирования – до 1,5 млн оттисков.
Гальванопластика дает возможность производить
пресс-формы из пластмассы, резины, металла,
заменяя трудоемкие работы
высококвалифицированных токарей и граверов.
Посмотрите, как это делают (фрагмент
видеофильма).
4-й ученик. Человек – основа всего.
Знание физики и химии помогает нам в жизни,
делает нас грамотными людьми. Человек должен
уметь пользоваться электролизом.
Как лучше принять лекарство? Что такое
электрофорез? Ответы на эти вопросы дает наш
врач.
Каждый из разделов науки помогает разным
отраслям науки. В ядерной физике используют
тяжелую воду D2О – это один из
компонентов ядерного оружия, в нем нуждается
ядерная энергетика. D2О используют как
заменитель в ядерных реакторах. Тяжелую воду
наша страна экспортирует. В обычной воде ионы
D+ обладают меньшей подвижностью, чем ионы
Н+. В электролите же, наоборот,
увеличивается процентное содержание молекул
тяжелой воды. Тяжелую воду получают электролизом
морской воды. В 10 кг морской воды содержится 2 г
тяжелой воды. В H2O Аr(H) = 1, в
D2O Аr(D) = 2. Поскольку подвижность
D+ и D2О меньше, чем Н+ и
Н2О, то при пропускании электрического
тока через воду на электролитах будут окисляться
и восстанавливаться молекулы обычной воды.
Вспомним: вода – слабый электролит,
незначительно диссоциирует на ионы H+ и
OH–.
На а н о д е : 4Н2О – 4e 4H+ + 2Н2O + О2
.
На к а т о д е : 4Н2О + 4e 2Н2
+ 4OН–.
Ионы Н+ и ОН–, образовавшиеся
в результате данных процессов, участвуют в
дальнейшем окислении-восстановлении, т.е.
разложению подвергаются молекулы воды с атомом
водорода, имеющем Ar = 1, молекулы же
тяжелой воды остаются в растворе. Электролизом
последней выделяют дейтерий, который затем
соединяют с кислородом, т.е. синтезируют тяжелую
воду.
Учитель. Вот и заканчивается наше
небольшое путешествие по одному из
многочисленных заливов океана науки –
электролизу. В будущем многим из вас придется
осваивать новые области применения электролиза,
работая на медном или никелевом заводах нашего
города.
Практическая часть
Итак, мы рассмотрели процессы, происходящие при
электролизе, область применения электролиза, и
теперь можно переходить к практической части
нашей работы.
Заканчиваем эксперимент, отключаем цепь,
отмечаем время, затраченное на эксперимент, и
взвешиваем электроды. С помощью закона
Фарадея вычисляем электрохимический эквивалент
(k) вещества.
СИ*
Решение
m = m2
– m1.
По 1-му закону Фарадея:
Ответ. 3•10–7 кг/Кл.
Закрепление знаний, умений, навыков
(ЗУН) (решение задач)
З а д а ч а 1. При никелировании изделий в
течение 2 ч отложился слой никеля толщиной
0,03 мм. Определить плотность тока при
электролизе. Электрохимический эквивалент
никеля равен
3•10–7 кг/Кл.
Решение
По определению:
Из 1-го закона Фарадея следует:
В результате получаем:
Ответ. 124 А/м2.
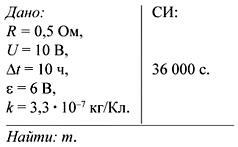
З а д а ч а 2. При рафинировании меди с помощью
электролиза к последовательно включенным
электролитическим ваннам, имеющим общее
сопротивление 0,5 Ом, подведено напряжение 10 В.
Определить количество чистой меди, выделившейся
на катодах ванны за 10 ч. ЭДС поляризации равна
6 В. Электрохимический эквивалент меди равен
3,3•10–7 кг/Кл.
Решение
По закону Ома: U = IR + .
По 1-му закону Фарадея: m = kIt.
Ответ. 9,5•10–2 кг.
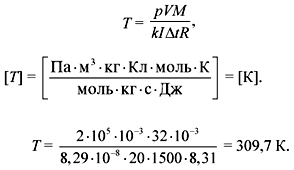
З а д а ч а 3. При электролизе воды через ванну
в течение 25 мин шел ток 20 А. Какова температура
выделившегося кислорода, если он находится в
объеме 1 л под давлением 2 атм?
Электрохимический эквивалент кислорода 8,29•10–8
кг/Кл.
Решение
Из уравнения Менделеева–Клапейрона:
Из 1-го закона Фарадея: m = kIt.
Получаем:
Ответ. 309,7 К.
З а д а ч а 4. Какая масса меди выделится на
катоде при электролизе раствора сульфата меди
массой 200 г?
Решение
200/320 = х/128, x = 80 г.
Ответ. 80 г.
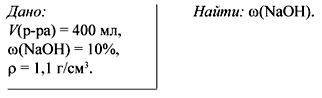
З а д а ч а 5. Вычислить массовую долю
вещества, получившегося в результате
электролиза
400 мл 10%-го раствора гидроксида натрия ( = 1,1 г/см3), если
известно, что при этом выделилось
56 см3 кислорода, измеренного при н.у.
Решение
К (–): 4Н2О + 4e 2Н2
+ 4OН–.
A (+): 4Н2О – 4e 2Н2O + О2 + 4H+.
Фактически происходит разложение воды:
2H2O = 2H2 + O2.
а) Определяем массу воды, подвергшуюся
разложению:
из 36 г – 22,4 см3 O2,
из x г – 56 см3 O2.
х/36 = 56/22,4, х = 90 г.
б) определяем массу раствора после электролиза:
m(р-ра) = 440 (г) – 90 (г) = 350 г.
(NaOH) =
44/350 • 100(%) = 12,57%.
Ответ. 12,57%.
Самостоятельная практическая
работа
Цель: убедиться в основных закономерностях
электрического тока в электролитах; решить
расчетные задачи.
З а д а н и е 1-й г р у п п е.
1. Определить скорость движения ионов при
электролизе (предложены поваренная соль, медный
купорос). Задание выполняется по описанию в
энциклопедическом словаре по физике.
2. Какие вещества и в каких количествах (m,
V) образуются при электролизе расплава 234 г
хлорида натрия. Сколько грамм железа может
вступить в реакцию с веществом, выделяющимся на
аноде?
З а д а н и е 2-й г р у п п е.
1. Определение заряда иона водорода.
Оборудование: источник тока, стакан с раствором
хлорида натрия, два электрода, пробирка
стеклянная, миллиамперметр, часы, ключ.
Запишите химические реакции, происходящие при
электролизе раствора хлорида натрия.
2. При полном электролизе раствора
двухвалентного хлорида меди на аноде выделилось
11,2 г газа (н.у.). Что и в каком количестве
выделилось на катоде?
З а д а н и е 3-й г р у п п е.
1. Определить электрохимический эквивалент
никеля. Оборудование: источник тока, амперметр,
реостат, стакан с раствором соли, соединительные
провода, часы, ключ.
2. На заводе был подвергнут электролизу
раствор, содержащий 468 кг хлорида натрия.
Полученные газы использовали для синтеза
хлороводорода, который растворили в 708 л воды.
Вычислить массовую долю хлороводорода в
полученной соляной кислоте.
З а д а н и е 4-й г р у п п е.
1. Снять вольтамперную характеристику для
твердых и жидких проводников. Предложить схему
установок, сделать выводы.
2. При электролизе 10 л раствора серной
кислоты с = 1,3 г/cм3
и молярной концентрацией 5 моль/л на катоде
выделилось 560 л газа. Определить массовую долю
вещества, находящегося в растворе после
электролиза.
Подведение итогов урока.
Л и т е р а т у р а
Адамович Т.П. и др. Сборник усложненных
задач по химии. Минск: Высшая школа, 1973; Ахметов
Н.С. Неорганическая химия. 8–9 класс. М.:
Просвещение, 1990; Бытько Н.Д. Физика. М.: Высшая
школа, 1967; Гудкова А.Е. и др. 500 задач по
химии. М.: Просвещение, 1977; Енохович А.С. Справочник
по физике и технике. М.: Просвещение, 1975; Елисеев
А.А. Б.С. Якоби. М.: Просвещение, 1978; Жданов В.А. и
др. Курс физики. М.: Высшая школа, 1978; Кузей М.Е.
Уроки физики в 9 классе. Минск: Народная асвета,
1985; Череда М.П. Конкурсные задачи по химии.
Киев: Вища школа, 1988; Фельдман Ф.Г., Рудзитис Т.Е.
Химия-9. М.: Просвещение, 1992; Шахмаев Н.М.,
Шахмаев С.М., Шодиев Д.Ш. Физика-10. М.:
Просвещение, 1991; Энциклопедический словарь юного
химика. М.: Педагогика, 1990.
* СИ – перевод единиц
измерения в СИ (международная система измерения).
Л.Ф.БЛИНОВА,
учитель химии;
О.Н.Кремнева,
учитель физики школы № 3
(г. Норильск)
Основные параметры электролиза
1.2. Основные параметры электролиза
Основными параметрами, характеризующими процесс электролиза, являются сила тока, плотност ь тока, выход по току, напряжение на ванне (табл. 1.2).
Сила тока представляет собой отношение приложенного напряжения к сопротивлению ванны и выражается в амперах (А). 1А= 1 вольт/10м =1 В/10м:.
I = U/R,.
Плотность тока представляет собой отношение силы тока к площади электрода, находящегося в электролите . выражается в А/дм2 или А/см2. Электролиты – химические вещества, водные растворы которых проводят электрический ток.
Если покрываемое изделие имеет суммарную поверхность, равную 40 дм
. а через ванну протекает ток в 120А, то плотность тока составляет ЗА/дм
. Сила тока в гальванической ванне равна плотности тока (1
), умноженной на суммарную поверхности деталей (S), одновременно загруженных в ванну:.
1 = IkS.
Для расчета силы тока в ванне необходимо знать площадь покрываемых изделий и плотности тока, требуемой ля получения покрытия.
Наибольшая возможная площадь покрываемого изделия определяется по формуле.
S ~ I / 1к ■).
Например, плотность катодного тока в ванне для золочения I
– 0,8А/дм
. возможная сила тока выпрямителя I = 2А. Наибольшая площадь покрываемого изделия будет равна.
S = I / 1к = 2/0.8 – 2.5дм
По площади покрываемого изделия вычисляют плотность тока. Если при гальваническом покрытии применить высокие плотности тока (выше рассчитанного), то процесс ускоряется. Но при этом на покрытии будут образовываться большие кристаллы, оно будет рыхлым и пористым. Такое покрытие имеет плохое сцепление с металлом и может отслаиваться.
Выход по току. В гальванотехнике значение выхода по току определяется отношением количества металла, осажденного на катоде (катодный выход по току) или растворившегося на аноде (анодный выход по току), к количеству металла, рассчитанному по закону Фарадея:.
.
где q
.- количество электричества, теоретически рассчитанное (по закону Фарадея); q, – количество электричества практически расходуемые на единицу продукта: м
– количество вещества, фактически выделившиеся на электроде; м
_- количество вещества теоретически рассчи танное.
Отметим, что масса (в граммах) 1мкм металлического покрытия, нанесенного на поверхность !Г . численно равна плотности данного металла, г/см. Например, для покрытия 1 м” поверхности 1 мкм слоем золота, плотностью 19,3г/см требуется 19,Зг золота.
Напряжение в ванне вычисляется по формуле.
U = (l+p) [q>, + q>K + U+a)IR].
где р – коэффициент .учитывающий потери на контактах покрываемых деталей: ср
, ф
потенциалы анода и катода соответственно. В; а – коэффициент, учитывающий потери напряжения в ванне за счет газонаполнения; I – сила тока в ванне. A; R – сопротивление электролита. Ом.
|
Таблица 1.2. Электролит I Плотность тока А/дм
2 і Потенциал, В і R.Om j Коэффициенты |
||||||||||||||||||||||||||||||
|
1.3.