Решение.
Рассчитаем плотности компонентов
газовой смеси:
;
;
.
Рассчитаем плотность газовой смеси:
.
Задача 3.
Определить плотность водного раствора
уксусной кислоты при температуре 53°С.
Содержание кислоты в растворе 50% (масс.).
Решение.
Рассчитаем плотность водного раствора
уксусной кислоты двумя различными
способами и сравним полученные результаты.
Рассчитаем плотность 50%-го водного
раствора уксусной кислоты при температуре
53°С по справочным данным из [1, табл. IV].
Плотность 50%-го раствора при 40°С и при
60°С составляет соответственно:
,
.
Методом линейной интерполяции находим
плотность раствора при 53°С:
Следовательно, плотность 50%-го водного
раствора уксусной кислоты при 53°С равна:
.
Теперь определим плотность смеси по
формуле
,
для этого предварительно определим
плотность уксусной кислоты и воды при
53°С методом линейной интерполяции. Из
[1, табл.IV] возьмём значения
плотностей этих веществ при 40°С и 60°С:
,
,
,
.
Из подобия большого и малого
(заштрихованного) треугольников получаем
соотношения:
;
.
Следовательно, плотности кислоты и воды
при 53°С соответственно равны:
,
.
Тогда плотность смеси составляет:

Ошибка, обусловленная объёмным эффектом
смешения составляет:
.
Задача 4.
Определить плотность и вязкость дымовых
газов, полученных при сжигании углерода.
Температура дымовых газов 300°С, давление
745 мм рт. ст. Коэффициент избытка
воздуха 1,2.
Решение.
Уравнение реакции горения: С + О2→ СО2
Задаваясь количеством углерода равным
1 моль, получаем:
;
;
;

.
Рассчитаем молярные (объёмные) доли
компонентов дымовых газов:

;
.
Рассчитаем молярную массу дымовых
газов:
.
Рассчитаем плотность дымовых газов:
.
Расчёт вязкости дымовых газов проводим,
пренебрегая влиянием давления.
Рассчитаем вязкость компонентов:

;
.
Значения вязкости при норм. условиях
μ0и константы Сатерленда
взяты из [1, табл.V].
Рассчитаем вязкость дымовых газов,
воспользовавшись двумя различными
формулами и сравнив полученные результаты
(значения
см. [1, табл.XI]):
;

Задача 5.
Определить плотность и вязкость паровой
смеси при 100°С, полученной испарением
2 л этилового эфира и 3 л ацетона.
Решение.
Плотности жидких эфира и ацетона при
20°С [6, c. 14]:,
.
Масса эфира и ацетона:
,
.
Количество вещества эфира и ацетона:
,
.
Молярные (объёмные) доли эфира и ацетона
в паровой смеси:

.
Молярная масса паров:
.
Плотность паров:
.
Вязкости паров компонентов при 100°С [6,
c. 22]:,
.
Вязкость смеси:

Семинар 3.
Уравнение
гидростатики.
Задача 6.
Рассчитать силы гидростатического
давления, действующие на дно и стенки
цилиндрического сосуда диаметром 1 м
и высотой 2 м заполненного водой.
Плотность воды принять равной 1000 кг/м3.
Решение.
В соответствие с уравнением гидростатики
[4, c. 102],
рассчитаем давление, действующее на
дно сосуда. Для этого запишем уравнение
гидростатики для двух сечений (сечение
1 – поверхность жидкости, сечение 2 –
дно сосуда):,
гдер1ир2– абсолютные
давления на поверхности жидкости и на
дне сосуда соответственно,z1иz2– нивелирные
высоты (расстояния до условной
горизонтальной плоскости).
Преобразуя уравнение гидростатики,
получаем:
.
Здесь
избыточное давление, действующее на
дно сосуда;высота столба жидкости (воды) в сосуде.
Тогда
.
Площадь дна сосуда:
.
Сила, действующая на дно сосуда:
.
С другой стороны, сила, действующая на
дно сосуда, может быть рассчитана по
закону Ньютона, как произведение массы
на ускорение.
Объём сосуда:
.
Масса воды в сосуде:
.
Сила, действующая на дно сосуда:
.
Давление, действующее на стенки сосуда,
возрастает по мере приближения к дну.
Зависимость давления от высоты столба
жидкости линейная. Поэтому среднее
давление, действующее на стенки сосуда,
может быть рассчитано как давление в
средней части сосуда:

Площадь боковой поверхности сосуда:
.
Сила, действующая на боковую поверхность:
.
Задача 7.
Определить высоту столба жидкости, если
в трубке Торричелли (ртутном барометре)
использовать воду вместо ртути. Расчёт
провести для трёх температур 20, 60 и 90°С.
Атмосферное давление принять равным
745 мм Hg.
Величина плотности растворителя в определенной степени определяет уровень его чистоты, и уксусная кислота не исключение.
Плотность уксусной кислоты, как и любых других веществ, принято измерять при температуре 20 °С и сравнивают ее с плотностью воды, измеренной при температуре 4 °С. Следует отметить, что уровень плотности большинства органически растворителей снижается при увеличении температуры. Их значение немного меньше чем у воды, однако, существует исключение – галогенированные углеводороды, у которых плотность выше, чем у воды.
Если вы не знаете, какова плотность уксусной кислоты, тогда запоминайте – она составляет 1,0492 г/см³.
Однако следует отметить, что плотность уксусной кислоты напрямую зависит от ее концентрации. Поэтому существует специальная таблица, которая позволяет опередить плотность кислоты в зависимости от уровня ее концентрации в жидкости.
Независимо от уровня плотности уксусной кислоты, в ходе ее применения нужно использовать средств индивидуальной защиты. Они защитят вашу кожу, глаза, дыхательные пути от негативного воздействия кислоты. Особенно важно применять средства индивидуальной защиты в случае работ с высококонцентрированной уксусной кислотой.
Как измерить плотность уксусная эссенция
Знаток
(317),
закрыт
12 лет назад
Дополнен 12 лет назад
Как замерить 80% ый ли получился раствор уксусной кислоты или нет? Это если другими словами. В домашних условиях.
Ирина Рудерфер
Высший разум
(120406)
12 лет назад
Плотность уксусной кислоты равна 1,0748 г/мл (при 15 оС) , эту величину и должен показать ареометр. Но метод это не очень точный, и зависит от точности ареометра.
Например, 76%-ный раствор имеет плотность 1,0747, а 82%-ный – 1,0746.
Если Ваш ареометр различает 1,0748, 1,0747 и 1,0746, то определите концентрацию с достаточнй точностью.
| Уксусная кислота | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Этановая кислота | |
| Сокращения | Уксус | |
| Традиционные названия | Уксусная кислота | |
| Хим. формула | CH3COOH | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 60,05 г/моль | |
| Плотность | 1,0492 г/см³ | |
| Поверхностное натяжение | 27,1 ± 0,01 мН/м[4], 24,61 ± 0,01 мН/м[4] и 22,13 ± 0,01 мН/м[4] | |
| Динамическая вязкость | 1,056 мПа·с[5], 0,786 мПа·с[5], 0,599 мПа·с[5] и 0,464 мПа·с[5] | |
| Энергия ионизации | 10,66 ± 0,01 эВ[1] | |
| Термические свойства | ||
| Температура | ||
| • плавления | 16,75 °C | |
| • кипения | 118,1 °C | |
| • вспышки | 103 ± 1 ℉[1] и 39 ± 6 °C[2] | |
| • самовоспламенения | 427 ± 1 °C[3] | |
| Пределы взрываемости | 4 ± 0,1 об.%[1] | |
| Критическая точка | 321,6 °C, 5,79 МПа | |
| Мол. теплоёмк. | 123,4 Дж/(моль·К) | |
| Энтальпия | ||
| • образования | −487 кДж/моль | |
| Давление пара | 11 ± 1 мм рт.ст.[1], 10 ± 1 кПа[6] и 100 ± 1 кПа[6] | |
| Химические свойства | ||
Константа диссоциации кислоты  |
4,76 (Ka=1,75*10-5) | |
| Оптические свойства | ||
| Показатель преломления | 1,372 | |
| Структура | ||
| Дипольный момент | 1,74 Д | |
| Классификация | ||
| Рег. номер CAS | 64-19-7 | |
| PubChem | 176 | |
| Рег. номер EINECS | 200-580-7 | |
| SMILES |
CC(=O)O |
|
| InChI |
InChI=1S/C2H4O2/c1-2(3)4/h1H3,(H,3,4) QTBSBXVTEAMEQO-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E260 | |
| RTECS | AF1225000 | |
| ChEBI | 15366 | |
| Номер ООН | 2789 | |
| ChemSpider | 171 | |
| Безопасность | ||
| Пиктограммы ECB |
|
|
| NFPA 704 |
2 3 1 ACID |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
У́ксусная кислота́ (эта́новая кислота, химическая формула — C2H4O2 или CH3COOH, AcOH) — cлабая органическая кислота, относящаяся к классу предельных карбоновых кислот.
При стандартных условиях уксусная кислота — это одноосновная карбоновая кислота, представляющая собой бесцветную жидкость с характерным резким запахом и кислым вкусом.
Соли и сложные эфиры уксусной кислоты называются ацета́тами.
История[править | править код]
Завод, производящий уксусную кислоту. 1884 год
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к III веку до н. э. Греческий учёный Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения свинцовых белил, а также ярь-медянки (зелёной смеси солей меди, содержащей, помимо прочего, ацетат меди). В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». Сапа содержала большое количество ацетата свинца, который также называют свинцовым сахаром или сахаром Сатурна. Высокая популярность сапы была причиной хронического отравления свинцом, распространённого среди римской аристократии[7].
В VIII веке арабский алхимик Джабир ибн Хайян впервые изложил способы получения уксуса.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреасом Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Огюстом Аде (фр. Pierre Auguste Adet)[7].
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорирование сероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту[8].
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия — в 1910 году ею было произведено более 10 тысяч тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго[7][9].
Физические свойства[править | править код]
Уксусная кислота — это одноосно́вная карбоновая кислота, представляющая собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Смешивается с водой в любых соотношениях, а также со многими растворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. В растворах и парах присутствует в виде циклических и линейных димеров[10].
Абсолютная уксусная кислота называется ледяной, так как при замерзании образует льдовидную массу. Способ получения ледяной уксусной кислоты в 1789 году открыл российский химик немецкого происхождения Товий Егорович Ловиц.
| Давление паров (в мм. рт. ст.): | Температура(°C) |
|---|---|
| 10 | 17,1 |
| 40 | 42,4 |
| 100 | 62,2 |
| 400 | 98,1 |
| 560 | 109 |
| 1520 | 143,5 |
| 3800 | 180,3 |
- Относительная диэлектрическая проницаемость: 6,15 (+20 °C)
- Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (+25,2 °C); 0,79 (+50 °C)
- Поверхностное натяжение: 27,8 мН/м (+20 °C)
- Удельная теплоёмкость при постоянном давлении: 2,01 Дж/г·K (+17 °C)
- Стандартная энергия Гиббса образования ΔfG0 (298 К, кДж/моль): −392,5 (ж)
- Стандартная энтропия образования ΔfS0 (298 К, Дж/моль·K): 159,8 (ж)
- Энтальпия плавления ΔHпл: 11,53 кДж/моль
- Температура вспышки в воздухе: +38 °C
- Температура самовоспламенения на воздухе: 454 °C
- Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | tкип, °C | массовая доля уксусной кислоты |
|---|---|---|
| четырёххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
- Уксусная кислота образует тройные азеотропные смеси
- с водой и бензолом (tкип +88 °C);
- с водой и бутилацетатом (tкип +89 °C).
- Криоскопическая постоянная: 3,6 К кг/моль
Получение[править | править код]
В промышленности[править | править код]
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана[11].
Ацетальдегид окислялся в присутствии ацетата марганца(II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 % при температуре +50—+60 °С.
Окисление н-бутана проводилось при 150 атм. Катализатором этого процесса являлся ацетат кобальта.
Оба метода основаны на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными и были вытеснены более совершенными каталитическими процессами карбонилирования метанола[11].
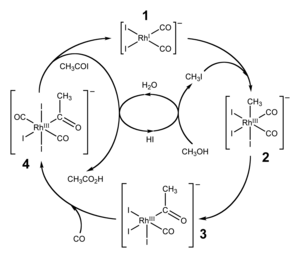
Каталитическое карбонилирование метанола[править | править код]
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола монооксидом углерода[12], которое происходит по формальному уравнению:
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом[13]. Катализатором превращения служил йодид кобальта. Метод заключался в барботировании монооксида углерода при температуре 180 °С и давлениях 200—700 атм через смесь реагентов. Выход уксусной кислоты составляет 90 % по метанолу и 70 % по СО. Одна из установок была построена в Гейсмаре (шт. Луизиана) и долго оставалась единственным процессом BASF в США[14].
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году[15][16]. Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO)[11].
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты[17].
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Биохимический способ производства[править | править код]
При биохимическом производстве уксусной кислоты используется способность некоторых микроорганизмов окислять этанол. Этот процесс называют уксуснокислым брожением. В качестве сырья используются этанолсодержащие жидкости (вино, забродившие соки), либо же просто водный раствор этанола[18].
Реакция окисления этанола до уксусной кислоты протекает при участии фермента алкогольдегидрогеназы. Это сложный многоступенчатый процесс, который описывается формальным уравнением[19]:
Гидратация ацетилена в присутствии ртути и двухвалентных солей ртути[править | править код]
-
— реакция Кучерова
Химические свойства[править | править код]
Уксусная кислота обладает всеми свойствами карбоновых кислот и иногда рассматривается как их наиболее типичный представитель (в отличие от муравьиной кислоты, которая обладает некоторыми свойствами альдегидов). Связь между водородом и кислородом карбоксильной группы (−COOH) карбоновой кислоты является сильно полярной, вследствие чего эти соединения способны легко диссоциировать и проявляют кислотные свойства.

В результате диссоциации уксусной кислоты образуется ацетат-ион CH3COO− и протон H+. Уксусная кислота является слабой одноосновной кислотой со значением pKa в водном растворе равным 4,75. Раствор с концентрацией 1,0 M (приблизительная концентрация пищевого уксуса) имеет pH 2,4, что соответствует степени диссоциации 0,4 %.
На слабой диссоциации уксусной кислоты в водном растворе основана качественная реакция на наличие солей уксусной кислоты: к раствору добавляется сильная кислота (например, серная), если появляется запах уксусной кислоты, значит, соль уксусной кислоты в растворе присутствует (кислотные остатки уксусной кислоты, образовавшиеся из соли, связались с катионами водорода от сильной кислоты и получилось большое количество молекул уксусной кислоты)[20].
Исследования показывают, что в кристаллическом состоянии молекулы образуют димеры, связанные водородными связями[21].
Уксусная кислота способна взаимодействовать с активными металлами. При этом выделяется водород и образуются соли — ацетаты:
Уксусная кислота может хлорироваться действием газообразного хлора. При этом образуется хлоруксусная кислота:
Характерные реакции уксусной кислоты
Этим путём могут быть получены также дихлоруксусная (CHCl2COOH) и трихлоруксусная (CCl3COOH) кислоты.
Уксусная кислота может быть восстановлена до этанола действием алюмогидрида лития. Она также может быть превращена в хлорангидрид действием тионилхлорида. Натриевая соль уксусной кислоты декарбоксилируется при нагревании со щелочью, что приводит к образованию метана и карбоната натрия.
Взаимодействует как с растворимыми гидроксидами (щелочами), так и с нерастворимыми гидроксидами
Уксусная кислота в биохимии организмов[править | править код]
Уксусная кислота образуется в живых организмах в процессе углеводного обмена, в том числе в организме человека в процессе биохимических реакции, в частности в цикле Кребса, утилизации алкоголя.
Применение[править | править код]
Уксусную кислоту, концентрация которой близка к 100 %, называют «ледяной». 70—80%-й водный раствор уксусной кислоты называют «уксусной эссенцией», а 3—15%-й — «уксусом»[22]. Водные растворы уксусной кислоты используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании и для избавления от накипи. Однако количество уксусной кислоты, используемой в качестве уксуса, очень мало, по сравнению с количеством уксусной кислоты, используемой в крупнотоннажном химическом производстве.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, таких как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении.
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния (что является нежелательным, если только это необходимо для его эвакуации из опасного места его собственными силами).
Токсикология[править | править код]
Безводная уксусная кислота — едкое вещество. Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей. Предельно допустимая концентрация в атмосферном воздухе составляет 0,06 мг/м3, в воздухе рабочих помещений — 5 мг/м3[10][23]. Порог восприятия запаха уксусной кислоты в воздухе по данным[10],[24] составляет 300—500 мг/м3 (то есть в 100 раз превышает ПДК).
Местное действие уксусной кислоты на биологические ткани зависит от степени её разбавления водой. Опасными считаются растворы, в которых концентрация кислоты превышает 30 %[10]. Концентрированная уксусная кислота способна вызывать химические ожоги, инициирующие развитие коагуляционных некрозов прилегающих тканей различной протяженности и глубины[25].
Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена[26]. Смертельная разовая доза составляет примерно 20 мл (при энтеральном приёме в перерасчёте на 100 % кислоту).
Последствиями приёма внутрь концентрированной уксусной кислоты являются тяжёлый ожог слизистой оболочки полости рта, глотки, пищевода и желудка; общетоксические последствия отравления уксусной кислотой — ацидоз, гемолиз, гемоглобинурия, нарушение свёртываемости крови, сопровождающееся тяжёлыми желудочно-кишечными кровотечениями. Характерно значительное сгущение крови из-за потери плазмы через обожжённую слизистую оболочку, что может вызвать шок. К опасным осложнениям отравления уксусной эссенцией относятся острая почечная недостаточность и токсическая дистрофия печени.
В качестве первой помощи при приёме уксусной кислоты внутрь следует выпить большое количество жидкости. Вызов рвоты является крайне опасным, так как вторичное прохождение кислоты по пищеводу усугубит ожог, также кислое содержимое может попасть в дыхательные пути. Допускается в целях нейтрализации кислоты и защиты слизистой приём жжёной магнезии, сырого яичного белка, киселя. Нельзя употреблять в этих целях соду, так как образующийся углекислый газ и вспенивание будет также способствовать забросу кислоты обратно в пищевод, гортань, а также может привести к прободению стенок желудка. Показано промывание желудка через зонд. Необходима немедленная госпитализация.
При ингаляционном отравлении парами требуется ополоснуть слизистые водой или 2 % раствором пищевой соды, приём внутрь молока, слабого щелочного раствора (2 % сода, щелочные минеральные воды) с последующей госпитализацией.
Примечания[править | править код]
- ↑ 1 2 3 4 http://www.cdc.gov/niosh/npg/npgd0002.html
- ↑ CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 16—19. — ISBN 978-1-4822-0868-9
- ↑ http://www.cdc.gov/niosh/ipcsneng/neng0363.html
- ↑ 1 2 3 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—182. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 4 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—232. — ISBN 978-1-4822-0868-9
- ↑ 1 2 CRC Handbook of Chemistry and Physics (англ.) / W. M. Haynes — 95 — Boca Raton: CRC Press, 2014. — P. 6—95. — ISBN 978-1-4822-0868-9
- ↑ 1 2 3 Martin, Geoffrey. Industrial and Manufacturing Chemistry (неопр.). — Part 1, Organic. — London: Crosby Lockwood, 1917. — С. 330—31.
- ↑ Goldwhite, Harold. Short summary of the career of the German organic chemist, Hermann Kolbe (англ.) // New Haven Section Bull. Am. Chem. Soc. : journal. — 2003. — September (vol. 20, no. 3). Архивировано 4 марта 2009 года.
- ↑ Schweppe, Helmut. Identification of dyes on old textiles (неопр.) // J. Am. Inst. Conservation. — 1979. — Т. 19, № 1/3. — С. 14—23. — doi:10.2307/3179569. Архивировано 29 мая 2009 года.
- ↑ 1 2 3 4 Уксусная кислота. Дата обращения: 8 сентября 2009. Архивировано 5 июня 2008 года.
- ↑ 1 2 3 Реутов О. А. Органическая химия. — М.: Изд-во МГУ, 1999. — Т. 4.
- ↑ Advances in Organometallic Chemistry. Дата обращения: 3 октября 2017. Архивировано 17 сентября 2014 года.
- ↑ Acetic Acid Production and Manufacturing Process. Дата обращения: 13 сентября 2009. Архивировано 6 октября 2009 года.
- ↑ Б. Лич. Катализ в промышленности. Том 1. — Москва: Мир, 1986. — 324 с.
- ↑ U.S. Patent 3 769 329
- ↑ Патент США
- ↑ Экологический фактор, или Окружающая среда как стимул эволюции промышленной химии. Дата обращения: 11 сентября 2009. Архивировано 28 января 2010 года.
- ↑ Кандидат биологических наук Н. Кустова. Уксус. Что это такое и как его делают. Интернет-ресурс «Всякая всячина». Дата обращения: 2 сентября 2010. Архивировано из оригинала 20 октября 2009 года.
- ↑ Биотехнология органических кислот и белковых препаратов: Учебное пособие (недоступная ссылка)
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 8. Реакции ионного обмена // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 15—18. — 2 350 000 экз.
- ↑ Jones, R.E.; Templeton, D. H. The crystal structure of acetic acid (англ.) // Acta Crystallogr. (англ.) (рус. : journal. — International Union of Crystallography, 1958. — Vol. 11, no. 7. — P. 484—87. — doi:10.1107/S0365110X58001341.
- ↑ Уксус — статья из Большой советской энциклопедии.
- ↑ (Роспотребнадзор). № 2400. Этановая кислота (уксусная кислота) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 162. — 170 с. — (Санитарные правила). Архивная копия от 12 июня 2020 на Wayback Machine
- ↑ Balavoine P. Observatiojns sur les Qualités Olfactifves et Gustatives des Aliments (англ.) // Mitteilungen aus dem Gebiete der Lebensmitteluntersuchung und Hygiene. — Bern: BAG, 1948. — Vol. 39. — P. 342–350. — ISSN 1424-1307. цитируется по: Odor Threshold Values Архивная копия от 11 июля 2020 на Wayback Machine p. 73.
- ↑ Уксусная кислота : Медицинский портал Eurolab. Дата обращения: 8 сентября 2009. Архивировано 15 декабря 2010 года.
- ↑ www.textra-vita.com/technology Глава 17. Уксусная кислота 7. Токсиколого-гигиеническая оценка. Дата обращения: 16 мая 2011. Архивировано из оригинала 25 мая 2012 года.
Ссылки[править | править код]
- Уксусная кислота
- Плотность водных растворов уксусной кислоты в зависимости от концентрации
Плотность жидких веществ и водных растворов в зависимости от температуры
Плотность жидкости в зависимости от температуры можно рассчитать по формуле
$rho_{2} = frac{ rho_{1} }{1 + beta(t_{2} – t_{1} )}$,
где $rho_{2}$ – искомая плотность жидкости при температуре $t_{2}$; $rho_{1}$ – известная плотность жидкости при температуре $t_{1}$; $beta$ – коэффициент термического объемного расширения жидкости, $К^{-1}$.
| Вещество | -20 ℃ | 0 ℃ | 20 ℃ | 40 ℃ | 60 ℃ | 80 ℃ | 100 ℃ | 120 ℃ |
|---|---|---|---|---|---|---|---|---|
| Азотная кислота ($HNO_{3}$) 100% | 1582 | 1547 | 1513 | 1478 | 1443 | 1408 | 1373 | 1338 |
| Азотная кислота ($HNO_{3}$) 50% | – | 1334 | 1310 | 1278 | 1263 | 1238 | 1212 | 1186 |
| Аммиак жидкий ($HN_{3}$) | 665 | 639 | 610 | 580 | 545 | 510 | 462 | 390 |
| Аммиачная вода ($NH_{3} cdot H_{2}O$) 25% | – | 918 | 907 | 897 | 887 | 876 | 866 | 856 |
| Анилин ($C_{6}H_{5}NH$) | – | 1039 | 1022 | 1004 | 987 | 969 | 952 | 933 |
| Ацетон ($C_{3}H_{6}O$) | 835 | 813 | 791 | 768 | 746 | 719 | 693 | 665 |
| Бензол ($C_{6}H_{6}O$) | – | 900 | 879 | 858 | 836 | 815 | 793 | 769 |
| Бутиловый спирт ($C_{4}H_{10}O$) | 838 | 824 | 810 | 795 | 781 | 766 | 751 | 735 |
| Вода ($H_{2}O$) | – | 1000 | 998 | 992 | 983 | 972 | 958 | 943 |
| Гексан ($C_{6}H_{14}$) | 693 | 677 | 660 | 641 | 622 | 602 | 581 | 559 |
| Глицерин, ($C_{3}H_{8}O_{3}$), 50% | – | 1136 | 1126 | 1116 | 1106 | 1006 | 996 | 986 |
| Диоксид серы ($SO_{2}$) | 1484 | 1434 | 1383 | 1327 | 1264 | 1193 | 1111 | 1010 |
| Дихлорэтан ($C_{2}H_{4}Cl_{2}$) | 1310 | 1282 | 1254 | 1224 | 1194 | 1163 | 1133 | 1102 |
| Диэтиловый эфир ($(C_{2}H_{5})_{2}O$) | 758 | 736 | 714 | 689 | 666 | 640 | 611 | 576 |
| Изопропиловый спирт ($C_{3}H_{8}O$) | 817 | 801 | 785 | 768 | 752 | 735 | 718 | 700 |
| Кальций хлористый, ($CaCl_{2} cdot H_{2})$) 25 % | 1248 | 1239 | 1230 | 1220 | 1210 | 1200 | 1190 | 1180 |
| м-Ксилол | – | 882 | 865 | 847 | 831 | 796 | 780 | 764 |
| Метиловый спирт, ($CH_{3}OH$) 100% | 828 | 810 | 792 | 774 | 756 | 736 | 714 | – |
| Метиловый спирт, ($CH_{3}OH$) 40% | – | 946 | 935 | 924 | 913 | 902 | 891 | 880 |
| Муравьиная кислота ($HCOOH$) | – | 1244 | 1220 | 1195 | 1171 | 1147 | 1121 | 1096 |
| Натр едкий, каустическая сода ($NaOH cdot H_{2}O$), 50% | – | 1540 | 1525 | 1511 | 1497 | 1483 | 1469 | 1454 |
| Натр едкий, каустическая сода ($NaOH cdot H_{2}O$), 40% | – | 1443 | 1430 | 1416 | 1403 | 1389 | 1375 | 1360 |
| Натр едкий, каустическая сода ($NaOH cdot H_{2}O$), 20% | – | 1230 | 1219 | 1208 | 1196 | 1183 | 1170 | 1155 |
| Натрий хлористый ($NaCl cdot H_{2}O$), 20% | – | 1157 | 1148 | 1189 | 1130 | 1120 | 1110 | 1100 |
| Натрий хлористый ($C_{6}H_{5}HO_{2}$) | – | 1223 | 1203 | 1183 | 1163 | 1143 | 1123 | 1103 |
| Октан ($C_{8}H_{18}$) | 734 | 718 | 702 | 686 | 669 | 653 | 635 | 617 |
| Олеум ($C_{8}H_{18}$), 20% | – | 1922 | 1896 | 1870 | 1844 | 1818 | 1792 | 1766 |
| Пропиловый спирт ($C_{3}H_{8}O$), 20% | – | 819 | 804 | 788 | 770 | 752 | 733 | 711 |
| Серная кислота ($H_{2}SO_{4}$), 98% | – | 1857 | 1837 | 1817 | 1798 | 1779 | 1761 | 1742 |
| Серная кислота ($H_{2}SO_{4}$), 92% | 1866 | 1845 | 1824 | 1803 | 1783 | 1765 | 1744 | 1723 |
| Серная кислота ($H_{2}SO_{4}$), 75% | 1709 | 1689 | 1669 | 1650 | 1632 | 1614 | 1597 | 1580 |
| Серная кислота ($H_{2}SO_{4}$), 60% | 1532 | 1515 | 1498 | 1482 | 1466 | 1450 | 1434 | 1418 |
| Сероуглерод ($CS_{2}$) | 1323 | 1293 | 1263 | 1233 | 1200 | 1165 | 1125 | 1082 |
| Соляная кислота, ($HCl cdot H_{2}O$) 30% | 1173 | 1161 | 1149 | 1138 | 1126 | 1115 | 1103 | 1090 |
| Толуол, ($C_{7}H_{8}$) | 902 | 884 | 866 | 847 | 828 | 808 | 788 | 766 |
| Уксусная кислота, ($CH_{3}COOH$) 100% | – | 1072 | 1048 | 1027 | 1004 | 981 | 958 | 922 |
| Уксусная кислота, ($CH_{3}COOH$) 50% | – | 1074 | 1058 | 1042 | 1026 | 1010 | 994 | 978 |
| Фенол (расплавленный) | – | – | 1075 | 1058 | 1040 | 1022 | 1003 | 987 |
| Хлорбензол ($C_{6}H_{5}Cl$) | 1150 | 1128 | 1107 | 1085 | 1065 | 1041 | 1021 | 995 |
| Хлороформ ($CHCl_{3}$) | 1563 | 1526 | 1489 | 1450 | 1411 | 1380 | 1326 | 1280 |
| Четыреххлористый углерод, фреон-10, хладон-10 ($CCl_{4}$) | 1670 | 1633 | 1594 | 1556 | 1517 | 1471 | 1434 | 1390 |
| Этилацетат, этиловый эфир уксусной кислоты ($С_{4}H_{8}O_{2}$) | 947 | 924 | 901 | 876 | 851 | 825 | 797 | 768 |
| Этиловый спирт, ($С_{2}H_{5}OH$) 100% | 823 | 806 | 789 | 772 | 754 | 735 | 716 | 693 |
| Этиловый спирт, ($С_{2}H_{5}OH cdot H_{2}O$) 80% | – | 857 | 843 | 828 | 813 | 797 | 783 | 768 |
| Этиловый спирт, ($С_{2}H_{5}OH cdot H_{2}O$) 60% | – | 904 | 891 | 878 | 864 | 849 | 835 | 820 |
| Этиловый спирт, ($С_{2}H_{5}OH cdot H_{2}O$) 40% | – | 947 | 935 | 923 | 910 | 897 | 885 | 872 |
| Этиловый спирт, ($С_{2}H_{5}OH cdot H_{2}O$) 20% | – | 977 | 969 | 957 | 946 | 934 | 922 | 910 |













![{mathsf {C_{2}H_{2}+H_{2}O{xrightarrow[ {}]{Hg^{{2+}}}}CH_{3}CHO}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1265093ffe50f2d20201276ae0bccb06deb88b78)
![{mathsf {CH_{3}CHO{xrightarrow[ {}]{CrO_{3},H_{2}SO_{4}}}CH_{3}COOH}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d2454a6f7a2d61114024a921740f2b40dc6fad18)





