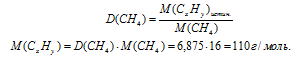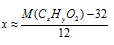Что значит «плотность по /хим. элемент/»?
Taisiya Vorobyeva
Ученик
(102),
закрыт
2 года назад
В задаче по химии написано: « найти плотность ПО МЕТАНУ смеси 80 г кислорода…». Что значит плотность по метану?
Вячек
Высший разум
(391245)
2 года назад
Это означает сравнение газов по плотности, не более того. Однако для газов есть более удобное сравнение – это по их молекулярной (или молярной) массе. Например, плотность кислорода по метану вычисляется по формуле:
D(CH4) = M(О2)/M(СН4) = 32/16 = 2. Как видно – кислород вдвое тяжелее метана
Определение молекулярной формулы углеводорода по относительной плотности паров по метану
В условиях некоторых задач фигурируют данные, позволяющие определить только молекулярную массу органического вещества. По ним требуется узнать формулу. Чаще всего такие задачи составляются в отношении углеводородов, причем без указания на гомологический ряд, к которому он относится. В этом случае существует иная стратегия решения. Рассмотрим ее на примере.
Задача 54
Определите молекулярную формулу углеводорода, у которого относительная плотность паров по метану составляет 6,875.
Дано: относительная плотность паров углеводорода по метану D(СН4) = 6,875.
Найти: молекулярную формулу углеводорода.
Решение:
В данном случае использовать обычный пошаговый алгоритм не возможно. Но есть иной путь решения, предполагающий составление математического уравнения с несколькими переменными.
Непосредственно из условия задачи установить зависимость между индексами у углерода и водорода не представляется возможным. Поэтому, обозначим формулу искомого углеводорода как СхНу. По относительной плотности паров определяем истинную молярную массу СхНу.
С другой стороны, значение молярной массы нашего вещества можно выразить с помощью молярных масс компонентов:
М(СхНY) = (12 . x) + (1 . y)
Приравниваем полученное выражение к значению истинной молярной массы, определенной по относительной плотности паров:
(12. x) + (1 . y) = 110
Получили одно уравнение с двумя неизвестными. Других данных, позволяющих составить еще одно уравнение, в условии не содержится.
Полученное нами математическое уравнение имеет бесконечное количество решений. Наша задача — выбрать из них то единственное значение, которое согласуется с физическим смыслом. Посмотрим, какие ограничения на значения «х» и «у» накладывает условие задачи.
1. Значения «х» и «у» в этом уравнении являются индексами в реальной формуле искомого углеводорода, следовательно, они должны быть положительными и целыми числами.
2. В состав молекул углеводорода входит только углерод и водород. Атомы этих элементов значительно различаются по массе. Поэтому вклад атомов углерода в молярную массу всего углеводорода значительно больше, чем вклад атомов водорода1.
Этот факт позволяет по значению молярной массы углеводорода примерно оценить количество атомов углерода в молекуле. Для этого мы пренебрегаем массовым вкладом водорода и упрощаем математическое уравнение. Таким образом, мы избавляемся от члена, отвечающего за вклад водорода в молярную массу (1 . у), и получаем одно уравнение с одним неизвестным2:
12 . х = 110
Решая его, получаем х = 9,17. Полученное значение не является индексом в формуле углеводорода, но позволяет ограничить количество вариантов при переборе. Оно показывает, что истинный индекс у углерода в искомой формуле близок к 9 и не может быть больше, чем 9. Следовательно, при подборе значений «х» и «у» (в уравнении 12 . х + 1 . у = 110), удовлетворяющих физическому смыслу, разумно начинать перебор значений, начиная с х = 9 с последовательным уменьшением. Приступим к перебору:
|
Задаваемое |
Уравнение | Вычисление значения «y» (индекс у водорода) |
Выводы |
| х = 9 | (12 . 9)+ + (1 . у) |
Y = 2 | Недостаточное количество атомов водорода по сравнению с количеством атомов углерода. Не соответствует ни одному классу углеводородов. Предло- жить структурную формулу вещества |
| ч = 8 | (12 . 8) + + (1 . у) |
Y = 14 | Углеводород с формулой С8Н14 реально существует. Он соответствует общей формуле СnН2n + 2, которая описывает алкины, алкадиены и циклоалкены. |
Дальнейший перебор приводит к избыточному количеству атомов водорода по сравнению с количеством атомов углерода.
Ответ: С8Н14.
———————
Сокращение количества вариантов перебора путем примерного определения количества атомов углерода в молекуле 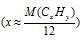
(12 . х) + (1 . у) + (16 . 2) = М(СхНуО2).
При известной молярной массе кислоты мы получим одно уравнение с двумя неизвестными, одним из которых (1 . у) можно пренебречь для примерного определения числа атомов углерода в молекуле:
Комментарии:
1 Даже у алканов, у которых вклад атомов водорода в общую молярную массу будет наибольшим среди всех углеводородов, массовая доля водорода не превышает 25% (у метана). У остальных членов этого гомологического ряда вклад водорода еще меньше и с увеличением молярной массы стремиться к 14,29%. У углеводородов других гомологических рядов он еще меньше чем 14,29% .
2 Применительно к любому углеводороду это упрощенное уравнение будет иметь вид: (12 . х) = М(СхНу).
Команда “Газы!” была объявлена еще две недели назад. И что?! Легкие задачи порешали и расслабились?! Или вы думаете, что задачи на газы касаются только 28-х заданий ЕГЭ?! Как бы не так! Если газов пока еще не было в 34-х заданиях, это ничего не значит! Задач на электролиз тоже не было в ЕГЭ до 2018 года. А потом как врезали, мама не горюй! Обязательно прочитайте мою статью “Тайны задач по химии? Тяжело в учении – легко в бою!”. В этой статье очень подробно рассказывается о новых фишках на электролиз. Статья вызвала шквал самых разных эмоций у преподавателей химии. До сих пор мне и пишут, и звонят, и благодарят, и бьются в конвульсиях. Просто цирк с конями, в котором я – зритель в первом ряду.
Однако, вернемся к нашим баранам, вернее, Газам. Я прошла через огонь и воду вступительных экзаменов и знаю точно – хочешь завалить абитуриента, дай ему задачу на Газы. Почитайте на досуге сборник задач И.Ю. Белавина. Я процитирую одну такую “мозгобойню”, чтобы вам жизнь медом не казалась. Попробуйте решить.
И.Ю. Белавин, 2005, задача 229
“Два из трех газов (сероводород, водород и кислород) смешали и получили газовую смесь, плотность которой оказалась равной плотности оставшегося газа. Полученную газовую смесь вместе с равным ей объемом третьего газа под давлением поместили в замкнутый сосуд емкостью 4 л, содержавший азот при н.у. и нагревали при 600 С до окончания химических реакций, затем постепенно охладили. Определите массы веществ, содержавшихся в сосуде после охлаждения, если плотность газовой смеси в сосуде перед нагреванием равнялась 9,25г/л. (Ответ: m(S) = 7,5 г, m(SO2) = 15 г, m(Н2О) = 9 г)”
Ну как, решили? Нет?! А ваши репетиторы?! Извините, это был риторический вопрос. Кстати, мои ученики, абитуриенты 2003-2008 гг. такие задачи щелкали, как семечки, на экзаменах во 2-й медицинский (теперь РНИМУ им. Н.И. Пирогова). Надеюсь, вам понятно, что 34-м задачам ЕГЭ еще есть куда усложняться, perfectio interminatus est (нет предела совершенству), с газами нужно работать, работать и работать. Поэтому команду “Газы!” отменять рано. Итак, поехали!
Сегодня мы поговорим о газовых смесях, затронем понятие плотности газа (абсолютной и относительной), средней молярной массы, решим задачи: определение средней молярной массы и плотности газа по компонентам смеси и наоборот.
• Газовая смесь – смесь отдельных газов НЕ вступающих между собой в химические реакции. К смесям газов относятся: воздух (состоит из азота, кислорода, углекислого газа, водяного пара и др.), природный газ (смесь предельных и непредельных углеводородов, оксида углерода, водорода, сероводорода, азота, кислорода, углекислого газа и др.), дымовые газы (содержат азот, углекислый газ, пары воды, сернистый газ и др.) и др.
• Объемная доля – отношение объема данного газа к общему объему смеси, показывает, какую часть общего объема смеси занимает данный газ, измеряется в долях единицы или в процентах.
• Мольная доля – отношение количества вещества данного газа к общему количеству вещества смеси газов, измеряется в долях единицы или в процентах.
• Плотность газа (абсолютная) – определяется как отношение массы газа к его объему, единица измерения (г/л). Физический смысл абсолютной плотности газа – масса 1 л, поэтому молярный объем газа (22,4 л при н.у. t° = 0°C, P = 1 атм) имеет массу, численно равную молярной массе.
• Относительная плотность газа (плотность одного газа по другому) – это отношение молярной массы данного газа к молярной массе того газа, по которому она находится
• Средняя молярная масса газа – рассчитывается на основе молярных масс составляющих эту смесь газов и их объемных долей
Настоятельно рекомендую запомнить среднюю молярную массу воздуха Мср(в) = 29 г/моль, в заданиях ЕГЭ часто встречается.
Обязательно посетите страницу моего сайта “Изучаем Х-ОбХ-04. Закон Авогадро. Следствия из закона Авогадро. Нормальные условия. Молярный объем газа. Абсолютная и относительная плотность газа. Закон объемных отношений” и сделайте конспекты по теории. Затем возьмите бумагу и ручку и решайте задачи вместе со мной.
ВАНГУЮ: чует мое сердце, что ЕГЭ по химии 2019 года устроит нам газовую атаку, а противогазы не выдаст!
Задача 1
Определить плотность по азоту газовой смеси, состоящей из 30% кислорода, 20% азота и 50% углекислого газа.
Задача 2
Вычислите плотность по водороду газовой смеси, содержащей 0,4 моль СО2, 0,2 моль азота и 1,4 моль кислорода.
Задача 3
5 л смеси азота и водорода имеют относительную плотность по водороду 12. Определить объем каждого газа в смеси.
Несколько задач со страницы моего сайта
Задача 4
Плотность по водороду пропан-бутановой смеси равна 23,5. Определите объемные доли пропана и бутана
Задача 5
Газообразный алкан объемом 8 л (н.у.) имеет массу 14,28 г. Чему равна его плотность по воздуху
Задача 6
Плотность паров альдегида по метану равна 2,75. Определите альдегид
Ну как? Пошло дело? Если туго, вернитесь к задачам и решайте их самостоятельно до тех пор, пока не щелкнет! А для стимуляции – десерт в виде еще одной задачи И.Ю. Белавина на газы. Наслаждайтесь ее решением самостоятельно!
И.Ю. Белавин, 2005, задача 202
“Сосуд емкостью 5,6 л при н.у. заполнили метаном, затем нагрели до высокой температуры, в результате чего произошло частичное разложение метана. Определите массу образовавшейся сажи, если известно, что после приведения к нормальным условиям объем полученной газовой смеси оказался в 1,6 раза больше объема исходного метана, эта газовая смесь обесцвечивает бромную воду и имеет плотность по воздуху 0,2931. (Ответ: m(C) = 0,6 г)”
Задачи И.Ю. Белавина – это крутой драйв! Попробуйте порешать, и вы откажетесь от просмотра любых ужастиков, поскольку запасетесь адреналином надолго! Но нам нужно спуститься на землю к ЕГЭ, простому и надежному, как первый советский трактор. Кстати, у меня в коллекции припасено немало сюрпризов с газовыми фишками, собранными за все годы работы и бережно хранимыми. Думаю, пришло время сказать им: “И снова здравствуйте!”, поскольку ЕГЭ с каждым годом становится “все чудесатее и чудесатее”. Но это уже совсем другая история. Читайте мои статьи – и вы подстелите соломку под свою ЕГЭшную попу.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Позвоните мне +7(903)186-74-55, приходите ко мне на курс, на бесплатные Мастер-классы “Решение задач по химии”. Я с удовольствием вам помогу.
Репетитор по химии и биологии кбн В.Богунова
Ответ:
D ( газа ) = 8
Объяснение:
Дано:
D ( газа ) = 2
Найти:
D ( газа ) – ?
Решение:
1)
Находим молекулярную массу газа, исходя из формулы относительной плотности:
D ( газа ) =
Нужно найти числитель, по формуле:
Mr ( газа ) = D ch₄ (газа) × Mr ( CH₄ )
Mr ( газа ) = 2 × 16 = 32
2)
Вычисляем относительную плотность газа по гелию:
D ( газа ) = Mr ( газа ) / Mr ( He )
D ( газа ) = 32 / 4 = 8
Найти массу, плотность или объем онлайн
На данной странице калькулятор поможет найти плотность, массу или объем вещества онлайн. Для расчета введите значения в калькулятор.
Объем, масса и плотность
Найти
Масса:
Объем:
Плотность:
Ответы:
Формула для нахождения массы тела через плотность и объем:
m – масса; V – объем; p – плотность.
Формула для нахождения объема тела через плотность и массу:
m – масса; V – объем; p – плотность.
Формула для нахождения плотности тела через объем и массу:
m – масса; V – объем; p – плотность.