Как определить плотность раствора
Раствор характеризуется объемом, концентрацией, температурой, плотностью и другими параметрами. Плотность раствора меняется в зависимости от массы и концентрации растворенного вещества.

Инструкция
Ключевой формулой для плотности является ρ=m/V, где ρ – плотность, m – масса раствора, V – его объем. Плотность может выражаться, например, в килограммах на литр, или в граммах на миллилитр. В любом случае, она показывает, сколько вещества по массе приходится на единицу объема.
Масса раствора складывается из массы жидкости и массы растворенного в ней вещества: m(раствора)=m(жидкости)+m(растворенного вещества). Масса растворенного вещества и объем раствора могут быть найдены из известного значения концентрации и молярной массы.
Пусть, например, в задаче дана молярная концентрация раствора. Она обозначается химической формулой соединения в квадратных скобках. Так, запись [KOH]=15 моль/л означает, что в одном литре раствора содержится 15 моль вещества гидроксида калия.
Молярная масса KOH составляет 39+16+1=56 г/моль. Молярные массы элементов можно посмотреть в таблице Менделеева, они указываются обычно снизу от наименования элемента. Количество вещества, масса вещества и его молярная масса связаны соотношением ν=m/M, где ν – количество вещества (моль), m – масса (г), M – молярная масса (г/моль).
Растворы, помимо жидкостных, бывают еще и газовыми. В этом случае необходимо понимать, что в равных объемах газа, близкого к идеальному, при одних и тех же условиях содержится одно и то же число молей. К примеру, при нормальных условиях один моль любого газа занимает объем Vm=22,4 л/моль, который назван молярным объемом.
В решении задачи на плотность газового раствора может понадобиться соотношение, устанавливающее связь между количеством вещества и объемом: ν=V/Vm, где ν – количество вещества, V – объем раствора, Vm – молярный объем, постоянная величина для данных условий. Как правило, в подобных задачах обговаривается, что условия являются нормальными (н.у.).
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Unit Converter
Enter the mass of the beaker, the mass of the beak plus the solution, and the volume of the solution to determine the solution density.
- All Density Calculators
- Percent Solution Calculator
- Vapor Pressure Calculator (Solvent/Solution)
- Heat of Solution Calculator
Solution Density Formula
The following formula is used to calculate the density of a solution:
- Where D is the density of the solution (g/cm^3)
- MS is the mass of the solution (g)
- V is the volume of the solution (ml or cm^3)
To calculate the solution density, simply divide the mass of the solution by the volume of the solution.
Solution Density Definition
What is a solution density?
A solution is simply a mixture of two or more liquid substances and a density a measure of the mass per unit volume. Therefore, a solution density is a measure of the mass of a mixture of solution per unit volume of that solution.
Example Problem
How to calculate a solution density?
The following example will outline the steps needed to calculate the density of a solution using the most common beaker method.
First, gather a beaker a measure is empty weight. For this example, the beaker is measure to be 15 grams.
Next, add the solution to the beaker and measure the weight. In this case, the combined weight is found to be 100 grams.
Next, measure the volume reading on the beaker. In this example, the beaker reads a total volume of 25ml.
Finally, calculate the solution density using the formula above:
D = (MB+S – MB) / V
D = (100 – 15) / 25
D = 3.4 g/ml = g/cm^3

Способы выражения состава.
|
Способ |
Обозначение содержания компонента |
Международные обозначения |
||
|
Название |
Значение |
в |
в |
|
|
Молярная |
|
x |
y |
х, у |
|
Массовая |
|
|
|
w |
|
Относительная молярная |
|
X |
Y |
X, Y |
|
Относительная массовая |
|
|
|
W |
|
Молярная концентрация |
|
Cx |
Cy |
c |
|
Массовая концентрация |
|
|
|
|
|
Объёмная |
|
xV |
y |
φ |
Примечание:
объёмная доля для газов равна молярной
доле и обозначается y;
объёмная доля для жидкостей обозначается
также как и молярная доля х,
но, поскольку для жидкостей это разные
величины, в скобках делается пометка,
например х
= 10% (об.).
Допускается также использование нижнего
индекса хv.
Расчёт плотности и вязкости.
Плотность газа при температуре Т
(К) и давлении р:
![]() ,
,
где![]() .
.
Здесь Т0 = 273 К,р0
= 760 ммHg= 1,013·105Па,Vm
= 22,4 м3/кмоль.
Плотность смеси газов:
![]() .
.
Плотность смеси жидкостей:
![]() ;
;
формула плохо применима к смесям
жидкостей со значительным объёмным
эффектом смешения, таким как вода–этанол.
Плотность суспензий:
![]() .
.
Вязкость газа при температуре Т
(К):
![]() ,
,
где С– постоянная Сатерленда [1,
табл.V].
Вязкость смеси газов:
![]() .
.
Для коксового, генераторного и подобных
им газов:
 ,
,
где Ткр i– критическая температураi-го
компонента, К [1, табл.XI].
Вязкость смеси жидкостей
через молярные доли:
![]() ;
;
через объёмные доли:
![]() .
.
Вязкость суспензий:
при
![]()
![]() ;
;
при
![]()
![]() .
.
Семинар 2.
Задача 1.
Определить объём воды и 96%-го (объёмные
%) раствора этанола необходимые для
получения 1 м340%-го раствора
этанола. Температуру жидкостей принять
равной 20°С.
|
Дано: φн= 96% (об.), φк= 40% (об.),
V40% = t= 20°C. |
Найти: Vв |
Схема аппарата:
|
Решение.
В зависимости от способа приготовление
растворов объёмные доли могут быть
рассчитаны по двум различным формулам:
![]() (1) и
(1) и![]() (2)
(2)
Вторая формула применима к растворам,
приготовленным в лабораторных условиях,
когда определённый объём спирта
помещается в мерный цилиндр, а затем
объём доводится дистиллированной водой
до метки.
В промышленности, где имеют дело с
большими объёмами, применима первая
формула, которую мы и будем использовать
в дальнейших расчётах.
Выведем формулу для пересчёта объёмных
долей в массовые:
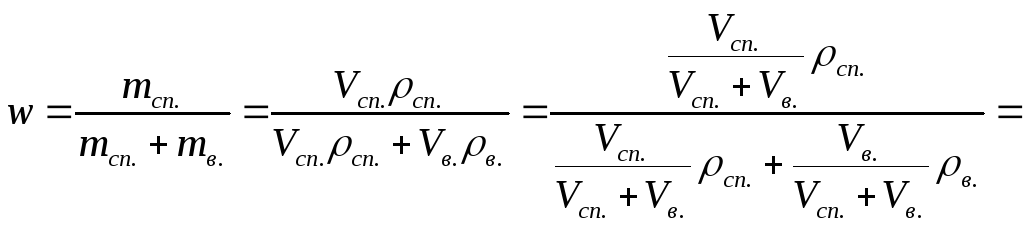
 (3).
(3).
Аналогично могут быть получены формулы
для пересчёта массовых долей в молярные
и молярных долей в массовые, соответственно:
![]() (4),
(4),![]() (5).
(5).
Таблица пересчёта одних концентраций
в другие приведена в [1, с. 283, табл. 6.2], в
начале главы 6 «Основы массопередачи.
Абсорбция».
По формуле (3) производим пересчёт
объёмных долей в массовые для 40%-го и
96%-го растворов:
![]() ,
,![]() .
.
Исходя из ближайших табличных значений
плотностей водных растворов этанола,
найдём плотности наших растворов методом
линейной интерполяции:
|
Плотности |
|
|
Масс. % |
Плотность, |
|
100 |
789 |
|
80 |
843 |
|
60 |
891 |
|
40 |
935 |
|
20 |
969 |
|
0 |
998 |
|
|
|
Из подобия большого и малого
(заштрихованного) треугольников получаем
соотношения:
![]() ;
;![]() .
.
Следовательно, плотности 40 и 96%-ного
растворов соответственно равны:
![]() ,
,![]() .
.
Рассчитаем массу 40%-го раствора этанола:
![]() .
.
Рассчитаем массу этанола, содержащегося
в растворе:
![]() .
.
Рассчитаем массовый расход 96%-го раствора
этанола:
![]() .
.
Рассчитаем массу воды, необходимой для
разбавления 96%-го раствора:
![]() .
.
Рассчитаем объём 96%-го раствора этанола:
![]() .
.
Рассчитаем объём воды, необходимой для
разбавления 96%-го раствора:
![]() .
.
Рассчитаем объёмный эффект смешения:
 .
.
Задача 2.
При синтезе аммиака из водорода и азота
на выходе из реактора получают смесь,
содержащую 12% (об.) аммиака, 22% (об.) азота
и 66% (об.) водорода. Температура смеси
500°С, давление 30 МПа. Определить
плотности компонентов и плотность
смеси.
Здравствуйте!
Калькуляторы для расчета инженерных физических величин.
1. Плотность вещества
2. Плотности газов при стандартных условиях
3. Расчет массы по плотности и объему вещества.
4. Расчет объему по плотности и массы вещества.
5. Плотность жидкости при смешивании нескольких веществ
6. Расчет плотности смеси газов
7. Удельный вес вещества
8. Кинематическая вязкость вещества
9. Плотность воды от температуры
СЛЕВА ТАБЛИЧКИ ДЛЯ ВЫБОРА
В платных разделах сайта калькулятора можно посчитать один раз в день.
Новости
Корректировок калькулятора нет.



