поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,896 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Школьные ответы на популярные вопросы, тесты, разбор заданий по различным предметам, а также разбор заданий ЕГЭ и ОГЭ
В автомобильную шину объемом 0,025 м3 накачали воздух до давления 8 · 105 Па. Найдите плотность воздуха внутри шины, если плотность воздуха при давлении 105 Па равна 1,29 кг/м3.
Ответ
Дано
V = 0,025 м3
p2 = 8 · 105 Па
p1 = 105 Па
ρ1 = 1,29 кг/м3
Найти
ρ2 = ?
Решение
p1/p2 = ρ1/ρ2
ρ2 = ρ1p2/p1
ρ2 = 1,29 кг/м3 · 8 · 105 Па/105 Па = 10,32 кг/м3
Ответ:
ρ2 = 10,32 кг/м3
Опубликовано: 07.12.2021
Обновлено: 31.10.2022
Условие задачи:
Какова плотность сжатого воздуха при 0° C в камере шины автомобиля “Волга”? Давление 0,17 МПа.
Задача №4.1.25 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
Дано:
(t=0^circ) C, (p=0,17) МПа, (rho-?)
Решение задачи:
Применим уравнение Клапейрона-Менделеева:
[pV = frac{m}{M}RT]
Поделим обе части уравнения на объем (V), тогда получим:
[p = frac{m}{{MV}}RT]
Отношение массы (m) к объему (V) есть плотность газа (rho), заменив в правой части равенства это отношение на плотность, получим:
[p = frac{rho }{M}RT]
Теперь выразим искомую величину, в итоге имеем такую формулу:
[rho = frac{{pM}}{{RT}}]
Молярная масса воздуха (M) равна 0,029 кг/моль. Заметьте, что её нельзя определить с помощью таблицы Менделеева, так как воздух – это смесь газов.
Переведем температуру (t) в шкалу Кельвина:
[0^circ;C = 273;К]
Посчитаем ответ:
[rho = frac{{0,17 cdot {{10}^6} cdot 0,029}}{{8,31 cdot 273}} = 2,17;кг/м^3 = 2,17;мг/см^3]
Ответ: 2,17 мг/см3.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
Смотрите также задачи:
4.1.24 При какой температуре средняя квадратичная скорость молекул кислорода
4.1.26 Определить среднюю квадратичную скорость молекул азота при температуре
4.1.27 Определить плотность воздуха при нормальных условиях. Молярную массу принять
решите пожалуйста
Аяна Ойдопова
Ученик
(91),
на голосовании
10 лет назад
В автомобильную шину V-0,025м (3) накачали воздух до давления 8*10(-5) Па. Найдите плотность воздуха внутри шины если плотность при давлении 8*10(-5) Па равна 1,29кг/м (3)?
Голосование за лучший ответ
LaFleurNike
Гуру
(3748)
10 лет назад
Используй уравнение Менделеева-Клапейрона, повыражай, если правую яасть равенства разделить на объем, получится давление=плотность×газовую пост. ×температуру (в Кельвинах) ÷на мол. массу
Самый главный вопрос — это не сколько весит воздух в шине (наверное, не слишком много, чтобы его мерить в граммах), а вопрос: зачем это знать?
Иногда довод, что шина будет весить меньше, приводится для того, чтобы убедить клиента, что надо накачивать шины не воздухом, а азотом. Правда, всякий мало-мальски знакомый с физикой, даже не прибегая к расчётам, скажет, что это не тот вес, который стоит учитывать в автомобиле.
А всё-таки, сколько лишнего веса мы постоянно возим с собой в каждой шине? Попробуем посчитать.
Внутренний объём колеса 205/60 R16 (например), как было показано в записи БЖ Шины. Какой объём воздуха в шине?, составляет 34 литра. Примем избыточное давление, равное 240 кпа, а атмосферное — 100 кпа.
Обычный воздух состоит из 78% азота, 21% кислорода и 1% аргона, не считая остальных малозначимых составляющих.
Но что это нам даёт, как вычислить массу этой смеси при нашем давлении 240+100=340 кпа?
Есть такое понятие, как парциальное (частичное) давление. Закон Дальтона гласит, что общее давление равно сумме парциальных давлений составляющих газов. В нашем случае 340 кпа сложится как
340*78%=265 кпа азота;
340*21%=71 кпа кислорода;
340*1%=3 кпа аргона.
Итого 265+74+3=339 кпа. Совпало? Нет, но это из-за округления, если посчитать точнее, то совпадёт.
Давление каждого газа знаем, а как вычислить массу каждого газа? Очень просто, выводится из уравнения Менделеева-Клайперона (если кто помнит, я — нет, но найти было нетрудно):
M=PmV/R/T, где
М — масса газа, г; P — давление, кпа; V — объём, л; R — универсальная газовая постоянная, для наших единиц= 8,31; T — температура в градусах кельвина (273+температура в градусах цельсия);
m — молярная масса: у азота — 28, кислорода — 32, аргона — 40.
В результате имеем, для воздуха, температуры 30 градусов С:
(265*28+71*32+3*40)*34/8,31/(30+273)=132 грамма.
А для смеси 95% азота и 5% кислорода, которой обычно накачивают шины:
(0,95*28+0,05*32)*340*34/8,31/(30+273)=129 грамм.
Итог: шина, накачанная азотом, весит на 3 грамма меньше накачанной воздухом.
Хорошо? Да. Но не о чем говорить.
Всё? Нет, не всё! Забыли самое главное.
В атмосферном воздухе присутствует водяной пар.
А с ним всё не так просто. В отличие от остальных составляющих воздуха, парциальное давление пара не может превысить некоторой предельной величины, которая зависит от температуры и называется давлением насыщенного пара.
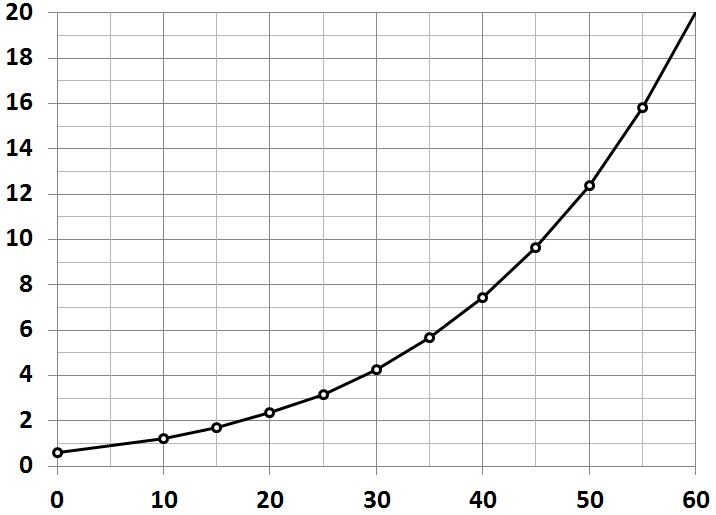
На этот случай имеется график (как же без этого):
Давление насыщенного пара воды (в кпа) от температуры (град С)
При 30 градусах цельсия оно составляет 4,3 кпа,
(а при 50 градусах — уже 12,42 кпа, в 3 раза больше, и, к слову, составит 5% от давления в шине).
В 34 литрах шины это соответствует:
18*4,3*34/8,31/(30+273)=1,05 грамма водяного пара. (18 — молярная масса H2O).
И не больше. В 34 литрах. При 30 град С. При любом давлении в шине.
А сколько пара может быть в исходном воздухе, которым, накачивают шину?
Если накачивали шину до избыточного давления 240 кпа при атмосферном 100 кпа, то воздуха потребовалось
34*(240+100)/100=116 литров.
В этих 116 литрах атмосферного воздуха при 30 градусах может содержаться уже
18*4,3*116/8,31/(20+273)=3,69 грамма водяного пара.
Итак, при 30 градусах цельсия:
1) в 116 литрах воздуха, используемого для накачки шины, может быть не больше 3,69 г воды в виде пара;
2) в 34 литрах сжатого из этих 116 литров воздуха в шине, может быть не больше 1,05 г воды в виде пара.
Вопрос к знатокам:
Что будет с этими лишними 2,64 граммами водяного пара при накачке шины:
1. Останутся в атмосфере.
2. Исчезнут без следа.
3. Испарятся.
4. Выпадут в осадок.
5. Это ошибка в расчётах.
Ответ см. в следующей серии:
Занимательная шинология. 2. Куда девается лишняя влага при накачке шины?