Иное название этого понятия — «коэффициент Пуассона»; о параметре, характеризующем упругие свойства материала, см. Коэффициент Пуассона.
| Статья является частью одноименной серии. |
| Термодинамика |
|---|
 |
|
| См. также «Физический портал» |
Показатель адиабаты (иногда называемый коэффициентом Пуассона) — отношение теплоёмкости при постоянном давлении (




Уравнение:
где
— теплоёмкость газа,
— удельная теплоёмкость (отношение теплоёмкости к единице массы) газа,
- индексы
и
обозначают условие постоянства давления или постоянства объёма, соответственно.
Для показателя адиабаты справедлива теорема Реша (1854)[2][3]:
где 

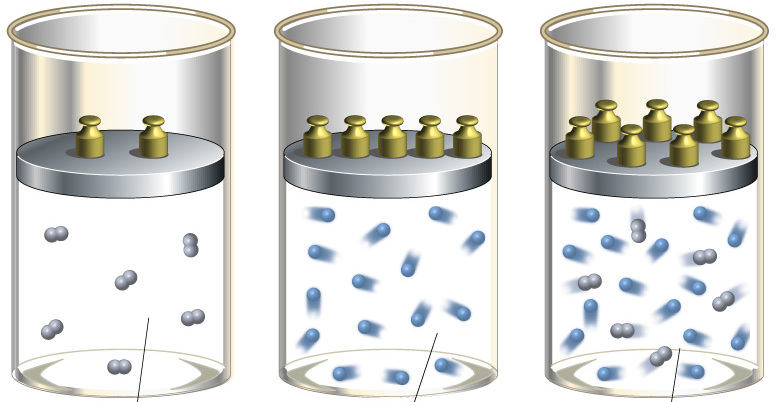
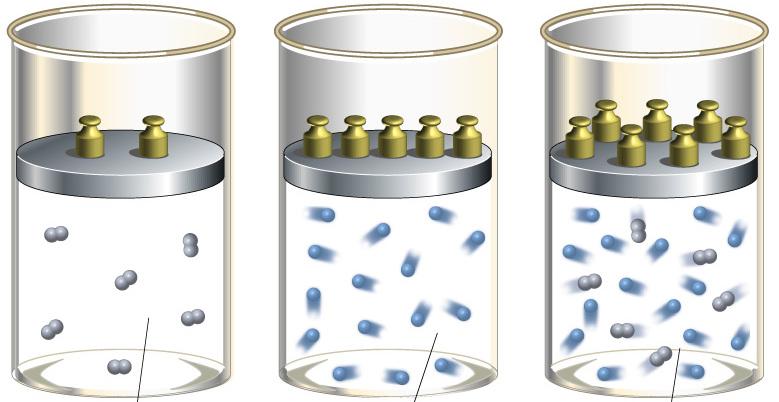
Для понимания этого соотношения можно рассмотреть следующий эксперимент. Закрытый цилиндр с закреплённым неподвижно поршнем содержит воздух. Давление внутри равно давлению снаружи. Этот цилиндр нагревается до определённой, требуемой температуры. До тех пор, пока поршень закреплён в неподвижном состоянии, объём воздуха в цилиндре остаётся неизменным, в то время как температура и давление возрастают. Когда требуемая температура будет достигнута, нагревание прекращается. В этот момент поршень «освобождается» и, благодаря этому, начинает перемещаться под давлением воздуха в цилиндре без теплообмена с окружающей средой (воздух расширяется адиабатически). Совершая работу, воздух внутри цилиндра охлаждается ниже достигнутой ранее температуры. Чтобы вернуть воздух к состоянию, когда его температура опять достигнет упомянутого выше требуемого значения (при всё ещё «освобождённом» поршне) воздух необходимо нагреть. Для этого нагревания извне необходимо подвести примерно на 40 % (для двухатомного газа — воздуха) большее количество теплоты, чем было подведено при предыдущем нагревании (с закреплённым поршнем). В этом примере количество теплоты, подведённое к цилиндру при закреплённом поршне, пропорционально 

Другой путь для понимания разницы между 




| показатели адиабаты для различных температур и газов[4][5] | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| темп. | газ | 
|
темп. | газ | 
|
темп. | газ | 
|
||
| 20 °C | He | 1,660 | 20 °C | NO | 1,400 | 20 °C | H2O | 1,330 | ||
| 19 °C | Ne | 1,640 | −181 °C | O2 | 1,450 | 100 °C | 1,324 | |||
| −180 °C | Ar | 1,760 | −76 °C | 1,415 | 200 °C | 1,310 | ||||
| 20 °C | 1,670 | 20 °C | 1,400 | 0 °C | сухой воздух |
1,403 | ||||
| 19 °C | Kr | 1,680 | 100 °C | 1,399 | 20 °C | 1,400 | ||||
| 19 °C | Xe | 1,660 | 200 °C | 1,397 | 100 °C | 1,401 | ||||
| 360 °C | Hg | 1,670 | 400 °C | 1,394 | 200 °C | 1,398 | ||||
| −181 °C | H2 | 1,597 | 20 °C | CO | 1,400 | 400 °C | 1,393 | |||
| −76 °C | 1,453 | 20 °C | Cl2 | 1,340 | 1000 °C | 1,365 | ||||
| 20 °C | 1,410 | 0 °C | CO2 | 1,310 | 2000 °C | 1,088 | ||||
| 100 °C | 1,404 | 20 °C | 1,300 | 15 °C | SO2 | 1,290 | ||||
| 400 °C | 1,387 | 100 °C | 1,281 | −115 °C | CH4 | 1,410 | ||||
| 1000 °C | 1,358 | 400 °C | 1,235 | −74 °C | 1,350 | |||||
| 2000 °C | 1,318 | 1000 °C | 1,195 | 20 °C | 1,320 | |||||
| −181 °C | N2 | 1,470 | 15 °C | NH3 | 1,310 | 15 °C | C2H6 | 1,220 | ||
| 15 °C | 1,404 | 20 °C | N2O | 1,310 | 16 °C | C3H8 | 1,130 |
Соотношения для идеального газа[править | править код]
Для идеального газа теплоёмкость не зависит от температуры. Соответственно, можно выразить энтальпию как 

С другой стороны, теплоёмкости могут быть выражены также через показатель адиабаты (

и
Может оказаться достаточно трудным найти информацию о табличных значениях 


где 
Соотношения с использованием количества степеней свободы[править | править код]
Показатель адиабаты (

или
Таким образом, для одноатомного идеального газа (три степени свободы) показатель адиабаты равен:
в то время как для двуатомного идеального газа (пять степеней свободы) (при комнатной температуре):
Для многоатомного идеального газа (шесть степеней свободы) показатель адиабаты равен:
Воздух на земле представляет собой в основном смесь двухатомных газов (около 78 % азота — N2, и около 21 % кислорода — O2), и при нормальных условиях его можно рассматривать как идеальный. Двухатомный газ имеет пять степеней свободы (три поступательных и две вращательных степени свободы; колебательная степень свободы не задействована, за исключением высоких температур). Как следствие, теоретически, показатель адиабаты для воздуха имеет величину:
Это хорошо согласуется с экспериментальными измерениями показателя адиабаты воздуха, которые приблизительно дают значение 1,403 (приведённое выше в таблице).
Соотношения для реальных газов[править | править код]
По мере того, как температура возрастает, более высокоэнергетические вращательные и колебательные состояния становятся достижимыми для молекулярных газов, и таким образом, количество степеней свободы возрастает, и уменьшается показатель адиабаты 
Для реальных газов, как 






Термодинамические выражения[править | править код]
Значения, полученные с помощью приближённых соотношений (в частности, 


Значения 

Вышеприведённые соотношения отражают подход, основанный на развитии строгих уравнений состояния (таких, как уравнение Пенга — Робинсона[en]), которые настолько хорошо согласуются с экспериментом, что для их применения требуется лишь незначительно развивать базу данных соотношений или значений 
Адиабатический процесс[править | править код]
Для изоэнтропийного, квазистатического, обратимого адиабатного процесса, происходящего в простом сжимаемом идеальном газе:
где 

Экспериментальное определение величины показателя адиабаты[править | править код]
Поскольку процессы, происходящие в небольших объёмах газа при прохождении звуковой волны, близки к адиабатическим[6], показатель адиабаты можно определить, измерив скорость звука в газе. В этом случае показатель адиабаты и скорость звука в газе будут связаны следующим выражением:
где 





Другим способом экспериментального определения величины показателя адиабаты является метод Клемана — Дезорма, который часто используется в учебных целях при выполнении лабораторных работ. Метод основан на изучении параметров некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами: адиабатическим и изохорическим.[7]
Лабораторная установка включает стеклянный баллон, соединённый с манометром, краном и резиновой грушей. Груша служит для нагнетания воздуха в баллон. Специальный зажим предотвращает утечку воздуха из баллона. Манометр измеряет разность давлений внутри и вне баллона. Кран может выпускать воздух из баллона в атмосферу.
Пусть первоначально в баллоне было атмосферное давление и комнатная температура. Процесс выполнения работы можно условно разбить на два этапа, каждый из которых включает в себя адиабатный и изохорный процесс.
1-й этап:
При закрытом кране накачиваем в баллон небольшое количество воздуха и зажимаем шланг зажимом. При этом давление и температура в баллоне повысятся. Это адиабатический процесс. Со временем давление в баллоне начнёт уменьшаться вследствие того, что газ в баллоне начнёт охлаждаться за счёт теплообмена через стенки баллона. При этом давление будет уменьшаться при постоянном объёме. Это изохорный процесс. Выждав, когда температура воздуха внутри баллона сравняется с температурой окружающего воздуха, запишем показания манометра 
2-й этап:
Теперь откроем кран 3 на 1—2 секунды. Воздух в баллоне будет адиабатно расширяться до атмосферного давления. При этом температура в баллоне понизится. Затем кран закроем. Со временем давление в баллоне начнёт увеличиваться вследствие того, что газ в баллоне начнёт нагреваться за счёт теплообмена через стенки баллона. При этом снова будет увеличиваться давление при постоянном объёме. Это изохорный процесс. Выждав, когда температура воздуха внутри баллона сравнится с температурой окружающего воздуха, запишем показание манометра 
Недостатком данного метода является то, что процессы быстрого расширения газа в ходе лабораторной работы не являются чисто адиабатическими ввиду теплообмена через стенку сосудов, а рассматриваемый газ заведомо не является идеальным. И хотя полученная в ходе лабораторной работы величина будет заведомо содержать методическую погрешность, всё же существуют различные способы её устранения, например, за счёт учёта времени расширения и количества подведенного за это время тепла.[8]
См. также[править | править код]
- Теплоёмкость
- Удельная теплоёмкость
- Скорость звука
- Термодинамические уравнения[en]
- Термодинамика
- Объёмная теплоёмкость
Примечания[править | править код]
- ↑ Fox, R., A. McDonald, P. Pritchard: Introduction to Fluid Mechanics 6th ed. Wiley
- ↑ Толпыго К. Б., Термодинамика и статистическая физика, 1966, с. 83.
- ↑ Партингтон Дж. Р., Раковский А. В., Курс химической термодинамики, 1932, с. 41.
- ↑ White, Frank M.: Fluid Mechanics 4th ed. McGraw Hill
- ↑ Lange’s Handbook of Chemistry, 10th ed. page 1524
- ↑ Савельев, 2001, с. 30—32.
- ↑ physdep.isu.ru
- ↑ physchem.msu.ru (недоступная ссылка)
Литература[править | править код]
- Партингтон Дж. Р., Раковский А. В. Курс химической термодинамики / Пер. с англ. Я. В. Герасимова, проработка и дополнения проф. А. В. Раковского. — 2-е изд., стереотипное. — М.—Л.: Госхимтехиздат, 1932. — 383 с.
- Толпыго К. Б. Термодинамика и статистическая физика. — Киев: Изд-во Киевского ун-та, 1966. — 364 с.
- Савельев И. В. Курс общей физики: Молекулярная физика и термодинамика. — М.: Астрель, 2001. — Т. 3. — 208 с. — 7000 экз. — ISBN 5-17-004585-9.
При изучении поведения газов в физике много внимания уделяется изопроцессам, то есть таким переходам между состояниями системы, во время которых сохраняется один термодинамический параметр. Тем не менее, существует газовый переход между состояниями, который не является изопроцессом, но который играет важную роль в природе и технике. Речь идет об адиабатическом процессе. В данной статье рассмотрим его подробнее, акцентируя внимание на том, что такое показатель адиабаты газа.
Адиабатический процесс
Согласно термодинамическому определению, под адиабатическим процессом понимают такой переход между начальным и конечным состояниями системы, в результате которого не существует обмена теплом между внешней средой и изучаемой системой. Такой процесс возможен при наличии следующих двух условий:
- теплопроводность между внешней средой и системой по той или иной причине является низкой;
- скорость процесса велика, поэтому обмен теплом не успевает происходить.
В технике адиабатный переход используют как для разогрева газа при его резком сжатии, так и для его охлаждения во время быстрого расширения. В природе рассматриваемый термодинамический переход проявляет себя, когда воздушная масса поднимается или опускается по склону холма. Такие подъемы и спуски приводят к изменению точки росы в воздухе и к возникновению осадков.
Уравнение Пуассона для адиабаты идеального газа

Идеальный газ представляет собой систему, в которой частицы движутся хаотично с большими скоростями, не взаимодействуют друг с другом и являются безразмерными. Такая модель является очень простой с точки зрения ее математического описания.
Согласно определению адиабатного процесса, можно записать следующее выражение в соответствии с первым законом термодинамики:
dU = -P*dV.
Иными словами, газ, расширяясь или сжимаясь, совершает работу P*dV за счет соответствующего изменения своей внутренней энергии dU.
В случае идеального газа, если воспользоваться уравнением его состояния (закон Клапейрона-Менделеева), то можно получить следующее выражение:
P*Vγ = const.
Это равенство называется уравнением Пуассона. Люди, которые знакомы с физикой газов, заметят, что если величина γ будет равна 1, то уравнение Пуассона перейдет в закон Бойля-Мариотта (изотермический процесс). Однако такое преобразование уравнений невозможно, поскольку γ для любого типа идеального газа больше единицы. Величина γ (гамма) называется показателем адиабаты идеального газа. Рассмотрим подробнее его физический смысл.
Что такое показатель адиабаты?
Показатель γ, который появляется в уравнении Пуассона для газа идеального, представляет собой отношение теплоемкости при постоянном давлении к аналогичной величине, но уже при постоянном объеме. В физике теплоемкостью называют величину теплоты, которую нужно передать данной системе или забрать у нее, чтобы она изменила свою температуру на 1 Кельвин. Будем обозначать символом CP изобарную теплоемкость, а символом CV – изохорную. Тогда для γ справедливо равенство:
γ = CP/CV.
Поскольку γ всегда больше одного, то он показывает, во сколько раз изобарная теплоемкость изучаемой газовой системы превышает аналогичную изохорную характеристику.
Теплоемкости CP и CV
Чтобы определить показатель адиабаты, следует хорошо понимать смысл величин CP и CV. Для этого проведем следующий мысленный эксперимент: представим, что газ находится в закрытой системе в сосуде с твердыми стенками. Если нагревать сосуд, то все сообщенное тепло в идеальном случае перейдет во внутреннюю энергию газа. В такой ситуации будет справедливо равенство:
dU = CV*dT.
Величина CV определяет количество теплоты, которое следует передать системе, чтобы изохорно нагреть ее на 1 К.
Теперь предположим, что газ находится в сосуде с подвижным поршнем. В процессе нагрева такой системы поршень будет перемещаться, обеспечивая поддержание постоянного давления. Поскольку энтальпия системы в таком случае будет равна произведению изобарной теплоемкости на изменение температуры, то первый закон термодинамики примет вид:
CP*dT = CV*dT + P*dV.
Отсюда видно, что CP>CV, так как в случае изобарного изменения состояний необходимо расходовать тепло не только на повышение температуры системы, а значит, и ее внутренней энергии, но и на выполнение газом работы при его расширении.
Величина γ для газа идеального одноатомного
Самой простой газовой системой является одноатомный идеальный газ. Предположим, что мы имеет 1 моль такого газа. Напомним, что в процессе изобарного нагрева 1 моль газа всего на 1 Кельвин, он совершает работу, равную величине R. Этим символом принято обозначать универсальную газовую постоянную. Она равна 8,314 Дж/(моль*К). Применяя последнее выражение в предыдущем пункте для данного случая, получаем такое равенство:
CP = CV + R.
Откуда можно определить значение изохорной теплоемкости CV:
γ = CP/CV;
CV = R/(γ-1).
Известно, что для одного моль одноатомного газа значение изохорной теплоемкости составляет:
CV = 3/2*R.
Из последних двух равенств следует значение показателя адиабаты:
3/2*R = R/(γ-1) =>
γ = 5/3 ≈ 1,67.
Отметим, что величина γ зависит исключительно от внутренних свойств самого газа (от многоатомности его молекул) и не зависит от количества вещества в системе.
Зависимость γ от числа степеней свободы
Выше было записано уравнение для изохорной теплоемкости одноатомного газа. Появившийся в нем коэффициент 3/2 связан с количеством степеней свободы у одного атома. У него существует возможность двигаться только в одном из трех направлений пространства, то есть существуют только поступательные степени свободы.
Если система образована двухатомными молекулами, то к трем поступательным добавляются еще две вращательные степени. Поэтому выражение для CV приобретает вид:
CV = 5/2*R.
Тогда значение γ будет равно:
γ = 7/5 = 1,4.
Отметим, что на самом деле существует у двухатомной молекулы еще одна колебательная степень свободы, но при температурах в несколько сотен Кельвин она не задействуется и не вносит вклад в теплоемкость.
Если молекулы газа состоят из более, чем двух атомов, тогда у них будет 6 степеней свободы. Показатель адиабаты при этом будет равен:
γ = 4/3 ≈ 1,33.
Таким образом, при увеличении числа атомов в молекуле газа величина γ уменьшается. Если построить график адиабаты в осях P-V, то можно заметить, что кривая для одноатомного газа будет вести себя более резко, чем для многоатомного.
Показатель адиабаты для смеси газов
Выше мы показали, что величина γ от химического состава газовой системы не зависит. Однако она зависит от количества атомов, которое составляет ее молекулы. Предположим, что система состоит из N компонент. Атомная доля компонента i в смеси равна ai. Тогда для определения показателя адиабаты смеси можно использовать следующее выражение:
γ = ∑i=1N(ai*γi).
Где γi – это величина γ для i-го компонента.
Например, это выражение можно применить для определения γ воздуха. Поскольку он состоит на 99 % из двухатомных молекул кислорода и азота, то его показатель адиабаты должен быть очень близок к значению 1,4, что подтверждается при экспериментальном определении этой величины.
5
Лабораторная
работа
ОПРЕДЕЛЕНИЕ
ПОКАЗАТЕЛЯ АДИАБАТЫ ВОЗДУХА
Задание
-
Определить
показатель адиабаты воздуха методом
Клемана-Дезорма. -
Сравнить полученное
значение показателя адиабаты с его
теоретическим значением и сделать
вывод о точности проведенных измерений
и достоверности использованного метода.
Приборы и
принадлежности
Установка для
определения показателя адиабаты воздуха
с манометром и насосом.
Общие сведения
Адиабатическим
называется процесс, совершаемый
термодинамической системой, при котором
отсутствует теплообмен между этой
системой и внешней средой.
Уравнение,
описывающее состояние системы в
адиабатическом процессе, имеет вид:
![]()
,
(1)
где
![]()
и
![]()
– давление и объем газа;
![]()
– показатель адиабаты.
Показатель адиабаты
– это коэффициент, численно равный
отношению теплоемкостей газа при
постоянном давлении
![]()
и при постоянном объеме
![]() :
:
![]()
.
(2)
Физический смысл
его заключается в том, что он показывает,
во сколько раз количество теплоты,
необходимой для нагревания газа на 1 К
в изобарическом процессе (![]() ),
),
больше количества теплоты, необходимой
для той же цели в изохорическом процессе
(![]() ).
).
Для идеального
газа показатель адиабаты определяется
по формуле:
![]()
,
(3)
где i
– число степеней свободы молекул газа.
Совершение газом
адиабатического процесса требует его
идеальной термоизоляции, что в реальных
условиях не вполне достижимо. Тем не
менее будем считать, что в данной работе
экспериментальная установка позволяет
осуществить адиабатический процесс.
Описание установки
Установка (рис.
1) для определения показателя адиабаты
воздуха состоит из стеклянного сосуда
1, жидкостного манометра 2 и насоса 3,
соединенных резиновыми и стеклянными
трубками. Горловина сосуда закрыта
пробкой с краном 4 для сообщения сосуда
с атмосферой. Насос позволяет изменять
давление в сосуде при закрытом кране,
а манометр – измерять это изменение.
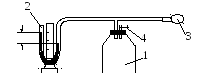
h
Рис. 1
Теория метода
Все изменения
состояния воздуха в процессе эксперимента
качественно представлены на рис. 2.

Рис. 2
Суть эксперимента
заключается в переводе воздуха в разные
состояния различными процессами и
анализе качественных изменений этих
состояний (точнее – изменений давления
воздуха в сосуде). Исходное состояние
(точка 0) воздуха в сосуде (кран 4 открыт)
характеризуется давлением p0
, равным атмосферному, объемом V0
и температурой T0,
равной температуре окружающей среды.
Закрыв кран, создают
насосом в сосуде избыточное давление:
при этом воздух, испытывая адиабатическое
сжатие, переходит в первое состояние
(точка 1). Это состояние характеризуется
параметрами
![]() ,
,
![]()
и
![]() ,
,
при этом
![]()
и
![]()
(адиабатическое сжатие газа сопровождается
его нагреванием).
После прекращения
работы насоса вследствие теплообмена
через стенки сосуда температура газа
снижается до первоначальной температуры
![]() ,
,
что вызывает некоторое снижение его
давления. В результате в сосуде
устанавливается давление, превышающее
атмосферное давление на некоторое
значение
![]() .
.
Это второе состояние газа (точка 2)
характеризуется параметрами
![]() ,
,
![]()
и
![]() .
.
Если кран
кратковременно открыть и закрыть, то
газ в сосуде адиабатически расширится
(так как теплообмен произойти не успеет),
и его давление практически мгновенно
выровняется с атмосферным давлением.
Это третье состояние газа (точка 3)
характеризуется параметрами
![]() ,
,
![]()
и
![]() ,
,
при этом
![]()
(адиабатическое сжатие газа сопровождается
его охлаждением).
Сразу после закрытия
крана в сосуде начинается изохорический
процесс нагревания воздуха путем
теплообмена с внешней средой,
сопровождающийся некоторым повышением
его давления. В результате в сосуде
устанавливается давление, повышенное
по сравнению с атмосферным давлением
на некоторое значение
![]() .
.
Это четвертое состояние газа (точка 4)
характеризуется параметрами
![]() ,
,
![]()
и
![]() .
.
Показатель адиабаты
полностью определяется значениями
избыточных давлений
![]()
и
![]() .
.
Для состояний 2
и 3 выполняется соотношение, получающееся
при выводе уравнения состояния газа в
адиабатическом процессе:
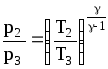
.
(4)
Для состояний 3 и
4 с помощью уравнения Клапейрона–Менделеева
можно получить соотношение (закон
Шарля):
![]()
.
(5)
С учетом того, что
![]() ,
,
![]() ,
,
![]() ,
,
подставляя выражение (4) в (3), получим:
 .
.
(6)
Логарифмируя
последнее выражение, получим:
![]() .
.
(7)
Известно, что
![]()
при
![]()
. С учетом этого можно записать, что
![]()
,
(8)
откуда следует,
что
![]() .
.
![]()
(9)
Избыточное давление
в сосуде, измеряемое манометром,
пропорционально разности уровней h
жидкости в обоих коленах трубки манометра
(см. рис. 2). С учетом этого обстоятельства
выражение (9) примет окончательный вид:
![]()
.
(10)
Отсчет уровней
производится с учетом кривизны поверхности
жидкости в трубке. Для отсчета берется
деление шкалы, совпадающее с касательной
к поверхности жидкости.
Порядок выполнения
работы
1. При закрытом
кране насосом создать избыточное
давление в сосуде (необходимо избегать
резких движений, так как жидкость может
быть легко вытолкнута из трубки
манометра).
2. Выждать, пока
уровни жидкости в манометре перестанут
изменять свое положение, и произвести
отсчет их разности h1
.
3. Открыть кран для
выпуска воздуха и быстро его закрыть в
момент первого пересечения уровнями
жидкости исходного их положения (до
накачки насосом).
4. Выждать, пока
уровни жидкости в манометре перестанут
изменять свое положение, и произвести
отсчет их разности h2
.
-
Эксперимент
необходимо повторить не менее 5 раз, и
полученные результаты занести в таблицу
1.
Таблица 1
|
№ п/п |
1 |
2 |
3 |
4 |
5 |
|
h1 |
|||||
|
h2 |
6. По формуле (10)
вычислить оценку
![]()
показателя адиабаты, использовав средние
значения (![]() )разностей
)разностей
уровней жидкости в манометре.
7. Рассчитать
погрешности измерения показателя
адиабаты воздуха.
8. Сравнить полученный
доверительный интервал значений
показателя адиабаты с его теоретическим
значением и сделать вывод о точности
проведенных измерений и достоверности
использованного метода.
Вычисление
погрешностей
1. В этой работе
велика роль случайных погрешностей,
поэтому приборными погрешностями, ввиду
их относительной малости, следует
пренебречь.
Случайные погрешности
рассчитываются по методу Стьюдента.
2. Полная относительная
погрешность измерения показателя
адиабаты:
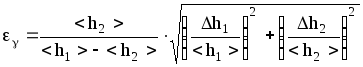
.
3. Полная абсолютная
погрешность измерения показателя
адиабаты:
![]()
.
Полученный результат
округляется и записывается в виде:
![]() ;
;
![]()
;
![]()
.
Правильность
проведенных измерений и вычислений
должна подтверждаться “перекрытием”
полученного доверительного интервала
для значения показателя адиабаты
воздуха и его теоретического значения.
Контрольные
вопросы
1. Дайте определения
изохорическому, изобарическому и
изотермическому процессам. Изобразите
эти процессы графически в координатных
осях p-V
. Запишите уравнение состояния идеального
газа в этих процессах и поясните смысл
входящих в них физических величин.
2. Дайте определение
адиабатическому процессу. Изобразите
этот процесс графически в координатных
осях p-V.
Запишите уравнение состояния газа в
этом процессе (уравнение Пуассона) и
поясните смысл входящих в него физических
величин.
3. Что такое
показатель адиабаты? Как определить
его теоретическое значение ?
4. Опишите состав
экспериментальной установки и порядок
действий при определении показателя
адиабаты воздуха.
5. Сформулируйте
первый закон термодинамики.
6. Что такое
внутренняя энергия вещества? Чему равна
внутренняя энергия идеального газа в
различных изопроцессах?
7. Дайте определение
теплоемкости вещества. Что такое удельная
и молярная теплоемкости вещества? Чему
равна молярная теплоемкость идеального
газа в различных изопроцессах ?
8. Как вычислить
работу, совершаемую идеальным газом, в
изохорическом, изотермическом,
изобарическом и адиабатическом процессах
?
9. Как вычислить
изменение внутренней энергии идеального
газа при совершении им изохорического
(изобарического, изотермического,
адиабатического) процессов ?
10. Как определить
количество теплоты, получаемой (или
отдаваемой) идеальным газом при совершении
им изохорического (изобарического,
изотермического, адиабатического)
процессов?
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Иное название этого понятия — «коэффициент Пуассона»; о параметре, характеризующем упругие свойства материала, см. Коэффициент Пуассона.
| Термодинамика |
|---|
 |
| Статья является частью одноименной серии. |
| Начала термодинамики |
| Уравнение состояния |
| Термодинамические величины |
| Термодинамические потенциалы |
| Термодинамические циклы |
| Фазовые переходы |
| править |
| См. также «Физический портал» |
Показатель адиабаты (иногда называемый коэффициентом Пуассона) — отношение теплоёмкости при постоянном давлении ( ) к теплоёмкости при постоянном объёме (
) к теплоёмкости при постоянном объёме ( ). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой
). Иногда его ещё называют фактором изоэнтропийного расширения. Обозначается греческой буквой  (гамма) или
(гамма) или  (каппа). Буквенный символ в основном используется в химических инженерных дисциплинах. В теплотехнике используется латинская буква
(каппа). Буквенный символ в основном используется в химических инженерных дисциплинах. В теплотехнике используется латинская буква  [1].
[1].
Уравнение:
 ,
,
где
 — теплоёмкость газа,
— теплоёмкость газа, — удельная теплоёмкость (отношение теплоёмкости к единице массы) газа,
— удельная теплоёмкость (отношение теплоёмкости к единице массы) газа,- индексы
 и
и  обозначают условие постоянства давления или постоянства объёма, соответственно.
обозначают условие постоянства давления или постоянства объёма, соответственно.
Для понимания этого соотношения можно рассмотреть следующий эксперимент:
Закрытый цилиндр с закреплённым неподвижно поршнем содержит воздух. Давление внутри равно давлению снаружи. Этот цилиндр нагревается до определённой, требуемой температуры. До тех пор, пока поршень закреплён в неподвижном состоянии, объём воздуха в цилиндре остаётся неизменным, в то время как температура и давление возрастают. Когда требуемая температура будет достигнута, нагревание прекращается. В этот момент поршень «освобождается» и, благодаря этому, начинает перемещаться под давлением воздуха в цилиндре без теплообмена с окружающей средой (воздух расширяется адиабатически). Совершая работу, воздух внутри цилиндра охлаждается ниже достигнутой ранее температуры. Чтобы вернуть воздух к состоянию, когда его температура опять достигнет упомянутого выше требуемого значения (при всё ещё «освобождённом» поршне) воздух необходимо нагреть. Для этого нагревания извне необходимо подвести примерно на 40 % (для двухатомного газа — воздуха) большее количество теплоты, чем было подведено при предыдущем нагревании (с закреплённым поршнем). В этом примере количество теплоты, подведённое к цилиндру с закреплённом поршне, пропорционально  , тогда как общее количество подведённой теплоты пропорционально
, тогда как общее количество подведённой теплоты пропорционально  . Таким образом, показатель адиабаты в этом примере равен 1.4.
. Таким образом, показатель адиабаты в этом примере равен 1.4.
Другой путь для понимания разницы между  и
и  состоит в том, что
состоит в том, что  применяется тогда, когда работа совершается над системой, которую принуждают к изменению своего объёма (то есть путём движения поршня, который сжимает содержимое цилиндра), или если работа совершается системой с изменением её температуры (то есть нагреванием газа в цилиндре, что вынуждает поршень двигаться).
применяется тогда, когда работа совершается над системой, которую принуждают к изменению своего объёма (то есть путём движения поршня, который сжимает содержимое цилиндра), или если работа совершается системой с изменением её температуры (то есть нагреванием газа в цилиндре, что вынуждает поршень двигаться).  применяется только если
применяется только если  — а это выражение обозначает совершённую газом работу — равно нулю. Рассмотрим разницу между подведением тепла при закреплённом поршне и подведением тепла при освобождённом поршне. Во втором случае давление газа в цилиндре остаётся постоянным, и газ будет как расширяться, совершая работу над атмосферой, так и увеличивать свою внутреннюю энергию (с увеличением температуры); теплота, которая подводится извне, лишь частично идёт на изменение внутренней энергии газа, в то время как остальное тепло идёт на совершение газом работы.
— а это выражение обозначает совершённую газом работу — равно нулю. Рассмотрим разницу между подведением тепла при закреплённом поршне и подведением тепла при освобождённом поршне. Во втором случае давление газа в цилиндре остаётся постоянным, и газ будет как расширяться, совершая работу над атмосферой, так и увеличивать свою внутреннюю энергию (с увеличением температуры); теплота, которая подводится извне, лишь частично идёт на изменение внутренней энергии газа, в то время как остальное тепло идёт на совершение газом работы.
| Показатели адиабаты для различных газов[2][3] | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Темп. | Газ | γ | Темп. | Газ | γ | Темп. | Газ | γ | ||
| −181 °C | H2 | 1.597 | 200 °C | Сухой воздух | 1.398 | 20 °C | NO | 1.400 | ||
| −76 °C | 1.453 | 400 °C | 1.393 | 20 °C | N2O | 1.310 | ||||
| 20 °C | 1.410 | 1000 °C | 1.365 | −181 °C | N2 | 1.470 | ||||
| 100 °C | 1.404 | 2000 °C | 1.088 | 15 °C | 1.404 | |||||
| 400 °C | 1.387 | 0°C | CO2 | 1.310 | 20 °C | Cl2 | 1.340 | |||
| 1000 °C | 1.358 | 20 °C | 1.300 | −115 °C | CH4 | 1.410 | ||||
| 2000 °C | 1.318 | 100 °C | 1.281 | −74 °C | 1.350 | |||||
| 20 °C | He | 1.660 | 400 °C | 1.235 | 20 °C | 1.320 | ||||
| 20 °C | H2O | 1.330 | 1000 °C | 1.195 | 15 °C | NH3 | 1.310 | |||
| 100 °C | 1.324 | 20 °C | CO | 1.400 | 19 °C | Ne | 1.640 | |||
| 200 °C | 1.310 | −181 °C | O2 | 1.450 | 19 °C | Xe | 1.660 | |||
| −180 °C | Ar | 1.760 | −76 °C | 1.415 | 19 °C | Kr | 1.680 | |||
| 20 °C | 1.670 | 20 °C | 1.400 | 15 °C | SO2 | 1.290 | ||||
| 0°C | Сухой воздух | 1.403 | 100 °C | 1.399 | 360 °C | Hg | 1.670 | |||
| 20 °C | 1.400 | 200 °C | 1.397 | 15 °C | C2H6 | 1.220 | ||||
| 100 °C | 1.401 | 400 °C | 1.394 | 16 °C | C3H8 | 1.130 |
Содержание
- 1 Соотношения для идеального газа
- 1.1 Соотношения с использованием количества степеней свободы
- 2 Соотношения для реальных газов
- 3 Термодинамические выражения
- 4 Адиабатический процесс
- 5 Экспериментальное определение величины показателя адиабаты
- 6 См. также
- 7 Примечания
[править] Соотношения для идеального газа
Для идеального газа теплоёмкость не зависит от температуры. Соответственно, можно выразить энтальпию как  и внутренняя энергия может быть представлена как
и внутренняя энергия может быть представлена как  . Таким образом, можно также сказать, что показатель адиабаты — это отношение энтальпии к внутренней энергии:
. Таким образом, можно также сказать, что показатель адиабаты — это отношение энтальпии к внутренней энергии:
С другой стороны, теплоёмкости могут быть выражены также через показатель адиабаты ( ) и универсальную газовую постоянную (
) и универсальную газовую постоянную ( ):
):
Может оказаться достаточно трудным найти информацию о табличных значениях  , в то время как табличные значения
, в то время как табличные значения приводятся чаще. В этом случае можно использовать следующую формулу для определения
приводятся чаще. В этом случае можно использовать следующую формулу для определения  :
:
где  — количество вещества в молях.
— количество вещества в молях.
[править] Соотношения с использованием количества степеней свободы
Показатель адиабаты ( ) для идеального газа может быть выражен через количество степеней свободы (
) для идеального газа может быть выражен через количество степеней свободы ( ) молекул газа:
) молекул газа:
 или
или 
Таким образом, для одноатомного идеального газа (три степени свободы) показатель адиабаты равен:
 ,
,
в то время как для двуатомного идеального газа (пять степеней свободы) (при комнатной температуре):
 .
.
Воздух на земле представляет собой в основном смесь двухатомных газов (около 78 % азота — N2, и около 21 % кислорода — O2), и при нормальных условиях его можно рассматривать как идеальный. Двухатомный газ имеет пять степеней свободы (три поступательных и две вращательных степени свободы; колебательная степень свободы не задействована, за исключением высоких температур). Как следствие, теоретически, показатель адиабаты для воздуха имеет величину:
 .
.
Это хорошо согласуется с экспериментальными измерениями показателя адиабаты воздуха, которые приблизительно дают значение 1.403 (приведённое выше в таблице).
[править] Соотношения для реальных газов
По мере того, как температура возрастает, более высокоэнергетические вращательные и колебательные состояния становятся достижимыми для молекулярных газов, и таким образом, количество степеней свободы возрастает, и уменьшается показатель адиабаты  .
.
Для реальных газов, как  , так и
, так и  возрастают с увеличением температуры, при этом разность между ними остаётся неизменной (согласно приведённой выше формуле
возрастают с увеличением температуры, при этом разность между ними остаётся неизменной (согласно приведённой выше формуле  =
=  ), и эта разность отражает постоянство величины
), и эта разность отражает постоянство величины  , то есть работы, совершаемой при расширении. Величина
, то есть работы, совершаемой при расширении. Величина  представляет собой разницу между количествами подведённой теплоты при постоянном давлении и при постоянном объёме. Следовательно, отношение двух величин,
представляет собой разницу между количествами подведённой теплоты при постоянном давлении и при постоянном объёме. Следовательно, отношение двух величин,  , возрастает при увеличении температуры. См. также удельная теплоёмкость.
, возрастает при увеличении температуры. См. также удельная теплоёмкость.
[править] Термодинамические выражения
Значения, полученные с помощью приближённых соотношений (в частности,  ), во многих случаях являются недостаточно точными для практических инженерных расчётов, таких, как расчёты расходов через трубопроводы и клапаны. Предпочтительнее использовать экспериментальные значения, чем те, которые получены с помощью приближённых формул. Строгие значения соотношения
), во многих случаях являются недостаточно точными для практических инженерных расчётов, таких, как расчёты расходов через трубопроводы и клапаны. Предпочтительнее использовать экспериментальные значения, чем те, которые получены с помощью приближённых формул. Строгие значения соотношения  может быть вычислено путём определения
может быть вычислено путём определения  из свойств, выраженных как:
из свойств, выраженных как:
Значения  не составляет труда измерить, в то время как значения для
не составляет труда измерить, в то время как значения для  необходимо определять из формул, подобных этой. См. здесь (англ.) для получения более подробной информации о соотношениях между теплоёмкостями.
необходимо определять из формул, подобных этой. См. здесь (англ.) для получения более подробной информации о соотношениях между теплоёмкостями.
Вышеприведённые соотношения отражают подход, основанный на развитии строгих уравнений состояния (таких, как уравнение Пенга — Робинсона[en]), которые настолько хорошо согласуются с экспериментом, что для их применения требуется лишь незначительно развивать базу данных соотношений или значений  . Значения могут быть также определены с помощью метода конечных разностей.
. Значения могут быть также определены с помощью метода конечных разностей.
[править] Адиабатический процесс
Для изоэнтропийного, квазистатического, обратимого адиабатного процесса, происходящего в простом сжимаемом идеальном газе:
где  — это давление и
— это давление и  — объём газа.
— объём газа.
[править] Экспериментальное определение величины показателя адиабаты
Поскольку процессы, происходящие в небольших объёмах газа при прохождении звуковой волны, близки к адиабатическим[4], показатель адиабаты можно определить, измерив скорость звука в газе. В этом случае показатель адиабаты и скорость звука в газе будут связаны следующим выражением:
где  — показатель адиабаты;
— показатель адиабаты;  — постоянная Больцмана;
— постоянная Больцмана;  — универсальная газовая постоянная;
— универсальная газовая постоянная;  — абсолютная температура в кельвинах;
— абсолютная температура в кельвинах;  — молекулярная масса;
— молекулярная масса;  — молярная масса.
— молярная масса.
Другим способом экспериментального определения величины показателя адиабаты является метод Клемана — Дезорма, который часто используется в учебных целях при выполнении лабораторных работ. Метод основан на изучении параметров некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами: адиабатическим и изохорическим.[5]
Лабораторная установка включает стеклянный баллон, соединенный с манометром, краном и резиновой грушей. Груша служит для нагнетания воздуха в баллон. Специальный зажим предотвращает утечку воздуха из баллона. Манометр измеряет разность давлений внутри и вне баллона. Кран может выпускать воздух из баллона в атмосферу.
Пусть первоначально в баллоне было атмосферное давление и комнатная температура. Процесс выполнения работы можно условно разбить на два этапа, каждый из которых включает в себя адиабатный и изохорный процесс.
1-й этап:
При закрытом кране накачиваем в баллон небольшое количество воздуха и зажимаем шланг зажимом. При этом давление и температура в баллоне повысятся. Это адиабатный процесс. Со временем давление в баллоне начнет уменьшаться вследствие того, что газ в баллоне начнёт охлаждаться за счет теплообмена через стенки баллона. При этом давление будет уменьшаться при построянном объёме. Это изохорный процесс. Выждав, когда температура воздуха внутри баллона сравняется с температурой окружающего воздуха, запишем показания манометра  .
.
2-ой этап:
Теперь откроем кран 3 на 1—2 секунды. Воздух в баллоне будет адиабатно расширяться до атмосферного давления. При этом температура в баллоне понизится. Затем кран закроем. Со временем давление в баллоне начнет увеличиваться вследствие того, что газ в баллоне начнет нагреваться за счет теплообмена через стенки баллона. При этом снова будет увеличиваться давление при постоянном объёме. Это изохорный процесс. Выждав, когда температура воздуха внутри баллона сравнится с температурой окружающего воздуха, запишем показание манометра  . Для каждой ветви 2-х этапов можно написать соответствующие уравнения адиабаты и изохоры. Получится система уравнений, которые включают в себя показатель адиабаты. Их приближённое решение приводит к следующей расчетной формуле для искомой величины:
. Для каждой ветви 2-х этапов можно написать соответствующие уравнения адиабаты и изохоры. Получится система уравнений, которые включают в себя показатель адиабаты. Их приближённое решение приводит к следующей расчетной формуле для искомой величины:
Недостатком данного метода является то, что процессы быстрого расширения газа в ходе лабораторной работы не являются чисто адиабатическими ввиду теплообмена через стенку сосудов, а рассматриваемый газ заведомо не является идеальным. И хотя полученная в ходе лабораторной работы величина будет заведомо содержать методическую погрешность, всё же существуют различные способы её устранения, например, за счет учета времени расширения и количества подведенного за это время тепла.[6]
[править] См. также
- Теплоёмкость
- Удельная теплоёмкость
- Скорость звука
- Термодинамические уравнения (англ.)
- Термодинамика
- Объёмная теплоёмкость
[править] Примечания
- ↑ Fox, R., A. McDonald, P. Pritchard: Introduction to Fluid Mechanics 6th ed. Wiley
- ↑ White, Frank M.: Fluid Mechanics 4th ed. McGraw Hill
- ↑ Lange’s Handbook of Chemistry, 10th ed. page 1524
- ↑ Савельев2001, с. 30—32
- ↑ http://www.physdep.isu.ru/kosm/method/obsh/lab/2-8.pdf
- ↑ http://www.physchem.msu.ru/doc/12_molecular.PDF
Показатели адиабаты: определение и процесс
При изучении поведения газов в физике много внимания уделяется изопроцессам, то есть таким переходам между состояниями системы, во время которых сохраняется один термодинамический параметр. Тем не менее, существует газовый переход между состояниями, который не является изопроцессом, но который играет важную роль в природе и технике. Речь идет об адиабатическом процессе. В данной статье рассмотрим его подробнее, акцентируя внимание на том, что такое показатель адиабаты газа.
Адиабатический процесс
 Вам будет интересно: Задачи социологии: предметы, основные методы, цели и развитие
Вам будет интересно: Задачи социологии: предметы, основные методы, цели и развитие
Согласно термодинамическому определению, под адиабатическим процессом понимают такой переход между начальным и конечным состояниями системы, в результате которого не существует обмена теплом между внешней средой и изучаемой системой. Такой процесс возможен при наличии следующих двух условий:
- теплопроводность между внешней средой и системой по той или иной причине является низкой;
- скорость процесса велика, поэтому обмен теплом не успевает происходить.
В технике адиабатный переход используют как для разогрева газа при его резком сжатии, так и для его охлаждения во время быстрого расширения. В природе рассматриваемый термодинамический переход проявляет себя, когда воздушная масса поднимается или опускается по склону холма. Такие подъемы и спуски приводят к изменению точки росы в воздухе и к возникновению осадков.
Уравнение Пуассона для адиабаты идеального газа
 Вам будет интересно: Что такое плиз? Молодежный сленг
Вам будет интересно: Что такое плиз? Молодежный сленг

Идеальный газ представляет собой систему, в которой частицы движутся хаотично с большими скоростями, не взаимодействуют друг с другом и являются безразмерными. Такая модель является очень простой с точки зрения ее математического описания.
Согласно определению адиабатного процесса, можно записать следующее выражение в соответствии с первым законом термодинамики:
Иными словами, газ, расширяясь или сжимаясь, совершает работу P*dV за счет соответствующего изменения своей внутренней энергии dU.
В случае идеального газа, если воспользоваться уравнением его состояния (закон Клапейрона-Менделеева), то можно получить следующее выражение:
Это равенство называется уравнением Пуассона. Люди, которые знакомы с физикой газов, заметят, что если величина γ будет равна 1, то уравнение Пуассона перейдет в закон Бойля-Мариотта (изотермический процесс). Однако такое преобразование уравнений невозможно, поскольку γ для любого типа идеального газа больше единицы. Величина γ (гамма) называется показателем адиабаты идеального газа. Рассмотрим подробнее его физический смысл.
Что такое показатель адиабаты?
Показатель γ, который появляется в уравнении Пуассона для газа идеального, представляет собой отношение теплоемкости при постоянном давлении к аналогичной величине, но уже при постоянном объеме. В физике теплоемкостью называют величину теплоты, которую нужно передать данной системе или забрать у нее, чтобы она изменила свою температуру на 1 Кельвин. Будем обозначать символом CP изобарную теплоемкость, а символом CV — изохорную. Тогда для γ справедливо равенство:
Поскольку γ всегда больше одного, то он показывает, во сколько раз изобарная теплоемкость изучаемой газовой системы превышает аналогичную изохорную характеристику.
Теплоемкости CP и CV
Чтобы определить показатель адиабаты, следует хорошо понимать смысл величин CP и CV. Для этого проведем следующий мысленный эксперимент: представим, что газ находится в закрытой системе в сосуде с твердыми стенками. Если нагревать сосуд, то все сообщенное тепло в идеальном случае перейдет во внутреннюю энергию газа. В такой ситуации будет справедливо равенство:
Величина CV определяет количество теплоты, которое следует передать системе, чтобы изохорно нагреть ее на 1 К.
Теперь предположим, что газ находится в сосуде с подвижным поршнем. В процессе нагрева такой системы поршень будет перемещаться, обеспечивая поддержание постоянного давления. Поскольку энтальпия системы в таком случае будет равна произведению изобарной теплоемкости на изменение температуры, то первый закон термодинамики примет вид:
CP*dT = CV*dT + P*dV.
Отсюда видно, что CP>CV, так как в случае изобарного изменения состояний необходимо расходовать тепло не только на повышение температуры системы, а значит, и ее внутренней энергии, но и на выполнение газом работы при его расширении.
Величина γ для газа идеального одноатомного
Самой простой газовой системой является одноатомный идеальный газ. Предположим, что мы имеет 1 моль такого газа. Напомним, что в процессе изобарного нагрева 1 моль газа всего на 1 Кельвин, он совершает работу, равную величине R. Этим символом принято обозначать универсальную газовую постоянную. Она равна 8,314 Дж/(моль*К). Применяя последнее выражение в предыдущем пункте для данного случая, получаем такое равенство:
Откуда можно определить значение изохорной теплоемкости CV:
Известно, что для одного моль одноатомного газа значение изохорной теплоемкости составляет:
Из последних двух равенств следует значение показателя адиабаты:
Отметим, что величина γ зависит исключительно от внутренних свойств самого газа (от многоатомности его молекул) и не зависит от количества вещества в системе.
Зависимость γ от числа степеней свободы
Выше было записано уравнение для изохорной теплоемкости одноатомного газа. Появившийся в нем коэффициент 3/2 связан с количеством степеней свободы у одного атома. У него существует возможность двигаться только в одном из трех направлений пространства, то есть существуют только поступательные степени свободы.
Если система образована двухатомными молекулами, то к трем поступательным добавляются еще две вращательные степени. Поэтому выражение для CV приобретает вид:
Тогда значение γ будет равно:
Отметим, что на самом деле существует у двухатомной молекулы еще одна колебательная степень свободы, но при температурах в несколько сотен Кельвин она не задействуется и не вносит вклад в теплоемкость.
Если молекулы газа состоят из более, чем двух атомов, тогда у них будет 6 степеней свободы. Показатель адиабаты при этом будет равен:
Таким образом, при увеличении числа атомов в молекуле газа величина γ уменьшается. Если построить график адиабаты в осях P-V, то можно заметить, что кривая для одноатомного газа будет вести себя более резко, чем для многоатомного.
Показатель адиабаты для смеси газов
Выше мы показали, что величина γ от химического состава газовой системы не зависит. Однако она зависит от количества атомов, которое составляет ее молекулы. Предположим, что система состоит из N компонент. Атомная доля компонента i в смеси равна ai. Тогда для определения показателя адиабаты смеси можно использовать следующее выражение:
Где γi — это величина γ для i-го компонента.
Например, это выражение можно применить для определения γ воздуха. Поскольку он состоит на 99 % из двухатомных молекул кислорода и азота, то его показатель адиабаты должен быть очень близок к значению 1,4, что подтверждается при экспериментальном определении этой величины.
Уравнение Пуассона
Определение и формула уравнения Пуассона
Уравнение Пуассона описывает адиабатический процесс, происходящий в идеальном газе. Адиабатический процесс — это процесс, в котором нет теплообмена между рассматриваемой системой и окружающей средой:
Уравнение Пуассона имеет вид:
Здесь V — объем, занимаемый газом, P — его давление, а значение k называется адиабатическим индексом.
Адиабатический индекс в уравнении Пуассона
Адиабатический индекс можно рассчитать как отношение изобарной теплоемкости газа к его изохорной теплоемкости:
В практических расчетах удобно помнить, что для идеального газа адиабатический индекс равен для двухатомного и для трехатомного .
Что относительно реальных газов, когда силы взаимодействия между молекулами начинают играть важную роль? В этом случае адиабатический индекс для каждого испытательного газа может быть получен экспериментально. Один из таких методов был предложен в 1819 году Климентом и Дезормом. Мы наполняем цилиндр холодным газом, пока давление в нем не достигнет Р1. Затем мы открываем клапан, газ начинает адиабатически расширяться, а давление в цилиндре падает до атмосферного ПА. После того, как изохорный газ нагрелся до температуры окружающей среды, давление в цилиндре повысится до P2. Тогда адиабатический индекс можно вычислить по формуле:
Адиабатический индекс всегда больше 1, поэтому при адиабатическом сжатии газа — как идеального, так и реального — температура газа всегда поднимается до меньшего объема, а при расширении газ охлаждается. Это свойство адиабатического процесса, называемого пневматическим кремнем, используется в дизельных двигателях, где горючая смесь сжимается в цилиндре и воспламеняется теплом. Напомним первый закон термодинамики: , где — внутренняя энергия системы, а А — выполненная на ней работа. Поскольку работа, выполняемая газом, идет только для изменения ее внутренней энергии — и, следовательно, температуры. Из уравнения Пуассона можно получить формулу для расчета газовой операции в адиабатическом процессе:
Здесь n — количество газа в молях, R — универсальная газовая постоянная, T — абсолютная температура газа.
Уравнение Пуассона для адиабатического процесса используется не только при расчетах двигателей внутреннего сгорания, но и при проектировании холодильных машин.
Стоит вспомнить, что уравнение Пуассона точно описывает только равновесный адиабатический процесс, состоящий из непрерывно меняющихся состояний равновесия. Если на самом деле мы открываем клапан в цилиндре так, чтобы газ расширялся адиабатически, то возникнет нестационарный переходный процесс с газовой турбулентностью, который будет испаряться из-за макроскопического трения.
Примеры решения проблем
Одноатомный идеальный газ был адиабатически сжат, так что его объем увеличился в 2 раза. Как изменится давление газа?
Адиабатический индекс для одноатомного газа равен . Однако его можно вычислить по формуле:
где R — универсальная газовая постоянная, а і — степень свободы молекулы газа. Для одноатомного газа степень свободы равна 3: это означает, что центр молекулы может выполнять поступательное движение вдоль трех координатных осей.
Поэтому адиабатический индекс:
Представьте себе состояние газа в начале и конце адиабатического процесса через уравнение Пуассона:
Давление уменьшится в 3.175 раз.
100 молей двухатомного идеального газа было адиабатически сжато при 300 К. В то же время давление газа увеличилось в 3 раза. Как изменился газ?
Степень свободы двухатомной молекулы равна i = 5, так как молекула может двигаться постепенно вдоль трех координатных осей и вращаться вокруг двух осей.
Рассчитайте диатомический адиабатический индекс:
Определите, как изменяется объем газа при адиабатическом сжатии, из уравнения Пуассона:
Это означает, что объем газа уменьшился в 2,19 раза.
Вычислите работу газа, используя следующую формулу:
1.5. Смеси газов
Возникает естественный вопрос: какими уравнениями описываются смеси идеальных газов? Ведь с чистыми газами нам редко приходится встречаться в природе. Например, наша естественная среда обитания — воздух — состоит из азота N2 (78,08 %), кислорода O2 (20,95 %), инертных газов (0,94 %), углекислого газа СO2 (0,03 %).
Пусть в некотором объеме V при некоторой температуре Т содержится смесь газов (которые мы будем нумеровать
индексом i ). Роль каждого компонента смеси будем характеризовать массовой долей:

где mi — масса i-го компонента. Наша задача — написать уравнение, подобное уравнению Клапейрона — Менделеева, и разобраться с эффективным числом степеней свободы смеси, где могут содержаться и одноатомные, и многоатомные молекулы.
Прежде всего, заметим, что мы рассматриваем идеальные газы. Молекулы не взаимодействуют друг с другом, и потому каждый компонент не мешает любому другому «жить» в том же общем сосуде. Различные газы в сосуде, в силу их предполагаемой идеальности, просто «не замечают» друг друга. Поэтому для каждого из компонентов справедливо одно и то же уравнение Клапейрона — Менделеева:
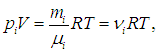
где ni — число молей вещества в i -м компоненте. Полное число n молей в смеси равно сумме числа молей ni в каждом из компонентов:
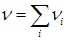
Аналогично, полная масса смеси равна сумме масс каждого из компонентов
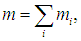
и естественно определить молярную массу смеси m как массу одного моля смеси:
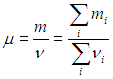
Введем величину, называемую парциальным давлением.
Парциальное давление pi — это давление, оказываемое i-м компонентом газовой смеси.
Имеет место закон Дальтона для газовой смеси:
Полное давление газовой смеси равно сумме всех парциальных давлений
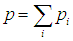
Суммируя левые и правые части (1.21), приходим к стандартной форме уравнения Клапейрона — Менделеева
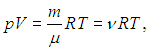
где m, μ, n определяются из условия конкретной задачи. Например, если заданы массовые доли компонентов, то молярную массу смеси находим из соотношения
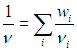
Внутренняя энергия Ui i-го компонента смеси определяется в соответствии с формулами (1.16) и (1.19):
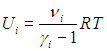
С одной стороны, полная внутренняя энергия смеси равна сумме энергий каждого компонента:
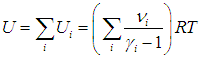
С другой стороны, запишем стандартное выражение вида (1.25)

Сравнивая (1.26) и (1.27), получаем формулу для показателя адиабаты смеси
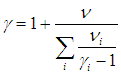
Найдя массу моля и показатель адиабаты смеси, мы можем пользоваться всеми формулами, полученными ранее для «чистых» идеальных газов.
Пример. Дана смесь кислорода O2 (компонент 1) и аргона Ar (компонент 2), причем количества вещества обоих компонентов одинаковы n1 = n2. Найдем показатель адиабаты смеси.
Показатель адиабаты двухатомного кислорода равен
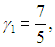
а одноатомного аргона
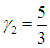
Поэтому для смеси газов на основании (1.29) получаем
источники:
http://www.homework.ru/spravochnik/uravnenie-puassona/
http://online.mephi.ru/courses/physics/molecular_physics/data/course/1/1.5.1.html






















