Министерство
образования и науки Российской Федерации
ФГАОУ ВПО Уральский
Федеральный Университет
имени первого
Президента России Б.Н. Ельцина
кафедра теоретической
теплотехники
анализ политропного
процесса
смеси идеальных газов
курсовая работа
по
технической термодинамике
Вариант 4
Преподаватель Нейская
Студент Иванова
И.Л.
Группа Т-200901
Екатеринбург
2011
Оглавление
-
Теоретический
анализ обратимого политропного
процесса…………………………………………………………………………3-
Определение
политропного процесса…………………………………….…3 -
Вывод уравнения
политропного процесса в переменных………………….3 -
Способы
определения показателя политропы………………………….…5 -
Вычисление
параметров состояния в начале и в конце
процесса………6 -
Вычисление
теплоемкости и количества теплоты
процесса……….….6 -
Вычисление
работы изменения объема и внешней
работы………….…..6 -
Вычисление
изменения термодинамических
функций……………….…..7
-
-
Расчет политропного
процесса……………………………………10-
Расчет
термодинамических свойств……………………………………..10-
Расчет
газовых постоянных и удельных массовых
теплоемкостей.10 -
Вычисление
массовых долей компонентов
смеси……………………….10 -
Удельные
теплоёмкости смеси…………………………………………….11 -
Газовая
постоянная смеси…………………………………………………..11 -
Показатель
адиабаты смеси……………………………………………….11
-
-
Определение
параметров в начале и в конце
процесса…………………..11 -
Расчет удельных
характеристик процесса………………………………12-
Удельная
работа изменения объема………………………………………12 -
Удельная
внешняя работа……………………………………………..……12 -
Удельное
количество теплоты процесса…………………………..……12 -
Расчёт
изменения термодинамических
функций………………………12 -
Проверка
расчётов по первому закону
термодинамики………………13 -
Изображение
процесса на диаграммах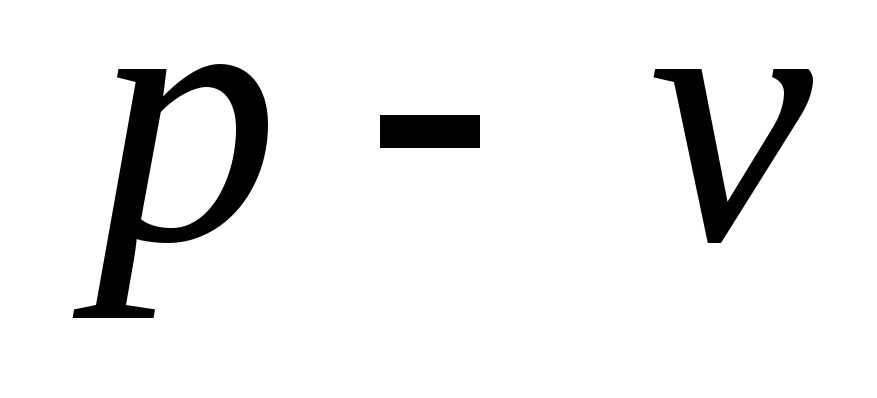
и
 ……………….14
……………….14
-
-
Основные
обозначения……………………………………………………15
Список использованных
источников……………………………..16
1. Теоретический
анализ обратимого
политропного
процесса.
1.1. Определение
политропного процесса
По определению
политропным процессом называется
процесс с постоянной заданной теплоёмкостью
cn
или, что то же, с постоянным заданным
отношением работы процесса к теплоте
процесса на любой стадии его протекания,
т.е.
![]()
Анализ процесса
включает
-
вывод
уравнения политропного процесса в
переменных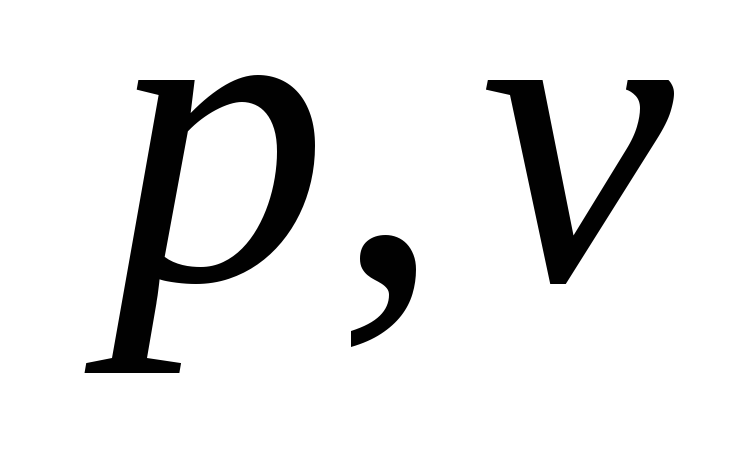 ;
; -
вычисление
параметров состояния в начале и в конце
процесса; -
вычисление
теплоемкости cn
и количества теплоты процесса q; -
вычисление
работы изменения объема l
и внешней работы процесса l`. -
вычисление
изменения термодинамических функций:
a)
внутренней энергии
![]() ,
,
b)
энтальпии
![]() ,
,
c)
энтропии
![]() .
.
6) изображение
процесса на диаграммах
![]()
и
![]() .
.
Рабочее тело –
идеальный газ, подчиняющийся уравнению
состояния
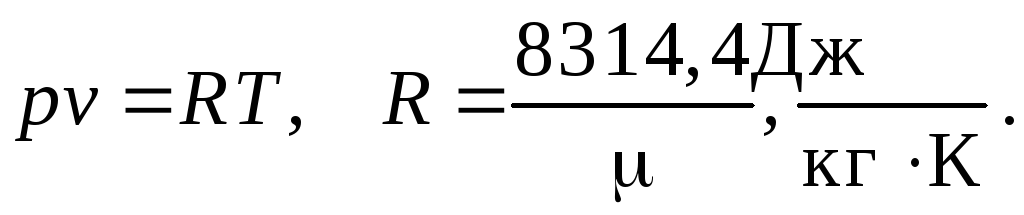
Анализ проводится
для 1 кг рабочего тела при постоянных
теплоёмкостях
![]() ,
,
вычисляемых с помощью молекулярно–кинетической
теории.
1.2. Вывод
уравнения политропного процесса в
переменных
(p,v)
Выражения первого
начала термодинамики можно записать в
двух эквивалентных формах (через
внутреннюю энергию и через энтальпию):
![]()
Здесь
![]()
(два последние
равенства представляют собой закон
Джоуля: внутренняя энергия и энтальпия
идеального газа не зависят только от
температуры).
Подставив
![]()
в уравнения и исключая из них
![]() ,
,
после простых преобразований получим
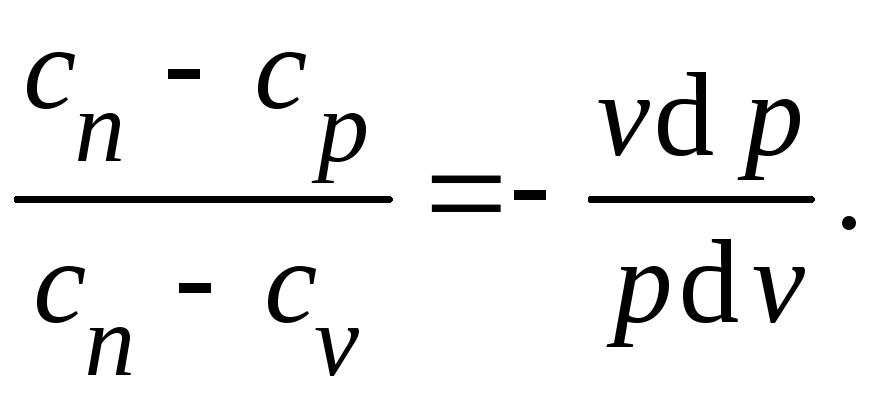
Постоянная величина
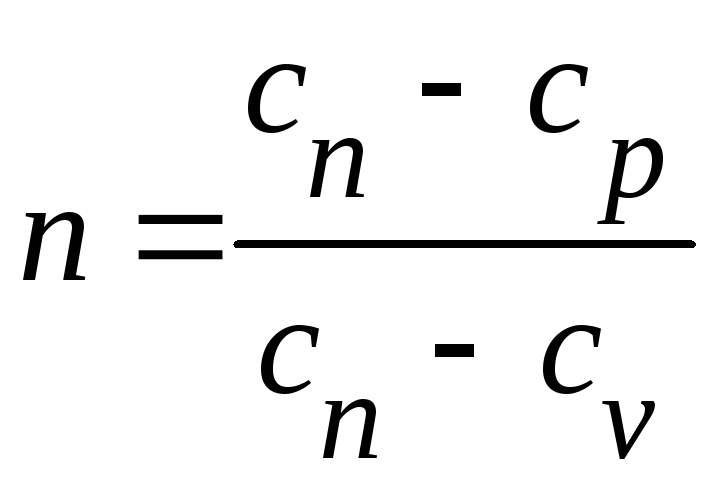
Называется
показателем
политропы.
Выражение
записывается в
виде дифференциального уравнения
первого порядка с разделёнными переменными
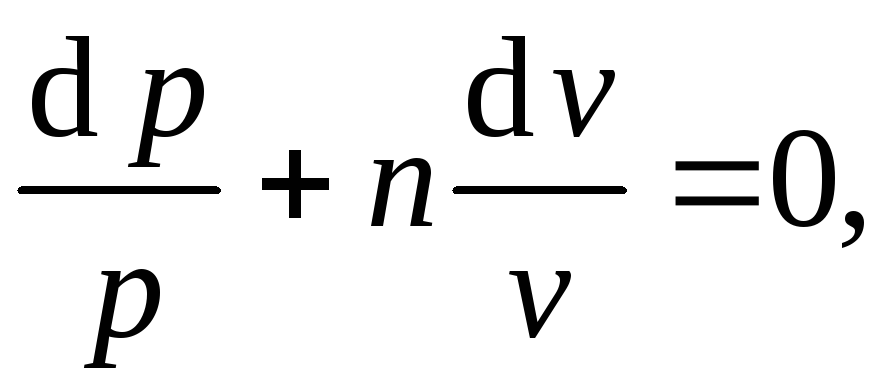
решение которого
имеет вид:
![]()
Или
![]() (8)
(8)
Графическое
изображение политропного процесса.
Зависимость для
различных значений показателя политропы
представлена на рис.1.
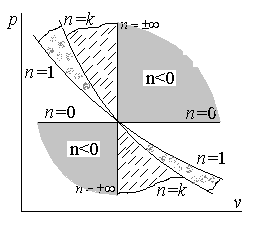
Рис.1. Изображение политропного процесса
в диаграмме
![]()
для различных значений показателя
политропы
![]() .
.
Выражение (4) для
показателя политропы n
представляет
собой отношение внешней работы и работы
расширения, которые на диаграмме p
–
v
графически изображаются площадями
слева от кривой процесса и под ней
соответственно (рис. 2).
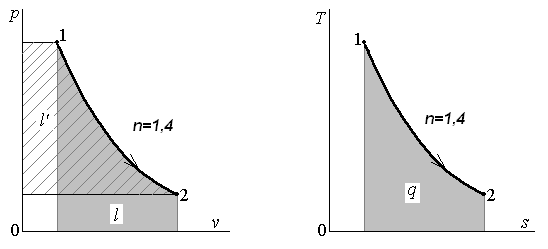
Рис. 2. Графическое определение показателя
политропы
 (9)
(9)
Таким образом, для
определения показателя политропы
необходимо знать, что процесс является
политропным, и иметь его изображение
на диаграмме p
–
v.
Такой способ называется графическим.
Показатель политропы
можно определить также по значениям
двух параметров в начале и в конце
процесса. Записывая уравнение политропного
процесса, например, для известных
давлений и объемов в начале и в конце
процесса (точки 1 и 2)
![]() (10)
(10)
получим
![]() (11)
(11)
Такой способ
определения показателя политропы
называется аналитическим.
1.4. Вычисление параметров состояния в начале и в конце процесса
Соотношение для
давлений и объемов в начальном и конечном
состояниях следует из (10); соотношения
для температур и давлений или температур
и объемов можно получить, выражая объемы
и давления через температуры из уравнения
состояния (1):
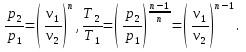 (12)
(12)
1.5. Вычисление теплоемкости и количества теплоты процесса
При заданном
значении показателя политропы
![]()
из определения находим теплоёмкость
политропного процесса:
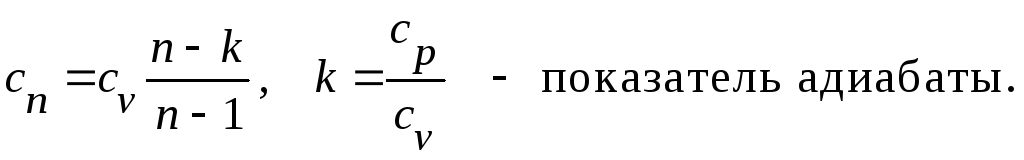 (13)
(13)
Тогда теплота
процесса ввиду постоянства теплоёмкости
определится простым выражением:
![]() (14)
(14)
1.6. Вычисление работы изменения объема и внешней работы
Работа изменения
объема по определению
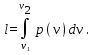
Поскольку теперь
известно уравнение процесса в переменных
p,v,
![]()
этот интеграл
может быть вычислен:
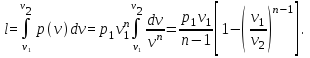 (15)
(15)
Используя
соотношение между давлением и объемом
в политропном процессе и уравнение
состояния, выражение для работы можно
также записать в виде:
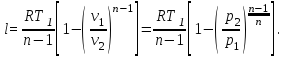 (16)
(16)
Внешняя
работа процесса.
Внешнюю
работу процесса также можно вычислить,
используя определение внешней работы
и взяв соответствующий интеграл
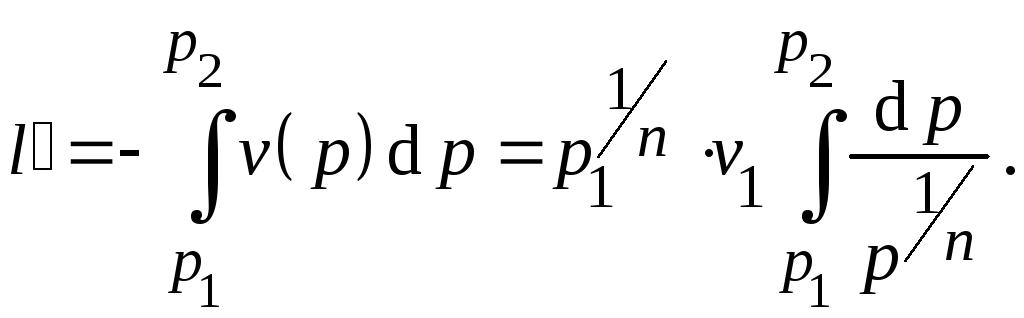
Однако проще
получить это выражение, воспользовавшись
определением показателя политропы (9),
из которого видно, что внешняя работы
в n
раз больше работы изменения объема:
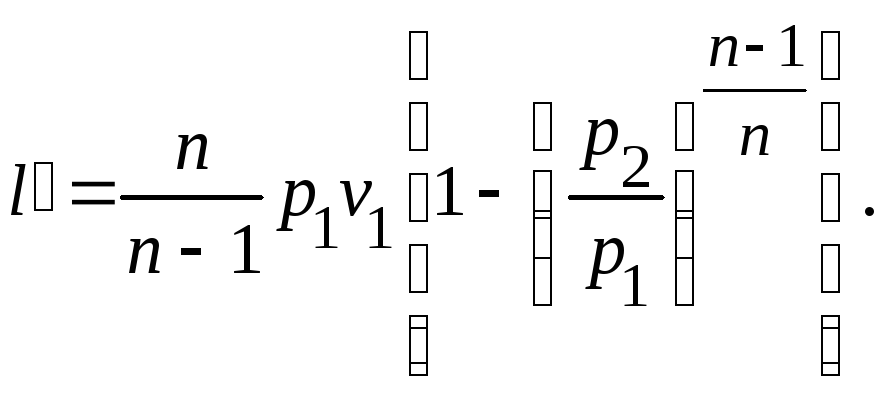 (17)
(17)
1.7. Вычисление изменения термодинамических функций
Для вычисления
изменения внутренней энергии и энтальпии
необходимо проинтегрировать два
последних уравнения в (3). Тогда
изменение
внутренней энергии
![]() (18)
(18)
изменение
энтальпии
![]() (19)
(19)
Выражение
для изменения энтропии можно получить
на основании II
закона термодинамики для необратимых
процессов:
![]() (20)
(20)
Тогда изменение
энтропии

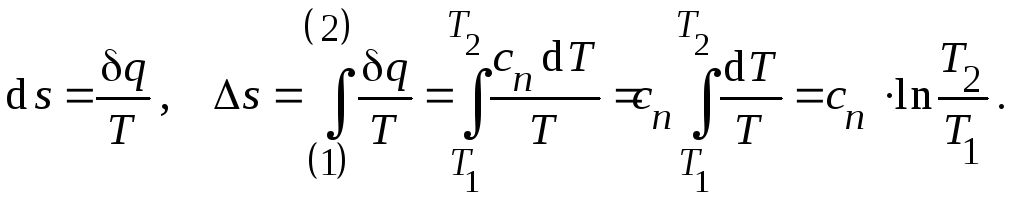 (21)
(21)
Уравнение
политропного процесса в переменных
![]()
следует из определения количества
теплоты через теплоёмкость (3) и из
математической записи второго начала
термодинамики (20):
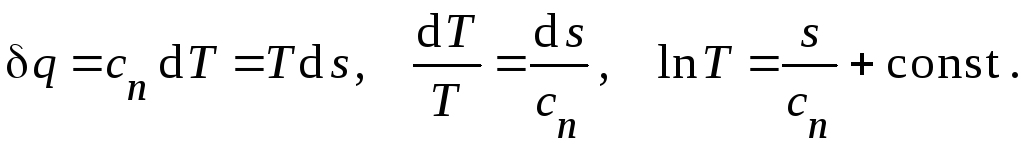
Если известны
значения температуры и энтропии в
начальном состоянии, то после нахождения
произвольной постоянной получаем:
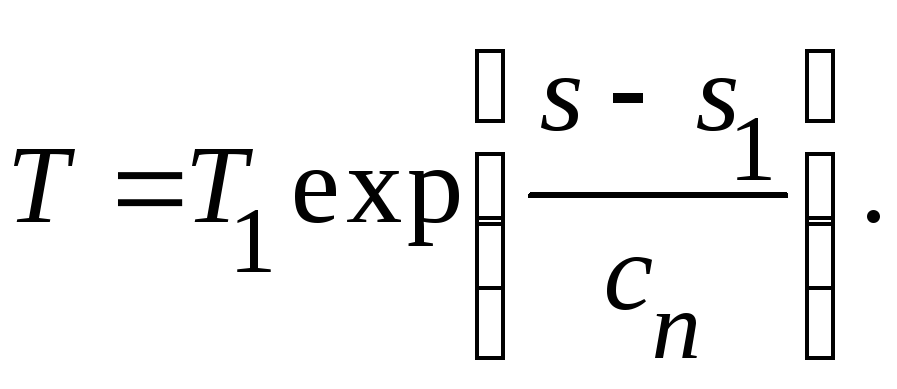 (22)
(22)
Графическое
изображение политропного процесса в
переменных
![]()
на основании (22) представлена на рис.3.
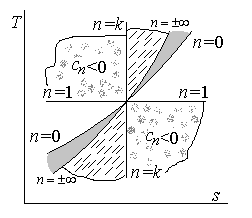
Рис.3. Изображение политропного процесса
в диаграмме
![]()
для различных значений показателя
политропы
![]() .
.
Примечание.
Для адиабатического процесса
![]()
Расчёт проводится по приведённым
формулам политропного процесса с заменой
n
на k.
Из первого закона термодинамики при
![]()
следует:
![]() (23)
(23)
где
![]()
вычисляются по формулам (18) и (19).
Проверка расчётов
проводится на основе первого закона
термодинамики:
![]() (24)
(24)
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
АНАЛИЗ.
В задаче рассматривается явление теплопроводности с точки зрения
молекулярно-кинетической теории. Коэффициент теплопроводности рассчитывается по
формуле ![]() . Этот коэффициент не зависит от
. Этот коэффициент не зависит от
давления при нормальных условиях. Зависимость проявляется, если давление
настолько мало, что средняя длина свободного пробега молекулы ![]() оказывается больше, чем расстояние
оказывается больше, чем расстояние
между стенками сосуда, т. е. ![]() > h. Следует найти минимальное давление,
> h. Следует найти минимальное давление,
при котором проявляется зависимость ![]() .
.
РЕШЕНИЕ.
Покажем, что при нормальных условиях коэффициент теплопроводности зависит от
температуры и не зависит от давления. Воспользуемся для этого формулой 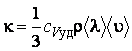 .
.
Учитывая,
что
![]() ;
; ![]() ;
;
![]() ,
,
запишем
![]() .
.
Если длина свободного
пробега молекул больше расстояния между стенками сосуда h, то давление газа при таких условиях
можно найти из формулы ![]() > h.
> h.
Следовательно,
минимальное значение давления pmin должно удовлетворять условию ![]() .
.
Проверим формулу на размерность:
![]() .
.
Подставим численные значения:
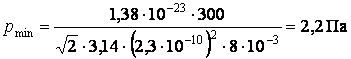 .
.
Чтобы теплоемкость оказалась пониженной, давление остаточного газа между
стенками дюаровского сосуда должно быть меньше 2,2 Па.
ОТВЕТ:
pmin= 2,2 Па.
ЗАДАЧА
8. Найти показатель политропы n
процесса, совершаемого идеальным газом при котором остается неизменным: а)
коэффициент диффузии D,
б) вязкость η, в) теплопроводность ![]() .
.
ДАНО:а) D = const б) η = const в) |
|
n – ? |
АНАЛИЗ.
В задаче требуется, используя представления молекулярно-кинетической теории,
найти показатель nполитропного
процесса, при котором:
а) ![]() ,
,
б) ![]() ,
,
в) ![]() . Политропным называется процесс, при
. Политропным называется процесс, при
котором теплоемкость остается постоянной. Следует учесть, что уравнение
политропы в различных переменных можно представить в виде: ![]() ,
, ![]() ,
, ![]()
РЕШЕНИЕ.
а) Запишем выражение для коэффициента диффузии как функцию давления p и температуры Т газа. Учтем,
что ![]() ,
, ![]() ,
,
тогда ![]() . Следовательно,
. Следовательно, ![]() .
.
По
условию задачи D = const, т. е. должна выполняться
зависимость ![]() .
.
Запишем
уравнение политропного процесса в виде ![]() ,
,
тогда ![]() , и
, и ![]() ,
,
отсюда ![]() , n = 3.
, n = 3.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание – внизу страницы.
10.3 Расчет политропного процесса сжатия газовой смеси в компрессоре
Рабочее тело – газовая смесь, имеющая тот же состав, что и в задаче №1 (в процентах по объему). Первоначальный объем, занимаемый газовой смесью, — V1 (табл. 2). Начальные параметры состояния: давление р1=0,1 МПа, температура t1=27 ºC. Процесс сжатия происходит при показателе политропы n. Давление смеси в конце сжатия р2, МПа (табл. 3).
Определить:
1) массу газовой смеси;
2) удельные объемы смеси в начале и в конце процесса;
3) объем, занимаемый смесью в конце процесса;
4) температуру газовой смеси в конце процесса;
5) работу сжатия в процессе;
6) работу, затрачиваемую на привод компрессора;
7) изменение внутренней энергии газовой смеси;
8) массовую теплоемкость рабочего тела в данном процессе;
9) количество теплоты, участвующего в процессе;
10) изменение энтропии в процессе.
Таблица 3
| Показатели | Вариант |
| 00 | |
| Объем смеси, V1, м3 | 120 |
| Показатель политропы n | 1,14 |
| Давление р2, МПа | 1,4 |
Построить (в масштабе) рассмотренный процесс в координатах р-υ и T-s. Необходимые для решения задачи теплоемкости компонентов газовой смеси принять независимыми от температуры. Значения теплоемкостей газов можно принять при температуре равной 0 ºC из приложения данного методического указания.
Газовую постоянную смеси взять из решения задачи №1.
Ответить в письменном виде на следующие вопросы:
1 В каких пределах может изменяться показатель политропного процесса?
2 В каких пределах может изменяться теплоемкость рабочего тела в политропном процессе?
3 Как выглядит уравнение 1-го закона термодинамики применительно к рассмотренному в задаче процессу?
4 Как зависит работа, затрачиваемая на привод компрессора, от показателя политропы n, почему?
Пример оформления
Варианты задачи: 01, 02, 03, 04, 05, 06, 07, 08, 09, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99.
Методичка: Техническая термодинамика.pdf
Методичка: Техническая термодинамика и теплопередача.pdf
