Запишем известное
из термодинамики выражение внутренней
энергии для поверхности.
UВ
=
GВ
+ TSВ
– уравнение
полной поверхностной энергии.
В
этом уравнении qВ
= TS
– теплота образования единицы поверхности
в обратимом процессе. Она равна количеству
теплоты, которую необходимо подвести
к системе, чтобы увеличить ее поверхность
на единицу при T=const.
Из уравнений фазы при постоянстве всех
параметров, кроме температуры, имеем:
dGs
= –
SsdT,.
Подставляя
эти значения в уравнение полной
поверхностной энергии, получаем:
–
уравнение Гиббса – Гельмгольца для
полной поверхностной энергии.
Оно
связывает полную поверхностную энергию
с энергией Гиббса (поверхностное
натяжение).
Для
гетерогенной системы изменение внутренней
энергии, исходя из I
и II
начал термодинамики:
где dU
– изменение внутренней энергии;
dS– изменение энтропии;
dV– изменение объема;
Т– температура;
Р– давление;
–
поверхностное натяжение;
n– число молей компонента;
dq– изменение электрического заряда;
–
химический потенциал компонентов;

электрический потенциал компонентов;
В– межфазная
поверхность.
При
S,
V,
n,
q=const
уравнение примет вид: dU
=dВ
,
т.е.
–
это изменение внутренней энергии на
единицу площади.
Из
уравнений видно
,
т.е. подтверждается, что при увеличении
температуры поверхностное натяжение
снижается. Если сопоставить изменение
,qs,
Us
от температуры, получим рис. 2.1.2.3. Из
графика видно, что величина Us
для индивидуального вещества величина
практически постоянна, т.е. Us
не зависит от температуры. Для расчета
зависимости
=f(T)
используются эмпирические и полуэмпирические
зависимости – метод парахор, формула
Этвеша [3].
В
случае твердых фаз процесс образования
новой поверхности носит необратимый
характер и
(поверхностное натяжение) можно измерить
только косвенным путем, например, путем
расчета.
Глава 2.2 Адсорбция
Тема
2.2.1. Понятие
адсорбции. Адсорбент и адсорбат.
Абсолютная и Гиббсовская адсорбция.
Зависимость величины адсорбции от
концентрации, давления и температуры.
Изотерма, изобара, изопикна, изостера
адсорбции.
Адсорбция
– процесс самопроизвольного перераспределения
компонентов системы между поверхностным
слоем и объемом фазы.
Адсорбция
может наблюдаться в многокомпонентных
системах и при перераспределении в
поверхностный слой уходит тот компонент,
который сильнее понижает поверхностное
натяжение. В однокомпонентной системе
при формировании поверхностного слоя
происходит изменение его структуры –
уплотнение, которое называется
автоадсорбцией.
В
не только благодаря стремлению
поверхностной энергии к уменьшению, но
и за счет химической реакции компонентов
с поверхностью вещества. В этом случае
поверхностная энергия может даже
увеличиваться на фоне снижения энергии
всей системы.
Вещество,
на поверхности которого происходит
адсорбция, называется адсорбентом,
а вещество, которое перераспределяется
– адсорбатом.
Обратный
процесс перехода вещества с поверхности
в объем фазы – десорбция.
В
зависимости от агрегатного состояния
фаз различают адсорбцию газа на твердых
адсорбентах, твердое тело – жидкость,
жидкость – жидкость, жидкость – газ. Для
количественного описания адсорбции
применяют две величины:
-
Абсолютная
адсорбция
– это количество адсорбата, приходящееся
на единицу поверхности адсорбента:
,
где
n – число молей
вещества в растворе;
В
– площадь поверхности;
CB– концентрация адсорбата в поверхностном
слое;
h–
толщина слоя.
-
Величина,
определяемая избытком вещества в
поверхностном слое, отнесенным к
единице площади поверхности или массы
адсорбента, называется Гиббсовской
или избыточной
адсорбцией
(Г).
,
где CB,CV–
концентрации адсорбата в поверхностном
слое и в объеме;
VB–
объем раствора;
B–
площадь поверхностного слоя.
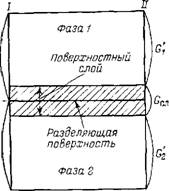
П
двухфазная равновесная система, в ней
распределен компонент, адсорбирующийся
на межфазной поверхности. Границы фаз
в методе «слоя конечной толщины»: х,
х
и хВ,
хВ.
Границы поверхностного слоя от хВ
до хВ.
Общее число молей распределяемого
компонента:
,
где 1-е и 2- слагаемые – число молей
адсорбата в фазах без поверхностного
слоя; 3-е – число молей адсорбата в
межфазном слое. Тогда общее число молей
адсорбата:
При
использовании метода избыточных величин
Гиббса:
,
где 1-е и 2-е слагаемые – число молей
адсорбата в фазах, включая части
поверхностного слоя с концентрациями,
равными концентрациям в объеме; 3-е
слагаемое – избыток числа молей
адсорбата, приходящийся на разделяющую
поверхность, абсцисса которойхВ.
Представив
избыточное число молей адсорбата niB
через среднюю концентрацию в поверхностном
слое
(считая ее постоянной на протяжении
всей толщины поверхностного слоя), после
интегрирования получим:,
гдеVB
и VB
– объемы частей поверхностного слоя
со стороны фаз соответственно
и .
Для
величины гиббсовской адсорбции:
Если
адсорбат не переходит в объем одной из
фаз (адсорбция на твердых адсорбентах),
то уравнение приобретает вид:
,
гдеVB– объем поверхностного слоя;сi
– концентрация адсорбата в объеме.
Для
получения соотношения А и Г составим
уравнение баланса относительно числа
молей адсорбата в поверхностном слое:
,
гдеVBиVB– объемы частей поверхностного слоя
со стороны фаз соответственнои,ciVB
– число молей адсорбата в поверхностном
слое без избытка.
Отсюда
,
гдеh– толщина
поверхностного слоя.
Эти
уравнения отражают физический смысл А
и Г, но их нельзя использовать для
определения величины адсорбции, т.к.
неизвестны объем и толщина поверхностного
слоя.
Для
получения необходимого соотношения
составим уравнение баланса относительно
числа молей адсорбата во всей системе
до и после адсорбции:
,
гдеVиVv– общий объем системы и объем фазы без
поверхностного слоя; с0– исходная
концентрацияi-того
компонента.
Исключив
число молей адсорбата в поверхностном
слое
,
подставимв
,
получим:
Т.к.
,
тоили
На рисунке величина
А – вся заштрихованная площадь под
кривой профиля концентрации в поверхностном
слое, а величина Г составляет площадь
с двойной штриховкой.
При установлении
адсорбционного равновесия в системе
количество адсорбированного вещества
в поверхностном слое находится в
зависимости от концентрации или
парциального давления этого компонента
в объеме и от температуры. Согласно
правилу фаз Гиббса, число параметров,
определяющих состояние системы, равно
(гдеF– число степеней
свободы, К – число компонентов системы,
Ф – число фаз, 2 – два параметра –
давление и температура).
При
адсорбции из газовой фазы система
состоит из адсорбента и газа-адсорбата
К = 2, Ф = 2,F= 2. Отсюда можно изменять произвольно
два параметра: Р и Т для достижения
равновесного состояния системы.
Для
конденсированных фаз (твердой и жидкой)
К= 3 (адсорбируется растворенное
вещество). Давлением в этом случае
пренебрегаемF= 2:сиТ.
Т.
обр., любой из параметров системы
однозначно определяется как минимум
через два других параметра, т.е.
.[3]
Виды зависимости
адсорбции от параметров системы
|
|
|
|
|
|
а) |
б) |
в) |
г) |
|
А=fT(c) A=fT(P) |
A=fC(T) |
А=fP(T) |
c=fA(T) P=fA(T) |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Лекция № 2
План лекции:
ОСНОВНЫЕ ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ ПОВЕРХНОСТНОГО СЛОЯ
ГЕОМЕТРИЧЕСКИЕ ПАРАМЕТРЫ ПОВЕРХНОСТИ
Межфазные поверхности могут существовать только при наличии в системе жидкой или твердой фазы. Межфазную поверхность т-ж определяет профиль поверхности твердого тела. Поверхностный слой на межфазных границах имеет одну часть в первой фазе, другую – во второй.
Удельная поверхность тела определяется отношением площади его поверхности S 1,2 между фазами 1 и 2 к объему тела V .
(2.1)
Поверхность между фазами может быть отнесена к дисперсной фазе или к дисперсной среде. Обычно при определении удельной поверхности дисперсной системы ее относят к объему дисперсной фазы.
Дисперсные системы с одинаковыми по размерам частицами дисперсной фазы называются монодисперсными, с разными – полидисперсными.
Если поверхность и объем дисперсной фазы междисперсной системы выразить через поверхность и объем отдельных частиц, то число частиц будет входить и в числитель и в знаменатель. Поэтому S уд монодисперсной системы можно определить, зная размер отдельных частиц. Например, для частиц кубических с размерами ребра 1 и сферическим диаметром d :
(2.2)
для сферических частиц:
(2.3)
k – коэффициент формы частиц.
Часто S уд относят к массе дисперсной фазы:
– для квадратных частиц (2.4)
– для сферических частиц
Изменение S уд с изменением дисперсности зависит от формы частиц.
SHAPE * MERGEFORMAT
D , a (дисперсность, Размер частиц)
(2.5)
(2.5)
(2.5)
Зависимость возрастает, т. к. возрастает коэффициент формы.
Более конкретная характеристика дисперсности кривизна поверхности, определяемая производной площади поверхности по объему.
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ( ).
– обусловлено нескомпенсированным полем межмолекулярных сил на межфазной поверхности; – фактор интенсивности поверхностной энергии.
Термодинамическое определение вытекает из объединенного уравнение 1-го и 2-го начал термодинамики. Запишем его для гетерогенной системы относительно изменения внутренней энергии U :
dU = TdS – pdV + dS + i dni + dq1
При S, V, n, q – const:
= ( U / S ) S , U , n , q (2.6)
т.е. – частная производная от внутренней энергии по площади поверхности раздела, при S , V, n, q – const .
(2.7)
т.е. в общем виде, – частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянны соответствующих параметрах.
– определяется энергией, приходящейся на единицу площади:
единицы измерения: СИ Дж/м 2 = Н*м/м 2 = Н/м
СГС Эр1/см 2 , Дин/см.
Физический смысл
1. Работа, расходуемая на разрыв межмолекулярной связи. Чем сильней межмокулярные связи в данном теле, тем больше его па границе с газовой фазой, т.е. поверхностное натяжение меньше у неполярных жидкостей со слабыми межмолекулярными связями. Большим поверхностным натяжением обладают вещества с водородными связями (вода).
2. Сила, направленная параллельно к поверхности. Поверхностные молекулы, обладая избыточной энергией, стремятся уйти вглубь конденсированной фазы и сжимают поверхность.
КОГЕЗИОННЫЕ И ПОВЕРХНОСТНЫЕ СИЛЫ
Когезия – взаимодействие молекул, атомов, ионов внутри одной фазы.
W к = 2 (2.8)
т.к. определяется затратой энергии на обратимый разрыв тела по сечению равному единице площади.
Точную информацию о когезии и поверхностном натяжении можно получить из т/д характеристик тел, связанных с парообразованием.
В процессе испарения происходит полный разрыв межмолекулярных связей, поэтому работа когезии определяется энтальпией парообразования.
H = G п + T S п (2.9)
При равновесии при р, Т = const G п = 0 Н = Т S п
Отсюда следует, что, чем больше энтальпия парообразования (т.е. больше работа когезии, а значит и поверхностное натяжение), тем меньше давление насыщенного пара над веществом, т.к.
S п = So – R·ln ( р / ратм ) (2.10),
где So – изменение энтропии парообразования. При температуре кипения.
При кипении р/ратм = 1
L = Ткип So So = L / Ткип (2.11)
L – энтальпия парообразования при Ткип.
Свойства поверхности отражают природу ионов, атомов и молекул в ней.
Для жидкостей и твердых тел когезионные силы выражаются в межмолекулярном взаимодействии, обусловленном ван-дер-ваальсовыми и водородными связями. Оно отличается от химического взаимодействия отсутствующей специфичностью и насыщаемостью небольшими энергиями. Разрыв таких связей приводит к формированию поверхностей, способных образовывать ван-дер-ваальсовые и водородные связи с молекулами, попадающими на эту поверхность.
ВНУТРЕННЯЯ (ПОЛНАЯ) УДЕЛЬНАЯ ПОВЕРХНОСТНАЯ ЭНЕРГИЯ. ЗАВИСИМОСТЬ ЭНЕРГЕТИЧЕСКИХ ПАРАМЕТРОВ ПОВЕРХНОСТИ ОТ ТЕМПЕРАТУРЫ.
За толщину поверхностного слоя принимают расстояние по обе стороны от границы раздела фаз, за пределами которой свойства слоя перестают отличаться от свойств объемных фаз.
Установление границ поверхностного слоя со стороны объемных фаз трудная задача. Гиббс предложил относить все изменения т/д параметров в слое к разделяющей поверхности, не имеющей объема или толщины (метод избыточных величин Гиббса).
G = G 1 + G 2 + * S (2.12)
G – энергия Гиббса системы;
G 1 и G 2 – энергия Гиббса объемных фаз;
S – поверхностная энергия Гиббса.
Избыточная внутренняя энергия:
Индекс « s » указывает на то, что потенциалы отнесены к единице поверхности.
q s = TS s теплота образования единицы поверхности (скрытая теплота образования, она равна количеству теплоты, которую нужно сообщить телу, чтобы при постоянной температуре увеличить его поверхность на единицу площади).
Учитывая, что G s = , можно написать:
U s = + qs (2.15)
Из уравнения 2.15 следует, что внутренняя энергия поверхности складывается из энергии Гиббса и теплоты образования поверхности.
Из объединенного уравнения, при постоянстве всех параметров, кроме температуры, имеем:
dGs = – S dT или ( Gs/ T) p = -S = -q s /T (2.16)
Подставляя (2.16) в (2.14) или (2.15), получаем:
U s = – T ( / T ) p (2.17)
(2.17) – уравнение Гиббса-Гельмгольца, оно связывает поверхностную энергию с поверхностным напряжением, следовательно, для определения полной поверхностной энергии нужно знать зависимость поверхностного напряжения от температуры. Конкретную зависимость можно получить только экспериментально, но качественные выводы можно сделать из уравнения (2.17).
qS – всегда больше 0. (для индивидуального вещества).
( G s / T ) p = ( / T ) p 0, следовательно, уменьшается с увеличением температуры. Для большинства неполярных жидкостей эта зависимость линейна и в первом приближении ее можно записать, как:
T = 0 – a D T (2.18)
– постоянная, равная температурному коэффициенту с обратным знаком.
Для большинства жидкостей поверхностная энергия почти не зависит от температуры.
Чтобы убедиться в этом проинтегрируем по температуре (2.17)
( U s / T) = ( / T) – ( / T) – T( 2 / T 2 )
( U s / T) = -T( 2 / T 2 )
– уменьшается с увеличением температуры, то (см. 2.18), таким образом,
( Us / T ) = 0, что означает независимость US от температуры.
Природа поверхностной энергии. Поверхностное натяжение
” data-shape=”round” data-use-links data-color-scheme=”normal” data-direction=”horizontal” data-services=”messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger”>
Природа поверхностной энергии. Поверхностное натяжение. ТЕРМОДИНАМИКА МЕЖФАЗНОЙ ПОВЕРХНОСТНОСТИ
Наиболее важной характеристикой поверхности является поверхностное натяжение а.
Поверхностное натяжение – это избыточная энергия, приходящаяся на единицу площади поверхности:
Физическая природа поверхностного натяжения в нескомпенсированности поля межмолекулярных сил на межфазных поверхностях.
Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем сильнее межмолекулярные связи в веществе, тем больше поверхностное натяжение на его межфазной поверхности.
С термодинамической точки зрения, поверхностное натяжение определяется частной производной от любого термодинамического потенциала по величине площади межфазной поверхности при постоянстве других параметров. Используя потенциал Гиббса (G), можно записать
где р – давление; Т- температура; п. – число молей компонентов.
Поверхностная энергия является частью свободной энергии системы в целом. В самопроизвольных процессах эта энергия может быть снижена либо за счет уменьшения площади поверхности и изменения ее формы, либо за счет снижения поверхностного натяжения.
Факторы, влияющие на поверхностное натяжение
Поверхностное натяжение на границе раздела фаз между жидкостью и газом определяют следующие факторы: химическая природа вещества, температура, природа граничащих фаз, наличие примесей, заряд поверхности, кривизна поверхности жидкости.
Энергия межмолекулярных взаимодействий зависит от температуры, а значит, имеет выраженную температурную зависимость.
Взаимосвязь поверхностного натяжения, температуры и полной поверхностной энергии (внутренней энергии поверхностного слоя) Us выражается уравнением Гиббса – Гельмгольца:
Для многих веществ температурные коэффициенты поверхностного натяжения находятся в диапазоне от -0,1 до 0,2 мДж/(м 2 *К).
Рис. 2.1. Зависимость поверхностного натяжения жидкостей от температуры: вода (У), глицерин (2), нитробензол (3), гексан (4).
С повышением температуры поверхностное натяжение уменьшается, а теплота образования единицы площади поверхности увеличивается. Это объясняется тем, что с повышением температуры расстояние между молекулами в жидких телах увеличивается, и соответственно равнодействующая межмолекулярных сил (и, следовательно, поверхностное натяжение) уменьшается. С помощью температурного коэффициента можно определить поверхностное натяжение при любой температуре, если известно значение поверхностного натяжения при какой-то температуре, т. е.
Появление кривизны поверхности из-за стремления системы
к минимуму поверхностной энергии ведет не только к изменению площади межфазной поверхности, но и к появлению избыточного давления внутри фаз. Взаимосвязь между избыточным внутренним давлением в теле и кривизной его поверхности выражается уравнением Лапласа:
Искривление поверхности вызывает повышение или понижение давления в фазе по сравнению с плоской поверхностью фазы такого же химического состава. Очевидно, что это приводит к изменению термодинамических параметров вещества, которые определяют его физические свойства и реакционную способность. Понятие термодинамическая реакционная способность вещества характеризует его способность изменять химический или фазо
вый состав, т. е. вступать в химическую реакцию или переходить в новую фазу (например, испаряться или конденсироваться, растворяться).
У тел с искривленной поверхностью меняется не только внутреннее давление, но и его свободная энергия
Уравнение показывает, что приращение реакционной способности пропорционально 1/r- кривизне поверхности или дисперсности. Чем выше кривизна поверхности или дисперсность, тем выше ее влияние на реакционную способность.
При переходе из газообразного состояния в жидкое
гдер – давление пара над искривленной поверхностью; ps– давление пара над плоской поверхностью.
Тогда уравнение, записанное для сферической поверхности, называется уравнением капиллярной конденсации Кельвина (Томсона):
Из анализа данного уравнения можно сделать вывод о том, что при положительной кривизне жидкости (капля в невесомости или на поверхности твердого тела при отсутствии или неполной смачиваемости) над ней создается повышенное по сравнению с плоской поверхностью давление пара, т. е. испаряется больше жидкости. При отрицательной кривизне (жидкость, смачивающая капилляр) количество испарившейся жидкости в равновесии с ее паром будет меньше по сравнению с плоской поверхностью; иными словами, конденсация будет происходить при меньшем давлении паров.
При появлении кривизны поверхности и увеличении степени дисперсности уменьшается и температура фазовых переходов.
Свободная энергия единицы поверхности и поверхностное натяжение
3.1. Поверхностные свойства веществ
Если взять частицу внутри жидкости и, рассматривая ее как точку, провести сферу радиуса действия межчастичных сил, то за промежуток времени, больший по сравнению с периодом собственных колебаний, на частицу будут действовать силы, одинаковые во всех направлениях.
Следовательно, силовое поле атомов или молекул в объеме жидкости симметрично. Частицы в глубине и на поверхности имеют разные силовые поля. На поверхности жидкости частица будет испытывать преимущественное притяжение со стороны жидкой фазы. Если вторая фаза — пар или газ, то силами взаимодействия со стороны другой фазы можно пренебречь. Если вторая фаза — жидкость, то равнодействующая будет другая.
В общем случае межчастичные силы на межфазной границе несимметричны. Наличие такой асимметрии силового поля приводит к тому, что появляется равнодействующая, направленная перпендикулярно поверхности. Под действием этой силы поля частица втягивается вглубь жидкости. Если частицы уподобить шарикам, то перемещение подвижных частиц жидкости можно проиллюстрировать следующим рис. 3.3:
Когда частица из поверхностного слоя уйдет в объем жидкости, между оставшимися двумя соседними частицами будут действовать силы притяжения. Силы притяжения между частицами В и С сближают поверхностные частицы, поэтому жидкость самопроизвольно сокращает свою поверхность. Такой характер поведения жидкости обусловлен ее текучестью. Если на жидкость не действуют никакие другие силы, то жидкость принимает форму сферы, обладающей минимальной поверхностью. Если же действуют силы тяжести, то форма жидкости может быть другой. При малом объеме жидкости поверхностные силы намного превосходят силы тяжести и жидкость собирается в сферическую капельку. По мере увеличения объема жидкости эти силы становятся соизмеримыми и получается приплюснутая капля. В случае большого объема жидкости силы тяжести значительно больше поверхностных сил и жидкость принимает форму сосуда.
Если увеличивать поверхность жидкости, то на это увеличение нужно затрачивать работу: δА — работа увеличения поверхности на dω. При обратимом изотермическом процессе эта работа максимальна и равна убыли свободной энергии системы: δАмакс = –dF. Изменение свободной энергии, отнесенной к единице поверхности при постоянных объеме и температуре (V, T = const), называется свободной энергией единицы поверхности, или поверхностным натяжением.
F Работа δА отрицательна, так как работу совершаем мы, а не система. Размерность поверхностного натяжения:
Энергия на единицу поверхности. Эти размерности можно преобразовать:
Сила, действующая на поверхности жидкости, направленная по касательной к этой поверхности. Эту силу называют поверхностным натяжением — это сила на единицу длины, действующая по касательной к поверхности. Количественно свободная энергия единицы поверхности жидкости равна поверхностному натяжению, однако отождествлять их нельзя. Энергия — это скалярная величина, а сила — векторная. Они совпадают только в изотропных средах. В анизотропных средах (кристаллах) эти характеристики могут существенно отличаться. В кристаллических телах сила — не вектор, а тензор. Вектор можно задать тремя числами, а тензор определяется числовой матрицей, т. е. набором чисел. Если этих чисел три, то имеем вектор r (x, y, z). Если состояние напряженное, то надо знать напряжение по различным направлениям.
Натяжение в общем случае нужно рассматривать как тензор. Поэтому в кристаллах нельзя отождествлять свободную энергию и поверхностное натяжение. В жидкости они совпадают количественно, и обычно в литературе их отождествляют:
Поверхностное натяжение жидкостей обычно определяют на границе с их собственным насыщенным паром или инертным газом. Величина свободной энергии зависит от свойств жидкости и является вполне определенной. Поверхностное натяжение жидкости — ее свойство, ее характеристика при данной температуре. Натяжение на границе двух конденсированных фаз (ж1‑ж2, ж‑тв) зависит от свойств каждой жидкости и является их совместной характеристикой. Поэтому его называют межфазным натяжением. Размерность та же.
Для конденсированных фаз при малых давлениях F ≈ G, и обычно технологи пользуются энергией Гиббса. F (V, T), G (P, T) — в скобках записаны независимые переменные.
Правильнее было бы обозначать как σ V и σ Р . σ V — работа образования единицы поверхности при неизменном объеме системы; σ Р — работа образования единицы поверхности при постоянном давлении. Если изменение объема ΔV мало, что характерно для конденсированных фаз, то этими различиями можно пренебречь.
Для чистых жидкостей при малых давлениях PdV → 0 . Если давление большое, то σР > σV на работу против сил внешнего давления. Для чистых жидкостей это справедливо, а для растворов эти понятия не тождественны (т. к. имеем различные структурные коэффициенты). В дальнейшем мы будем рассматривать небольшие давления и считать, что σР = σV
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 2.1.
При конденсации тумана, состоящего из капель кадмия, образовалось 12,5 • 10 -6 м 3 жидкого кадмия. Поверхностное натяжение при температуре конденсации равно 570 мДж/м 2 . Свободная поверхностная энергия всех капель составляла 53 Дж. Вычислите дисперсность и диаметр капель жидкого кадмия.
Пример 2.2.
Рассчитать давление насыщенных паров над каплями воды с дисперсностью 0,1 нм -1 при 293 К. Давление над плоской поверхностью при этой температуре составляет 2338 Па, р = 1 г/см 3 , поверхностное натяжение 72,7 мДж/м 2 , мольный объем 18 • 10 -6 м 3 /моль.
Пример 2.3.
В воздухе, содержащем пары воды, образуется туман при температуре 270 К. Степень пересыщения составляет 3,01. Поверхностное натяжение 73 мДж/м 2 , мольный объем вещества в конденсированном состоянии 18*10 -6 м 3 /моль. Рассчитать критический размер ядер конденсации и число молекул, содержащихся в них.
Пример 2.4.
По экспериментальным данным (табл. 2.1) температурной зависимости поверхностного натяжения найти температурный коэффициент.
Термодинамика поверхностного слоя
Термодинамическая характеристика дисперсных систем. Термодинамический метод избыточных величин Гиббса и метод «слоя конечной толщины.
Дисперсной называют систему, в которой одно вещество распределено в среде другого, причем между частицами и дисперсионной средой есть граница раздела фаз. Дисперсные системы состоят из дисперсной фазы и дисперсионной среды.
Дисперсная фаза – это частицы, распределенные в среде. Ее признаки: дисперсность и прерывистость (рис. 1.1.1.1).
Дисперсионная среда – материальная среда, в которой находится дисперсная фаза. Ее признак – непрерывность .
Поверхность раздела фаз характеризуется раздробленностью и гетерогенностью. Раздробленность характеризуется:
1) степенью дисперсности : 
2) дисперсностью – величиной, обратной минимальному размеру:



3)удельной поверхностью : 

4) кривизной поверхности : 

где r 1 и r 2 – радиусы окружностей при прохождении через поверхность и нормаль к ней в данной точке двух перпендикулярных плоскостей.
5) размером тела по трем осям , причем определяющим является размер по той оси, где он минимальный. В зависимости от размеров частиц они имеют свои исторические названия (см. рис. 1.1.1.1).
Лиофильные системы – в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться – растворы коллоидных ПАВ, растворы ВМС. Свободная энергия системы DF 0;
где W ког – работа когезии;
W сольв – работа сольватации.
При DU > 0, DU DU . Эта группа характеризуется малым значением поверхностного натяжения на границе раздела фаз.
Лиофобные системы – в них дисперсная фаза не способна взаимодействовать с дисперсионной средой и растворяться в ней. Для них DF > 0. Диспергирование в этом случае совершается либо за счет внешней работы, либо за счет других процессов, идущих в системе спонтанно (химическая реакция) и характеризуется высоким значением поверхностного натяжения на границе раздела фаз, что соответствует малому значению энергии сольватации.
Существует две группы способов получения дисперсных систем:
1. Способы диспергирования заключаются в раздроблении тела до коллоидного состояния (мукомольное производство).
2. Способы конденсации заключаются в укрупнении частиц, атомов, молекул до частиц коллоидных размеров (химическая реакция с образованием осадка).
Как уже отмечалось, на границе раздела фаз существует избыток свободной энергии. Процесс увеличения площади поверхности при постоянном объеме выводит молекулы из глубины фазы на поверхностный слой, совершая при этом работу против межмолекулярных сил. Эта работа в изотермических условиях равна увеличению свободной поверхностной энергии. Для описания термодинамики поверхностных явлений используют два метода:
1. Метод избыточных величин Гиббса .
2. Метод слоя конечной толщины .
За толщину поверхностного слоя принимаем расстояние по обе стороны границы раздела фаз, за пределами которого свойства слоя перестают отличаться от свойств фазы в объеме.
Определение границы поверхностного слоя задача очень сложная, поэтому Гиббсом предложено относить все изменения термодинамических параметров слоя разделяющей поверхности, не имеющей объема и толщины. При таком рассмотрении поверхность будет обладать избыточными термодинамическими параметрами, непосредственно отражающими проявление поверхностной энергии. В соответствии метода Гиббса позиция 1 на рис. 2.1.1.1 – энергия системы равна сумме энергий Гиббса объемных фаз DG 1 и 


В методе слоя конечной толщины рассматривается поверхностный слой, имеющий определенные размеры (позиция II на рис. 2.1.1.1). Его термодинамические параметры включают как поверхностную энергию, так и энергию объема слоя, имеющего те же свойства, что и объемная фаза. Этот метод не рассматриваем. В методе Гиббса все экстенсивные величины выражаются в виде избытков по сравнению со значением этих величин в реальных объемных фазах.
Тема 2.1.2. Поверхностное натяжение. Методы измерения поверхностного натяжения. Зависимость поверхностного натяжения от температуры и концентрации. Уравнение Шишковского
На образование коллоидной системы затрачивается работа А= × S , где коэффициент пропорциональности; S – новая поверхность.
Поверхностное натяжение есть частная производная от любого термодинамического потенциала по площади межфазной поверхности при постоянстве соответствующих параметров.
Если проводить процесс образования новой поверхности изотермически и обратимо, то вся работа перейдет в запас свободной энергии поверхности: A = F s , F s = s×S ; 
Коэффициент s – поверхностное натяжение; – это работа, совершаемая для образования единицы новой поверхности.
Поверхностное натяжение – это сила, действующая на единицу длины контура, ограниченного единицей поверхности и направленная в сторону сокращения поверхности, перпендикулярно к контуру вовнутрь его.
Наиболее часто используются 4 метода определения поверхностного натяжения.
1. Метод максимального давления в пузырьке газа (метод Ребиндера) (рис. 2.1.2.1, а).
Основан на продавливании пузырька газа (воздуха) под воздействием внешнего давления р через калиброванный капилляр радиусом r 0 . С увеличением давления пузырек растет, а радиус кривизны его поверхности R превышает радиус капилляра (положение 1 рис. 2.1.2.1, а : R > r 0 ). Дальнейшее увеличение объема пузырька будет происходить до тех пор, пока внутреннее давление достигнет своего максимального значения; радиус кривизны при этом будет минимальным, т.е. R = r 0 (положение 2). В этот момент пузырек теряет устойчивость: при увеличении его объема он отрывается от капилляра. Если в момент отрыва пузырька измерить давление р , то поверхностное натяжение можно представить


Чтобы не измерять радиус капилляра, можно определить р для жидкости, поверхностное натяжение которой известно (эталон, часто, вода). Отсюда

Исключив в уравнениях (1) и (2) радиус капилляра, получим выражение для определения поверхностного натяжения

где 



2. Сталагмометрический метод (рис. 2.1.2.1, б).
Определяют вес капли, которая отрывается от капилляра под действием силы тяжести. Считают, что при отрыве вес капли Р к уравновешивается силой, равной произведению поверхностного натяжения и длины окружности капилляра радиусом r 0 :

где k – поправочный коэффициент, учитывающий, что отрыв капель происходит по радиусу шейки капли, который меньше радиуса самой капли.
Определяют экспериментально вес капель и при помощи разработанных таблиц с учетом (3) находят s. Рекомендуется увеличивать время формирования капли до тех пор, пока число капель станет постоянным.

где r – плотность исследуемой жидкости;
n – число капель исследуемой жидкости;
sст , rст , n ст – значения s, r и n для стандартной жидкости.
3. Метод отрыва кольца (рис. 2.1.2.1, в).
Измеряют силу F , которой противодействует поверхностное натяжение жидкости, смачивающей периметр поверхности кольца.

где k – поправочный коэффициент, учитывает, что поднимающийся при отрыве кольца столб жидкости не имеет формы правильного полого цилиндра.
Метод капиллярного поднятия (рис. 2.1.2.1, г).
В капилляре за счет смачивания образуется вогнутый мениск с радиусом кривизны r , поверхностное натяжениеsжг вызывает капиллярное давление Dр . Оно уравновешивается весом Р н столба жидкости высотой Н :

где q – краевой угол смачивания.
Капиллярное давление уравновешивается весом столба РН жидкости высотой Н , т.е. Dр = РН . С учетом (4) и веса столба жидкости можно записать:

где r, r0 – плотность жидкости и газа (воздуха).
В связи с тем, что r >> r0 , плотностью газа можно пренебречь, тогда высота подъема жидкости в капилляре определяется по формуле

Р и с. 2.1.2.1. Методы определения поверхностного натяжения: а – наибольшего давления в пузырьке, б – сталагмометрическим, в – отрыва кольца,
г – капиллярного поднятия
При полном смачивании, когда q = 0 и cosq = 1, имеем


гдеD r – разность плотностей жидкости и газовой фазы;
g – ускорение свободного падения;
а – капиллярная постоянная.
Поверхностное натяжение индивидуальных веществ (жидкостей) монотонно убывает с возрастанием температуры.



где 

D Т – разность температур;
а – температурный коэффициент; 

Это объясняется тем, что вначале вся поверхность раздела жидкой фазы свободна от поверхностно-активных веществ (ПАВ) и небольшое его количество, присутствующее в растворе, почти целиком уходит на поверхность. Затем следует криволинейный участок, отвечающий средней концентрации. В этих условиях значительная часть поверхности занята молекулами поверхностно-активных веществ (ПАВ), что снижает скорость повышения концентрации на границе раздела. Большим концентрациям на изотерме отвечает почти горизонтальный участок (кривая 3), показывающий, что поверхностное натяжение мало зависит от концентрации. При этих условиях на границе «жидкость – воздух» образуется сплошной монослой поверхностно-активного вещества (ПАВ), и увеличение его концентрации на границе невозможно в дальнейшем. При увеличении концентрации поверхностного инактивного вещества в растворе изотерма полого поднимается (кривая 2). Это объясняется тем, что поверхностные инактивные вещества благодаря высокому поверхностному натяжению и активности уходят в объем, а на границе раздела «жидкость – воздух» имеются лишь сравнительно небольшие концентрации вещества, попадающего туда за счет диффузии из объема раствора. При увеличении концентрации веществ, не влияющих на поверхностное натяжение, изотерма представляет собой прямую, параллельную оси концентрации. Следует отметить, что отнесение веществ к той или иной группе зависит от природы растворителя. Одно и тоже вещество для разных растворителей может быть и поверхностно-активным веществом (ПАВ), и не влиять на поверхностное натяжение.
Для малых и средних концентраций поверхностно-активных веществ (ПАВ) при описании зависимости 

где s 0 – поверхностное натяжение растворителя (Н/м);
c – концентрация поверхностно-активного вещества (ПАВ);
А, b – константы, данные в справочнике.
Уравнение Гиббса-Гельмгольца для поверхностной энергии. Полная поверхностная энергия
Запишем известное из термодинамики выражение внутренней энергии для поверхности.



В этом уравнении q s = T D S – теплота образования единицы поверхности в обратимом процессе. Она равна количеству теплоты, которую необходимо подвести к системе, чтобы увеличить ее поверхность на единицу при T = const . Из уравнений фазы при постоянстве всех параметров, кроме температуры, имеем:
dG s = – S s dT , 
Подставляя эти значения в уравнение полной поверхностной энергии, получаем:

Оно связывает полную поверхностную энергию с энергией Гиббса (поверхностное натяжение).
Для гетерогенной системы изменение внутренней энергии, исходя из I и II начал термодинамики:
dU =TdS – pdV + 

гдеdU – изменение внутренней энергии;
dS – изменение энтропии;
dV – изменение объема;

n – число молей компонента;
dq – изменение электрического заряда;


S – межфазная поверхность.
При S , V , n , q =const уравнение примет вид: dU = 


т.е. 
Из уравнений видно 



В случае твердых фаз процесс образования новой поверхности носит необратимый характер и 
Возможны два варианта:
1. 
Отсюда следует, что в дисперсных системах в самопроизвольных процессах поверхность (а, следовательно, и поверхностное натяжение) уменьшается.
[spoiler title=”источники:”]
http://www.zinref.ru/000_uchebniki/02800_logika/011_lekcii_raznie_31/411.htm
[/spoiler]
Полная поверхностная энергия
Cтраница 1
Полная поверхностная энергия Es обычно больше поверхностной свободной энергии. Нередко Es более информативна, чем две другие поверхностные величины, или по крайней мере легче связывается с молекулярными моделями.
[1]
Полная поверхностная энергия U, как будет видно ниже, является важной характеристикой жидкостей.
[2]
Полная поверхностная энергия твердого тела, например хлорида натрия, выделяется в виде тепла при его растворении, причем чем меньше величина частиц, тем теплота их растворения больше. Однако эти измерения требуют точного знания площади поверхности частиц и потому связаны с большими ошибками.
[3]
Полная поверхностная энергия адгезива U ( или субстрата [ /) складывается из энергии взаимодействия в объеме фазы Щ ( Щ) и энергии Us, возникающей за счет несимметричности силового поля на поверхности. Первая компонента определяется природой взаимодействующих молекул и измеряется работой, которую следует затратить на разделение таких же молекул, расположенных в объеме фазы. Вторая компонента измеряется работой, которую следовало бы затратить, чтобы разделить эти молекулы, если их взаимодействие обусловлено только несимметричностью силового поля. Полная энергия взаимодействия твердой и жидкой фаз при их молекулярном контакте C / s / складывается из энергии взаимодействия в объеме их раствора ( расплава) и энергии взаимодействия, обусловленной ростом симметричности силового поля в межфазной зоне. Вторая компонента измеряется работой, которую следовало бы затратить, чтобы разделить молекулы обеих фаз при условии, что их взаимодействие обусловлено только несимметричностью силового поля на поверхности.
[4]
Полная поверхностная энергия диспергированного материала зависит не только от удельной поверхностной энергии, но и от величины образовавшейся поверхности, которая в свою очередь зависит от поверхности отдельных частиц.
[6]
Полную поверхностную энергию образования единицы поверхности можно рассчитать по уравнению ( 1), если известны температурный коэффициент да / дТ и поверхностное натяжение о. Как уже было показано, температурный коэффициент в уравнении имеет отрицательное значение.
[7]
Полную поверхностную энергию образования единицы поверхности можно рассчитать по уравнению ( 1), если известны температурный коэффициент да / дТ и поверхностное натяжение а. Как уже было показано, температурный коэффициент в уравнения имеет отрицательное значение. Поэтому всегда Ua, причем с изменением температуры U не должно изменяться.
[8]
Величина полной поверхностной энергии ( 73) от температуры не зависит в тех температурных интервалах, для которых имеет место фор.
[9]
Итак, полная поверхностная энергия твердого тела зависит от его дисперсности. Средняя удельная поверхностная энергия данного вещества также может быть переменной величиной и может отличаться от своего идеального значения. Остается только подчеркнуть, что и среднее значение Es описывает реальную поверхность неадекватно.
[10]
Для определения полной поверхностной энергии необходимо знать поверхностное натяжение и его температурный коэффициент.
[11]
Известно, что полная поверхностная энергия твердого тела зависит от его дисперсности. Средняя удельная поверхностная энергия вещества также является переменной величиной, отличающейся от своего идеального значения. Значение Es также описывает реальную поверхность неадекватно.
[12]
Величины 82 – полной поверхностной энергии жид-кости, хорошо известны.
[13]
При длительных высокотемпературных отжигах полная поверхностная энергия системы снижается в результате уменьшения площади границ раздела. Этот фактор стремится стабилизировать поверхность раздела.
[15]
Страницы:
1
2
3
4
Для описания термодинамики поверхностных явлений приме няют два метода: метод избыточных величин Гиббса и метод «слоя конечной толщины». За толщину поверхностного слоя принимают расстояние по обе стороны от границы раздела фаз, за пределами которого свойства слоя перестают отличаться or свойств объемных фаз. Практически вся поверхностная энергия сосредоточена в поверхностном слое толщиной в несколько молекул, поэтому все связанные с нею соотношения можно относить только к поверхностному слою. Как следует из определения толщины поверхностного слоя, установление его границ со стороны объемных фаз представляет довольно трудную задачу. Более того, из-за чрезвычайно малой толщины поверхностных слоев погрешности при ее экспериментальном измерении могут
Рис. 11.3. Схема, иллюстрирующая принцип термодинамических методов избыточных величин Гиббса (I) и слоя конечной толщины (//)
Быть значительными, что, в свою очередь, приводит к неточным определениям и термодинамиче — Q-.s_ ских параметров слоев.
Чтобы не определять границы поверхностного слоя (поверхности разрыва по Гиббсу), Гиббс предложил относить все изменения термодинамических параметров в слое в сравнении с параметрами объемной фазы к разделяющей поверхности, не имеющей объема или толщины (метод избыточных величин Гиббса). При таком рассмотрении поверхность характеризуется избыточными термодинамическими параметрами, непосредственно отражающими проявление поверхностной энергии. Объемные фазы считаются однородными вплоть до разделяющей поверхности. В соответствии с методом избыточных величин (рис. II.3, /) энергия Гиббса системы равна сумме энергий Гиббса Gi и G2 объемных фаз 1,2 и поверхностной энергии Гиббса os, которая является избыточной:
G = G, + G2+Oa— (11.22)
В методе «слоя конечной толщины» рассматривается поверхностный слой, имеющий определенные размеры (рис. II.3, 11). Его термодинамические параметры включают как поверхностную энергию os, так и энергию объема слоя Gvc.Имеющего те же свойства, что и объемные фазы (Осл = os+ Gvcn). Границы объемных фаз совпадают с границами поверхностного слоя, что отвечает фактическому началу появления неоднородности. Энергия Гиббса той же системы в методе «слой конечной толщины» выразится соотношением
G=G1’+G2′ + GCil = Gl’+ G2′ + G°Ca+os (11.231
Где Gи G2′ — энергия Гиббса соответственно фазы / и фазы 2 до границы поверхностного слоя (поверхности разрыва).
В уравнении (11.23) все параметры отвечают реальному строению системы и имеют определенный физический смысл. Однако этот метод требует знания толщины поверхностного слоя и использует довольно сложные уравнения, так как термодинамические параметры изменяются нелинейно по толщине слоя. В то же время он дает возможность определить этот °чень важный параметр поверхностного слоя. При использовании же метода избыточных величин нет необходимости опреде-
.
лять границы поверхностного слоя. Кроме того, этот метод оперирует поверхностными избытками, что упрощает математические выражения, хотя избыточные параметры зависят от положения разделяющей поверхности, которым надо задаваться. Далее используется в основном более простой и распространенный метод избыточных величин Гиббса.
В соответствии с известным термодинамическим соотношением энтальпия поверхности (ее избыток) выражается уравнением
H=G + TS (11.24)
Аналогичным выражением характеризуется избыток внутренней энергии поверхности конденсированных систем:
Us = Gs + TSs (11.25)
Где индекс s означает отнесение потенциалов к единице поверхности.
В соответствии со вторым началом термодинамики избыточная энтропия равна
Ss = Qs/T (11.26)
Где qa— теплота образования единицы поверхности (в обратимом процессе). Иногдз q„ называют скрытой теплотой образования поверхности. Она равна количеству теплоты, которое необходимо сообщить телу, чтобы при постоянной температуре увеличить его поверхность на единицу площади.
Учитывая, что Gs = c, из уравнений (11.25) и (11.26) получим следующее выражение:
Us = o + qs (II.27)
Из уравнения (11.27) следует, что внутренняя энергия поверхности складывается из энергии Гиббса и теплоты образования поверхности. Для индивидуальных веществ теплота qs всегда положительна, так как при образовании поверхности теплота поглощается. В результате внутренняя удельная поверхностная энергия (единицы поверхности) больше поверхностной энергии Гиббса на теплоту образования единицы поверхности. Поэтому ее обычно называют полной поверхностной энергией.
Из уравнения (1.2) при постоянстве всех параметров, кроме температуры Г, имеем:
RfGs=— SsdT или (dGs/dT)p=— S„=— qs/T (11.28)
Подставляя это выражение в уравнения (11.25) или (11.27), получим:
Us = a — Tida/dT)p (11.29)
Уравнение (11.29) называется уравнением Гиббса — Гельмгольца. Оно связывает полную поверхностную энергию с энергией Гиббса (поверхностным натяжением). Из этого уравнения
Таблица 11.3. Температурные коэффициенты поверхностного натяжения некоторых жидкостей
|
Жидкость |
—да/дТ. МДж/(м?-К) |
Жидкость |
-до/дТ. МДж/{м—К) |
|
Вода |
0.1541 |
Бутанол |
0.0822 |
|
Ртуть |
0,2330 |
Уксусная кислота |
0.0850 |
|
Бензол |
0,1183 |
Глицерин |
0,1282 |
|
Тетрахлорид углерода |
0,1028 |
Анилин |
0,1144 |
Следует, что для определения полной поверхностной энергии необходимо знать зависимость поверхностного натяжения or температуры. Конкретную зависимость можно получить только экспериментально, однако качественные выводы можно сделать из уравнения (11.28). Как было уже указано, для индивидуальных веществ теплота Qs всегда положительна, а это значит, что температурный коэффициент поверхностного натяжения [см. уравнение (11.28)] отрицателен (табл. II.3):
T,dGs/dT)p = (do/dT)p < 0 (11.30»
Таким образом, поверхностное натяжение индивидуальных веществ на границе с газом (воздухом) снижается с повышением температуры. Для большинства неполярных жидкостей эта зависимость линейная и в первом приближении может быть аппроксимирована простым соотношением
Ог=Оо-—”АГ, откуда а = —да/дТ (11.31 >
Где пт и Со — поверхностное натяжение соответственно при температуре Т и при стандартной температуре; ДГ — разность между данной и стандартной температурами; а — постоянная, равная температурному коэффициенту поверхностного натяжения с обратным знаком.
Другие вещества менее строго следуют такой зависимости, но часто отклонениями можно пренебречь, так как температурные коэффициенты дв/дТ слабо зависят от температуры.
Зная температурный коэффициент поверхностного натяжения, по уравнению (11.29) можно рассчитать внутреннюю энергию той или иной межфазной поверхности. Например, на границе с воздухом для воды при 298 К: Us = 72—298(—0,154) « «118 мДж/м2; для ртути при 298 К: £/* = 473,5—298(—0,23) « «542 мДж/м2.
В табл. II.4 приведены значения внутренней поверхностной энергии некоторых веществ, а также теплоты образования поверхности и поверхностные натяжения. При сравнении значений величин, представленных в таблице, видно, что значительный вклад в полную поверхностную энергию вносит энтропийная составляющая— теплота образования поверхности. Для многих органических веществ она составляет около половины полной
|
Гексан |
49,5 |
18,41 |
• 31,09 |
|
Октан |
48,4 |
21.78 |
26.62 |
|
Этанол |
46,4 |
22.03 |
24,37 |
|
Октанол |
50,8 |
27,53 |
23,27 |
|
Уксусная кислота |
55,9 |
27,79 |
28,11 |
|
Масляная кислота |
54,5 |
26,74 |
27.74 |
|
Этиламин |
48.1 |
20,4 |
27,7 |
|
Пропиламии |
50.4 |
22,4 |
28,0 |
|
Вода |
118,1 |
71,95 |
46,15 |
|
Ртуть |
542,0 |
473,5 |
68,5 |
Таблица 11.4. Энергетические параметры поверхностей некоторых жидкостей при 298 К
Поверхности энергии. Это объясняется тем, что при переходе молекул и атомов из объема тела на поверхность связи разрываются и на поверхности вещество оказывается в состоянии более близком к паровой фазе с большей энтропией, чем для вещества в других агрегатных состояниях.
Предложены нолуэмпирические соотношения более точно описывающие температурную зависимость поверхностного натяжения, чем соотношение (11.31). Так как при критической температуре о = 0 (это было показано Д. И. Менделеевым) и, как установил венгерский ученый Л. Этвеш, линейной зависимости от температуры более точно следует параметр иК.2’3 (иногда называемый мольной поверхностной энергией), то можно записать:
О У.» 2/18 = К1.Ткр — Г) (Н.32)
Где К — коэффициент пропорциональности.
Более точные наблюдения показали, что поверхностное натяжение имеет нсчезающе малые значения уже при температурах, равных Гкр — 6, поэтому уравнение (11.32) можно записать в следующей форме:
AVx-l3 = K(TKp~6 — T) (11.33)
Соотношения (11.32) и (11.33) называют законом Этвеша. Для неполярных жидкостей в СИ К = 2,1-Ю”7, для полярных жидкостей К<2,1-10-7, а для жидкостей с большой молекулярной массой К>2,1-10-7.
Очень важным является полуэмпирическое соотношение, предложенное Сагденом:
Р^Мо^/ІАр) или о= (РДр/М)й (11.34)
Где Р—величина, названная автором парахором; М — молекулярная масса жидкости; Др — разность между плотностями жидкости и пара; k—-показатель степени; в зависимости от природы жидкости может принимать значения от 3,5 до 4,5.
Из соотношения (11.34) следует: daldT~pk~’dpldT, т. е. температурный коэффициент поверхностного натяжения определяется главным образом плотностью и ее температурным коэффициентом, что можно объяснить подобием зависимостей поверхностного натяжения н плотности жидкости от межмолекуляриого взаимодействия.
Парахор Р практически не зависит от температуры. Зависимость поверхностного натяжения от температуры компенсируется изменением плотности вещества. Отсюда следует, что парахор можно рассматривать как мольный объем с поправкой на эффект сжатия, обусловленный межмолекулярнымн силами.
Для большинства жидкостей, особенно неполярных, полная поверхностная энергия также почти не зависит от температуры. Чтобы в этом убедиться, продифференцируем по температуре уравнение Гиббса — Гельмгольца (11.29):
DUs/dT = do/dT — да/дТ — Тд2о/дГ Или ди./дТ^—Тд^о/дП (11.35)
Так как для неполярных жидкостей поверхностное натяжение линейно снижается с повышением температуры, то [см. уравнение (11.31)]:
Д2<з/дТ2 = 0
Отсюда следует, что и производная полной поверхностной энергии по температуре тоже должна быть равна нулю [см. уравнение (11.35)], т. е. dUs/dT = 0, а это означает независимость полной поверхностной энергии от температуры. Для примера укажем, что вторые производные поверхностного натяжения по температуре для воды и бензола равны соответственно —0,00048 и +0,00012. Так как поверхностное натяжение снижается с повышением температуры, а полная энергия от нее не зависит, то в соответствии с уравнением (11.27) теплота образования единицы поверхности увеличивается в этом же направлении. Энтропию, как производную поверхностного натяжения по температуре со знаком минус, в таких случаях можно приравнять к постоянной а [уравнение (11.31)], которая не зависит от температуры. Температурные зависимости основных термодинамических параметров показаны на рис. 11.4. При критической температуре исчезает межфазная поверхность и соответственно снижаются до нуля ее энергетические характеристики.
От рассмотренных систем жидкость — газ существенно отличаются температурные зависимости энергетических параметров поверхностей между конденсированными фазами. Они будут рассмотрены в разделе, посвященном адгезии.
Комментирование и размещение ссылок запрещено.
Лекция 6. Поверхностная энергия и поверхностное натяжение.
Основные определения.
Оценка поверхностного натяжения жидкостей. Методы.
Межфазное натяжение.
Смачивание.
Уравнение Юнга-Дюпре.
Определение поверхностного натяжения твердых тел.
Адсорбция на границе жидкость-газ.
Уравнение Гиббса.
Рекомендуемые материалы
Изотерма адсорбции. Построение.
Поверхностный слой жидкости, соприкасающийся с другой средой, находится в особых условиях по сравнению с остальной массой жидкости.
Эти особые условия возникают потому, что молекулы поверхностного слоя, в отличии от молекул внутренних слоев, подвергаются неодинаковому притяжению молекулами жидкости и газа.
Каждая молекула внутри жидкости со всех сторон притягивается с одинаковыми силами соседними молекулами, расположенными на расстоянии радиуса сферы действия межмолекулярных сил, как показано на рис. 6.1.
Рис. 6.1. Схема действия межмолекулярных сил внутри жидкости и на ее поверхности.
В результате, силы притяжения компенсируются и равнодействующая сил для молекулы 1 равна 0.
У молекул поверхностного слоя (молекула 2) одна часть сферы действия межмолекулярных сил находится в жидкости, другая – в газовой фазе. Так как плотность газа меньше плотности жидкости, то силы притяжения молекул газа очень малы и равнодействующая всех сил притяжения будет направлена внутрь жидкости перпендикулярно ее поверхности.
Таким образом, поверхностные молекулы жидкости всегда находятся под действием силы, стремящейся втянуть их внутрь и, тем самым, сократить поверхность жидкости.
Этим объясняется шарообразная форма капли жидкости (шар имеет минимальную поверхность).
При увеличении поверхности, например, при растяжении жидкой пленки, некоторое число молекул из внутренних областей жидкости переходит на поверхность. Этот переход молекул из равновесного состояния в особое состояние молекул поверхностного слоя требует затраты внешней работы.
Работа, затрачиваемая на увеличение площади поверхности жидкости, переходит в потенциальную энергию молекул поверхностного слоя – поверхностную энергию.
Поверхностная энергия, отнесенная к единице поверхности, называется поверхностным натяжением (ПН):
где 


В единицах СИ поверхностное натяжение измеряется в Дж/м2 или Н/м, так как Дж=Н.м.
Единица измерения ПН [Н/м] соответствует представлению о ПН как о силе, отнесенной к единице длины контура поверхности, направленной вдоль поверхности и стремящейся ее уменьшить.
Так как ПН определяется работой создания единицы площади поверхности, расходуемой на разрыв межмолекулярных связей, то чем прочнее межмолекулярные связи, тем больше ПН жидкости (например, вода ПНводы=71,95 мН/м, бензол ПНбензола=28,2 мН/м при 25 0С).
С повышением температуры ПН снижается, т.к. ослабляются межмолекулярные связи.
Таким образом, поверхностная энергия – это прямое проявление межмолекулярных взаимодействий.
Молекулы, находящиеся на поверхности жидкости или твердого тела испытывают воздействие неуравновешенных молекулярных сил, вследствие чего получают дополнительную энергию по сравнению с молекулами, которые находятся внутри жидкости или твердого тела.
Проявляет себя поверхностная энергия как сила, которая стремится уменьшить площадь поверхности до минимально возможной величины.
В твердых телах подвижность молекул на поверхности отсутствует, поэтому поверхностная энергия здесь не может наблюдаться в виде поверхностного натяжения. Измерять поверхностную энергию можно лишь косвенными методами.
Дополнительная свободная энергия на поверхности раздела двух конденсированных фаз называется межфазным натяжением.
ПН и межфазное натяжение являются важными характеристиками, потому что они определяют ход важных технологических процессов.
Эти показатели важны для устойчивости дисперсий, суспензий, эмульсий и других дисперсных систем.
Существует ряд независимых методов оценки ПН, среди которых различают статистические и динамические, косвенные и непосредственные.
Оценка ПН жидкостей из родственных
характеристик
Поскольку ПН есть проявление действия межмолекулярных сил, эта характеристика связана с другими свойствами, в основе которых лежит действие межмолекулярных сил, например, с энергией когезии.
Известно эмпирическое сооотношение между ПН и плотностью энергии когезии (
где 
Связь между ПН, энергией когезии и мольным объемом для низкомолекулярных соединений устанавливает соотношение:
где 


Расчет ПН из аддитивной функции через парахор:


Парахор – аддитивная величина. Понятие парахора ввел Сагден.
Парахор равен:
Межфазное натяжение на поверхности раздела
твердое тело-жидкость. Смачивание.
Капля жидкости на поверхности твердого тела может вести себя различно (рис. 6.2):
Рис. 6.2. Контактные углы, образованные жидкостями на поверхности твердого тела:
S – твердое тело;
L – капля жидкости;

Если жидкость смачивает твердое тело, то она стремится растечься по поверхности.
Контактный угол при этом равен 0 (рис. 6.2а), т.е. при полном смачивании q=0, а cos q=1.
Краевой угол q является мерой смачивания. Он определяется как угол между твердой поверхностью и касательной в точке соприкосновения трех фаз. Угол q отсчитывается в сторону жидкой фазы.
В случае жидкости L2 (рис. 6.2б) тенденция к растеканию по поверхности менее выражена и угол 0<q<900.
В третьем примере жидкость не смачивает поверхность (рис. 6.2в) и контактный угол превышает 900. Жидкость стремится уменьшить площадь контакта с твердым телом.
В состоянии равновесия:
Величина 
Уравнение известно как соотношение Юнга-Дюпре, которое устанавливает условие равновесия сил, из которого можно определить ПН твердого тела или межфазное натяжение:
Поверхностные натяжения рассмотрены как силы, приложенные перпендикулярно к единице длины периметра смачивания и действующие по касательной к соответствующим поверхностям (рис. 6.3).
Рис. 6.3. Действие трех сил (пограничных) поверхностного натяжения.
Смачиванию благоприятствует низкая свободная энергия поверхности раздела, высокая поверхностная энергия твердого тела и низкая свободная энергия поверхности жидкости.




Величины 



При этом различают силы когезии (слипания) и адгезии (прилипания).
Первые действуют между молекулами внутри фазы, вторые – в разных фазах.
Работа когезии 
Поскольку при этом образуется две новых поверхности жидкости, то:
Работа адгезии 
(Свободная энергия уменьшается за счет работы сил взаимодействия).
Из этих двух уравнений следует уравнение, известное как уравнение Дюпре:
По этому уравнению вычисляют 



Таким образом силы межфазного взаимодействия (адгезионные силы) стремятся растянуть каплю, а силы когезии стягивают каплю, препятствуя растеканию.
Определение 

Эта величина определяется как значение 



Жидкость с 

Численно 

Рис. 6.4. Определение 
Известно эмпирическое соотношение, которое соблюдается для многих систем – это правило Антонова:
Связь между величинами 
где Ф – эмпирический параметр, который можно рассчитать теоретически из молекулярных свойств через константы Гамахера и потенциал Леннарда-Джонса.
Адсорбция. Изотерма адсорбции. Уравнение Гиббса.
ПН растворов обычно отличается от ПН растворителя.
Растворенное вещество может не изменять 
Поверхностная свободная энергия стремится к минимуму, поэтому при повышении 
Под влиянием этих двух факторов устанавливается равновесие, в результате которого концентрация вещества в поверхностном слое уменьшается по сравнению с концентрацией в объеме.
Если растворенное вещество снижает 
Самопроизвольное изменение концентрации вещества в поверхностном слое, отнесенное к единице поверхности, называется адсорбцией, обозначается через Г и выражается в кмоль/м2, или моль/см2.
Если Г>0 адсорбцию называют положительной, если Г<0 – отрицательной.
Если растворенное вещество не изменяет 
Простое термодинамическое соотношение между поверхностной концентрацией Г и изменением ПН с активной концентрацией растворяемого вещества 
где 


Для разбавленных растворов активность заменяют концентрацией С:
Из уравнения следует, что только те вещества показывают положительную адсорбцию, с повышением концентрации которых ПН понижается, 
Если 
Вещества, повышающие ПН, называются отрицательно поверхностно-активными веществами (инактивными, ими являются неорганические соли).
Вещества, понижающие ПН называют поверхностно-активными (ПАВ) (см. стр. 98-102).
К ПАВ относятся органические вещества, молекулы которых построены из участков с резко различающимися свойствами. Одна часть молекулы полярная, другая – неполярная (углеводородный радикал).
Полярная: -OH, -COOH, -SO3Na, -SO3H, -NH2, -SO2H.
Полярная часть гидрофильна, неполярная – гидрофобна.
ПАВ характеризуются величиной ГЛБ (гидрофильно-липофильного баланса).
Величина 

В гомологическом ряду жирных кислот, спиртов и аминов понижение 
Согласно правилу Дюкло-Траубе, при удлинении цепи на группу СН2 поверхностная активность 
Для определения этой характеристики строят зависимость 

Построение изотермы адсорбции и нахождение величин 
Изотерма адсорбции описывается уравнением Ленгмюра:
где 
ванного на 1 м2 поверхности, кмоль/м2;

Зная Г можно рассчитать площадь S, приходящуюся на 1 молекулу.
Число адсорбированных молекул на 1 м2 составляет:
Отсюда:
С увеличением Г величина S уменьшается и при 

Пользуясь 



Строят изотерму ПН (зависимость 
По изотерме ПН рассчитывают Г по уравнению Гиббса.
Для этого к кривой 




Рис. 6.5. Построение изотермы адсорбции по изотерме
поверхностного натяжения.
Каждой концентрации С соответствует отрезок Z на оси ординат.
Длина отрезка, выраженная в единицах ПН равна: 

Подставив полученные значения Z в уравнение:
получим:
Используя Z для ряда концентраций, рассчитывают адсорбцию Г.
Строят изотерму адсорбции, откладывая по оси абсцисс С, а по оси ординат Г.
Где сложно провести касательную (в интервале концентраций 0,2-0,15 моль/л) рассчитывают изменение: 


Данные заносят в таблицу:
Значение 
Рекомендуем посмотреть лекцию “Формирование территориальных структур в дореволюционной России”.
Рис. 6.6. График уравнения Ленгмюра в прямолинейных координатах.
Угол 


Отрезок 
Из этого уравнения определяем 
Из уравнения