Как определить полярность молекул
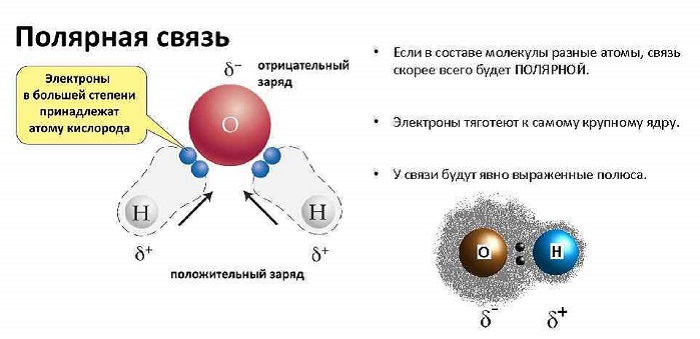
Полярность молекул – это несимметричное распределение электронной плотности, возникающее из-за различной электроотрицательности элементов, входящих в состав молекулы. Иными словами, когда один элемент как бы притягивает к себе электрон другого, вдоль невидимой оси, соединяющей центры их атомов. Как можно определить, является ли та или иная молекула полярной?

Инструкция
Прежде всего посмотрите на формулу молекулы. Легко можно понять, что если она образована атомами одного и того же элемента (например, N2, O2, Cl2 и т.п.), то она неполярна, поскольку электроотрицательность одинаковых атомов также одинакова. Поэтому смещения электронной плотности к одному из них в данном случае быть не может.
Если же молекулы состоят из разных атомов, то тут необходимо представить ее структурную форму. Она может быть как симметричной, так и несимметричной.
В том случае, если молекула симметрична (например, СО2, СН4, BF3 и т.п.), молекула является неполярной; если же она несимметрична (из-за наличия неспаренных электронов или неподеленных пар электронов), то такая молекула полярная. Характерные примеры – H2O, NH3, SO2.
А как быть в тех случаях, когда в симметричной неполярной молекуле один из боковых атомов заменяется каким-либо другим атомом? Возьмите, к примеру, молекулу метана, в структурном виде представляющую собой тетраэдр. Это симметричная фигура и, казалось бы, ее неполярность не должна измениться, ведь плоскость симметрии по-прежнему проходит через центральный атом углерода и тот атом, который заменил водород.
Поскольку электроотрицательность элемента-«заменителя» отличается от электроотрицательности водорода, в молекуле произойдет перераспределение электронной плотности и, соответственно, изменится ее геометрическая форма. Поэтому такая молекула станет полярной. Характерные примеры: СН3Cl (хлорметан), CH2Cl2 (дихлорметан), CHCl3 (трихлорметан, хлороформ).
Ну а если последний атом водорода также будет заменен хлором, то образовавшийся тетрахлорметан (четыреххлористый углерод) снова станет симметричной неполярной молекулой! Чем больше разница в электроотрицательности элементов, составляющих несимметричную молекулу, тем более полярной будет связь между этими элементами (и, соответственно, сама молекула).
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Download Article
Download Article
Molecules are groups of atoms bonded together. Sometimes, molecules are bonded in a way that unevenly distributes charge and creates 2 poles (1 positive and 1 negative). When this happens, the molecule is considered polar. You can determine the polarity of a molecule by analyzing its bonds, testing how it interacts with other polar substances, or observing its reaction to an electromagnetic field.
-
1
Write the symbols for all atoms in the molecule. Atomic symbols for atoms can be found on the periodic table. These symbols are used to represent each atom in a Lewis dot structure. Be sure not to mix up the symbols, as this would cause confusion.[1]
- For example, if you are looking at a water molecule, you would write out O, H, and H.
-
2
Find the central atom. The central atom is the atom that all (or at least most) of the other atoms are bonded to. Those atoms may or may not be bonded to each other as well. As a rule of thumb, central atoms are usually atoms with low electronegativity.[2]
- The water molecule breaks this general trend since the oxygen atom (the most electronegative atom in the molecule) is the center atom.
- Carbon dioxide is an example of a molecule that follows the trend of center atoms being less electronegative. In this case, carbon is the center atom.
Advertisement
-
3
Add all of the bonds. Use the octet rule to determine the number and type of bonds present. Each atom’svalence shell should contain 8 electrons for the molecule to be stable. Some atoms may be double or triple bonded to achieve this.[3]
- In a water molecule, add a single bond from the oxygen to both hydrogens. The hydrogens are not bonded to each other.
-
4
Include unbound electrons. While most electrons are used in bonding, some atoms have a set of non-bonding electrons. These electrons should also be included in the Lewis structure, as they are very important when determining polarity. Represent all electrons (bonded and unbonded) with dots around their respective atoms.[4]
- Oxygen has 2 lone pair electrons. This means they are not used for bonding, but stay attached to the oxygen.
-
5
Look for dipoles. A dipole exists when electrons are unevenly distributed from one side of the molecule to the other. If this is present, then the molecule is polar. If the distribution looks even, the molecule is nonpolar.[5]
- Since electrons are more attracted to oxygen than hydrogen, they tend to congregate on that end of the molecule. That gives the oxygen a negative charge and the hydrogens a positive charge, creating a dipole. Thus, water is polar.
Advertisement
-
1
Fill a beaker with water. Water is a polar solvent. Put 100 mL of water into a clean beaker. Set the beaker aside to come back to later.[6]
-
2
Add a nonpolar solvent to a new beaker. Nonpolar solvents include things like toluene, gasoline, and oils. Add 100 mL of a chosen nonpolar solvent to another beaker. Let this beaker sit beside the water beaker.[7]
- Many nonpolar solvents fall into the category of volatile organic compounds (VOCs) and are quite dangerous. Be careful when heating them, and always wear a mask and gloves.
- For example, you could put vegetable oil into the second container. It is not volatile, but still acts as a nonpolar solvent.
- Acetone is also relatively safe organic solvent, but you should still keep it away from fire and wear your mask and gloves. Acetone is a volatile compound.
-
3
Place equal amounts of the substance into each beaker. Put the substance in question into the beaker filled with water and the beaker filled with the nonpolar solvent. Be sure to use the same amount in each beaker for consistency. You can start by adding 10-20 mL into each new beaker.[8]
- For example, you could put 20 mL of isopropyl alcohol into each beaker.
-
4
Stir and/or heat the mixtures. The solvents may need to be heated or stirred to spur interaction. If this is the case, be sure that you stir and heat the solvents to the same degree. That said, heating organic solvents, such as toluene, is very dangerous and you should exercise caution.[9]
- There is no need to heat when testing isopropyl alcohol. Stirring is sufficient.
- If heating, use a hot plate and heat slowly. Do not heat organic solvents with a flame.
-
5
Allow both beakers to cool. Once the substance seems to have interacted with one or both of the solvents, let them each cool. This will give the substance a chance to separate from the solvent if it is not compatible. It also makes the samples easier for you to handle.[10]
-
6
Observe the outcomes. Look for any solids or liquids separating from the solvent. This indicates that the substance is not compatible with that solvent. Since polar molecules are compatible with polar solvents and nonpolar molecules are compatible with nonpolar solvents, you can deduce that any substance that dissolves in water is polar. Any substance that does not dissolve in water, but dissolves in gasoline, toluene, acetone, or another nonpolar solvent is nonpolar.[11]
- Once both beakers settle, you will notice that the isopropyl alcohol dissolved completely in the water. However, there will be 2 distinct layers where the alcohol separated from the vegetable oil in the second beaker. This shows that isopropyl alcohol is polar.
Advertisement
-
1
Bring the substance close to a magnet. If you bring a substance close to a magnet or magnetically charged object, you may be able to tell if it is polar or nonpolar. Place the substance on a bench and bring the magnet close. Avoid touching the substance with the magnet.
-
2
Look for any interaction. If there is any attraction or repulsion from the magnet, your substance is polar. However, that does not mean that the substance is nonpolar if the magnet does not interact. Some polar molecules are not polarized enough to interact with a weak magnet.
- For example, if you have a running stream of water, a magnet will cause the stream to bend away from the magnet. This shows a clear interaction.
-
3
Heat the substance in question in a microwave. Microwaves work by using high-frequency electromagnetic radiation to cause polar molecules to spin. The spinning creates friction, which creates heat. To test the polarity of your substance, place it in the microwave.[12]
- Never put metals, flammables, or explosives into a microwave.
- If you put water in the microwave, you will notice that it gets hot. It is polar.
- If you try putting baby oil in the microwave, you will notice that the microwave doesn’t seem to heat it very well. It is nonpolar.
-
4
Observe the substance. Look for signs of deformation or melting. Check to see whether the substance is hot. If the microwave affected the substance, it is polar.[13]
- When the microwave comes on, the substance will be subjected to radiation. If it is a polar substance, the radiation will make the molecules spin (though this will not be visible). If the substance is nonpolar, the microwaves will have little effect.
Advertisement
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
About This Article
Thanks to all authors for creating a page that has been read 49,451 times.
Did this article help you?
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июля 2020 года; проверки требуют 2 правки.
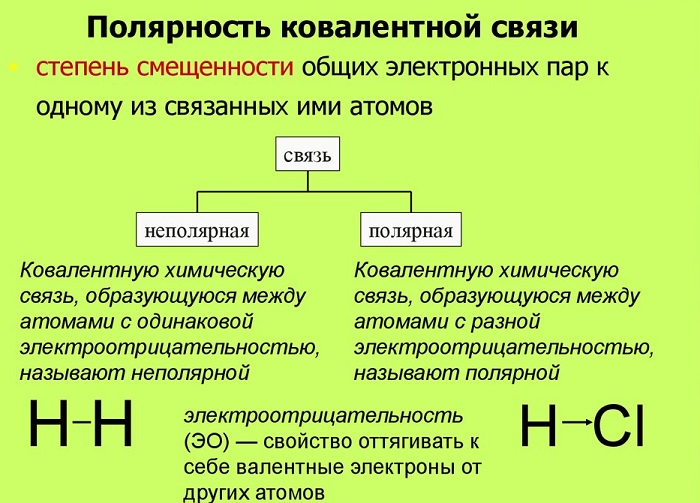
Полярность химических связей — характеристика химической связи (как правило, ковалентной), показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах.
Можно количественно оценить полярность связи в молекуле. Трудность точной количественной оценки состоит в том, что полярность связи зависит от нескольких факторов: от размеров атомов и ионов соединяющихся молекул; от числа и характера связи уже имевшихся у соединяющихся атомов до их данного взаимодействия; от типа структуры и даже особенностей дефектов их кристаллических решёток. Такого рода расчёты производятся различными методами, которые в общем-то дают примерно одинаковые результаты (величины). Например, для HCl установлено, что на каждом из атомов в этой молекуле имеется заряд, равный 0,17 заряда целого электрона. На водородном атоме +0,17, а на атоме хлора −0,17.
В качестве количественной меры полярности связи чаще всего используются так называемые эффективные заряды на атомах.
Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный [относительный] смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи.
Наличие эффективного заряда может быть указано символами зарядов у атомов (например, Нδ+ — Clδ−, где δ — некоторая доля элементарного заряда) 
Практически все химические связи, за исключением связей в двухатомных гомоядерных молекулах — в той или иной степени полярны. Ковалентные связи обычно слабо полярны.
Ионные связи — сильно полярны.
Эффективный заряд[править | править код]
Анализ рентгеновского спектра позволяет определять эффективные заряды атомов, а следовательно, и тип химической связи в соединениях. Для этого сравнивают расположение линий рентгеновского спектра свободных атомов и их соединений. Если атом в соединении имеет соответствующий эффективный заряд δ, то линии спектра оказываются смещенными по сравнению со спектрами свободного атома. По величине смещения спектральных линий соответствующими методами расчёта определяют δ.
Значения δ, определяемые разными методами, существенно различаются. Приводимые здесь значения δ интересуют нас с точки зрения иллюстрации общей тенденции их изменения в ряду однотипных соединений.
| Эффективные заряды O оксидов элементов 2-го, 3-го периода и I-й группы ПСХЭ | |||||
|---|---|---|---|---|---|
| Оксид | Заряд | Оксид | Заряд | Оксид | Заряд |
| Li2O | 0.80− | Na2O | 0.81− | Li2O | 0.80− |
| BeO | 0.35− | MgO | 0.42− | Na2O | 0.81− |
| B2O3 | 0.24− | Al2O3 | 0.31− | K2O | 0.89− |
| CO2 | 0.11− | SiO2 | 0.23− | Rb2O | 0.92− |
| N2O5 | 0.05− | P2O5 | 0.13− | Cs2O | 0.96− |
| OO2 | SO3 | 0.06− | |||
| OF2 | Cl2O7 | 0.02− (0,01−) |
| Эффективные заряды δ атомов некоторых соединений | |||||
|---|---|---|---|---|---|
| Вещество | Атом и его степень окисления | Заряд δ | Химическое соединение | Атом и его степень окисления | δ |
| HF | H (I) | 0.40+ | Cr[(CO)6] | Cr (0) | 0.4+ |
| HCl | H (I) | 0.18+ | CrCl2 | Cr (II) | 1.9+ |
| NaF | Na (I) | 0.98+ | CrCl3 | Cr (III) | 1.2+ |
| NaCl | Na (I) | 0.92+ | [Cr(NH3)6]Cl3 | Cr (III) | 1.2+ |
| NaBr | Na (I) | 0.83+ | K2CrO4 | Cr (VI) | 0.2+ |
| NaI | Na (I) | 0.75+ | K2Cr2O7 | Cr (VI) | 0.1+ |
| MgCl2 | Mg (II) | 1.50+ | KMnO4 | Mn (VII) | 0.3+ |
| MgBr2 | Mg (II) | 1.38+ | CaSO4 | S (VI) | 0.4+ |
| MgO | Mg (II) | 1.01+ | KClO3 | Cl (V) | 0.7+ |
| MgS | Mg (II) | 1.05+ | K3[Fe(CN)6] | Fe (III) | 1.0+ |
| SiO2 | Si (IV) | 1.97+ | OsO2 | Os (IV) | 0.8+ |
| SiS2 | Si (IV) | 1.69+ | K2[OsO4] | Os (VI) | 0.8+ |
| Co(NO3)2 | Co (II) | 1.20+ | K[OsO3N] | Os (VIII) | 1.0+ |
![{stackrel {}{{mbox{K}}}}[{stackrel {+1}{{mbox{I}}}}{stackrel {-1}{{mbox{I}}}}_{{2}}]](https://wikimedia.org/api/rest_v1/media/math/render/svg/855f49c42c2037819cbb0ffc3ea4f36a7b5f520b) |
I (−1), периферийный | 0,5− | B2H6 | B (III) | 0.22+ |
![{stackrel {}{{mbox{K}}}}[{stackrel {+1}{{mbox{I}}}}{stackrel {-1}{{mbox{Cl}}}}_{{2}}]](https://wikimedia.org/api/rest_v1/media/math/render/svg/75378f5d0c6df0930f86fb114c1a491898efce5b) |
Cl (−1) | 0,55− | B2H6 | H (I), мостиковый | 0,22− |
![{stackrel {}{{mbox{K}}}}[{stackrel {+1}{{mbox{I}}}}{stackrel {-1}{{mbox{Cl}}}}_{{2}}]](https://wikimedia.org/api/rest_v1/media/math/render/svg/75378f5d0c6df0930f86fb114c1a491898efce5b) |
I (+1), центральный | 0,11+ | XeF2 | F (I) | 0.5− |
| [•C≡N:]− |  |
[•N≡C:]− /  •[1] •[1] |

|
Как видно из таблицы, степень окисления элемента в соединении по значению не совпадает с результирующим [эффективным] зарядом на атоме. Об этом же говорит исследование энергии связи 1s-электрона азота в зависимости от эффективного заряда на атоме. Так, при степени окисления азота +5 в NaNO3 атом азота имеет эффективный заряд всего 0,4+
(

![({stackrel {}{{mbox{Na}}}}[{stackrel {-3}{{mbox{N}}}}={stackrel {+5}{{mbox{N}}}}={stackrel {-3}{{mbox{N}}}}])](https://wikimedia.org/api/rest_v1/media/math/render/svg/f559747ccdbc53673256b09db368da65553e42d1)

![[{stackrel {-1}{{mbox{N}}}}{stackrel {}{{mbox{H}}}}_{{3}}{stackrel {}{{mbox{O}}}}{stackrel {}{{mbox{H}}}}]{stackrel {}{{mbox{Cl}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2d0b59412ab3aa75365fb45d82a07ee31f78795c)

![[{stackrel {-2}{{mbox{N}}}}_{{2}}{stackrel {}{{mbox{H}}}}_{{6}}]{stackrel {}{{mbox{S}}}}{stackrel {}{{mbox{O}}}}_{{4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/725961c96efe05443b9d5a5c55c4ba8b60c2905d)

((δ) 




при общей тенденции прямо-пропорционального повышения значений энергии связи).
Значения относительных эффективных зарядов, полученные различными методами (оптической спектроскопии, ЯМР, также на основе квантовохимических расчетов), могут расходиться. Однако имеющиеся значения δ свидетельствуют о том, что атомы в соединениях высоких зарядов не имеют [отвечающих абсолютному заряду электрона] и чисто ионных соединений не существует.
- Мгновенные и индуцированные диполи.
Молекула представляет собой динамическую систему, в которой происходит постоянное движение электронов и колебание ядер. Поэтому распределение зарядов в ней не может быть строго постоянным. Например, молекулу Cl2 относят к неполярным: значение её электрического момента диполя равно нулю. Однако в каждый данный момент происходит временное смещение зарядов к одному из атомов хлора: Clδ+ → Clδ− или Clδ− ← Clδ+ с образованием мгновенных микродиполей. Поскольку подобное смещение зарядов к любому из атомов равновероятно, среднее распределение зарядов как раз и соответствует среднему нулевому значения момента диполя.
Для полярных молекул значение момента диполя в каждый данный момент времени несколько больше или несколько меньше его среднего значения. Направление и величина мгновенного диполя подвержены непрерывным колебаниям постоянного момента диполя. Таким образом, любую неполярную и полярную молекулу (и атом в ней) можно рассматривать как совокупность периодических очень быстро меняющихся по величине и направлению мгновенных микродиполей.
Под действием внешнего электрического поля молекула поляризуется, то есть в ней происходит перераспределение зарядов, и молекула приобретает новое значение электрического момента диполя. При этом неполярные молекулы могут превратиться в полярные, а полярные становятся ещё более полярными. Иначе говоря, под действием внешнего эл. поля в молекулах индуцируется диполь, называемый наведённым или индуцированным. В отличие от постоянных и мгновенных наведенные (индуцированные) диполи существуют лишь при действии внешнего электрического поля. После прекращения действия поля наведённые диполи исчезают. Полярностью и поляризуемостью молекул обусловлено межмолекулярное взаимодействие.
Примечания[править | править код]
- ↑ Здесь знаками обозначены формальные заряды, то есть целочисленные значения −1 и +1 (см. Формальный заряд).
См. также[править | править код]
- Электроотрицательность
- Полярные вещества
Источники[править | править код]
- Полярность химических связей — статья из Большой советской энциклопедии.
- Ахметов Н.С. Общая и неорганическая Химия: Учеб. — 2-е изд., перераб. и доп. — М.: Высш. шк., 1988. — стр. 84, 87-89, 141, 237, 240, 273, 293, 300, 387, 419, 426, 475, 524.
Полярные и неполярные молекулы – две группы, на которые подразделяются все диэлектрики.
Полярные по-другому называются дипольными. А неполярные являются нейтральными или бездипольными.
Что такое полярность в химии
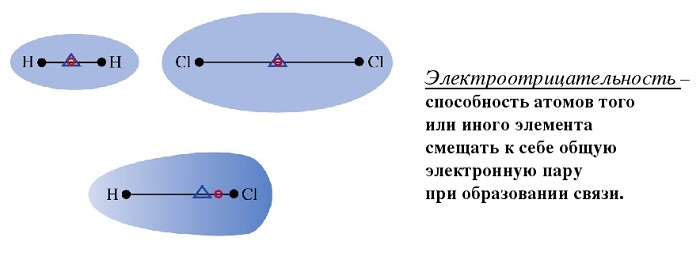
Полярность – свойство, показывающее изменение распределения электронной плотности около ядер, если сравнивать с изначальным ее распределением в образующих данную связь нейтральных частицах.
Поляризуемость — способность поляризоваться под воздействием электрического поля.
Мерой полярности называется электрический момент диполя. В нейтральных соединениях он равен нулю. Его значение зависит от разности электроотрицательностей элементов.
Длина диполя — расстояние между его полюсами. Данная характеристика также влияет на степень полярности.
Любое соединение состоит из ядра (положительные частицы) и электронов (отрицательные частицы). И положительные, и отрицательные частицы имеют свой электрический центр тяжести.
Если центры тяжести частиц совпадают, то соединение считается неполярным. Если же полюса не накладываются друг на друга, то в этом случае речь идет о дипольной связи.
Примеры полярных молекул
Эта связь образуется, если вещество состоит из атомов разных элементов и ассиметрична (имеются неспаренные электроны). Такие соединения имеют угловую, изогнутую геометрическую форму.
Например, это такие газы как NH3, SO2, NO2 и жидкость – вода.
Примеры неполярных молекул
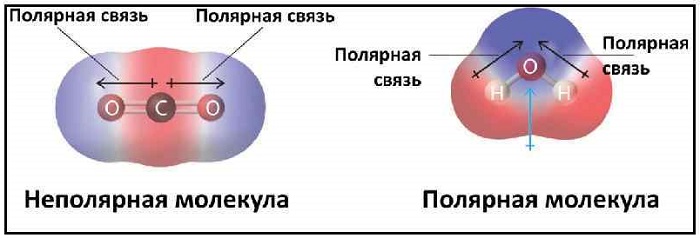
В качестве примера таких связей можно привести молекулы, состоящие из одинаковых атомов: H2, Cl2, O2, N2, F2 и т. д.
Эта связь также может встречаться в соединениях, состоящих из атомов разных элементов и при этом являющихся симметричными (линейные, тетраэдрические и т. д.). Такими веществами являются: BeH2, BF3, CH4, CO2(углекислый газ) и SO3.
При нейтральной связи электронное облако равномерно распределяется между ядрами всех атомов данного вещества. Поэтому ядра действуют на него в равной мере.
Как определить полярность молекулы и от чего она зависит
Чтобы определить, является ковалентная связь дипольной или нет, необходимо посмотреть на химическую формулу вещества.
Если молекула состоит из атомов одного и того же вещества, то она в любом случае нейтральна.
Если же молекулярное строение является сложным, то речь может идти как о полярной, так и неполярной ковалентной связи. Это зависит от геометрической формы.
Узнаем сегодня, как определить полярность связи и зачем это нужно. Раскроем физический смысл рассматриваемой величины.
Химия и физика
Когда-то все дисциплины, посвященные изучению окружающего мира, объединялись одним определением. И астрономы, и алхимики, и биологи были философами. Но сейчас существует строгое распределение по разделам науки, а большие университеты точно знают, что нужно знать математикам, а что – лингвистам. Впрочем, в случае химии и физики четкой границы нет. Часто они взаимно проникают друг в друга, а бывает, что идут параллельными курсами. В частности, спорным объектом является полярность связи. Как определить, относится эта область знания к физике или химии? По формальному признаку – ко второй науке: сейчас школьники изучают это понятие как часть химии, но без знаний по физике им не обойтись.
Строение атома
Для того чтобы понять, как определить полярность связи, сначала надо вспомнить, как устроен атом. В конце девятнадцатого века было известно, что любой атом нейтрален в целом, но содержит в разных обстоятельствах разные заряды. Резерфод установил, что в центре любого атома располагается тяжелое и положительно заряженное ядро. Заряд атомного ядра всегда целочисленный, то есть он составляет +1, +2 и так далее. Вокруг ядра располагается соответствующее количество легких отрицательно заряженных электронов, число которых строго соответствует заряду ядра. То есть если заряд ядра +32, то вокруг него должны располагаться тридцать два электрона. Они занимают определенные позиции вокруг ядра. Каждый электрон как бы «размазан» вокруг ядра на своей орбитали. Ее форма, позиция и расстояние до ядра определяются четырьмя квантовыми числами.
Почему возникает полярность
В нейтральном атоме, расположенном вдалеке от других частиц (например, в глубоком космосе, вне галактики), все орбитали симметричны относительно центра. Несмотря на довольно сложную форму некоторых из них, орбитали любых двух электронов не пересекаются в одном атоме. Но если наш отдельно взятый атом в вакууме встретит на своем пути другой (например, войдет в облако газа), то он захочет взаимодействовать с ним: орбитали валентных внешних электронов вытянутся в сторону соседнего атома, сольются с ним. Возникнет общее электронное облако, новое химическое соединение и, следовательно, полярность связи. Как определить, какой атом возьмет себе большую часть общего электронного облака, расскажем далее.
Какими бывают химические связи
В зависимости от типа взаимодействующих молекул, разности в зарядах их ядер и силы возникающего притяжения, существуют следующие типы химических связей:
- одноэлектронная;
- металлическая;
- ковалентная;
- ионная;
- ван-дер-ваальсова;
- водородная;
- двухэлектронная трёхцентровая.
Для того чтобы задаваться вопросом о том, как определить полярность связи в соединении, она должна быть ковалентной или ионной (как, например, у соли NaCl). В целом эти два типа связи различаются только тем, насколько сильно смещается электронное облако в сторону одного из атомов. Если ковалентная связь не образована двумя одинаковыми атомами (например, О2), то она всегда слегка поляризована. В ионной связи смещение сильнее. Считается, что ионная связь приводит к образованию ионов, так как один из атомов «забирает» электроны другого.
Но на самом деле полностью полярных соединений не существует: просто один ион очень сильно притягивает к себе общее электронное облако. Настолько сильно, что оставшимся кусочком равновесия можно пренебречь. Итак, надеемся, стало понятно, что определить полярность ковалентной связи можно, а полярность ионной связи не имеет смысла определять. Хотя в данном случае различие между этими двумя типами связи – это приближение, модель, а не истинное физическое явление.
Определение полярности связи
Надеемся, читатель уже понял, что полярность химической связи – это отклонение распределения в пространстве общего электронного облака от равновесного. А равновесное распределение существует в изолированном атоме.
Способы измерения полярности
Как определить полярность связи? Вопрос этот далеко не однозначный. Для начала надо сказать, что раз симметрия электронного облака поляризованного атома отличается от аналогичной нейтрального, то и рентгеновский спектр изменится. Таким образом, смещение линий в спектре даст представление о том, какова полярность связи. А если требуется понять, как определить полярность связи в молекуле более точно, то надо знать не только спектр испускания или поглощения. Требуется выяснить:
- размеры участвующих в связи атомов;
- заряды их ядер;
- какие связи были созданы у атома до возникновения этой;
- какова структура всего вещества;
- если структура кристаллическая, какие в ней существуют дефекты и как они влияют на все вещество.
Полярность связи обозначается как верхний знак следующего вида: 0,17+ или 0,3-. Стоит также помнить, что один и тот же вид атомов будет иметь непохожую полярность связи в соединении с различными веществами. Например, в оксиде BeO у кислорода полярность 0,35-, а в MgO – 0,42-.
Полярность атома
Читатель может задать и такой вопрос: “Как определить полярность химической связи, если факторов так много?” Ответ одновременно и прост, и сложен. Количественные меры полярности определяются как эффективные заряды атома. Эта величина является разностью между зарядом находящегося в определенной области электрона и соответствующей области ядра. В целом эта величина достаточно хорошо показывает некую асимметричность электронного облака, которая возникает при образовании химической связи. Сложность состоит в том, что определить, какая именно область нахождения электрона принадлежит именно этой связи (особенно в сложных молекулах) почти что невозможно. Так что, как и в случае разделения химических связей на ионные и ковалентные, ученые прибегают к упрощениям и моделям. При этом отбрасываются те факторы и значения, которые влияют на результат незначительно.
Физический смысл полярности соединения
Каков же физический смысл значения полярности связи? Рассмотрим один пример. Атом водорода H входит как во фтороводородную кислоту (HF), так и в соляную (HCl). Его полярность в HF равна 0,40+, в HCl – 0,18+. Это значит, что общее электронное облако гораздо сильнее отклоняется в сторону фтора, чем в сторону хлора. И значит, что электроотрицательность атома фтора намного сильнее электроотрицательности атома хлора.
Полярность атома в молекуле
Но вдумчивый читатель вспомнит, что, помимо простых соединений, в которых присутствуют два атома, существуют и более сложные. Например, чтобы образовать одну молекулу серной кислоты (H2SO4), требуется два атома водорода, один – серы, и целых четыре кислорода. Тогда возникает другой вопрос: как определить наибольшую полярность связи в молекуле? Для начала надо помнить, что любое соединение имеет некоторую структуру. То есть серная кислота – это не нагромождение всех атомов в одну большую кучу, а некая структура. К центральному атому серы присоединяются четыре атома кислорода, образуя подобие креста. С двух противоположных сторон атомы кислорода присоединяются к сере двойными связями. С двух остальных сторон атомы кислорода присоединяются к сере одинарными связями и «держат» с другой стороны по водороду. Таким образом, в молекуле серной кислоты существуют следующие связи:
- O-H;
- S-O;
- S=O.
Определив по справочнику полярность каждой из этих связей, можно найти наибольшую. Однако стоит помнить, что если в конце длинной цепочки атомов стоит сильно электроотрицательный элемент, то он может «перетягивать» на себя электронные облака соседних связей, повышая их полярность. В более сложной, чем цепочка, структуре вполне возможны иные эффекты.
Чем полярность молекулы отличается от полярности связи?
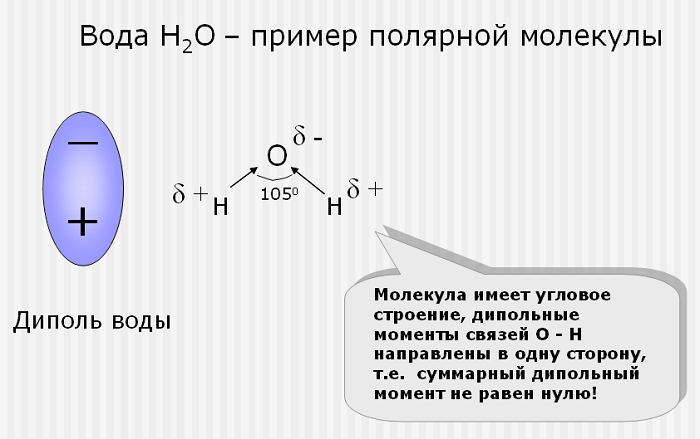
Как определить полярность связи, мы рассказали. В чем состоит физический смысл понятия, мы раскрыли. Но эти слова встречаются и в других словосочетаниях, которые относятся к данному разделу химии. Наверняка читателей интересует, каким образом взаимодействуют химические связи и полярность молекул. Отвечаем: эти понятия взаимно дополняют друг друга и невозможны по отдельности. Это мы продемонстрируем на классическом примере воды.
В молекуле H2O две одинаковые связи H-O. Между ними угол в 104,45 градуса. Так что структура молекулы воды представляет собой нечто вроде двузубой вилки с водородами на концах. Кислород – это более электроотрицательный атом, он оттягивает на себя электронные облака двух водородов. Таким образом, при общей электронейтральности, зубчики вилки получаются немного более положительными, а основание – немного более отрицательным. Упрощение приводит к тому, что молекула воды имеет полюса. Это и называется полярностью молекулы. Поэтому вода – такой хороший растворитель, эта разница в зарядах позволяет молекулам чуть-чуть оттягивать на себя электронные облака других веществ, разъединяя кристаллы на молекулы, а молекулы – на атомы.
Чтобы понять, почему у молекул при отсутствии заряда существует полярность, надо помнить: важна не только химическая формула вещества, но и строение молекулы, виды и типы связей, которые в ней возникают, разница в электроотрицательности входящих в нее атомов.
Наведенная или вынужденная полярность
Помимо собственной полярности, существует еще и наведенная или вызванная факторами извне. Если на молекулу действует внешнее электромагнитное поле, которое значительнее существующих внутри молекулы сил, то оно способно изменить конфигурацию электронных облаков. То есть если молекула кислорода тянет на себя облака водорода в H2O, и внешнее поле сонаправлено с этим действием, то поляризация усиливается. Если поле как бы мешает кислороду, то полярность связи немного уменьшается. Надо отметить, что требуется приложить достаточно большое усилие, чтобы как-то повлиять на полярность молекул, и еще большее – чтобы повлиять на полярность химической связи. Достигается этот эффект только в лабораториях и космических процессах. Обычная микроволновка лишь усиливает амплитуду колебаний атомов воды и жиров. Но это никак не влияет на полярность связи.
В каком случае имеет смысл направление полярности
В связи с термином, который рассматривается нами, нельзя не упомянуть, что такое прямая и обратная полярность. Если речь идет о молекулах, то полярность имеет знак «плюс» или «минус». Это значит, что атом либо отдает свое электронное облако и таким образом становится чуть более положительным, либо, наоборот, тянет облако на себя и приобретает отрицательный заряд. А направление полярности имеет смысл только тогда, когда заряд движется, то есть когда по проводнику идет ток. Как известно, электроны движутся от их источника (отрицательно заряженного) к месту притяжения (положительно заряженного). Стоит напомнить, что существует теория, согласно которой электроны на самом деле движутся в обратную сторону: от положительного источника к отрицательному. Но в целом это не имеет значения, важен лишь факт их движения. Так вот, в некоторых процессах, например при сварке металлических частей, важно, куда именно присоединены какие полюса. Следовательно, важно знать, как подключена полярность: напрямую или в обратную сторону. В некоторых приборах, даже бытовых, это тоже имеет значение.