…
Мы уже знаем, что в атомах электроны находятся на разрешенных энергетических состояниях – атомных орбиталях (АО). Аналогичным образом, электроны в молекулах существуют в разрешенных энергетических состояниях – молекулярных орбиталях (МО).
Молекулярная орбиталь
Молекулярная орбиталь устроена намного сложнее атомной орбитали. Приведем несколько правил, которыми мы будем руководствоваться при построении МО из АО:
- При составлении МО из набора атомных орбиталей, получается такое же число МО, сколько АО в данном наборе.
- Средняя энергия МО, полученных из нескольких АО, примерно равна (но может быть больше или меньшее) средней энергии взятых АО.
- МО подчиняются принципу запрета Паули: на каждой МО не может находиться более двух электронов, которые должны иметь противоположные спины.
- АО, которые обладают сопоставимой энергией, комбинируются наиболее эффективно.
- Эффективность, с которой комбинируют две атомные орбитали, пропорциональна их перекрыванию друг с другом.
- При образовании МО при перекрывании двух неэквивалентных АО связывающая МО содержит больший вклад АО с наиболее низкой энергией, а разрыхляющая орбиталь – вклад АО с более высокой энергией.
Введем понятие порядок связи. В двухатомных молекулах, порядок связи показывает насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:
Теперь на примерах рассмотрим как строить молекулярные орбитали с применением этих правил.
Молекулярно-орбитальные диаграммы элементов первого периода
Диаграмма МО молекулы Н2
Пример образования молекулы водорода из двух атомов водорода.
В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали.
При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (σ). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
Электроны, в соответствии с принципом Паули, занимают сначала орбиталь с самой низкой энергией σ-орбиталь.
Диаграмма МО молекулы Не2
Теперь рассмотрим пример образования молекулы гелия He2, при сближении двух атомов гелия. В этом случае тоже происходит взаимодействие 1s-орбиталей и образование и σ*-орбиталей, при этом два электрона занимают связывающую орбиталь, а другие два электрона – разрыхляющую.
σ *— орбиталь дестабилизирована в такой же мере, насколько стабилизирована σ –орбиталь, поэтому два электрона, занимающие σ*— орбиталь, дестабилизируют молекулу He2. Действительно, экспериментально доказано, что молекула He2 очень неустойчива.
Как узнать несколько велика прочность молекулы? Чем больше разница в заполненности связывающей и разрыхляющей орбиталей, тем молекула более прочная. Как видно из диаграммы разница в заполненности орбиталей молекулы водорода больше, чем молекулы гелия, поэтому молекула водорода намного более прочная, чем молекула гелия.
Молекулярно-орбитальные диаграммы элементов второго периода
Рассмотрим, как взаимодействуют два одинаковых атома второго периода между собой, имеющие набор из s- и p-орбиталей. Следует ожидать, что 2s-орбитали будут соединяться только друг с другом, а 2p-орбитали – только с а 2p-орбиталями.
Т.к. 2p-орбитали могут взаимодействовать друг с другом двумя различными способами, то образуют σ- и π-молекулярные орбитали. Пользуясь обобщенной диаграммой, показанной ниже, можно установить электронные конфигурации двухатомных молекул второго периода, которые приведены в таблице.
Так, образование молекулы, например, фтора F2 из атомов в системе обозначений теории молекулярных орбиталей может быть записано следующим образом:
2F [1s22s22p5] =F2[(σ1s)2(σ*1s)2(σ2s)2(σ*2s)2(σ2px)2(π2py)2(π2pz)2(π*2py)2(π*2pz)2].
Т.к. перекрывание 1s-облаков незначительно, то участием электронов на этих орбиталях можно пренебречь. Тогда электронная конфигурация молекулы фтора будет такой:
F2[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)2(π*z)2],
где К — электронная конфигурация К-слоя.
В таблице приведены молекулярные орбитали двухатомных молекул элементов второго периода бора (B2), углерода (C2), азота (N2), кислорода (O2), фтора (F2)
Рассмотрим подробнее пример образования молекулы лития Li2, принимая во внимание, что 1s- и 2s-орбитали слишком сильно отличаются по энергии и поэтому между ними не возникает сильного взаимодействия.
Диаграмма энергетических уровней молекулы Li2 показана ниже, где электроны, находящиеся на 1s-связывающих и 1s-разрыхляющих орбиталях не вносят значительного вклада в связывание. Поэтому за образование химической связи в молекуле Li2 отвечают 2s-электроны.
Это действие распространяется и на образование других молекул, в которых заполненные атомные подоболочки (s, p, d) не дают вклада в химическую связь. Таким образом, рассматриваются только валентные электроны.
В итоге, для щелочных металлов, молекулярно-орбитальная диаграмма будет иметь вид подобный рассмотренной нами диаграмме молекулы Li2.
Порядок связи n в молекуле Li2 равен 1
Молекулярные орбитали полярных двухатомных молекул
Учение о МО позволяет объяснить и образование двухатомных гетероядерных молекул. Если атомы в молекуле не слишком отличаются друг от друга (например, NO, CO, CN), то можно воспользоваться диаграммой, приведенной выше для элементов 2 периода.
При значительных различиях между атомами, входящих в состав молекулы, диаграмма видоизменяется.
Чем больше электроотрицательность атома, тем более низко на диаграмме обозначают атомные орбитали.
Диаграмма МО молекулы HF
Рассмотрим молекулу HF, в которой атомы сильно отличаются по электроотрицательности.
Энергия 1s-орбитали атома водорода выше энергии самой высокой из валентных орбиталей фтора – 2p — орбитали. Взаимодействие 1s-орбитали атома водорода и 2p — орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы HF, образуют полярную ковалентную связь.
Для связывающей орбитали молекулы HF 2p — орбиталь атома фтора играет более важную роль, чем 1s — орбиталь атома водорода.
Для разрыхляющей орбитали молекулы HF наоборот: 1s — орбиталь атома водорода играет более важную роль, чем 2p — орбиталь атома фтора
Т.к. электроотрицательность фтора больше, чем электроотрицательность водорода, то на диаграмме, атомные орбитали фтора расположени ниже, чем атомная орбиталь водорода.
Определим порядок связи, т.е. кратность связи:
Т.о. в молекуле H-F связь одинарная.
Диаграмма МО молекулы СО
Электронная конфигурация внешнего слоя атомов углерода и кислорода:
С+6 1s2 2s2 2p2
O+8 1s2 2s2 2p4
Кислород более электроотрицательный элемент, поэтому его атомная орбиталь на диаграмме расположена ниже орбитали углерода.
Диаграмма МО молекулы СО имеет вид:
СO[KK(σs)2(σ*s)2(σx)2(πy)2(πz)2(π*y)]
Кратность связи равна:
n=(8-2)/2 = 3
Диаграмма молекулы NO приведена в разделе Задачи к разделу Химическая связь и строение молекул
Метод молекулярных орбиталей (ММО, МО).
Глава 4. Химическая связь и строение молекул
Хронологически метод молекулярных орбиталей появился позже метода валентных связей, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом ВС. Укажем некоторые из них.
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двухэлектронных облаков). Но это не всегда так. В ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н2+ одноэлектронная связь. Метод ВС образование одноэлектронной связи объяснить не может, она противоречит его основному положению.
Метод ВС не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны, т. е. втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны – выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с параллельной ориентацией спинов, что противоречит методу ВС. Необходимо также отметить, что метод ВС не смог объяснить ряд свойств комплексных соединений – их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей (ММО).
4.5.1. Основные положения ММО, МО.
1. В молекуле все электроны являются общими. Сама молекула — это единое целое, совокупность ядер и электронов.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И обозначения орбиталей аналогичны:

3. В первом приближении молекулярная орбиталь представляет собой линейную комбинацию (сложение и вычитание) атомных орбиталей. Поэтому говорят о методе молекулярных орбиталей ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей), при которой из N АО образуется N МО (это основное положение метода).

Рис. 12. Энергетическая схема образования молекулы водорода Н2
Рассмотрение химических связей в методе молекулярных орбиталей заключается в распределении электронов в молекуле по ее орбиталям. Последние заполняются в порядке возрастания энергии и с учетом принципа Паули. В этом методе предполагается увеличение электронной плотности между ядрами при образовании ковалентной связи.
Пользуясь положениями 1—3, объясним образование молекулы H2 с точки зрения метода молекулярных орбиталей. При достаточном сближении атомов водорода происходит перекрывание их электронных орбиталей. Согласно п. 3 из двух одинаковых ls-орбиталей образуются две молекулярные орбитали: одна из них от сложения атомных орбиталей, другая от их вычитания (рис.12). Энергия первой E1 < E2, а энергия второй E2 < E3.
Молекулярная орбиталь, энергия которой меньше энергии атомной орбитали изолированного атома, называется связывающей (обозначается символом св), а находящиеся на ней электроны—связывающими электронами.
Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей (обозначается символом разр), а находящиеся на ней электроны — разрыхляющими электронами.
Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую молекулярную орбиталь, возникает химическая связь (рис. 12), сопровождающаяся выделением энергии E1 (435 кДж/моль). Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной молекулярной орбитали: один из них разместится на связывающей, а другой на разрыхляющей орбитали, значит химическая связь образоваться не может.
Согласно методу молекулярных орбиталей образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если же число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существования молекулы Нe2, так как в ней два электрона находились бы на связывающей орбитали и два — на разрыхляющей. Всегда разрыхляющий электрон сводит на нет действие связывающего электрона.
В системе обозначений метода молекулярных орбиталей реакцию образования молекулы водорода из атомов записывают так:
2H[1s1] = H2[(σ CB1s)2],
т. е. используются символы, выражающие размещение электронов на атомных и молекулярных орбиталях. При этом символ каждой молекулярной орбитали заключается в круглые скобки и над скобками справа проставляется число электронов на этой орбитали.
Число валентных связей определяется по формуле:

В молекуле водорода В = (2—0) : 2=1, водород одновалентен. Молекула Н2 диамагнитна (электроны спарены).
Теперь легко объясняется одноэлектронная связь в молекулярном ионе Н2+ (рис.13). Единственный электрон этого иона занимает энергетически наиболее выгодную орбиталь св1s. Уравнение процесса:
H[1s1] + H+ = H2+[(σсв1s)1], ∆H = — 259,4 кДж
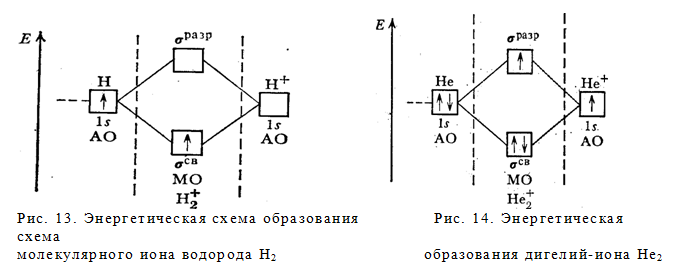
Число связей в ионе H2+ равно ½ (связь одним электроном). Ион H2+ — парамагнитен (имеет один неспаренный электрон).
Возможно существование молекулярного дигелий иона Не2+ (рис.14). Уравнение его образования
He[1s2] + He+[1s1] = He2+ [(σCB 1s)2 (σ разр1s)1], ∆H = — 292,8 кДж
Этот ион экспериментально обнаружен. Число связей в нем (2—1) : 2 = 1/2. Ион— парамагнитен (имеет неспаренный электрон).

Рис. 15 . Энергетическая схема образования двухатомных гомонуклеарных молекул элементов второго периода
4.5.2. Основные двухатомные гомонуклеарные молекулы элементов 2-го периода. Рассмотренный принцип построения молекулярных орбиталей из двух одинаковых АО сохраняется при построении гомонуклеарных молекул элементов 2-го периода системы Д.И. Менделеева. Они образуются в результате взаимодействия 2s- и 2рx-, 2рy— и 2рz-орбиталей.
Участием внутренних электронов 1s-орбиталей можно пренебречь (на последующих энергетических схемах они не учтены). 2s-орбиталь одного атома взаимодействует только с 2s-орбиталью другого атома (должна быть близость значений энергий взаимодействующих орбиталей), образуя МО σ2sсв и σ2sразр. При перекрывании (взаимодействии) 2р-орбиталей обоих атомов образуются МО: σхсв, σхразр, πусв, πуразр, πzсв, πzразр
(рис.15). Т.е. из шести исходных 2р-орбиталей образуется шесть молекулярных орбиталей – три связывающих и три разрыхляющих. Молекулярные орбитали, образующиеся из s- и рx-атомных орбиталей, обозначаются буквой , а из ру— и рz— – буквой . С помощью рис. 15 легко представить электронные конфигурации этих молекул в системе обозначений метода молекулярных орбиталей.

Рис. 16. Энергетическая схема образования молекулы Li2
Пример 1. Молекула лития Li2. Схема ее образования представлена на рис.16. В ней два связывающих электрона, молекула диамагнитна (электроны спарены). Написание уравнения и формулы можно упростить, обозначив внутренний уровень через K:
2Li[K2s] = Li2[KK(σCB2s)2]
Число связей равно 1.
Пример 2. Молекула бериллия Be2. Восемь электронов молекулы размещены на МО следующим образом:
Ве2[KK(σ CB2s)2 (σ разр2s)2]
Как видно, число связей в молекуле равно нулю: два разрыхляющих электрона уничтожают действие двух связывающих. Такая молекула не может существовать, и она до сих пор не обнаружена. Необходимо отметить, что невозможны двухатомные молекулы у всех элементов IIА-группы, палладия и инертных элементов, так как их атомы имеют замкнутую электронную структуру.
Пример 3. Молекула азота N2 (рис. 17). Распределение 14 электронов по МО записывается так:


Рис. 17. Энергетическая схема образования молекулы N2
Под формулой указано число связей в молекуле, исходя из расчета, что два электрона, расположенные на одной МО, образуют валентную связь; знак плюс обозначает связующие орбитали, знак минус – разрыхляющие. Число связей в молекуле 3. нет неспаренных электронов – молекула диамагнитна.
Пример 4. Молекула O2 (рис. 18). Электроны размещаются по молекулярным орбиталям в последовательности:
В молекуле две валентные связи. Последние два электрона разместились на различных π-разрыхляющих орбиталях в соответствии с правилом Гунда. Два неспаренных электрона обусловливают парамагнетизм молекулы кислорода.


Рис. 18. Энергетическая схема образования молекулы O2
4.5.3. Двухатомные гетеронуклеарные молекулы элементов 2-го периода. Энергетическая схема образования МО гетеронуклеарных двухатомных молекул, состоящих из атомов элементов 2-го периода, представлена на рис. 19. Она сходна со схемой образования молекулярных орбиталей гомонуклеарных молекул.
Основное различие сводится к тому, что значения энергии одноименных орбиталей атомов разных элементов не равны между собой, поскольку различны заряды ядер атомов. В качестве примера рассмотрим электронную валентную конфигурацию молекул СО и NO.

Рис. 19 . Энергетическая схема образования двух атомных гетеронуклеарных молекул элементов второго периода
Пример 5.Молекула СО. Внешняя электронная оболочка атома углерода имеет конфигурацию 2s22p2, а кислорода 2s22p4. Стало быть, в заполнении МО молекулы СО принимают участие 4+6=10 электронов. Из них два размещаются на орбитали σ2sсв , два – на орбитали σ2sразр, четыре – на орбиталях πyCB и πzCB, а девятый и десятый – на σхсв. Таким образом, электронную валентную конфигурацию молекулы СО можно выразить формулой:

Как и предусматривалось теорией ВС, в молекуле СО три валентные связи (сравните с N2). Молекула диамагнитна – все электроны спарены.
Пример 6. Молекула NO. На МО молекулы оксида азота (II) должны разместиться 11 электронов: пять азота – 2s22p3 и шесть кислорода – 2s22p4. Десять из них размещаются так же, как и электроны молекулы оксида углерода (II) (пример 5), а одиннадцатый разместится на одной из разрыхляющих орбиталей – πy разр или πZ разр (эти орбитали энергетически эквивалентны между собой). Тогда
Значит, молекула NO имеет две с половиной валентные связи, энергия связи большая —677,8кДж/моль. Она парамагнитна, так как содержит один неспаренный электрон.

Приведенные примеры служат иллюстрацией возможностей метода МО в объяснении строения и свойств молекул.
Пример 7. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном состояниях?
Решение. Распределение электронов внешнего энергетического уровня фосфора 3s23р3 (учитывая правило Хунда, ) по квантовым ячейкам имеет вид:

Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние:

Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти.
Пример 8. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-, sp2-, sp3-гибридизации орбиталей атома А?
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только чистых АО, но и смешанных, так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и с одинаковой энергией. Число гибридных орбиталей (q) равно числу исходных. Ответ см. в табл. 13.
Таблица 13.
Гибридизация орбиталей и пространственная конфигурация молекул

Пример 9. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F+2 и О+2, чем, соответственно, в молекулах F2 и O2; наоборот, меньшую прочность связи в ионе N+2 , чем в молекуле N2; существование молекулярного иона Не2+ и неустойчивость молекулы Не2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомной, соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
σCB1s<σразр1s<σCB2s<σразр2s<σCB2px<πCB2py =
= πCB2pz<πразр2py=πразр2pz< σразр2x
На рис. 20 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.
Следует отметить, что при образовании молекул N2 энергия связывающей 2рx-орбитали больше энергии связывающих 2ру— и 2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих 2ру— и 2рz-орбиталей больше энергии связывающей 2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).

Рис.20. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орбитали обозначаются греческими буквами . Так, электронная конфигурация молекулы O2 записывается следующим образом:
O2 [КК (σsCB)2 (σsразр)2(σpxCB)2 (πpyCB)2 πpzразр πpyразр πpzразр]
Буквами КК показано, что четыре 1s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Основные положения метода молекулярных орбиталей
Электронное строение гомоядерных двухатомных молекул и ионов
Электронное строение гетероядерных молекул и ионов
Задачи для самостоятельного решения
Основные положения метода молекулярных орбиталей (МО ЛКАО)
- В результате линейной комбинации две атомные орбитали (АО) формируют две молекулярные орбитали (МО) – связывающую, энергия которой ниже, чем энергия АО, и разрыхляющую, энергия которой выше энергии АО.
- Электроны в молекуле располагаются на молекулярных орбиталях в соответствии с принципом Паули и правилом Хунда.
- Отрицательный вклад в энергию химической связи электрона, находящегося на разрыхляющей орбитали больше, чем положительный вклад в эту энергию электрона на связывающей МО.
- Кратность связи в молекуле равна деленной на два разности числа электронов, находящихся на связывающих и разрыхляющих МО.
- С повышением кратности связи в однотипных молекулах увеличивается ее энергия связи и уменьшается ее длина.
Если при образовании молекулы из атомов электрон займет связывающую МО, то полная энергия системы понизится, т.е. образуется химическая связь. При переходе электрона на разрыхляющую МО энергия системы повысится, система станет менее устойчивой (рис. 1).

Рис. 1. Энергетическая диаграмма образования молекулярных орбиталей из двух атомных орбиталей.
Молекулярные орбитали, образованные из s-атомных орбиталей, обозначаются ss. Если МО образованы рz-атомными орбиталями – они обозначаются s z. Молекулярные орбитали, образованные рx— и рy-атомными орбиталями, обозначаются π x и π y соответственно.
При заполнении молекулярных орбиталей электронами следует руководствоваться следующими принципами:
- Каждой МО отвечает определенная энергия. Молекулярные орбитали заполняются в порядке увеличения энергии.
- На одной молекулярной орбитали может находиться не более двух электронов с противоположными спинами.
- Заполнение молекулярных квантовых ячеек происходит в соответствии с правилом Хунда.
Экспериментальное исследование (изучение молекулярных спектров) показало, что энергия молекулярных орбиталей возрастает в следующей последовательности:
σ 1s < σ *1s < σ 2s <σ *2s < σ 2pz < π 2рх = π 2ру < π *2рх = π *2ру < σ *2pz.
Звездочкой (*) в этом ряду отмечены разрыхляющие молекулярные орбитали.
У атомов В, С и N энергии 2s- и 2p-электронов близки и переход 2s-электрона на молекулярную орбиталь σ 2pz требует затраты энергии. Следовательно, для молекул В2, С2, N2 энергия орбитали σ 2pz становится выше энергии орбиталей π 2рх и π 2ру:
σ 1s < σ *1s < σ 2s <σ *2s < π 2px = π 2ру < σ 2pz <π *2рх = π *2ру < σ *2pz.
При образовании молекулы электроны располагаются на орбиталях с более низкой энергией. При построении МО обычно ограничиваются использованием валентных АО (орбиталей внешнего слоя), так как именно они вносят основной вклад в образование химической связи.
Электронное строение гомоядерных двухатомных молекул и ионов
Процесс образования частицы H2+ можно представить следующим образом:
Н[1s] + Н+ → H2+[σ 1s].
Таким образом, на связывающей молекулярной σ -орбитали располагается один электрон.
Кратность связи равна полуразности числа электронов на связывающих и разрыхляющих орбиталях. Значит, кратность связи в частице H2+ равна (1 – 0):2 = 0,5. Метод ВС, в отличие от метода МО, не объясняет возможность образования связи одним электроном.
Молекула водорода имеет следующую электронную конфигурацию:
H2 [(σ 1s)2]
В молекуле H2 имеется два связывающих электрона, значит, связь в молекуле одинарная.
Молекулярный ион H2— имеет электронную конфигурацию:
H2— [(σ 1s)2(σ *1s)1]
Кратность связи в H2— составляет (2 – 1):2 = 0,5.
Рассмотрим теперь гомоядерные молекулы и ионы второго периода.
Электронная конфигурация молекулы Li2 следующая:
2Li (K2s) Li2 [KK*(σ 2s)2]
Молекула Li2 содержит два связывающих электрона, что соответствует одинарной связи.
Процесс образования молекулы Ве2 можно представить следующим образом:
2 Ве(K2s2) Ве2 [KK*(σ 2s)2 (σ *2s)2]
Число связывающих и разрыхляющих электронов в молекуле Ве2 одинаково, а поскольку один разрыхляющий электрон уничтожает действие одного связывающего, то молекула Ве2 в основном состоянии не обнаружена.
В молекуле азота на орбиталях располагаются 10 валентных электронов. Электронное строение молекулы N2:
N2 [KK*(σ 2s)2 (π *2s)2 (π2px)2 (π2py)2 (σ 2pz)2]
Поскольку в молекуле N2 восемь связывающих и два разрыхляющих электрона, то в данной молекуле имеется тройная связь. Молекула азота обладает диамагнитными свойствами, поскольку не содержит неспаренных электронов.
На орбиталях молекулы O2 распределены 12 валентных электронов, следовательно, эта молекула имеет конфигурацию:
O2 [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)1]

Рис. 2. Схема образования молекулярных орбиталей в молекуле О2 (показаны только 2р-электроны атомов кислорода)
В молекуле O2, в соответствии с правилом Хунда, два электрона с параллельными спинами размещаются по одному на двух орбиталях с одинаковой энергией (рис. 2). Молекула кислорода по методу ВС не имеет неспаренных электронов и должна обладать диамагнитными свойствами, что не согласуется с экспериментальными данными. Метод молекулярных орбиталей подтверждает парамагнитные свойства кислорода, которые обусловлены наличием в молекуле кислорода двух неспаренных электронов. Кратность связи в молекуле кислорода равна (8–4):2 = 2.
Рассмотрим электронное строение ионов O2+ и O2— . В ионе O2+ на его орбиталях размещаются 11 электронов, следовательно, конфигурация иона следующая:
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1]
или
O2+ [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2py)1]
Кратность связи в ионе О2+ равна (8–3):2 = 2,5. В ионе O2— на его орбиталях распределены 13 электронов. Этот ион имеет следующее строение:
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)1]
или
O2— [KK*(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)1 (π*2py)2]
Кратность связи в ионе О2— равна (8 – 5):2 = 1,5. Ионы О2— и О2+ являются парамагнитными, так как содержат неспаренные электроны.
Электронная конфигурация молекулы F2 имеет вид:
F2 [KK(σ 2s)2 (σ *2s)2 (σ 2pz)2 (π2px)2 (π2py)2 (π*2px)2 (π*2py)2]
Кратность связи в молекуле F2 равна 1, так как имеется избыток двух связывающих электронов. Поскольку в молекуле нет неспаренных электронов, она диамагнитна.
В ряду N2, O2, F2 энергии и длины связей в молекулах составляют:
| Молекула | N2 | O2 | F2 |
| Избыток связывающих электронов | 6 | 4 | 2 |
| Энергия связи, кДж/моль | 941 | 494 | 155 |
| Длина связи, пм | 110 | 121 | 142 |
Увеличение избытка связывающих электронов приводит к росту энергии связи (прочности связи). При переходе от N2 к F2 длина связи возрастает, что обусловлено ослаблением связи.
В ряду О2— , О2, О2+ кратность связи увеличивается, энергия связи также повышается, длина связи уменьшается.
Электронное строение гетероядерных молекул и ионов
Изоэлектронными частицами называют частицы, содержащие одинаковое число электронов. Например, к изоэлектронным частицам относятся N2, CO, BF, NO+, CN- .
Согласно методу МО электронное строение молекулы СО аналогично строению молекулы N2:
CO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ2pz)2]
На орбиталях молекулы СО располагаются 10 электронов (4 валентных электрона атома углерода и 6 валентных электронов атома кислорода). В молекуле СО, как и в молекуле N2, связь тройная. Сходство в электронном строении молекул N2 и СО обуславливает близость физических свойств этих веществ.
В молекуле NO на орбиталях распределены 11 электронов (5 электронов атома азота и 6 электронов атома кислорода), следовательно, электронная конфигурация молекулы такова:
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2px)1] или
NO [KK*(σ 2s)2 (σ *2s)2 (π2px)2 (π2py)2 (σ 2pz)2 (π*2py)1]
Кратность связи в молекуле NO равна (8–3):2 = 2,5.
Конфигурация молекулярных орбиталей в ионе NO— :
NO— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 (π*2px)1(π*2py)1]
Кратность связи в этой молекуле равна (8–4):2 = 2.
Ион NO+ имеет следующее электронное строение:
NO+ [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]
Избыток связывающих электронов в этой частице равен 6, следовательно, кратность связи в ионе NO+ равна трём.
В ряду NO— , NO, NO+ избыток связывающих электронов увеличивается, что приводит к возрастанию прочности связи и уменьшению её длины.
Задачи для самостоятельного решения
1. Используя метод МО, установите порядок уменьшения энергии химической связи в частицах:
NF+; NF —; NF.
2. Используя метод МО, установите порядок увеличения энергии химической связи в частицах:
CO—; CO; CO+.
3. На основе метода МО установите, какие из перечисленных частиц не существуют:
He2; He2+; Be2; Be2+.
4. Распределите электроны на молекулярных орбиталях для молекулы B2. Определите кратность связи.
5. Распределите электроны на молекулярных орбиталях для молекулы N2. Определите кратность связи.
6. Используя метод МО, определите кратность связи в молекуле С2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
7. На основе метода МО объясните, почему не существует молекулы Ne2.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
8. Объясните уменьшение энергии связи при переходе от нейтральной молекулы N2 к иону N2—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: |
9. Распределите электроны на молекулярных орбиталях для иона CN—. Определите кратность связи в этом ионе.
|
CN— [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2]. |
10. Используя метод МО определите, как изменяется длина связи и энергия связи в ряду CN+, CN, CN—.
|
Электроны располагаются на молекулярных орбиталях следующим образом: CN+ [KK*(σ2s)2 (σ*2s2 (π2px)2 (π2py)2 ]; CN [KK*(σ2s)2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)1]; CN— [KK*(σ2s) 2 (σ*2s)2 (π2px)2 (π2py)2 (σ2pz)2 ]. Избыток связывающих электронов в CN+, CN, CN— соответственно составляет 4, 5, 6. |
Download Article
Download Article
On the atomic level, bond order is the number of bonded electron pairs between two atoms. In diatomic nitrogen (N≡N), for instance, the bond order is 3 because there are 3 chemical bonds linking the two nitrogen atoms. In molecular orbital theory, bond order is also defined as half of the difference between the number of bonding and antibonding electrons. For a straightforward answer: use this formula: Bond order = [(Number of electrons in bonding molecules) – (Number of electrons in antibonding molecules)]/2.
-

1
Know the formula. In molecular orbital theory, bond order is defined as half of the difference between the number of bonding and antibonding electrons. Bond order = [(Number of electrons in bonding molecules) – (Number of electrons in antibonding molecules)]/2.[1]
-

2
Know that the higher the bond order, the more stable the molecule. Each electron that entered a bonding molecular orbital will help stabilize the new molecule.[2]
Each electron that entered an antibonding molecular orbital will act to destabilize the new molecule. Note the new energy state as the bond order of the molecule.- If the bond order is zero, the molecule cannot form. The higher bond orders indicate greater stability for the new molecule.
Advertisement
-

3
Consider a simple example. Hydrogen atoms have one electron in the s shell, and the s shell is capable of holding two electrons. When two hydrogen atoms bond together, each completes the s shell of the other. Two bonding orbitals are formed. No electrons are forced to move to the next higher orbital, the p shell – so no antibonding orbitals are formed. The bonding order is thus
, which equals 1. This forms the common molecule H2: hydrogen gas.[3]
Advertisement
-

1
Determine bond order at a glance. A single covalent bond has a bond order of one; a double covalent bond, a bond order of two; a triple covalent bond, three – and so on.[4]
In its most basic form, the bond order is the number of bonded electron pairs that hold two atoms together.- For a more in-depth look, check the periodic table to see what kind of bonding you’ve got going on.[5]
- For a more in-depth look, check the periodic table to see what kind of bonding you’ve got going on.[5]
-

2
Consider how atoms come together into molecules. In any given molecule, the component atoms are bound together by bonded pairs of electrons. These electrons revolve around the nucleus of an atom in “orbitals,” each of which can only hold two electrons. If an orbital is not “full”—i.e., it only holds one electron, or no electrons—then the unpaired electron can bond to a corresponding free electron on another atom.
- Depending on the size and complexity of a particular atom, it might have only one orbital, or it might have as many as four.
- When the nearest orbital shell is full, new electrons start to gather in the next orbital shell out from the nucleus, and continue until that shell is also full. The collection of electrons continues in ever-widening orbital shells, as larger atoms have more electrons than smaller atoms.[6]
-

3
Draw Lewis dot structures. This is a handy way to visualize how the atoms in a molecule are bonded to one another.[7]
Draw the atoms as their letters (e.g. H for Hydrogen, Cl for Chlorine). Illustrate the bonds between them as lines (e.g. – for a single bond, = for a double bond, and ≡ for a triple bond). Mark the unbonded electrons and electron pairs as dots (e.g. :C:). Once you’ve drawn your Lewis dot structure, count the number of bonds: this is the bond order.- The Lewis dot structure for diatomic nitrogen would be N≡N. Each nitrogen atom features one electron pair and three unbonded electrons. When two nitrogen atoms meet, their combined six unbonded electrons intermingle into a powerful triple covalent bond.[8]
- The Lewis dot structure for diatomic nitrogen would be N≡N. Each nitrogen atom features one electron pair and three unbonded electrons. When two nitrogen atoms meet, their combined six unbonded electrons intermingle into a powerful triple covalent bond.[8]
Advertisement
-

1
Consult a diagram of electron orbital shells. Note that each shell lies further and further out from the nucleus of the atom. According to the property of entropy, energy always seeks the lowest possible state of order. The electrons will seek to populate the lowest orbital shells available.[9]
-

2
Know the difference between bonding and antibonding orbitals. When two atoms come together to form a molecule, they seek to use each other’s electrons to fill the lowest possible states in the electron orbital shells. Bonding electrons are, essentially the electrons that stick together and fall into the lowest states. Antibonding electrons are the “free” or unbonded electrons that are pushed to higher orbital states.[10]
- Bonding electrons: By noting how full the orbital shells of each atom are, you can determine how many of the electrons in higher energy states will be able to fill the more stable, lower-energy-state shells of the corresponding atom. These “filling electrons” are referred to as bonding electrons.
- Antibonding electrons: When the two atoms try to form a molecule by sharing electrons, some electrons will actually be driven to higher-energy-state orbital shells as the lower-energy-state orbital shells are filled up. These electrons are referred to as antibonding electrons.[11]
Advertisement
Add New Question
-
Question
How do you use the periodic table of elements?

Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.

Retired Science Professor & Dean
Expert Answer
Reference the periodic table to see what type of bonding is going on at different kinds of levels.
-
Question
How do you visualize different bonds?

Dr. Chris Hasegawa was a Science Professor and the Dean at California State University Monterey Bay. Dr. Hasegawa specializes in teaching complex scientific concepts to students. He holds a BS in Biochemistry, a Master’s in Education, and his teaching credential from The University of California, Davis. He earned his PhD in Curriculum and Instruction from The University of Oregon. Before becoming a professor, Dr. Hasegawa conducted biochemical research in Neuropharmacology at the National Institute of Health. He also taught physical and life sciences and served as a teacher and administrator at public schools in California, Oregon, and Arizona.

Retired Science Professor & Dean
Expert Answer
Use the bond’s Lewis dot structure as a starting point. You can reference bonding diagrams, too.
-
Question
What is the bond order of He2?

The bond order of He2 is 0. It has 2 antibonding electrons and 2 bonding electrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
About This Article
Article SummaryX
To calculate bond order in chemistry, subtract the number of the electrons in the antibonding molecules from the number of electrons in the bonding molecules. Divide the result by 2 to get the result. The higher the bond order, the more stable the molecule. To learn how to determine a bond order at a glance, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 626,656 times.
Did this article help you?
Метод молекулярных орбиталей
Метод ВС
широко используется химиками. В рамках
этого метода большая и сложная молекула
рассматривается как состоящая из
отдельных двухцентровых и двухэлектронных
связей. Принимается, что электроны,
обусловливающие химическую связь,
локализованы (расположены) между двумя
атомами. К большинству молекул метод
ВС может быть применен с успехом. Однако
имеется ряд молекул, к которым этот
метод неприменим или его выводы находятся
в противоречии с опытом.
Установлено,
что в ряде случаев определяющую роль в
образовании химической связи играют
не электронные пары, а отдельные
электроны. На возможность химической
связи при помощи одного электрона
указывает существование иона H2+.
При образовании этого иона из атома
водорода и иона водорода выделяется
энергия в 255 кДж . Таким образом, химическая
связь в ионеH2+![]() довольно
довольно
прочная.
Если попробовать
описать химическую связь в молекуле
кислорода по методу ВС, то придем к
заключению, что, во-первых, она должна
быть двойной (σ- и p-связи), во-вторых, в
молекуле кислорода все электроны должны
быть спарены, т.е. молекула О2должна быть диамагнитна (у диамагнитных
веществ атомы не обладают постоянным
магнитным моментом и вещество выталкивается
из магнитного поля). Парамагнитным
веществом называется то, атомы которого
или молекулы обладают магнитным моментом,
и оно обладает свойством втягиваться
в магнитное поле. Экспериментальные
данные показывают, что по энергии связь
в молекуле кислорода действительно
двойная, но молекула является не
диамагнитной, а парамагнитной. В ней
имеется два неспаренных электрона.
Метод ВС бессилен объяснить это факт.
Метод
молекулярных орбиталей (МО) наиболее
нагляден в его графической модели
линейной комбинации атомных орбиталей
(ЛКАО). Метод МО ЛКАО основан на следующих
правилах.
1) При сближении
атомов до расстояний химических связей
из атомных орбиталей (АО) образуются
молекулярные.
2) Число
полученных молекулярных орбиталей
равно числу исходных атомных.
3) Перекрываются
атомные орбитали, близкие по энергии.
В результате перекрывания двух атомных
орбиталей образуются две молекулярные.
Одна из них имеет меньшую энергию по
сравнению с исходными атомными и
называется связывающей,
а вторая молекулярная орбиталь обладает
большей энергией, чем исходные атомные
орбитали, и называетсяразрыхляющей.
4) При
перекрывании атомных орбиталей возможно
образование и σ-связи (перекрывание по
оси химической связи), и π-связи
(перекрывание по обе стороны от оси
химической связи).
5) Молекулярная
орбиталь, не участвующая в образовании
химической связи, носит название
несвязывающей. Ее энергия
равна энергии исходной АО.
6)На одной
молекулярной орбитали (как, впрочем, и
атомной) возможно нахождение не более
двух электронов.
7)Электроны
занимают молекулярную орбиталь с
наименьшей энергией (принцип наименьшей
энергии).
8)Заполнение
вырожденных (с одинаковой энергией)
орбиталей происходит последовательно
по одному электрону на каждую из них.
Применим
метод МО ЛКАО и разберем строение
молекулы водорода.
Мысленно перекроем
две атомные орбитали, образовав две
молекулярные, одна из которых (связывающая)
обладает меньшей энергией (расположена
ниже), а вторая (разрыхляющая) – большей
энергией (расположена выше)
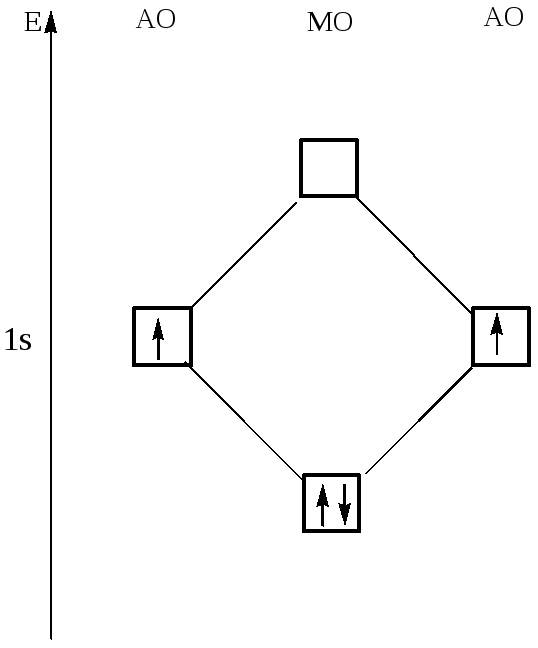
Рис. 8Энергетическая
диаграмма образования молекулы Н2
Метод МО ЛКАО
позволяет наглядно объяснить образование
ионов Н2+, что вызывает
трудности в методе валентных связей.
На σ-связывающую молекулярную орбиталь
катиона Н2+переходит один
электрон атома H с выигрышем энергии.
Образуется устойчивое соединение с
энергией связи 255кДж/моль. Кратность
связи равна ½. Молекулярный ион
парамагнитен. Молекула обычного водорода
содержит уже два электрона с противоположными
спинами на σcв1s-орбитали: Энергия
связи в Н2больше, чем вH2+![]() –
–
435 кДж/моль. В молекуле Н2имеется
одинарная связь, молекула диамагнитна.
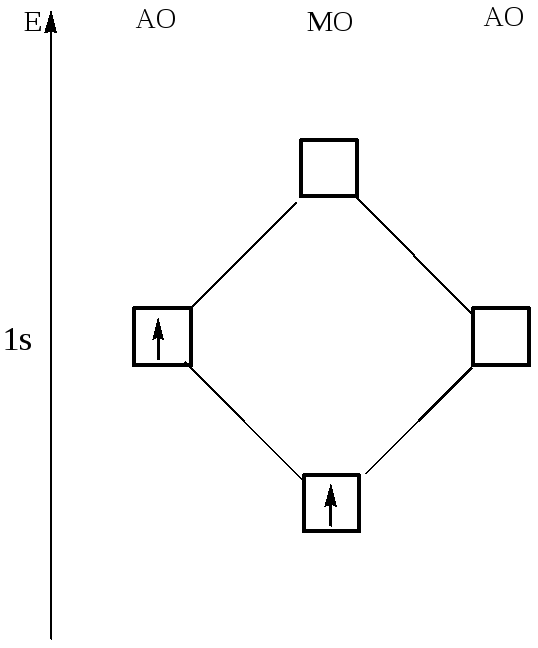
Рис.
9Энергетическая диаграмма образования
иона Н2+
Используя
метод МО ЛКАО, рассмотрим возможность
образования молекулы He2
В этом случае
два электрона займут связывающую
молекулярную орбиталь, а два других –
разрыхляющую. Выигрыша в энергии такое
заселение двух орбиталей электронами
не принесет. Следовательно, молекулы
He2не существует.
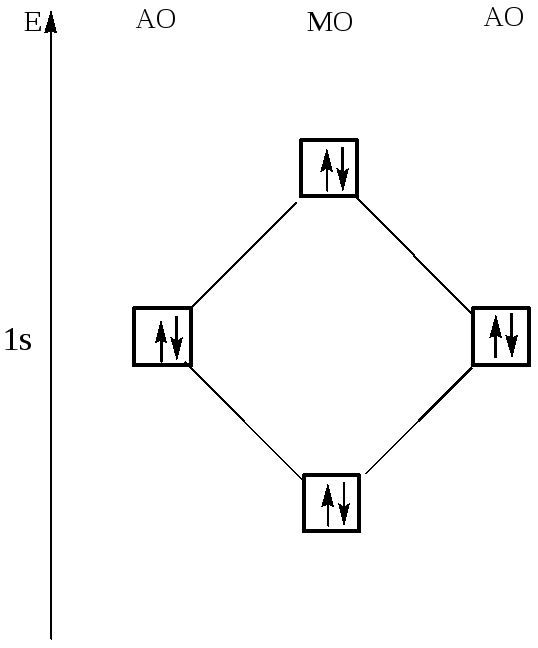
Рис.
10 Энергетическая
диаграмма, иллюстрирующая невозможность
образования химической
связи между атомами
He
Заполнение молекулярных орбиталей
происходит при соблюдении принципа
Паули и правила Хунда по мере увеличения
их энергии в такой последовательности:
σ1s
< σ*1s < σ2s
< σ*2s < σ2pz
<
π2px
= π2py
< π*2px
=π*2py <
σ*2pz
Значения энергии σ2pи π2pблизки и для некоторых
молекул(В2,С2,N2)
соотношение обратное приведённому:
сначала π2pпотом σ2p
Таблица
1Энергия и порядок связи в молекулах
элементов 1 периода
|
Молекулы |
Электронная |
Энергия кДж/моль |
Порядок связи |
|
Н2+ |
(σs)1 |
256 |
0,5 |
|
Н2 |
(σs)2(σs*)1 |
431 |
1 |
|
Н2– |
(σs)2(σs*)1 |
– |
0,5 |
|
НеН |
(σs)2(σs*)1 |
– |
0,5 |
|
Не2+ |
(σs)2(σs*)1 |
243 |
0,5 |
|
Не2 |
(σs)2(σs*)2 |
– |
0 |
Согласно методу МО порядок
связив молекуле определяется
разностью между числом связывающих и
разрыхляющих орбиталей, деленный на
два. Порядок связи может быть равен нулю
(молекула не существует), целому или
дробному положительному числу. При
нулевой кратности связи,как в случае
Не2,молекула не образуется.
На
рисунке 11 изображена энергетическая
схема образования молекулярных орбиталей
из атомных для двухатомных гомоядерных
(одного и того же элемента) молекул
элементов второго периода. Число
связывающих и разрыхляющих электронов
зависит от их числа в атомах исходных
элементов.
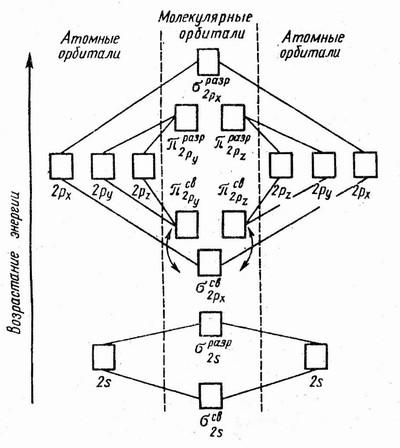
Рис.11Энергетическая диаграмма
образования двухатомных молекул
элементов 2 периода
Образование
молекул из атомов элементов II периода
может быть записано следующим образом
(К – внутренние
электронные слои):
Li
2 [KK(σs)2]
Be2
[KK(σs)2(σs*)2]
молекула не
обнаружена, как и молекула Не2
B2
[KK(σs)2(σs*)2
(πx)1(πy)1]
молекула
парамагнитна
C2
[KK(σs)2(σs*)2(πx)2(πy)2]
N2
[KK(σs)2(σs*)2(πx)2(πy)2(σz)2
]
O2
[KK(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)1(πy)1
] молекула парамагнитна
F2
[KK(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)2(πy)2
]
Ne2
[KK(σs)2(σs*)2(σz)2(πx)2(πy)2(πx)2(πy)2(σz*)2
] молекула не обнаружена
Методом МО
ЛКАО легко продемонстрировать
парамагнитные свойства молекулы
кислорода. С тем чтобы не загромождать
рисунок, не будем рассматривать
перекрывание 1s-орбиталей атомов
кислорода первого (внутреннего)
электронного слоя. Учтем, чтоp-орбитали
второго (внешнего) электронного слоя
могут перекрываться двумя способами.
Одна из них перекроется с аналогичной
с образованием σ-связи.
|
|
|
Рис.12 Перекрывание |
Две
других p-АО перекроются по обе стороны
от осиxс образованием двух π-связей.
|
|
|
Рис.13 |
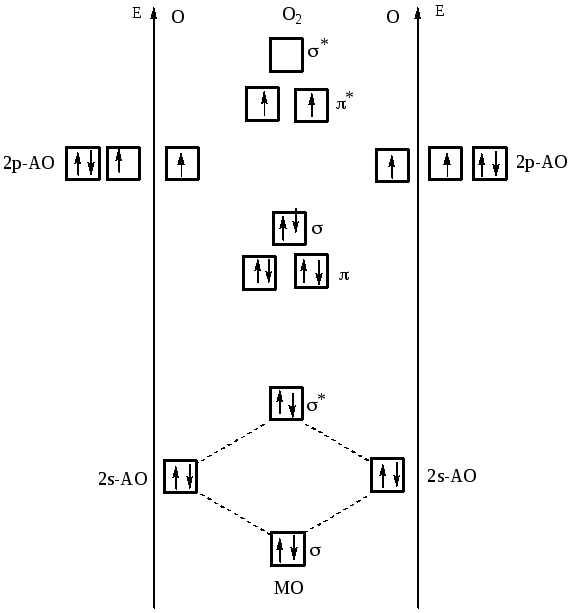
Рис. 14 Энергетическая
диаграмма,иллюстрирующая с помощью
метода МО ЛКАО
парамагнитные свойства молекулы O2
Энергии
молекулярных орбиталей могут быть
определены по данным спектров поглощения
веществ в ультрафиолетовой области.
Так, среди молекулярных орбиталей
молекулы кислорода, образовавшихся в
результате перекрывания p-АО, две
π-связывающие вырожденные (с одинаковой
энергией) орбитали обладают меньшей
энергией, чем σ-связывающая, впрочем,
как и π*-разрыхляющие орбитали обладают
меньшей энергией в сравнении с
σ*-разрыхляющей орбиталью .
В
молекуле O2 два электрона с
параллельными спинами оказались на
двух вырожденных
(с одинаковой
энергией) π*-разрыхляющих молекулярных
орбиталях. Именно наличием неспаренных
электронов и обусловлены парамагнитные
свойства молекулы кислорода, которые
станут заметными, если охладить кислород
до жидкого состояния.
Так, электронная
конфигурация молекул О2описывается
следующим образом:
О2
[КК(σs)2(σs*)2(σz)2(πx)2(πy)2(πx*)1(πy*)1]
Буквами КК
показано, что четыре 1 s-электрона
(два связывающих и два разрыхляющих)
практически не оказывают влияния на
химическую связь.
Поскольку
три атома водорода имеют только три
1s-орбитали, то суммарное число
образованных молекулярных орбиталей
будет равно шести (три связывающих и
три разрыхляющих). Два электрона атома
азота окажутся на несвязывающей
молекулярной орбитали (неподеленная
электронная пара).
Наилучшим
способом квантовомеханической трактовки
химической связи в настоящее время
считается метод молекулярных орбиталей
(МО). Однако он гораздо сложнее метода
ВС и не столь нагляден, как последний.
Существование
связывающих и разрыхляющих МО
подтверждается физическими свойствами
молекул. Метод МО позволяет предвидеть,
что если при образовании молекулы из
атомов электроны в молекуле попадают
на связывающие орбитали, то потенциалы
ионизации молекул должны быть больше,
чем потенциалы ионизации атомов, а если
электроны попадают на разрыхляющие
орбитали, то наоборот. Так, потенциалы
ионизации молекул водорода и азота
(связывающие орбитали) – 1485 и 1500 кДж/моль
соответственно – больше, чем потенциалы
ионизации атомов водорода и азота –
1310 и 1390 кДж/моль, а потенциалы ионизации
молекул кислорода и фтора (разрыхляющие
орбитали) – 1170 и 1523 кДж/моль – меньше,
чем у соответствующих атомов – 1310 и
1670 кДж/моль. При ионизации молекул
прочность связи уменьшается, если
электрон удаляется со связывающей
орбитали (H2и N2), и увеличивается,
если электрон удаляется с разрыхляющей
орбитали(О2и F2).
Полярность связи
Между разными
атомами чистая ковалентная связь может
проявляться, если электроотрицательность
(ЭО) атомов одинакова. Такие молекулы
электросимметричны, т.е. «центры тяжести»
положительных зарядов ядер и отрицательных
зарядов электронов совпадают в одной
точке, поэтому их называют неполярными.
Если соединяющиеся
атомы обладают различной ЭО, то электронное
облако, находящееся между ними, смещается
из симметричного положения ближе к
атому с большей ЭО:
Смещение
электронного облака называется
поляризацией. В результате односторонней
поляризации центры тяжести положительных
и отрицательных зарядов в молекуле не
совпадают в одной точке, между ними
возникает некоторое расстояние (l).
Такие молекулы называются полярными
или диполями, а связь между атомами в
них называется полярной. Например, в
молекулеHClсвязующее
электронное облако смещено в сторону
более электроотрицательного атома
хлора. Таким образом, атом водорода в
хлороводороде поляризован положительно,
а атом хлора отрицательно.
На атоме водорода
возникает положительный заряд δ= +0,18, а
атоме хлора – отрицательный δ=-018.
следовательно связь в молекуле
хлороводорода имеет на 18% ионный характер.
Полярная
связь – разновидность ковалентной
связи, претерпевшей незначительную
одностороннюю поляризацию. Расстояние
между «центрами тяжести» положительных
и отрицательных зарядов в молекуле
называется длиной диполя. Естественно,
что чем больше поляризация, тем больше
длина диполя и больше полярность молекул.
Для оценки полярности молекул обычно
пользуются постоянным дипольным моментом
µ, представляющим собой произведение
величины элементарного электрического
заряда qна длину диполя
(l), т.е. µ =q∙l. Дипольные моменты измеряют в
кулонометрах.
Таблица
2Электрический момент диполя µ
некоторых молекул
|
Молекула |
µ∙1029Кл∙м |
Молекула |
µ∙1029Кл∙м |
|
H2 |
0 |
HF |
0,640 |
|
N2 |
0 |
HCl |
0,347 |
|
CO |
0,033 |
HBr |
0,263 |
|
NO |
0,023 |
HI |
0,127 |
Суммарный
дипольный момент сложной молекулы можно
считать равным векторной сумме дипольных
моментов отдельных связей. Дипольный
момент обычно принято считать направленным
от положительного конца диполя к
отрицательному. Результат сложеиия
зависит от структуры молекулы. Дипольный
моиент высокосимметричных молекул
BeCl2,BF3,CCl4равен нулю, хотя
связиBe-Cl,B-F,C-Clимеют сильно полярный характер. В
угловой молекуле Н2О полярные
связи О-Н расположены под углом 104,5о.
Поэтому молекула оказывается полярной
(µ = 0,61∙10-29Кл∙м)
При очень
большой разности электроотрицательности
у атомов имеет место явная односторонняя
поляризация: электронное облако связи
максимально смещается в сторону атома
с наибольшей электроотрицательностью,
атомы переходят в противоположно
заряженные ионы и возникает ионная
молекула. Ковалентная связь становится
ионной. Электроасимметрия молекул
возрастает, длина диполя увеличивается,
дипольный момент возрастает.
Предсказать
полярность связи можно с помощью
относительной ЭО атомов. Чем больше
разность относительных ЭО атомов, тем
сильнее выражена полярность. Правильнее
говорить о степени ионности связи,
поскольку связи не бывают ионными на
100%. Даже в соединении CsF связь ионная
только на 89%.
Если
рассматривать соединения элементов
какого-либо периода с одним и тем же
элементом, то по мере передвижения от
начала к концу периода преимущественно
ионный характер связи сменяется на
ковалентный. Например, у фторидов 2-го
периода LiF, BeF2, CF4, NF3,
OF2, F2степень ионности связи
от фторида лития постепенно ослабевает
и заменяется типично ковалентной связью
в молекуле фтора.
Электроотрицательность серы значительно
меньше, чем ЭО кислорода. Поэтому
полярность связи H –S в H2S меньше
полярности связи Н–О в Н2О, а длина
связи H–S (0,133 нм) больше, чем Н–О (0,56 нм)
и угол между связями приближается к
прямому. Для H2S он составляет 92о,
а для H2Se – 91o.
По этим же
причинам молекула аммиака имеет
пирамидальное строение и угол между
валентными связями H–N–H больше прямого
(107,3о). При переходе от NH3к
PH3, AsH3и SbH3углы между
связями составляют соответственно
93,3о; 91,8ои 91,3о.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
12.02.20151.51 Mб20POSOBIE_DLQ_PODGOTOVKI_K_EKZAMENU.rtf
- #
12.02.20153.69 Mб1918Posobie_dlya_10kl_gl_var.doc
- #
- #
- #
- #
- #
- #
- #