Электропроводность (ОФС.1.2.1.0020.15)
Государственная фармакопея 13 издание (ГФ XIII)
Электропроводность является мерой способности среды проводить электрический ток. Ток, текущий через проводник, прямо пропорционален приложенной электродвижущей силе и обратно пропорционален сопротивлению проводника.
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
ОФС.1.2.1.0020.15 Электропроводность
ОФС вводится впервые
Электропроводность является мерой способности среды проводить электрический ток. Ток, текущий через проводник, прямо пропорционален приложенной электродвижущей силе и обратно пропорционален сопротивлению проводника. Электропроводность характеризуется величиной удельного объемного сопротивления, которая равняется сопротивлению кубического объёма среды с ребром в 1 см. Электропроводность по определению является величиной, обратной сопротивлению. Единицей сопротивления в международной системе СИ является Ом·м, на практике обычно выражается в Ом·см. Единицей электропроводности в международной системе СИ является См·м-1 (сименс·м-1) На практике электропроводность раствора выражается в См·см-1 или в мкСм·см-1.
Аппаратура
Используемая аппаратура (кондуктометр) служит для измерения сопротивления столба жидкости между электродами, погруженными в раствор (ячейка электропроводности). Ячейка электропроводности представляет собой сосуд с двумя параллельно расположенными платиновыми электродами, покрытыми платиновой чернью. Оба электрода обычно впаяны в стеклянную трубку. Могут быть использованы другие типы электродов. При измерении сопротивления используют переменный ток, чтобы избежать влияния поляризации электрода.
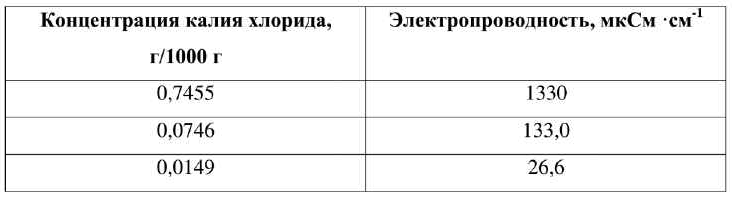
Электропроводность растворов существенно зависит от температуры. Если нет других указаний, измерения обычно проводят при температуре 20 °С. В таблице приведены значения электропроводности растворов калия хлорида при 20 °С.
Таблица. Электропроводность растворов калия хлорида при 20 °С
Аппаратура снабжена термометром и температурным компенсатором.
Методика 1. Определение постоянной ячейки
Ячейку электропроводности выбирают таким образом, чтобы она соответствовала электропроводности испытуемого раствора. Чем больше ожидаемая электропроводность, тем более высокое значение постоянной ячейки должно быть выбрано (низкое сопротивление). Обычно используемые ячейки электропроводности имеют константы порядка 0,1, 1 и 10 см-1. Для определения постоянной ячейки используют сертифицированные стандартные растворы (например, раствор калия хлорида), которые готовят в воде, свободной от диоксида углерода. Для ячеек, имеющих постоянную около 0,1 см-1, могут использоваться другие сертифицированные стандарты.
Ячейку электропроводности несколько раз промывают водой, свободной от диоксида углерода, и 2 раза стандартным раствором, используемым для определения постоянной ячейки. Измерение сопротивления ячейки электропроводности проводят при температуре (20 + 0,1) °С. Постоянная ячейки K (в см-1) определяется уравнением:
K = R ∙ kст,
где R — измеренное сопротивление стандартного раствора, мегаОм (МОм);
kст — электропроводность используемого стандартного раствора, мкСм ∙ см-1.
Если определение постоянной ячейки проводят при температуре, которая отличается от 20 °С, например для области температур от 15 до 25 °С, исправленное значение электропроводности для этой температуры может быть вычислено по уравнению:
kT = k20 ͦС ∙ [1+ 0,021(T – 20)] ,
где kT — величина электропроводности при температуре, установленной при калибровке в соответствии с фармакопейной статьей;
k20 ͦС — величина электропроводности стандартного раствора при 20 °С;
T — температура, установленная при калибровке в соответствии с фармакопейной статьей, °С;
0,021 — температурный коэффициент для электропроводности стандартного раствора калия хлорида.
После калибровки аппаратуры сертифицированным стандартным раствором ячейку электропроводности несколько раз промывают водой, свободной от углекислого газа, и по крайней мере два раза — испытуемым раствором. Проводят последовательные измерения, как указано в фармакопейной статье.
При калибровке ячейки определяют постоянную ячейки /С = = 1/5. Для этого измеряют сопротивление стандартного раствора хлорида калия, удельная электропроводность которого известна. Удельные электропроводности стандартных растворов хлорида калия при различных температурах приведены в табл. 2.1 [c.96]
Определение постоянной электролитической ячейки. В ка честве стандартного раствора для определения постоянной электролитической ячейки используют раствор хлорида калия разной концентрации, насыщенный раствор хлорида натрия или сульфата кальция, приготовленные на бидистилляте. Удельные электропроводности этих растворов при различных температурах определены с большой точностью и приведены в справочных таблицах. Постоянную ячейки типа Х38, предназначенную для определения малой удельной электропроводности растворов, рекомендуется устанавливать по Хст и Rx, -i 0,001 н. раствора КС1. Для ячеек других конструкций стандартный раствор указывается в соответствующей лабораторной работе. [c.102]
II. Используем постоянную ячейки для определения неизвестной электрической проводимости так как [c.270]
Постоянная ячейки Кяч определяется по измерению сопротивления ячейки, содержащей раствор с известной электропроводностью. Удельные электропроводности некоторых стандартных растворов были тщательно измерены. [c.344]
По табличным значениям эквивалентной электронроводности и уравнению (1.6.) для кондуктометрического детектора с известной постоянной ячейки можно вычислить электропроводность различных растворов с заданной концентрацией. Предельные значения эквивалентной электронроводности некоторых часто встречающихся на практике попов приведены в табл. 1.3. Эквивалентная электропроводность ионов обычно снижается с увеличением их концентрации вследствие межионных взаимодействий. Для разбавленных растворов (10″ -10″ н.) эквивалентная электропроводность мало отличается от значений, приведенных в табл. 1.3. [c.9]
Отношение Ijs представляет собой постоянную ячейки, которую можно вычислить, зная эти величины. Для ячеек неодинаковой формы и с непостоянным расстоянием между электродами константу ячейки можно установить, измеряя сопротивление растворов в ней с известными удельными электропроводностями (табл. 19). В качестве таких растворов применяют 0,1-н. или 1-н. КС1. Исследуемый электролит заливают в сосуд для определения электропроводности. Конструкция подобных сосудов может быть самой разнообразной (рис. 14) важно лишь, чтобы электроды в них были укреплены неподвижно. [c.130]
Для определения постоянной ячейки ее заполнили прн 20 С 0,1000 М раствором хлорида калия. Сопротивление стало 324,2 ом. После заполнения ячейки 0,050 н. раствором серной кислоты оно оказалось 1305,5 ом. [c.152]
Подставив значения ео = 8,854 пФ/м и Св = 51 пФ и произведя расчет, получают значение К — постоянной ячейки ЭЖ-1 [c.133]
Приводят эквивалентные электрические проводимости при бесконечном разбавлении, величину постоянной ячейки, результаты оценки погрешности, дают схему ячейки и моста для кондуктомет рических измерений. [c.72]
Критерий применимости и постоянная -ячейки [c.123]
Величину Сй можно назвать постоянной ячейки без диафрагмы. Очевидно, что величина С , измеренная в любом растворе, будет одинаковой так же, как и Су- Например, для контрольного раствора [c.217]
Как следует из уравнения (2.48), для вычисления удельной электропроводности необходимо знать величину 1/з, называемую постоянной ячейки. Постоянную ячейки нельзя найти путем непосредственного измерения длины сосуда и площади его поперечного сечения. Поэтому ее определяют опытным путем, используя раствор с точно известной удельной электропроводностью. Чаще всего для этой цели используют растворы хлорида калия. [c.94]
Вычислить растворимость н произведение растворимости хлорида серебра, если постоянная ячейки 0,18 0,02 см . Рассчита 1ь точность определения и найти величину, дающую наибольшую ошибку. [c.154]
Постоянная ячейки К выражается соотношением [c.9]
В качестве нуль-инструмента можно использовать анализатор напряжения со стрелочным индикатором. Для компенсации возможной емкостной составляющей в схему моста включается переменная емкость. Постоянную ячейки рассчитывают из данных для электропроводности расплавленных хлоридов калия и лития. Она меняется в интервале 620—820° С от 33,4 до 32,15. [c.133]
Постоянная ячейки А может зависеть также от глубины погружения электрода, вследствие чего электрод необходимо погружать достаточно глубоко, чтобы этой зависимостью можно было пренебречь. Во многих современных кондуктометрах электроды сконструированы так, что постоянная А равна просто 1 см либо измерительный прибор содержит компенсирующее [c.127]
Удельную электропроводность можно вычислить из электропроводности, если известны параметры ячейки (уравнение 1.2.). Однако на практике измеряют проводимость разбавленного раствора с известной удельной электропроводностью (папример, 0.00100 п. КС1) п вычисляют постоянную ячейки по уравпепию 1.4. Если постоянная ячейки известна, то измерив G, можно рассчитать удельную электропроводность других растворов. [c.9]
Имея подходящий кристалл и изучив свойства его элементарной ячейки с помощью пленочных методов, можно затем измерить интенсивности, укрепив кристалл в дифрактометре таким образом, чтобы была известна ориентация обратной решетки относительно геометрии дифрактометра. В этом случае ЭВМ будет знать, где находится каждое отражение hkl. На схеме типичного гониометра дифрактометра (рис. 17.24) показан диапазон движений при координировании дифрактометра и кристалла. На самом деле не слишком трудно установить кристалл вручную. Установку можно также осуществить, направляя беспорядочные отражения на дифрактометр и используя автоиндексирующую программу (описанную ранее). Этот метод находит все большее применение. Как только в счетчике зарегистрированы три отражения за счет подгонки углов х, Ф, ш и 20 при условии, что они корректно индексированы ( — кфк и т.д.), ЭВМ может рассчитать матрицу ориентаций (и постоянные ячейки) из этих данных ЭВМ может определить углы дифрактометра, соответствующие любым значениям h, к и I. Естествен- [c.396]
Постоянная ячейки в интервале температур от 90 до 100°С практически не менялась и была равна 93,5. [c.216]
Измерительная ячейка представляет собой и-образную трубку, в нижней горизонтальной части которой расположены введенные на шлифах через отверстия платиновые электроды. Электроды имеют поверхность по 0,42 см” каждый и находятся на расстоянии 1 —1,3 см друг от друга. Постоянная ячейки 2,21 сж . Одна из сторон трубки имеет на 3 см выше нижнего сгиба третий боковой отвод с горловиной, имеющей шлиф для заполнения ячейки. К этой горловине сверху присоединен боковой [c.64]
Если поперечное сечение ячейки а неодинаково, но известна его зависимость от расстояния до одного из электродов, то постоянная ячейки вычисляется по уравнению [c.140]
При кондуктометрическом титровании измеряют электропроводность раствора. В титровальном сосуде находится электролитическая ячейка, состоящая из двух электродов, величину электрического сопротивления между которыми и измеряют в ходе титрования. Электролитическая ячейка характеризуется некоторой постоянной величиной, выражающей собой отношение усредненной длины путей движения ионов между электродами к площади электродов. Постоянную ячейки обычно определяют опытным путем при помощи образцового раствора известной концентрации, для которого известно значение удельной электропроводности Яо при различных значениях температуры. В качестве стандартных растворов обычно применяют водный раствор КС1. Заполнив электролитическую ячейку образцовым раствором, измеряют ее электрическое сопротивление (R) и определяют постоянную (С) из соотношения =7 Xq. [c.136]
Зная постоянную ячейки и измерив сопротивление между электродами, можно установить концентрацию раствора, находящегося в ячейке. [c.136]
Было обнаружено, что постоянная ячейки для каждой марки ионита различна и почти не зависит от его ионной формы (табл. Г). [c.43]
Значения постоянной ячейки с ионитами различного типа [c.43]
Измерение сопротивления производится при помощи мостика Уитстона. Для измерения сопротивления электролитов служат Измерительные ячейки с двумя электродами. Постоянная ячейки определяется соотношением [c.478]
Постоянную ячейки вычисляют по формуле [c.195]
N9 опыт Концентрация раствора Измеренное R, Ом ср Удел ьная электропроводность раствора Постоянная ячейки К п [c.97]
Рассчитать гюстоянную ячейки Измерить постоянную ячейки при 18 и 20° С. Объяснить причины изменения постоянной ячейки при изменении температуры. [c.97]
В зависимости от конструктивных деталей применяемого моста измерения и подсчет Rx, i повторяют при разном сопротивлении R (см. рис. 22) или непосредственно отсчитывают 7 , , ст 3—4 раза. Из отдельных отличающихся друг от друга не более чем на ,5% значении Rx, – вычисляют среднее арифметическое значение Rx, t, а по нему К- Если после измерений расстояние между электродами и поверхностный слой платиновой черни нарушаются, вновь устанавливают постоянную ячейки. Если для определения постоянной ячейки используют стандартные растворы с малой концентрацией, то в расчете учитывают сопротивление воды поды- Тогда [c.103]
Сопротивление воды п постоянную ячейки К ввиду того, что платиновая чернь адсорбирует электролиты, рекомендуется измерять с гладкими платиновыми иеплатииироваипыми электродами. Параллельные измерения Нх не должны расходиться более чем на I 7о [c.104]
Выполнение работы. 1. Собрать установку для кондуктометрических измерений (см. рис. 22). Определить постоянную ячейки (см, 8), 2, Приготовить на бидистилляте 0,05 и. водный раствор слабого электролита кислоты муравьиной, уксусной, хлоруксусной, дихлоруксусной, бензойной, янтарной гидроокиси аммония или какого-либо амина. Путем последовательных разбавлений исходного 0,05 и. раствора получать серию из восьми растворов концентрации (г-экв/л) 0,05 0,025 0,01 0,008 0,006 0,004 0,002 0,001. 3. Измерить сопротивление объема раствора электролитов в порядке возрастания концентраций. Перед измерениями сосуд и электроды тщательно промыть дистиллированной водой и наиболее разбавленным раствором. [c.110]
I Нориальность, если со-1 противление в ячейке 33,4 0,1 . а постоянная ячейки 23,6 ом [c.149]
Постоянная ячейки определялась по раствору хлористого калия, который доводился до 0,1-н. концентрации при различных температурах. Удельные электропроводности этого раствора, взятые из Iniernaiional riti al Tables (том VI, стр. 234), имеют следующие значения [c.216]
Ячейку заполняют раствором хлористого калия и определяют электропроводность ( ). Из таблиц находят удельную электропроводность (х) раствора хлористого калия (для 0,1М раствора при 15° С х= 1.066 10 2, при 20° С х=1Д6б-10 2). Если нужно определить электропроводность при промежуточной температуре, производят интерполяцию. Найденное значение постоянной ячейки используют при всех дальнейших работах с данной ячейкой. [c.194]
Кинетика гетерогенных процессов (1976) — [
c.316
]
Биосенсоры основы и приложения (1991) — [
c.352
]
В растворах электролитов
перенос электричества осуществляется
за счет перемещения ионов. Для
количественной характеристики способности
растворов проводить электрический ток
при приложении электрического напряжения
используется электрическая проводимость
(удельная и молярная).
Удельная
электрическая проводимость
раствора электролита – это электрическая
проводимость раствора, заключенного
между двумя плоскими электродами,
площадью 1 м2
каждый, расположенными параллельно на
расстоянии 1 м друг от друга. Требования
к электродам (плоские, параллельно
расположенные) вытекают из необходимости
создания однородного электрического
поля.
Удельная
электрическая проводимость
æ является величиной, обратной удельному
электрическому сопротивлению :
|
æ |
(2.1) |
Удельное
электрическое сопротивление
определяется из уравнения:
|
|
(2.2) |
где
R
– электрическое сопротивление, Ом;
–
расстояние между электродами, м;
S
– эффективное поперечное сечение
раствора электролита, заключенного
между электродами, м2.
Единица
измерения удельного электрического
сопротивления – Омм.
Следовательно, удельная электрическая
проводимость æ выражается в Ом-1м-1
или в См/м (сименс на метр).
Экспериментальное
определение электрической проводимости
растворов основано на измерении
сопротивления кондуктометрической
ячейки с платиновыми электродами и
исследуемым раствором. Для любой ячейки
можно определить константу k,
которая называется постоянной
кондуктометрической ячейки,
и рассчитать удельную электрическую
проводимость раствора по уравнению:
|
|
(2.3) |
где
k
– постоянная кондуктометрической
ячейки, м–1;
R
– измеренное сопротивление ячейки с
раствором, Ом.
Постоянную
кондуктометрической ячейки k
выражают в м-1
и определяют по раствору, удельная
электрическая проводимость которого
известна (обычно используют раствор
хлорида калия).
Удельная электрическая
проводимость зависит от переносимого
каждым ионом заряда, концентрации ионов,
скорости их перемещения (см. формулу
(2.10)). Последнее затрудняет сравнение
различных электролитов по их электрической
проводимости. Поэтому чаще пользуются
молярной электрической проводимостью.
Молярная
электрическая проводимость
– это проводимость раствора электролита,
содержащего 1 моль растворенного вещества
и находящегося между двумя плоскими
электродами, расположенными параллельно
на расстоянии 1 м друг от друга.
Молярная
и удельная электрические проводимости
связаны между собой уравнением:
|
|
(2.4) |
где
c
– молярная концентрация электролита,
моль/м3.
Молярную
электрическую проводимость измеряют
в
Ом-1м2моль-1
или Смм2/моль.
Такую
величину как эквивалентная электрическая
проводимость в настоящее время применять
не рекомендуется.
Молярная
электрическая проводимость возрастает
с уменьшением концентрации раствора
электролита, достигая максимального
значения
при
разбавлении. Поскольку в предельно
разбавленном растворе взаимодействие
между ионами отсутствует, можно считать,
что каждый ион движется независимо от
других ионов и, следовательно, с
максимальной скоростью.
В
условиях предельного разбавления
электролитов выполняется закон
Кольрауша:
|
|
(2.5) |
где
и
– молярные электрические проводимости
соответственно катиона и аниона при
бесконечном разбавлении.
Перемещение
иона в электрическом поле характеризуют
величиной электрической
подвижности ui,
равной скорости движения иона в
электрическом поле υi,
деленной на напряженность этого
электрического поля E:
|
ui |
(2.6) |
Если
скорость движения иона υi
выражается в м/с, а напряженность
электрического поля E
– в В/м, то единицей измерения электрической
подвижности ui
будет м2/(Вс).
Другой
величиной, часто используемой при
рассмотрении растворов электролитов,
является число
переноса t,
представляющее собой долю общего
количества электричества, переносимую
ионами данного вида:
|
|
(2.7) |
где
qi
– количество электричества, переносимого
i-ми
ионами, Кл;
q
– количество электричества, переносимого
всеми ионами, Кл.
Числа
переноса ионов связаны с электрическими
подвижностями ионов следующими
соотношениями:
|
|
(2.8.1) |
|
|
(2.8.2) |
где
u+
и u–
– электрические подвижности катиона
и аниона соответственно; t+
и t–
– числа переноса соответственно катиона
и аниона.
Алгебраическое
суммирование уравнений (2.8.1) и (2.8.2) дает
следующую очевидную формулу:
|
|
(2.9) |
Связь
между удельной электрической проводимостью
æ и электрическими подвижностями ионов
ui
выражается уравнением:
|
|
(2.10) |
где
F
= 96485 Кл/моль – постоянная Фарадея;
zi
– зарядовое число иона
i-го
вида;
сi
– молярная концентрация i-х
ионов, моль/м3;
ui
– электрическая подвижность i-го
иона, м2/(Вс);
α
– степень диссоциации электролита;
c
– молярная концентрация электролита,
моль/м3;
i
– число ионов i-го
вида в формульной единице электролита.
Для
слабых электролитов используется
понятие степени диссоциации .
При диссоциации слабого 1,1-зарядного
электролита:
КА
К+
+ А–
степень
диссоциации
определяется формулой:
|
|
(2.11) |
где
[К+]
и [А–]
– равновесная молярная концентрация
катионов и анионов соответственно,
моль/л; с
– молярная концентрация электролита,
моль/л.
Константа
диссоциации Кдис
электролита КА выражается по закону
действующих масс уравнением:
|
|
(2.12) |
где
[КА] – равновесная молярная концентрация
недиссоциированных молекул электролита,
моль/л.
Выразим
молярные концентрации ионов К+
и А–
и недиссоциированных молекул КА через
степень диссоциации ,
используя формулу (2.11) и уравнение
материального баланса (2.15):
|
[К+] |
(2.13) |
|
[А–] |
(2.14) |
|
[КА] |
(2.15) |
Подставив
выражения (2.13) – (2.15) в уравнение (2.12),
получим закон
разведения Оствальда:
|
|
(2.16) |
Степень
диссоциации
слабого электролита в разбавленном
растворе можно также выразить через
молярную электрическую проводимость
:
|
|
(2.17) |
где
– молярная электрическая проводимость
при данной концентрации, Смм2/моль;
– молярная электрическая проводимость
при бесконечном разведении, Смм2/моль.
Подстановка
выражения (2.17) в уравнение (2.16) приводит
к следующему соотношению:
|
|
(2.18) |
Используя
формулу (2.4), приведем выражение (2.18) к
следующему виду:
|
|
(2.19) |
Уравнение
(2.19) используется для определения Кдис
и
по экспериментальным данным о зависимости
электропроводности от концентрации
электролита. При этом Кдис
определяется по тангенсу угла наклона
прямой, построенной в координатах
,
к оси абсцисс, а
находят по величине отрезка, отсекаемого
данной прямой на оси ординат.
Задание
2
Определите
графически константу кислотности Кк
слабой кислоты по данным о зависимости
электрического сопротивления ее водных
растворов от разведения V
при 25 С,
представленным в табл.2. Постоянная
кондуктометрической ячейки k
= 50 м–1.
Таблица
2. Исходные данные к заданию 2.
|
№ вар |
Кислота |
Формула |
Электрическое при |
|||||
|
32 |
64 |
128 |
256 |
512 |
1024 |
|||
|
1 |
Синильная |
HCN |
235330 |
332818 |
470698 |
665711 |
941545 |
1331721 |
|
2 |
Азотистая |
HNO2 |
316 |
459 |
673 |
1003 |
1527 |
2389 |
|
3 |
Фторо-водородная |
HF |
292 |
426 |
628 |
942 |
1447 |
2293 |
|
4 |
Йодная |
HIO4 |
70 |
116 |
201 |
364 |
683 |
1319 |
|
5 |
Муравьиная |
HCOOH |
546 |
784 |
1133 |
1653 |
2443 |
3673 |
|
6 |
Уксусная |
CH3COOH |
1750 |
2487 |
3541 |
5058 |
7252 |
10459 |
|
7 |
Пропионовая |
C2H5COOH |
2025 |
2877 |
4093 |
5838 |
8357 |
12023 |
|
8 |
Масляная |
C3H7COOH |
1925 |
2735 |
3893 |
5556 |
7959 |
11462 |
|
9 |
Изомасляная |
C3H7COOH |
1989 |
2825 |
4020 |
5736 |
8214 |
11822 |
|
10 |
Валериановая |
C4H9COOH |
1991 |
2828 |
4024 |
5742 |
8223 |
11838 |
|
11 |
Фторуксусная |
CH2FCOOH |
162 |
243 |
374 |
592 |
974 |
1676 |
|
12 |
Хлоруксусная |
CH2ClCOOH |
217 |
321 |
482 |
741 |
1175 |
1939 |
|
13 |
Дихлор-уксусная |
CHCl2COOH |
66 |
111 |
197 |
365 |
697 |
1357 |
|
14 |
Трихлор-уксусная |
CCl3COOH |
47 |
89 |
172 |
338 |
669 |
1332 |
|
15 |
Йодуксусная |
CH2ICOOH |
301 |
439 |
648 |
973 |
1495 |
2370 |
|
16 |
Циан-уксусная |
CH2CNCOOH |
146 |
220 |
342 |
549 |
918 |
1608 |
|
17 |
Фенил-уксусная |
C6H5CH2CO-OH |
1087 |
1550 |
2218 |
3188 |
4613 |
6740 |
|
18 |
Бензойная |
C6H5COOH |
954 |
1362 |
1951 |
2811 |
4081 |
5989 |
|
19 |
Салициловая |
HOC6H4CO-OH |
254 |
372 |
554 |
843 |
1317 |
2134 |
|
20 |
Пикриновая |
(NO2)3C6H2-OH |
48 |
90 |
175 |
343 |
680 |
1354 |
|
21 |
Синильная |
HCN |
235330 |
332818 |
470698 |
665711 |
941545 |
1331721 |
|
22 |
Азотистая |
HNO2 |
316 |
459 |
673 |
1003 |
1527 |
2389 |
|
23 |
Фторо-водородная |
HF |
292 |
426 |
628 |
942 |
1447 |
2293 |
|
24 |
Йодная |
HIO4 |
70 |
116 |
201 |
364 |
683 |
1319 |
|
25 |
Пропионовая |
C2H5COOH |
2025 |
2877 |
4093 |
5838 |
8357 |
12023 |
|
26 |
Масляная |
C3H7COOH |
1925 |
2735 |
3893 |
5556 |
7959 |
11462 |
|
27 |
Изомасляная |
C3H7COOH |
1989 |
2825 |
4020 |
5736 |
8214 |
11822 |
|
28 |
Валериановая |
C4H9COOH |
1991 |
2828 |
4024 |
5742 |
8223 |
11838 |
Рассмотрим решение
задания 2 на примере.
Соседние файлы в предмете Физическая химия
- #
- #
- #
- #
- #
- #
- #
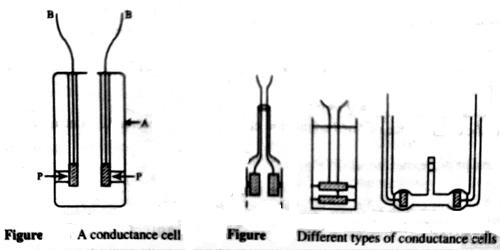
Conductance Cell: Cell Constant
A conductance cell is a devise to measure the conductance of electrolytic solutions. Different forms of cells are in use for conductance measurement. A cell which is commonly used is shown in Figure 1. The container is a glass vessel, A, which carries two thick Platonized platinum (fine particles of platinum, black in color, deposited on the platinum foil electrolytically) foils, PP, securely fixed so that their distances are not altered. Two metallic wires, BB, sealed to the platinum foils and protected by glass tubes serve as the leads for connecting to the measuring bridge. Several other forms of cells are shown in Figure 2.
It is known from equation (Conductance of Electrolytic Solutions) that the resistance of a conductor is given by
R = ρ x (l//a)
In the case of conductance cell ‘l’ is the distance between the two electrodes and a is the area of cross-section of the electrodes, as the resistance of the column of solution between the two electrodes is measured. For a particular cell (l/a), known as cell constant, is a constant. As the dimension of the electrodes and the distance between them can hardly be measured accurately the usual practice is to determine the cell constant by measuring the conductance of a solution whose specific conductance is accurately known at a particular temperature. Standard solutions of KCl are used for the purpose. The specific conductance of any solution may then be obtained from the equation (Conductance of Electrolytic Solutions).
Specific conductance = Observed conductance x cell constant.
Постоянная ячейки с учетом проводимости и проводимости Калькулятор
| Search | ||
| Дом | Химия ↺ | |
| Химия | Электрохимия ↺ | |
| Электрохимия | Электропроводность и проводимость ↺ |
|
✖Удельная проводимость – это способность вещества проводить электрический ток. Это величина, обратная удельному сопротивлению.ⓘ Удельная проводимость [K] |
+10% -10% |
||
|
✖Проводимость (также известная как электрическая проводимость) определяется как способность вещества проводить электричество.ⓘ Проводимость [G] |
+10% -10% |
|
✖Константа ячейки в электролитическом проводнике представляет собой отношение расстояния между электродами к площади поперечного сечения электрода.ⓘ Постоянная ячейки с учетом проводимости и проводимости [b] |
⎘ копия |
Постоянная ячейки с учетом проводимости и проводимости Решение
ШАГ 0: Сводка предварительного расчета
ШАГ 1. Преобразование входов в базовый блок
Удельная проводимость: 4 Сименс/ метр –> 4 Сименс/ метр Конверсия не требуется
Проводимость: 50 сименс –> 50 Сименс (Проверьте преобразование здесь)
ШАГ 2: Оцените формулу
ШАГ 3: Преобразуйте результат в единицу вывода
0.08 диоптрия –>0.08 1 на метр (Проверьте преобразование здесь)
20 Электропроводность и проводимость Калькуляторы
Постоянная ячейки с учетом проводимости и проводимости формула
Постоянная ячейки = (Удельная проводимость/Проводимость)
b = (K/G)
Что такое удельная проводимость?
Удельная проводимость – это способность вещества проводить электричество. Это величина, обратная удельному сопротивлению. Удельная проводимость определяется как проводящая способность раствора растворенного электролита, и весь раствор помещается между двумя электродами размером 1 кв. См и длиной 1 см.