Электро́дный
потенциа́л —
разность электрических
потенциалов между электродом и
находящимся с ним в контакте электролитом (чаще
всего между металлом и
раствором электролита).
Возникновение
электродного потенциала обусловлено
переносом заряженных частиц через
границу раздела фаз,
специфической адсорбцией ионов,
а при наличии полярных молекул (в
том числе молекул растворителя) —
ориентационной адсорбцией их. Величина
электродного потенциала в неравновесном
состоянии зависит как от природы и
состава контактирующих фаз, так и от
кинетических закономерностей электродных
реакций на границе раздела фаз.
Равновесное
значение скачка потенциалов на границе
раздела электрод/раствор определяется
исключительно особенностями электродной
реакции и не зависит от природы электрода
и адсорбции на нём поверхностно-активных
веществ. Эту абсолютную разность
потенциалов между
точками, находящимися в двух разных
фазах, нельзя измерить экспериментально
или рассчитать теоретически.
45. Электродный потенциал. Уравнение Нернста.
Электро́дный
потенциа́л —
разность электрических
потенциалов между электродом и
находящимся с ним в контакте электролитом (чаще
всего между металлом и
раствором электролита).
Вывод
уравнения Нернста
![]() ,
,
где
E —
электродный потенциал, E0 —
стандартный электродный потенциал,
измеряется в вольтах;
R — универсальная
газовая постоянная, равная 8.31 Дж/(моль·K);
T —
абсолютная температура;
F — постоянная
Фарадея, равная 96485,35 Кл·моль−1;
т —
число моль электронов, участвующих
в процессе;
![]() и
и ![]() — активности соответственно окисленной
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если
в формулу Нернста подставить числовые
значения констант R и F и
перейти от натуральных
логарифмов к десятичным, то
при ![]() получим
получим
![]()
46. Газовые электроды. Уравнение Нернста для расчета потенциалов газовых электродов
Газовые
электроды состоят из проводника 1-го
рода, контактирующего одновременно с
газом и раствором, содержащим ионы
этого газа. Проводник 1-го рода служит
для подвода и отвода электронов и, кроме
того, является катализатором электродной
реакции (ускоряет установление равновесия
на электроде). Проводник 1-го рода не
должен посылать в раствор собственные
ионы. Лучше всего удовлетворяют этому
условию платина и платиновые металлы,
поэтому они чаще всего используются
при создании газовых электродов. Так
как в равновесных электродных реакциях
газовых электродов участвуют газообразные
компоненты, то электродные потенциалы
этих электродов зависят от парциальных
давлений газов. Это можно показать на
примерах водородного и кислородного
электродов. Равновесие на водородном
электроде выражается уравнением
2Н++3е↔Н2.
Уравнение для расчетов потенциалов
водородного электрода можно вывести
так же, как было введено уравнение для
расчета потенциала металлического
электрода. Оно имеет вид:
 =
=
 или для 298 К
или для 298 К lg
lg
47. Гальванический элемент. Расчет эдс гальванического элемента.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ-
химический источник тока, в котором
лектрическаяэнергиявырабатывается
в результате прямого преобразования
химической энергии окислительно-восстановительной
реакцией. В состав гальванического
элемента входят два разнородных
электрода (один-
содержащий окислитель, другой –
восстановитель), контактирующие с
электролитом. Различают гальванические
элементы одноразового использования
(т. н. первичные элементы, напр.Лекланше
элемент), многоразового действия
(электрические аккумуляторы) и с
непрерывной подачей реагентов (топливные
элементы). Ранеетермин”гальванический
элемент” относился только к первичным
элементам.
ЭДС
гальванического элемента определяется
как
разность
электродных
потенциалов.
По
уравнению НЕРНСТА
![]()
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Потенциал электрода E в химии и электрохимии, согласно определению, представляет собой электродвижущую силу ячейки, построенной из двух электродов.
На границе раздела между электродом и электролитом из-за процесса переноса заряженных частиц возникает электродный потенциал, связанный с удельной адсорбцией ионов и ориентацией полярных молекул, в том числе растворителя.
Электродный потенциал представляет собой электрический потенциал на электродном компоненте. В ячейке имеется электродный потенциал для катода и электродный потенциал для анода. Разность между электродными потенциалами катода и анода будет равна потенциалу ячейки:
E ячейки = E катода – E анода
Таким образом потенциал электрода зависит от характера и состава контактных фаз и от кинетики электродных реакций на границе раздела.
Разность потенциалов зависит от конкретных веществ, составляющих электроды. Для любой электрической ячейки общий потенциал представляет собой сумму сумм, вырабатываемых реакциями на двух электродах.
Электрохимический ряд напряжений металлов
На практике были измерены напряжения большого числа электродов, подключая их в ячейку со стандартным водородным электродом, который представляет собой газообразный водород при 1 атмосфере, барботирующий поверх платиновой проволоки, погруженной в 1 М раствор (вод.). Этот стандартный электрод произвольно был назначен в качестве обладателя потенциала в 0 вольт (он был взят за отправную точку шкалы), а измерение ЭДС всей ячейки позволяет определить потенциал другого, изучаемого электрода. В таблице 1 приведены некоторые стандартные потенциалы для электродов, при которых происходит измерение.
Значения данных стандартных электродных потенциалов измерены для следующих условий:
Температура 298,15 К (25,00°С, 77,00°F).
Эффективная концентрация 1 моль/л.
Парциальное давление 101,325 кПа (абсолютное) (1 атм, 1,01325 бар) для каждого газообразного реагента. Данное давление считается традиционным для подобного рода.
Таблица электродных потенциалов
| Е, В | Полуреакция |
|---|---|
| 2.87 | F2(г) + 2 e- → 2F(ж) |
| 1.36 | Cl2(г) + 2 e→2Cl (ж) |
| 1.20 | Pt2+(ж) + 2 e→ Pt(тв) |
| 0.92 | Hg2+(ж) + 2 e→Hg(I) |
| 0.53 | I2(тв) + 2 е→ 2I(ж) |
| 0.34 | Cu2+(ж) + 2 e→Cu(тв) |
| 0 | 2H+(ж) + 2 e → H2(г) |
| -0.13 | Pb2+(ж) + 2e → Pb(тв) |
| -0.26 | Ni2+(ж) + 2 e → Ni(тв)2 |
| -0.44 | Fe2+(ж) + 2 e→Fe(тв) |
| -0.76 | Zn2+(ж) + 2 e→Zn(тв) |
| -1.66 | Al3+(ж) + 3 e→Al(тв) |
| -2.71 | Na+(ж) + e→Na(тв) |
| -2.87 | Ca2+(ж) + 2 e→Ca(тв) |
| -2.91 | K+(ж) + e→K(тв) |
| -3.04 | Li+(ж) + e→Li(тв) |
В середине списка вы увидите 0 вольт – произвольно назначенный за стандартный водородный электрод; все остальные потенциалы относительны к полуреакции водорода.
Уравнение Нернста
В электрохимии уравнение Нернста представляет собой уравнение, которое связывает восстановительный потенциал электрохимической реакции (полуреакции) со стандартным электродным потенциалом, температурой и активностью (часто аппроксимируемыми концентрациями) химических веществ, подвергающихся восстановлению и окислению. Это самое важное уравнение в области электрохимии. Оно было названо в честь Вальтера Нернста, немецкого физика и химика, который сформулировал уравнение:
Е=Е0+RTnFln(a)Е=Е^0 + frac{RT}{nF} ln(a),
где EE – электродный потенциал (В);
E0E^0 – нормальный (стандартный) электродный потенциал (В);
RR – универсальная газовая постоянная равная 8,313 Дж/К · моль;
ТТ – температура (по шкале Кельвина);
nn – заряд иона;
FF – постоянная Фарадея 96500 Кл/моль;
aa – активность ионов.
Чтобы упростить расчет вместо активности ионов можно использовать концентрацию:
Е=Е0+RTnFln(C)Е=Е^0+frac{RT}{nF} ln(C).
Тест по теме «Электродные потенциалы»
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 августа 2020 года; проверки требуют 3 правки.
У этого термина существуют и другие значения, см. Потенциал.
Электро́дный потенциа́л — ЭДС электрода, составленного из данного элемента и стандартного водородного электрода, электродный потенциал которого принят равным нулю. При этом знак электродного потенциала считают отрицательным, если в таком гальваническом элементе испытуемый электрод является катодом, и положительным, если испытуемый электрод является анодом. Иногда электродный потенциал определяют как «разность потенциалов на границе электрод — раствор», то есть считают его тождественным потенциалу ЭДС, что не вполне правильно (хотя эти величины взаимосвязаны).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Измерение потенциалов[править | править код]
Практическое значение имеют относительные электродные потенциалы, обычно называемые просто электродные потенциалы, представляющие собой разность электродных потенциалов рассматриваемого электрода и электрода сравнения — чаще всего нормального водородного электрода, электродный потенциал которого условно принимается равным нулю (для водных систем).
Способы устранения омической составляющей при измерении[править | править код]
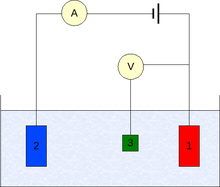
- Компенсационная схема
- Трёхэлектродная схема
См. также[править | править код]
- Стандартный электродный потенциал
From Wikipedia, the free encyclopedia
In electrochemistry, electrode potential is the electromotive force of a galvanic cell built from a standard reference electrode and another electrode to be characterized.[1] By convention, the reference electrode is the standard hydrogen electrode (SHE). It is defined to have a potential of zero volts. It may also be defined as the potential difference between the charged metallic rods and salt solution.
The electrode potential has its origin in the potential difference developed at the interface between the electrode and the electrolyte. It is common, for instance, to speak of the electrode potential of the M+/M redox couple.
Origin and interpretation[edit]
Electrode potential appears at the interface between an electrode and electrolyte due to the transfer of charged species across the interface, specific adsorption of ions at the interface, and specific adsorption/orientation of polar molecules, including those of the solvent.
In an electrochemical cell, the cathode and the anode have a certain electrode potential independently and the difference between them is the cell potential:
The electrode potential may be either that at equilibrium at the working electrode (“reversible potential”), or a potential with a non-zero net reaction on the working electrode but zero net current (“corrosion potential”, “mixed potential”), or a potential with a non-zero net current on the working electrode (like in galvanic corrosion or voltammetry). Reversible potentials can be sometimes converted to the standard electrode potential for a given electroactive species by extrapolation of the measured values to the standard state.
The value of the electrode potential under non-equilibrium depends on the nature and composition of the contacting phases, and on the kinetics of electrode reactions at the interface (see Butler–Volmer equation).
An operational assumption for determinations of the electrode potentials with the standard hydrogen electrode involves this reference electrode with hydrogen ion in an ideal solution having is “zero potential at all temperatures” equivalently to standard enthalpy of formation of hydrogen ion is also “zero at all temperatures”.
Measurement[edit]

Three-electrode setup for measurement of electrode potential
The measurement is generally conducted using a three-electrode setup (see the drawing):
- working electrode,
- counter electrode,
- reference electrode (standard hydrogen electrode or an equivalent).
In case of non-zero net current on the electrode, it is essential to minimize the ohmic IR-drop in the electrolyte, e.g., by positioning the reference electrode near the surface of the working electrode (e.g., see Luggin capillary), or by using a supporting electrolyte of sufficiently high conductivity. The potential measurements are performed with the positive terminal of the electrometer connected to the working electrode and the negative terminal to the reference electrode.
Sign conventions[edit]
Historically, two conventions for sign for the electrode potential have formed:[2]
- convention “Nernst–Lewis–Latimer” (sometimes referred to as “American”),
- convention “Gibbs–Ostwald–Stockholm” (sometimes referred to as “European”).
In 1953 in Stockholm[3] IUPAC recognized that either of the conventions is permissible; however, it unanimously recommended that only the magnitude expressed according to the convention (2) be called “the electrode potential”. To avoid possible ambiguities, the electrode potential thus defined can also be referred to as Gibbs–Stockholm electrode potential. In both conventions, the standard hydrogen electrode is defined to have a potential of 0 V. Both conventions also agree on the sign of E for a half-cell reaction when it is written as a reduction.
The main difference between the two conventions[4] is that upon reversing the direction of a half-cell reaction as written, according to the convention (1) the sign of E also switches, whereas in the convention (2) it does not. The logic behind switching the sign of E is to maintain the correct sign relationship with the Gibbs free energy change, given by ΔG = –nFE where n is the number of electrons involved and F is the Faraday constant. It is assumed that the half-reaction is balanced by the appropriate SHE half-reaction. Since ΔG switches sign when a reaction is written in reverse, so too, proponents of the convention (1) argue, should the sign of E. Proponents of the convention (2) argue that all reported electrode potentials should be consistent with the electrostatic sign of the relative potential difference.
Potential difference of a cell assembled of two electrodes[edit]
Potential of a cell assembled of two electrodes can be determined from the two individual electrode potentials using
or, equivalently,
This follows from the IUPAC definition of the electric potential difference of a galvanic cell,[5] according to which the electric potential difference of a cell is the difference of the potentials of the electrodes on the right and the left of the galvanic cell. When ΔVcell is positive, then positive electrical charge flows through the cell from the left electrode (anode) to the right electrode (cathode).
See also[edit]
- Absolute electrode potential
- Electric potential
- Galvani potential
- Nernst equation
- Overpotential
- Potential difference (voltage)
- Standard electrode potential
- Table of standard electrode potentials
- Thermodynamic activity
- Volta potential
References[edit]
- ^ IUPAC, IUPAC, Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”) (1997). Online corrected version: (2006–) “electrode potential, E”. doi:10.1351/goldbook.E01956
- ^ C.A. Hamel, “The Encyclopedia of Electrochemistry”, Reinhold Publishing Corporation, New York-Chapman & Hall Ltd., London, 1964, p. 429–431.
- ^ P. van Rysselberghe, “Bericht der Kommission für electrochemische Nomenklatur und Definitionen”, Z. Electrochem., 58 (1954), 530–535.
- ^ Anson, Fred C. “Common sources of confusion; Electrode Sign Conventions,” J. Chem. Educ., 1959, 36, p. 394.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the “Gold Book”) (1997). Online corrected version: (2006–) “electric potential difference, ΔV of a galvanic cell“. doi:10.1351/goldbook.E01934
Лекция 7
Электродный потенциал. Водородная шкала потенциалов. Формула Нернста. Стандартный электродный потенциал.
Классификация электродов. Электроды первого и второго рода. Электроды сравнения. Газовые электроды. Амальгамные электроды. Окислительно-восстановительные электроды, правило Лютера. Хингидронный электрод, измерение рН.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ.
Одна из основных особенностей электрохимической системы состоит в пространственном разделении участников протекающей в ней реакции. Общая реакция распадается здесь на две частные реакции, каждая из которых совершается на отдельном электроде. В соответствии с этим ЭДС электрохимической системы также должен представлять собой сумму двух электродных потенциалов : Е = j1 + j2.
Скачок потенциала на границе электрод-раствор (как и разность потенциалов между двумя точками, находящимися в различных фазах) экспериментально измерить невозможно. Величина такого скачка потенциала может быть рассчитана теоретически, но лишь в том случае, если точно известно строение границы раздела двух фаз. Структура границы между электродом и раствором изучена до сих пор недостаточно.
Экспериментально можно измерить лишь общее значение Е цепи, т.е. только сумму электродных потенциалов. Для устранения неопределённости величин j необходимо ввести дополнительное условие – принять потенциал какого-либо электрода равным 0 и относить к нему значения потенциалов всех других электродов. В этом случае потенциалы электродов даются в некоторой условной шкале и их значения зависят от природы электрода, выбранного за основу шкалы.
Нернст предложил считать условным нулём потенциал водородного электрода при концентрации водородных ионов в растворе, равной 1, и давлении газообразного водорода 1 атм. Эта условная шкала потенциалов называется водородной шкалой. В настоящее время применяется главным образом условная водородная шкала, в которой при всех Т за ноль выбран потенциал стандартного водородного электрода. Она отличается от первоначальной водородной шкалы Нернста тем, что в ней вместо единичных концентраций и давления выбраны единичная активность и летучесть. Это условие позволяет определять потенциалы электродов в водородной шкале при любых Т, однако при каждой Т потенциал водородного электрода может быть иным, то есть условный нуль не будет одним и тем же при разных Т.
Рекомендуемые материалы
Т.о., электродным потенциалом электрода называется ЭДС элемента, составленного из этого электрода (справа) и стандартного водородного электрода (слева), например :
(+) Pt ïH2 ç H+, aq çç Zn2+ ç Zn (-)
ЭДС этого элемента (jZn2+çZn) отрицательна (-0,763 В при активности ионов цинка в растворе, равной 1, – это и есть стандартный электродный потенциал цинка). Чтобы найти электродный потенциал меди, нужно составить элемент:
(-) Pt ïH2 ç H+, aq çç Cu2+ ç Cu (+)
Здесь ЭДС цепи (jCu2+çCu) положительна (+0,337 В при активности ионов меди, равной 1, – стандартный электродный потенциал меди).
Целесообразно в схеме полуэлемента записывать сочетание электрод + раствор иона в том порядке, который имеется в записи элемента, составленного из стандартного водородного электрода и данного; именно для записанного таким образом электрода следует приводить электродный потенциал с соответствующим знаком. При обратной записи следует изменить знак потенциала, например :
(1) Zn2+, aq ç Zn ; j = -0,763 B , (2) Zn ç Zn2+, aq ; j = +0,763 B
Только первый тип записи приводит к тем знакам величин j, которые соответствуют электродным потенциалам. Величины, соответствующие записи (2), не следует называть электродными потенциалами, но ими можно пользоваться при подсчете ЭДС цепи (для электродов, расположение которых в схеме цепи является обратным расположению их в сочетании с водородным электродом), например :
(-) Zn ç Zn2+, aq ç Cu2+, aq ç Cu (+)
+0,763 В +0,337 В
Е = j1 + j2 = 0,763 + 0,337 = 1,110 В
Диффузионный потенциал, возникающий на границе растворов ZnSO4-CuSO4, усложняет расчет.
Диффузионный потенциал возникает на границе двух растворов, отличающихся друг от друга и качественно, и количественно. Причина его возникновения – неодинаковая подвижность ионов электролита и наличие градиента их концентрации.
На границе двух растворов имеется некоторый переходный слой, где состав меняется от раствора I до раствора II и от раствора II до раствора I ; в этом переходном слое локализуется диффузионный потенциал. Ионы, обладающие большей подвижностью, диффундируют в более разбавленный раствор с большей скоростью, и поверхность соприкосновения двух растворов заряжается знаком этих ионов со стороны более разбавленного раствора и обратным знаком – со стороны концентрированного. Образуется диффузный двойной электрический слой с соответствующим скачком потенциала. Возникающая разность потенциалов будет ускорять движение медленно движущегося иона и замедлять движение быстро движущегося, пока не наступит стационарное состояние, при котором скорости диффундирующих ионов сравняются. Дальнейшее взаимное удаление зарядов прекращается ; установившаяся в пограничном слое разность потенциалов и носит название диффузионного потенциала.
Диффузионный потенциал – неравновесный. Точно его рассчитать в общем случае невозможно.
При измерениях невысокой точности можно существенно снизить диффузионный потенциал на границе двух растворов, включив между ними солевой мостик – концентрированный электролит (насыщенный KCl или NH4NO3) с числами переноса ионов, близкими к 0,5. Резкое уменьшение диффузионного потенциала в этом случае связано с тем, что ионы концентрированного раствора проводят практически весь ток в зонах соприкосновения ; один диффузионный потенциал заменяется при введении солевого мостика двумя потенциалами меньшей величины, часто противоположными по знаку.
С этой же целью используется введение индифферентной соли во все растворы цепи.
Зависимость величины электродного потенциала от концентрации (активности) вещества в электролите может быть установлена методами термодинамики. На электроде Мn+çМ с равновесным потенциалом j протекает электрохимическая реакция :
Мn+, aq + ne = М
Это – реакция дегидратации иона металла и включения его в кристаллическую решетку.
Для равновесного процесса при постоянных Р и Т убыль изобарного потенциала равна максимальной полезной работе А¢ – работе электрического тока :
А¢ = -DG = nFj
При переходе 1 г-иона металла из раствора в электрод изменение изобарного потенциала равно разности химических потенциалов вещества в двух фазах : в растворе (m¢) и в электроде (m¢¢) :
DG = m+¢¢ – m+¢
При Р,Т = const в электроде неизменного состава (чистый металл)
m+¢¢ = m+о = const
В растворе m+¢ = m+¢о + RT ln a+
m+¢о – химический потенциал иона в растворе в стандартном состоянии; эта величина при заданной Т постоянна.
DG = m+o – m+¢o – RT ln a+
j = – (m+o – m+¢o)/nF +  ln a+
ln a+
Первый член правой части уравнения при постоянных Р и Т – величина постоянная (для металлического электрода эта величина практически не зависит от давления). Можно обозначить ее символом jо :
j = jо +  ln a+ (1)
ln a+ (1)
В разбавленном растворе вместо активностей можно подставить концентрации (а+ ® m+ , c+ , N+) в зависимости от выбора меры концентрации и соответственно стандартного состояния для активности, например :
j = jо +  ln m+ (2)
ln m+ (2)
Уравнение (2) было выведено Нернстом (1888) иным путем. Это уравнение, а также более общее уравнение (1) носит название уравнения электродного потенциала Нернста.
jо – это потенциал электрода относительно раствора с активностью соответствующих ионов, равной 1. Он называется стандартным электродным потенциалом и зависит от температуры.
Считая g¢± » g¢+ и m+ » m± , для бинарного одно-одновалентного электролита (n = 1) имеем :
j = jо +  ln a± = jо +
ln a± = jо +  ln m± +
ln m± +  ln g¢±
ln g¢±
Подставляя значение F и переходя от натуральных логарифмов к десятичным, получаем для n = 1 и Т = 298 К :
j = jо + 0,0591 lg m± g¢±
СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ. Значение стандартного электродного потенциала не зависит от активностей участников электродной реакции и представляет собой константу, характерную для данного электрода. Стандартные потенциалы (табличные величины) отнесены к 25оС; их значения при других Т могут быть найдены по температурным коэффициентам, также сведенным в таблицу.
Стандартные потенциалы используются при решении многих проблем, связанных с химическим равновесием в растворах.
Любой электрод, расположенный ниже в ряду стандартных электродных потенциалов (т.е. более положительный), находится в более окисленном состоянии, чем электрод, расположенный выше (пример : элемент Даниэля-Якоби). Если из двух таких электродов составить электрохимическую систему, то на «нижнем» будет протекать реакция восстановления (Cu), а на «верхнем» – реакция окисления (Zn). Процесс идет в том же направлении, если активные вещества обоих электродов находятся в непосредственном контакте друг с другом и реакция протекает по химическому пути. Равновесие в системе наступит в тот момент, когда потенциалы двух электродных реакций сделаются одинаковыми. Такое состояние достигается при определенном соотношении активностей участников реакции, отвечающем константе ее равновесия (примеры : системы Ce3+, Ce4+ и Fe2+, Fe3+ ; Fe2+, Fe3+ и Sn2+, Sn4+ ; ряд активности металлов).
КЛАССИФИКАЦИЯ ЭЛЕКТРОДОВ.
Если на электроде протекает частная реакция
nA A + … + nF = nL L + …
то потенциал электрода определяется уравнением :
j = jо +  ln
ln 
т.е. при заданных Т и Р определяется (кроме jо, который является константой) активностями веществ, участвующих в электродной реакции. Характер влияния активностей компонентов раствора на значение j связан с природой электродной реакции и лежит в основе классификации электродов. Принято различать электроды первого рода, второго рода, газовые, окислительно-восстановительные и некоторые специальные типы электродов.
ЭЛЕКТРОДЫ ПЕРВОГО РОДА.
Электроды первого рода можно схематически представить в виде Мn+ êМ (если электрод – металл) или в виде Меn– êМе (если электрод – металлоид). Электродную реакцию записывают как
Mn+ + ne ® M или Me + ne ® Men–
 =
=  +
+  ln
ln  =
=  + 2,303
+ 2,303  lg
lg 
 =
=  +
+  ln
ln  =
=  – 2,303
– 2,303  lg
lg 
(т.к. активность чистого твердого вещества при заданной Т постоянна и можно принять ее условно равной 1).
Из уравнений следует, что потенциал электрода первого рода зависит от активности лишь одного вида ионов; эти ионы называются потенциалоопределяющими. В случае металлических электродов первого рода такими ионами являются катионы металла, а в случае металлоидных электродов – анионы металлоида. Примеры металлических электродов : металл, погруженный в раствор своей соли (Ag в растворе AgNO3 – Ag+ êAg ; Cu в растворе CuSO4 – Cu2+ êCu). Пример металлоидных электродов первого рода – селеновый электрод Se2- êSe.
Металлические электроды первого рода имеют большое практическое значение и легче реализуются, чем металлоидные.
ЭЛЕКТРОДЫ ВТОРОГО РОДА.
Электроды второго рода представляют собой полуэлементы, состоящие из металла, покрытого слоем его труднорастворимого соединения (соли, оксида, гидроксида) и погруженного в раствор, содержащий тот же анион, что и труднорастворимое соединение электродного металла. Схематически электрод второго рода можно представить как An– êMA êM , а протекающую в нем реакцию
MA + ne = M + An-
 =
=  + 2,303
+ 2,303  lg
lg  =
=  – 2,303
– 2,303  lg
lg 
(учитывая, что активности металла и твердого соединения МА постоянны).
Т.о., потенциал электрода второго рода определяется активностью анионов труднорастворимого соединения электродного металла. Однако электроды второго рода обратимы и по отношению к катионам электродного металла :
ПРМА = 
 =
=  – 2,303
– 2,303  lg ПРМА + 2,303
lg ПРМА + 2,303  lg
lg  =
=
 + 2,303
+ 2,303  lg
lg  =
= 
Из сопоставления потенциалов соответствующих электродов первого и второго рода можно найти ПР труднорастворимых солей.
Потенциалы электродов второго рода легко воспроизводимы и устойчивы, поэтому эти электроды часто применяют в качестве электродов сравнения, по отношению к которым измеряют потенциалы других электродов. Наиболее важны в практическом отношении каломельные, ртутно-сульфатные, хлорсеребряные, ртутнооксидные и сурьмяные электроды.
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД. Это ртуть, покрытая пастой из смеси каломели со ртутью, находящаяся в контакте с раствором KCl :
Cl– êHg2Cl2 êHg
Электродная реакция : Hg2Cl2 + 2e = Hg + 2 Cl–
jкал = jокал – 2,303  lg
lg 
При 25оС jкал = + 0,2678 – 0,059 lg 
jкал определяется активностью ионов Cl–. Наиболее часто употребляются каломельные полуэлементы, в которых концентрация KCl – насыщенный раствор, 1.0 М или 0.1 М. Каломельные электроды, особенно насыщенный, удобны тем, что диффузионный потенциал, возникающий на границе данного раствора с насыщенным KCl, незначителен и во многих случаях его можно не принимать во внимание.
РТУТНО–СУЛЬФАТНЫЙ ЭЛЕКТРОД SO42- êHg2SO4 êHg аналогичен каломельному, ртуть покрыта слоем пасты из ртути и сульфата ртути (I), а в качестве раствора используется H2SO4. При 25оС :
jрт.с. = + 0,6156 – 0,0296 lg 
ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД представляет собой систему
Cl– êAgCl êAg
jхс = jохс – 2,303  lg
lg  = + 0,2224 – 0,059 lg
= + 0,2224 – 0,059 lg 
Ртутно-сульфатный и хлорсеребряный электроды целесообразно применять в тех случаях, когда исследуемый полуэлемент содержит в качестве электролита либо серную кислоту или сульфаты, либо соляную кислоту или хлориды. Чтобы уменьшить величину диффузионного потенциала, концентрацию этих электролитов в электродах сравнения следует брать такую же, как и в исследуемых полуэлементах.
МЕТАЛЛОКСИДНЫЕ ЭЛЕКТРОДЫ интересны тем, что здесь в роли анионов труднорастворимого соединения электродного металла выступают ионы гидроксида. К ним относятся, например, ртутнооксидный и сурьмяный электроды :
OH– êHgO êHg и OH– êSb2O3 êSb
Уравнения электродных реакций и потенциалов этих электродов :
HgO + H2O + 2e = Hg + 2OH– jрт.окс. = jорт.окс. – 2,303  lg
lg 
Sb2O3 + 3H2O + 6e = 2Sb + 6OH– jсурьм. = jосурьм. – 2,303  lg
lg 
Уравнения для электродного потенциала получены при допущении, что постоянны активности не только соответствующих металлов и их оксидов, но и воды, также принимающей участие в электродной реакции.
Металлоксидные электрода второго рода, как и металлсолевые электроды второго рода, обратимы по отношению не только к ионам гидроксила, но и к ионам электродного металла. Кроме того, они обратимы и по отношению к ионам водорода, потому что ионное произведение воды при заданной Т постоянно для любого водного раствора электролита.
Металлоксидные электроды можно применять как электроды сравнения в любых растворах кислот и щелочей, однако ртутнооксидный электрод вследствие заметной растворимости оксидов ртути в кислотах можно рекомендовать лишь для растворов с рН > 7. Сурьмяный электрод из-за неустойчивости состава его поверхностного оксида применять как электрод сравнения нельзя; он используется в качестве индикаторного электрода для приближенных определений рН в умеренно кислых и нейтральных растворах.
ГАЗОВЫЕ ЭЛЕКТРОДЫ.
Газовый электрод представляет собой полуэлемент, состоящий из металлического проводника, контактирующего одновременно с соответствующим газом и с раствором, содержащим ионы этого газа. Конструирование газового электрода невозможно без участия проводника с электронной проводимостью. Требования к металлу в газовых электродах : 1) должен ускорять медленно устанавливающееся электродное равновесие, т.е. служить катализатором электродной реакции; 2) потенциал металла в газовом электроде не должен зависеть от активности других ионов раствора, в частности от активности собственных ионов металла; 3) должен быть инертным по отношению к другим возможным реакциям; 4) должен обеспечивать создание максимально развитой поверхности раздела между фазами, на которой могла бы протекать обратимая реакция ионизации газа. Всем этим требованиям лучше всего удовлетворяет платина, электролитически покрытая платиновой чернью (платинированная платина). Газовые электроды очень чувствительны к изменению состояния поверхности платины, особенно к отравлению ее каталитическими ядами.
ВОДОРОДНЫЙ ЭЛЕКТРОД. Схема электрода :
H+ êH2 êPt
Электродная реакция : 2Н+ + 2е = Н2
 =
=  + 2,303
+ 2,303  lg
lg  = 2,303
= 2,303  lg
lg  – 2,303
– 2,303  lg
lg 
(т.к.  при всех Т принят равным нулю)
при всех Т принят равным нулю)
Потенциал водородного электрода определяется не только активностью ионов Н+, но и парциальным давлением газообразного водорода, следовательно, водородный электрод (как и все газовые электроды) более сложен, чем электроды первого и второго рода, потенциалы которых зависят непосредственно от активности частиц одного сорта.
Когда парциальное давление водорода равно 1 атм, уравнение упрощается :  = – 2,303
= – 2,303  рН , т.е. при определенных условиях потенциал водородного электрода дает непосредственное значение рН.
рН , т.е. при определенных условиях потенциал водородного электрода дает непосредственное значение рН.
КИСЛОРОДНЫЙ ЭЛЕКТРОД. Схема электрода :
ОН– êО2 êPt
Электродная реакция : О2 + 2Н2О + 4е = 4ОН–
 =
=  + 2,303
+ 2,303  lg
lg  =
=
 + 2,303
+ 2,303  lg
lg  – 2,303
– 2,303  lg
lg 
В величину  включена активность воды. При 25оС и
включена активность воды. При 25оС и  = 1 атм
= 1 атм
 = 0,401 – 0,059 lg
= 0,401 – 0,059 lg 
Однако реализовать кислородный электрод на практике весьма трудно. Это обусловлено способностью кислорода окислять металлы, даже платину, поэтому на основную электродную реакцию накладывается реакция, отвечающая металлоксидному электроду второго рода. Кроме того, часть кислорода восстанавливается на электроде не до воды, а до ионов перекиси водорода. Поэтому значения потенциала кислородного электрода, полученные опытным путем, обычно не совпадают с теоретическими.
ХЛОРНЫЙ ЭЛЕКТРОД. Реализация обратимого газового хлорного электрода Cl– êCl2 êPt связана со значительными трудностями. Теоретически электродная реакция здесь проста : Cl2 + 2e = 2Cl– и электродный потенциал можно описать уравнением :
 =
=  + 2,303
+ 2,303  lg
lg 
Однако на основной электродный процесс накладываются побочные реакции с участием хлора. Высокое положительное значение  (+ 1,358 В при 25оС) затрудняет подбор устойчивого, не реагирующего с хлором материала электрода. Тем не менее при соблюдении определенных мер удалось получить опытные значения потенциалов хлорного электрода, совпадающие с теоретической величиной.
(+ 1,358 В при 25оС) затрудняет подбор устойчивого, не реагирующего с хлором материала электрода. Тем не менее при соблюдении определенных мер удалось получить опытные значения потенциалов хлорного электрода, совпадающие с теоретической величиной.
АМАЛЬГАМНЫЕ ЭЛЕКТРОДЫ.
Это полуэлементы, в которых амальгама какого-либо металла находится в контакте с раствором, содержащим ионы этого металла :
Мn+ êMm, Hg mMn+ + mne ® Mm (Hg)
Ртуть ведет себя как инертная среда, в которой растворен металл, а потенциалоопределяющими являются ионы этого металла :
 =
=  + 2,303
+ 2,303  lg
lg 
т.е. потенциал зависит от активности ионов металла не только в растворе, но и в амальгаме. Если металл находится в ртути в атомарном состоянии (m=1), то можно написать :
 =
=  + 2,303
+ 2,303  lg
lg 
Амальгамные электроды широко применяются в технике и в лабораторной практике. Кадмиевый амальгамный электрод Cd2+ êCd, Hg (Cd2+ + 2e ® Cd (Hg)) в виде амальгамы, содержащей 12,5% Cd, используется для изготовления нормальных элементов Вестона, ЭДС которых практически не изменяется со временем.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ, или РЕДОКСИ-ЭЛЕКТРОДЫ. Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ, и в этом смысле все электроды представляют собой редокси-системы. Однако термин окислительно-восстановительные, или редокси-электроды, употребляется обычно в тех случаях, когда в реакции не участвуют непосредственно металлы или газы. Металл в редокси-электроде, обмениваясь электронами с участниками окислительно-восстановительной реакции, принимает потенциал, отвечающий установившемуся редокси-равновесию. К металлическому проводнику предъявляются здесь те же требования, что и в случае газовых электродов.
Следует различать простые и сложные редокси-электроды. В первом случае электродная реакция сводится к перемене валентности ионов без изменения их состава, например :
Fe3+ + e = Fe2+
Tl3+ + 2e = Tl+
MnO4– + e = MnO42-
Fe (CN)63- + e = Fe (CN)64-
Если обозначить окисленные ионы Ox, а восстановленные Red, то все написанные выше реакции можно выразить одним общим уравнением :
Ox + ne = Red
Простой редокси-электрод записывается в виде схемы :
Red, Ox êPt
а его потенциал дается уравнением
jRed,Ox = joRed,Ox + 2,303  lg
lg 
Как видно, потенциал простого редокси-электрода определяется отношением активностей ионов в двух различных степенях окисления. Если элемент образует ионы нескольких валентностей, то ему будет отвечать столько редокси-электродов, сколько можно получить попарных сочетаний (три валентности – три различных редокси-электрода).
Потенциалы простых редокси-электродов можно легко связать с потенциалами соответствующих электродов первого рода. Пусть, например, металл М способен существовать в растворе в виде ионов высшей валентности Мh и низшей валентности Mn. Для него возможны два электрода первого рода Mh êM и Mn êM и один редокси-электрод Mn, Mh êM , стандартные потенциалы которых соответственно равны  ,
,  и
и  . Связь между этими величинами можно найти, проведя мысленно процесс электрохимического растворения металла М с получением ионов высшей валентности Mh либо непосредственно, либо через промежуточное образование ионов низшей валентности Mn. Предполагается, что процесс растворения протекает обратимо и изотермически в бесконечно большом объеме раствора, в котором активности ионов каждого сорта равны 1. Этот процесс можно представить в виде следующего простого цикла :
. Связь между этими величинами можно найти, проведя мысленно процесс электрохимического растворения металла М с получением ионов высшей валентности Mh либо непосредственно, либо через промежуточное образование ионов низшей валентности Mn. Предполагается, что процесс растворения протекает обратимо и изотермически в бесконечно большом объеме раствора, в котором активности ионов каждого сорта равны 1. Этот процесс можно представить в виде следующего простого цикла :
– hFjoh
M —-® Mh
– nFjon æ ä – (h-n)Fjon,h
Mn
Из цикла следует : hjoh = njon + (h – n)jon,h
Это уравнение известно как правило Лютера ; по нему можно рассчитать стандартный потенциал любого из трех электродов, если известны значения стандартных потенциалов двух других электродов. Уравнение применяется в тех случаях, когда непосредственное определение одного из потенциалов или затруднительно, или невозможно. Так, например, потенциал электрода первого рода Fe3+ | Fe , измерить который непосредственно не удается из-за неустойчивости в этих условиях ионов Fe3+, можно найти из доступных прямому измерению стандартных потенциалов электрода первого рода Fe2+ | Fe и простого редокси-электрода Fe2+, Fe3+| Fe :  =
=  +
+ 
В сложных редокси-электродах реакция протекает с изменением валентности реагирующих частиц и их состава. В реакциях такого рода участвуют обычно ионы водорода и молекулы воды; участие молекул воды не сказывается на характере уравнений для электродного потенциала, т.к. активность воды в ходе реакции (за исключением очень концентрированных растворов) остается постоянной. Схему сложного редокси-электрода можно записать следующим образом :
Red, Ox, H+ | Pt
Т.о., потенциал сложного редокси-электрода является функцией не только активностей окисленных и восстановленных частиц, но и активности водородных ионов. Например, для системы MnO4– – Mn2+, в которой протекает электродная реакция
MnO4– + 8H+ + 5e = Mn2+ + 4H2O
потенциал электрода передается уравнением :
 =
=  +
+  ln
ln  =
=
=  + 2,303
+ 2,303  lg
lg  + 2,303
+ 2,303 
 lg
lg 
Сложные редокси-электроды можно использовать как индикаторные электроды при измерении рН. Для этой цели часто применяют электрод, обратимый по отношению к системе хинон-гидрохинон. Для системы хинон-гидрохинон (х, гх) с реакцией
С6Н4О2 + 2Н+ + 2е = С6Н4(ОН)2
потенциалу электрода отвечает уравнение
jх, гх = jох, гх + 2,303  lg
lg  = jох, гх + 2,303
= jох, гх + 2,303  lg
lg  +
+
Вместе с этой лекцией читают “Тема 2. СИСТЕМА «ЧЕЛОВЕК – МАШИНА – СРЕДА» “.
+ 2,303  lg
lg 
В раствор, рН которого хотят измерить, вводят эквимолярную смесь хинона и гидрохинона. Если считать, что отношение концентраций равно отношению активностей
 =
=  = 1
= 1
то уравнение упрощается до
jх, гх = jох, гх + 2,303  lg
lg  = jох, гх – 2,303
= jох, гх – 2,303  рН
рН
и потенциал такого электрода, обычно называемого хингидронным , будет определяться непосредственно значением рН раствора. При 25оС jох, гх = 0,6992 В ; температурная зависимость jох, гх хорошо изучена. Хингидронный электрод легко приготовляется и удобен в работе. Хингидронным электродом нельзя пользоваться в щелочных растворах (гидрохинон – слабая кислота, в щелочной среде он сильно диссоциирует и концентрация его в насыщенном растворе не является постоянной), а также в присутствии сильных окислителей или восстановителей.



