1. Найдите потенциал электростатического поля, созданного протоном на расстоянии 5,3 • 10-11 м от него. Какой потенциальной энергией будет обладать электрон, движущийся в атоме водорода вокруг протона по круговой орбите такого радиуса? [27,2 В; -27,2 эВ = -4,35 ⋅ 10-18 Дж]
1.
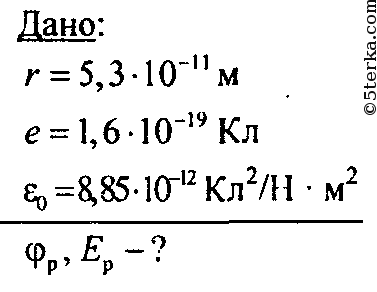
Решение:
Потенциал точечного заряда протона:
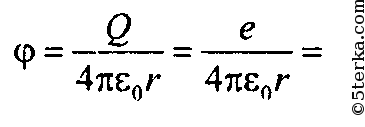
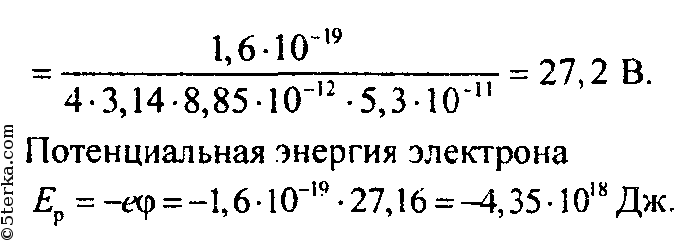
Ответ:
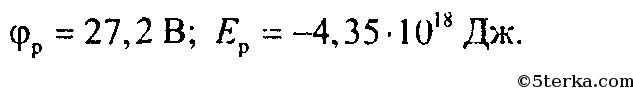

Диаграмма концентраций ионов и зарядов, пересекающих полупроницаемую клеточную мембрану. Видно как ионы Na+ и Cl– движутся во внутрь клетки, а ионы K+ стремятся наружу, вследствие разницы концентраций.
Электрохими́ческий градиéнт, или градиéнт электрохимического потенциáла, — совокупность градиента концентрации и мембранного потенциала, которая определяет направление движения ионов через мембрану. Состоит из двух составляющих: химического градиента (градиента концентрации), или разницы в концентрациях растворённого вещества по обе стороны мембраны, и электрического градиента (мембранного потенциала), или разницы зарядов, расположенных на противоположных сторонах мембраны. Градиент возникает вследствие неодинаковой концентрации ионов на противоположных сторонах водопроницаемой мембраны. Ионы двигаются через мембрану из области, имеющую более высокую концентрацию в область с более низкой концентрацией путём простой диффузии. Также ионы несут электрический заряд, который формирует электрический потенциал на мембране (мембранный потенциал). Если существует неравномерное распределение зарядов по обе стороны мембраны, то разница в электрическом потенциале порождает силу, которая приводит к ионной диффузии, пока заряды по обе стороны не будут сбалансированы[1].
Обзор[править | править код]
Электрохимический потенциал используется в электроаналитической химии, а в промышленности применяется при изготовлении батареек и топливных элементов. Он представляет собой одну из многих взаимозаменяемых форм потенциальной энергии, в форме которых возможно сохранение энергии.
В биологических процессах ионы проходят через мембрану путём диффузии или активного транспорта, определяемую электрохимическим градиентом. В митохондриях и хлоропластах протонные градиенты используются для генерации хемиосмотического потенциала, который также известен как протон-движущая сила Δp или ΔμH+. Эта потенциальная энергия используется для синтеза АТФ посредством окислительного фосфорилирования или фотофосфорилирования[2]. Протон-движущая сила согласно хемиосмотической теории Митчелла является общим продуктом сопряжённых процессов дыхания и окислительного фосфорилирования. Она складывается из двух факторов: химического (или осмотического) — разности концентраций ионов H+, в митохондриальном матриксе и межмембранном пространстве, и электрического — обусловленного разностью электрических зарядов, расположенных на противоположных сторонах мембраны. Разность концентраций ионов H+, измеряемая в единицах pH, обозначается ΔpH. Разность электрических потенциалов обозначается символом Δψ. Следовательно, уравнение принимает вид[3]:

где

разности концентраций ионов H+ (химический градиент) на А(+)-стороне и B(-)-cтороне мембраны.
Связь между ΔμH+ и F (число Фарадея) Митчелл определил как:

ΔμH+ = 1 кДж*моль соответствует Δp = 10,4 мВ. При температуре 25° С (298 К) это уравнение приобретает следующий вид:

Электрохимический градиент включает в себя два компонента. Первый компонент — электрический градиент, который обусловлен разницей заряда на противоположных сторонах липидной мембраны. Второй компонент — химический градиент, вызывается дифференциальной (различной) концентрацией ионов, располагающихся на противоположных сторонах мембраны. Сочетание этих двух факторов определяет термодинамически выгодное направление движения иона через мембрану[1][5].
Электрохимический градиент похож на давление воды, которое она оказывает при протекании через плотину гидроэлектростанции. Мембранные транспортные белки, такие как натрий-калиевая АТФаза, аналогичны турбинам, преобразующим потенциальную энергию воды в другие формы физической или химической энергии, а ионы, которые проходят через мембрану, аналогичны воде, которая падает на дно плотины. Кроме того, энергия может быть использована для перекачки воды в озеро, располагающееся выше по течению от плотины. Аналогичным образом, химическая энергия в клетках может быть использована для создания электрохимических градиентов[6][7].
Химия[править | править код]
Термин «электрохимический потенциал» обычно применяется в тех случаях, когда должна произойти химическая реакция, например, с переносом электрона в электрической батарее. В аккумуляторах электрохимический потенциал, возникающий от движения ионов, уравновешивает энергию реакции электродов. Максимальное напряжение, которое может произвести реакция батареи, называют стандартным электрохимическим потенциалом данной реакции. Наряду с макроэргическими соединениями химическая энергия может запасаться на биологических мембранах, функционирующих подобно электрическим конденсаторам, которые выступают в роли изолирующего слоя для заряжённых ионов[3].
Биологическое значение[править | править код]
Генерация трансмембранного электрического потенциала посредством движения ионов через клеточную мембрану приводит к возникновению биологических процессов, таких как нервная проводимость, сокращение мышц, секреция гормонов и сенсорные реакции. Считается, на мембране типичной животной клетки имеется трансмембранный электрический потенциал от -50 мВ до -70 мВ[8].
Электрохимические градиенты также играют определённую роль в установлении протонных градиентов окислительного фосфорилирования в митохондриях. Конечной стадией клеточного дыхания является цепь переноса электронов. Четыре встроенных комплекса во внутренней мембране митохондрии (кристах) составляют цепь переноса электронов. Однако только комплексы I, III и IV являются протонными насосами и перекачивают протоны из матрикса в межмембранное пространство. Суммарно получается десять протонов, которые перемещаются из матрикса в межмембранное пространство, генерируя электрохимический потенциал более 200 мВ. Это приводит в движение поток протонов обратно в матрикс через АТФ-синтазу, которая синтезирует АТФ путём присоединения неорганического фосфата к молекуле АДФ[9]. Таким образом, генерация протонного электрохимического градиента имеет решающее значение для синтеза энергии в митохондриях[10]. Общее уравнение для цепи переноса электронов выглядит так:

Подобно дыхательной цепи переноса электронов действует и электронтранспортная цепь фотосинтеза в растениях, где происходит закачка протонов в люмен хлоропластов (просвет тилакоидов), а полученный градиент используется для синтеза АТФ посредством фермента АТФ-синтазы. Протонный градиент может быть сгенерирован с помощью нециклического или циклического фотофосфорилирования. Белки, которые участвуют в нециклическом фотофосфорилировании, фотосистема II (ФСII) и цитохром-b6f-комплекс непосредственно способны к генерации протонного градиента. На каждый из четырёх фотонов, поглощаемых ФСII, приходится восемь протонов, которые перекачивается в люмен (просвет тилакоида) из стромы[12]. Общее уравнение для фотофосфорилирования выглядит следующим образом:

Несколько других транспортёров и ионных каналов играют роль в генерации протонного электрохимического градиента. Одним из них является TPK3-калиевый ионный канал, активируемый ионами Са2+. Он перемещает ионы K+ из люмена в строму, которые помогают установить градиент рН (градиент концентрации) внутри стромы. С другой стороны, электронейтральный антипортер K+ (KEA3) транспортирует ионы K+ в люмена, а Н+ в строму, поддерживая баланс ионов и не нарушая электрическое поле[14].
Ионный градиент[править | править код]

Схема действия Na+-K+-АТФазы. Справа показаны градиенты концентраций ионов натрия и калия.
Так как ионы несут заряд, они не могут пройти через мембрану путём облегчённой диффузии. Перенос ионов через мембрану возможен двумя путями, через активный или пассивный транспорт. Примером активного транспорта ионов является работа Na+-K+-АТФазы. Она катализирует реакцию гидролиза АТФ до АДФ и неорганического фосфата Фн. При гидролизе одной молекулы АТФ выделяется энергия, которая изменяет конформацию фермента, так, чтобы три иона Na+ транспортировались наружу, а два иона K+ транспортируются внутрь клетки. В результате содержимое клетки становится более отрицательно заряжённым, чем окружающая среда, генерируется электрический потенциал (ЭДС) Vm ≈ -60 мВ[7]. Примером пассивного транспорта является ток ионов через ионные каналы (каналы для Na+, K+, Ca2+ и Cl–) по градиенту концентрации, из области большей концентрации в область меньшей. Например, так как существует высокая концентрация Na+ вне клетки, то ионы Na+ будут стремиться проникнуть в клетку через натриевый ионный канал. Поскольку электрический потенциал внутри клетки отрицательный, приток положительных ионов вызовет деполяризацию мембраны, вследствие чего происходит сдвиг значения трансмембранного электрического потенциала ближе к нулю. Однако ионы Na+ продолжат движение вниз по градиенту концентрации, до тех пор пока движущая сила химического градиента больше, чем электрического потенциала. После того как эффект обоих градиентов (химического и электрического) уравновесит друг друга (Vm для Na+ составляет около +70 мВ), приток ионов Na+ остановится, поскольку движущая сила или изменение энергии Гиббса (ΔG) станет равна нулю. Уравнение для движущей силы выглядит следующим образом[15][16]:

Где, R — универсальная газовая постоянная, равная 8,3144598(48) Дж/(моль∙К); T — абсолютная температура (при н.у. = 298 K); Z — заряд иона, F — постоянная Фарадея, равная 96485 Кл/моль; Сin и Cext — соответственно концентрации ионов в ммоль/л, с наружной и внутренней стороны мембраны клетки; Vm — электрический потенциал (ЭДС) иона[17].
Протонные градиенты[править | править код]
Протонные градиенты имеют важное значение как одна из форм накопления энергии во многих различных типах клеток.
Градиент обычно используется для работы АТФ-синтазы, вращения жгутика, или переноса метаболитов через мембрану[18]. В этом разделе основное внимание будет уделёно трём процессам, которые помогают установить протонные градиенты в соответствующих клетках: работе бактериородопсина, нециклическому фотофосфорилированию и окислительному фосфорилированию.
Бактериородопсин[править | править код]

Схема работы бактериородопсина.
Бактериородопсин, обнаруженный в археях, формирует путь для градиента протонов, посредством протонного насоса. Работа протонного насоса опирается на переносчик протонов (родопсин), который движется от стороны мембраны с низкой концентрацией ионов H+ к стороне с более высокой концентрацией H+. Протонный насос бактериородопсина активируется путём поглощения фотонов с длиной волны 568 нм, это приводит к фотоизомеризации основания Шиффа (SB) в ретинале, вызывая его переход из транс– в 13-цис-форму. Фотоизомеризация чрезвычайно быстра и занимает всего 200 фемтосекунд. Как следствие, родопсин претерпевает ряд быстрых конформационных перестроек: происходит смещение основания Шиффа от остатков Asp85 и Asp212, вызывая передачу ионов H+ остатку Asp85, при этом формируется состояние M1 (мета-I). Затем белок переходит к состоянию М2 (мета-II) посредством отделения остатка Glu204 от Glu194, который высвобождает протон во внешнюю среду. Такое состояние является сравнительно долгоживущим. Основание Шиффа репротонируется по остатку Asp85, формируя состояние N. Важно, что второй протон происходит от Asp96, так как его депротонированное состояние неустойчиво и быстро репротонируется (повторно протонируется) протоном из цитоплазмы. Протонирование Asp85 и Asp96 приводят к повторной изомеризации SB, формируя при этом состояние O. Также при этом остаток Asp85 высвобождает свой протон на Glu204 и бактериородопсин возвращается в состояние покоя[18][19].
Фотофосфорилирование[править | править код]

Фотосистема II (ФСII) также использует энергию света для создания протонных градиентов в хлоропластах, однако, для достижения этой цели ФСII использует векторальные (однонаправленные) окислительно-восстановительные реакции. Поглощение фотонов с длиной волны 680 нм используется для возбуждения двух электронов в пигменте Р680 с переходом на более высокий энергетический уровень. Эти электроны с высокой энергией передаются к белок-связанному пластохинону (PQA), а затем к несвязанному пластохинону (PQB), что приводит к восстановлению последнего с образованием пластохинола (PQH2), который высвобождается из ФСII после присоединения двух протонов, поступивших из стромы. Электроны в P680 пополняются путём окисления воды посредством водоокисляющего комплекса (ВОК)[18]. При этом происходит выделение молекул О2 и Н+ в просвет тилакоида (люмен). Общее уравнение реакции выглядит следующим образом:

После освобождения из ФСII восстановленный пластохинон PQH2 перемещается в цитохром-b6f-комплекс, который передает два электрона от PQH2 к белку пластоцианину в двух отдельных реакциях. Данный процесс похож на Q-цикл, происходящий в комплексе III ЭТЦ. В первой реакции пластохинол PQH2 связывается с комплексом со стороны люмена и один электрон переходит на железо-серный центр (Fe-S), который затем передаёт его на цитохром f, последний осуществляет передачу электрона на молекулу пластоцианина. Второй электрон переходит на молекулу гема bL, который затем передаёт его гему bH, последний передаёт электрон второй молекуле пластохинона PQ. Во второй реакции 2-ая молекула пластохинола PQH2 окисляется, передавая электрон другой молекуле пластоцианина и наполовину восстановленному PQ, который восстанавливается до PQH2 и покидает комплекс. Обе реакции сопровождаются переносом четырёх протонов в люмен[20][21].
Окислительное фосфорилирование[править | править код]

Подробная схема цепи переноса электронов в митохондриях.
В дыхательной цепи переноса электронов комплекс I катализирует восстановление убихинона (UQ) до убихинола (UQH2) за счёт двух электронов от восстановленной молекулы никотинамидадениндинуклеотида (НАДН), и переносит четыре протона из матрикса митохондрии в межмембранное пространство по уравнению[22]:

Комплекс III катализирует Q-цикл. Первая часть данного цикла — перехода двух электронов от восстановленного в комплексе I убихинола (UQH2) к двум молекулами окисленного цитохрома с на участке Qo. Во второй части (на участке Qi) происходит передача ещё двух электронов от UQ к UQH2 и, соответственно, восстановление убихинона[22]. Общее уравнение процесса выглядит следующим образом:

Комплекс IV катализирует реакцию переноса двух электронов от восстановленного цитохрома в комплексе III на 1/2 молекулы кислорода (1/2О2). На одну полную молекулу кислорода (О2) требуется перенос четырёх электронов. Помимо четырёх электронов к молекуле кислорода присоединяются четыре протона (4H+), поступающих из матрикса, с образованием молекулы воды. Полное уравнение процесса выглядит так:

Примечания[править | править код]
- ↑ 1 2 Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 403. — ISBN 978-1-4292-3414-6.
- ↑ Nath, Sunil; Villadsen, John. Oxidative phosphorylation revisited (англ.) // Biotechnology and Bioengineering (англ.) (рус. : journal. — 2015. — 1 March (vol. 112, no. 3). — P. 429—437. — ISSN 1097-0290. — doi:10.1002/bit.25492.
- ↑ 1 2 Кольман Я., Рём К.-Г. Наглядная биохимия. — М.: Мир, 2011. — С. 128—129. — 469 с. — 7000 экз. — ISBN 5-03-003304-1.
- ↑ Строев Е.А. Биологическая химия. — М.: Высшая школа, 1986. — С. 210. — 479 с.
- ↑ Yang, Huanghe; Zhang, Guohui; Cui, Jianmin. BK channels: multiple sensors, one activation gate (неопр.) // Membrane Physiology and Membrane Biophysics. — 2015. — 1 January (т. 6). — С. 29. — doi:10.3389/fphys.2015.00029. — PMID 25705194. — PMC 4319557.
- ↑ Shattock, Michael J.; Ottolia, Michela; Bers, Donald M.; Blaustein, Mordecai P.; Boguslavskyi, Andrii; Bossuyt, Julie; Bridge, John H. B.; Chen-Izu, Ye; Clancy, Colleen E. Na+/Ca2+ exchange and Na+/K+-ATPase in the heart (англ.) // The Journal of Physiology (англ.) (рус. : journal. — 2015. — 15 March (vol. 593, no. 6). — P. 1361—1382. — ISSN 1469-7793. — doi:10.1113/jphysiol.2014.282319. — PMID 25772291. — PMC 4376416.
- ↑ 1 2 Aperia, Anita; Akkuratov, Evgeny E.; Fontana, Jacopo Maria; Brismar, Hjalmar. Na+-K+-ATPase, a new class of plasma membrane receptors (англ.) // American Physiological Society (англ.) (рус. : journal. — 2016. — 1 April (vol. 310, no. 7). — P. C491—C495. — ISSN 0363-6143. — doi:10.1152/ajpcell.00359.2015. — PMID 26791490.
- ↑ Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 464. — ISBN 978-1-4292-3414-6.
- ↑ Poburko, Damon; Demaurex, Nicolas. Regulation of the mitochondrial proton gradient by cytosolic Ca2+ signals (англ.) // Pflügers Archiv – European Journal of Physiology (англ.) (рус. : journal. — 2012. — 24 April (vol. 464, no. 1). — P. 19—26. — ISSN 0031-6768. — doi:10.1007/s00424-012-1106-y.
- ↑ Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 743—745. — ISBN 978-1-4292-3414-6.
- ↑ Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 744. — ISBN 978-1-4292-3414-6.
- ↑ Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 769—770. — ISBN 978-1-4292-3414-6.
- ↑ Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 770. — ISBN 978-1-4292-3414-6.
- ↑ Höhner, Ricarda; Aboukila, Ali; Kunz, Hans-Henning; Venema, Kees. Proton Gradients and Proton-Dependent Transport Processes in the Chloroplast (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2016. — 1 January (vol. 7). — P. 218. — doi:10.3389/fpls.2016.00218. — PMID 26973667. — PMC 4770017.
- ↑ Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 464—465. — ISBN 978-1-4292-3414-6.
- ↑ Eisenberg, Bob. Interacting Ions in Biophysics: Real is not Ideal (англ.) // Biophysical Journal (англ.) (рус. : journal. — 2013. — 7 May (vol. 104, no. 9). — P. 1849—1866. — doi:10.1016/j.bpj.2013.03.049. — PMID 23663828. — PMC 3647150.
- ↑ Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 465. — ISBN 978-1-4292-3414-6.
- ↑ 1 2 3 4 Gunner, M. R.; Amin, Muhamed; Zhu, Xuyu; Lu, Jianxun. Molecular mechanisms for generating transmembrane proton gradients (англ.) // Biochimica et Biophysica Acta (BBA) – Bioenergetics (англ.) (рус. : journal. — 2013. — 1 August (vol. 1827, no. 8—9). — P. 892—913. — doi:10.1016/j.bbabio.2013.03.001. — PMID 23507617. — PMC 3714358.
- ↑ Wickstrand, Cecilia; Dods, Robert; Royant, Antoine; Neutze, Richard. Bacteriorhodopsin: Would the real structural intermediates please stand up? (англ.) // Biochimica et Biophysica Acta (BBA) – General Subjects (англ.) (рус. : journal. — 2015. — 1 March (vol. 1850, no. 3). — P. 536—553. — doi:10.1016/j.bbagen.2014.05.021.
- ↑ Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — С. 782—783. — ISBN 978-1-4292-3414-6.
- ↑ Schöttler, Mark Aurel; Tóth, Szilvia Z.; Boulouis, Alix; Kahlau, Sabine. Photosynthetic complex stoichiometry dynamics in higher plants: biogenesis, function, and turnover of ATP synthase and the cytochrome b 6 f complex (англ.) // Journal of Experimental Botany : journal. — Oxford University Press, 2015. — 1 May (vol. 66, no. 9). — P. 2373—2400. — ISSN 0022-0957. — doi:10.1093/jxb/eru495. — PMID 25540437.
- ↑ 1 2 3 4 5 Sun, Fei; Zhou, Qiangjun; Pang, Xiaoyun; Xu, Yingzhi; Rao, Zihe. Revealing various coupling of electron transfer and proton pumping in mitochondrial respiratory chain (англ.) // Current Opinion in Structural Biology : journal. — Elsevier, 2013. — 1 August (vol. 23, no. 4). — P. 526—538. — doi:10.1016/j.sbi.2013.06.013.
Литература[править | править код]
- Nelson, David; Cox, Michael. Lehninger Principles of Biochemistry (неопр.). — New York: W.H. Freeman (англ.) (рус., 2013. — ISBN 978-1-4292-3414-6.
- Campbell & Reece. Biology (неопр.). — Pearson Benjamin Cummings, 2005. — ISBN 0-8053-7146-X.
- Stephen T. Abedon, “Important words and concepts from Chapter 8, Campbell & Reece, 2002 (1/14/2005)”, for Biology 113 at the Ohio State University
См. также[править | править код]
- Мембранный потенциал
- Хемиосмос
- Гальванический элемент
Задача
5. Электрон переместился в ускоряющем
поле из точки с потенциалом 200В в точку
с потенциалом 300В. Найти кинетическую
энергию электрона, изменение потенциальной
энергии взаимодействия с полем и
приобретенную скорость. Начальная
скорость электрона равна нулю.
РЕШЕНИЕ
При
перемещении электрона с зарядом е
силами электростатического поля
совершается работа:
A
= –e
(φ1
– φ2).
Эта работа численно
равна изменению потенциальной энергии
заряда в электрическом поле, взятому с
противоположным знаком:
A
= –ΔWp
или ΔWp
= e
(φ1
– φ2).
По
теореме о кинетической энергии работа
сил электрического поля численно
равна
приобретенной электроном кинетической
энергии WK:
A
= WK
или –
e
(φ1
– φ2)
=![]() .
.
Отсюда
скорость электрона,
прошедшего
разность потенциалов
φ1
– φ2:
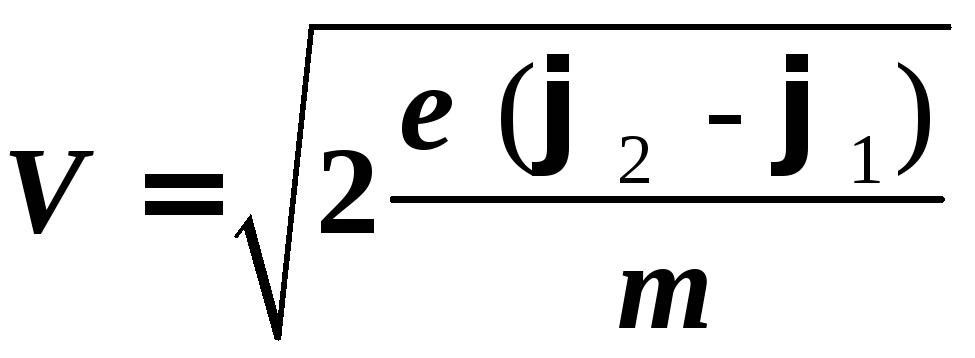
где
е
= 1,6![]() 10-19
10-19
Кл, m
= 9,1![]() 10-31кг
10-31кг
— заряд и масса
электрона.
Вычисления:
WР
= -1,6![]() 10-19
10-19
(300 – 200) = -1,6![]() 10-17
10-17
Дж.
Потенциальная
энергия электрона уменьшилась.
WK
= 1,6![]() 10-17
10-17
Дж.
Кинетическая
энергия электрона увеличилась.
 .
.
4.Движенне заряженных частиц в электростатическом поле
Задача
6.
Какова
максимальная
сила взаимодействия между двумя
протонами, каждый с энергией
106
эВ,
летящих во
встречных
пучках?
РЕШЕНИЕ
Выберем
систему отсчета связанную с одним из
протонов, тогда скорость второго протона
увеличиться в два раза, а его кинетическая
энергия — в четыре раза.По
мере сближения протонов кинетическая
энергия движущегося протона уменьшается,
переходя в потенциальную энергию WP
взаимодействия
двух протонов. Условие остановки
протонов:
WК
= WP.
Учитывая,
что Wp
= q
φ
получаем:
WК
= q
φ
(1)
где
q
— заряд движущегося протона и
![]() (2)
(2)
— потенциал
поля неподвижного протона, r
— расстояние
между протонами.
Из формул (1-2)
находим расстояние r,
на которое сблизятся протоны:
 .
.
(3)
Зная
расстояние r
, найдем максимальную силу F
взаимодействия протонов. По закону
Кулона:
![]()
С
учетом (3):
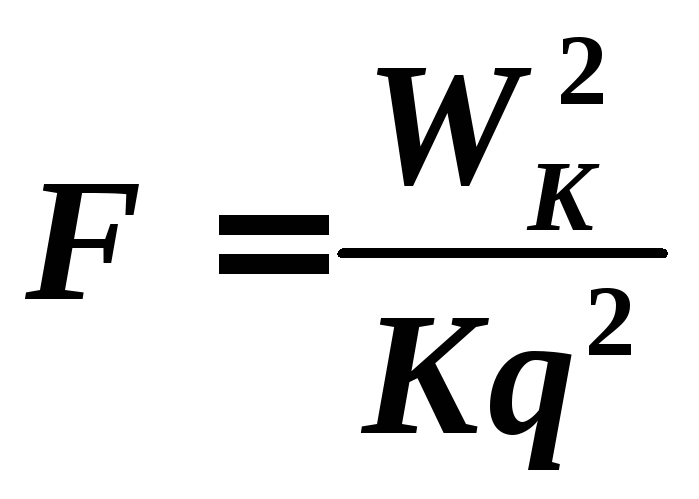 .
.
Проверка
размерности:
![]() .
.
q
= 1,6![]() 10-19
10-19
Кл,
WK
= 4![]() 10
10
6 1,6![]() 10-19
10-19
= 6,4![]() 10-13
10-13
Дж.
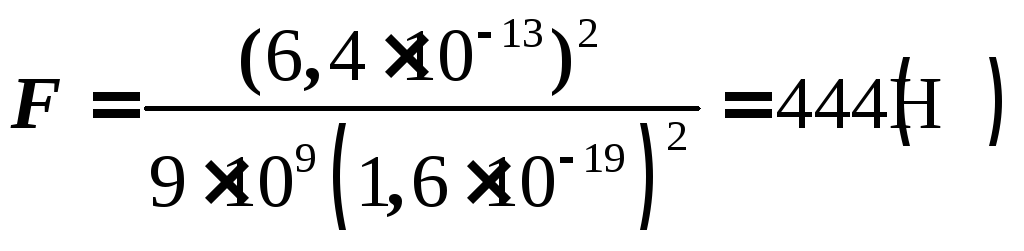 .
.
Задача
7. Электрон
испускается верхней пластиной конденсатора
с нулевой скоростью. Напряженность поля
между пластинами 6 105
В/м, расстояние
─
5 мм. Найти: 1)
силу, действующую на электрон; 2) ускорение
электрона;
3) скорость,
с которой электрон подлетает
ко второй пластине; 4) плотность заряда
на пластинах.
ДАНО:
E
= 6 105
В/м, V0
= 0, d
= 0,05 м.
О ПРЕДЕЛИТЬ:FК
ПРЕДЕЛИТЬ:FК
,
a
, V,
.
РЕШЕНИЕ
-
На
частицу с зарядом q
в
электрическом поле горизонтально
расположенного конденсатора действуют
две силы:
mg
— сила тяжести
и FК
= q
E
—
кулоновская сила со стороны поля.
Рис.
5
Результирующая
этих сил равна:
F
= mg
+ q
E.
-
Из
второго закона Ньютона, определяем
ускорение электрона:
![]() .
.
-
Движение
электрона —
равноускоренное
с ускорением а
и начальной скоростью,
равной нулю.
Поэтому:
![]()
 ,
,
где
d
— расстояние между пластинами.
-
Плотность
заряда на пластине конденсатора найдем
из формулы напряженности поля плоского
конденсатора:

Вычисления:
Силой тяжести mg
вследствие её малости можно пренебречь.
F
=
1,6![]() 10-19
10-19![]() 6
6![]() 105
105
= 9,6![]() 10-14
10-14
(Н).

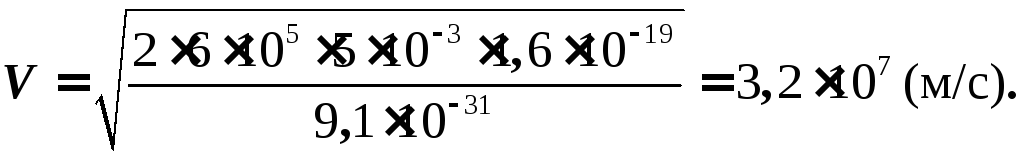
Задана
8. В
пространство между двумя параллельными
заряженными пластинами, помещенными в
вакуум, параллельно им влетает электрон
со скоростью V0
. На расстоянии L
скорость электрона отклоняется на угол
α
от первоначального
направления. Найти напряженность поля
конденсатора.

РЕШЕНИЕ
На
заряд действует сила Кулона
F
= q
E,
поэтому
электрон приобретает ускорение вдоль
оси OY
:
![]() .
.
(1)
Рис.6
![]()
Рис.6
Скорость
электрона вдоль оси Y
:
![]() .
.
(2)
Вдоль
оси X
электрон движется с постоянной скоростью
V0.
Время t
, за которое электрон пройдет расстояние
L:
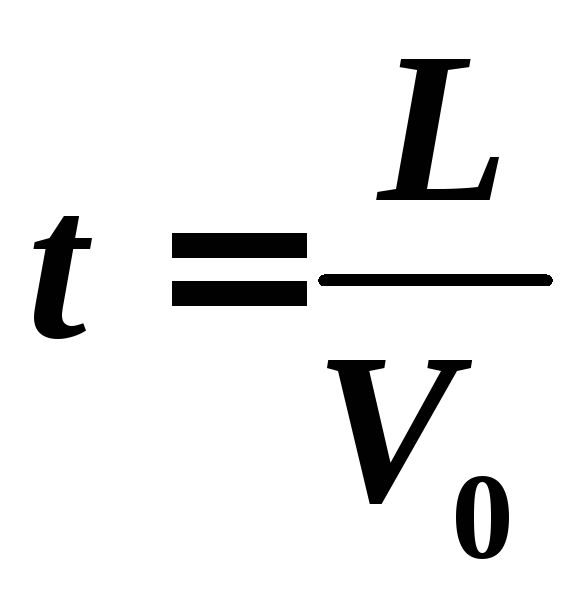 .
.
(3)
Подставив
(3) в (2),
получим:
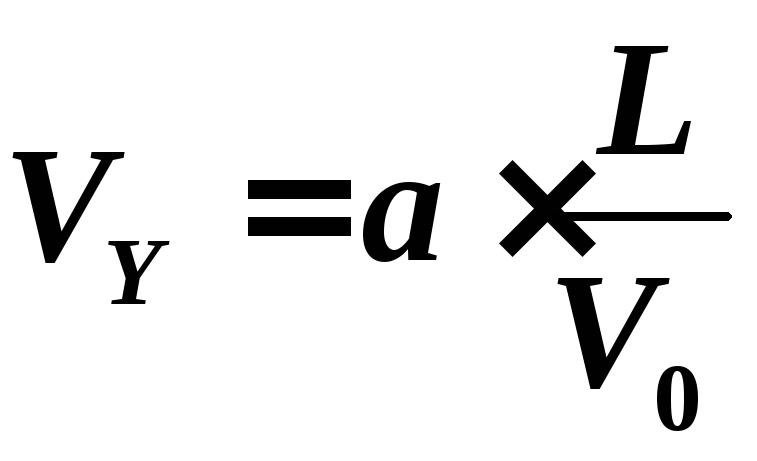 .
.
(4)
С
другой стороны,
![]()
можно выразить из треугольника скоростей
(см. рис.6):
![]() .
.
(5)
Из формул (4) и (5) находим:
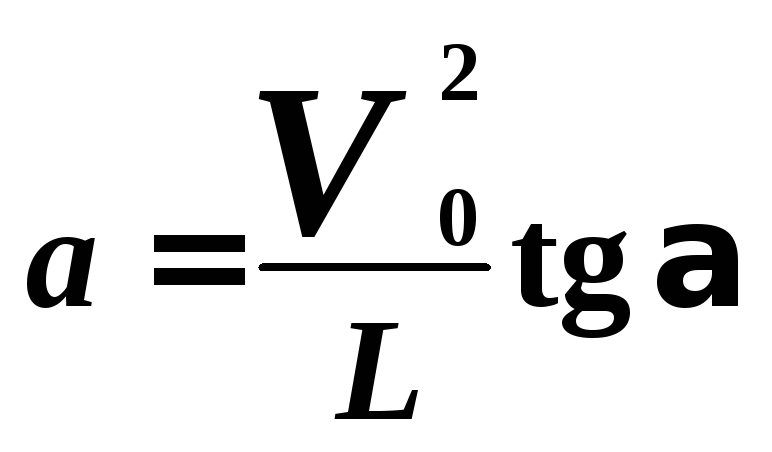 .
.
(6)
Напряженность
электростатического поля конденсатора
E
выразим из соотношения (1) с учетом (6):
 .
.
Проверка
размерности:
:
![]()
-
Электроемкость
Задача
9.
Тысяча одинаковых наэлектризованных
капель сливаются в одну, причем их общий
заряд сохраняется. Как изменится общая
электрическая энергия капель, если
считать, что капли сферические и маленькие
капли находились на большом расстоянии
друг от друга?
РЕШЕНИЕ:
Обозначим
через
![]() радиус, емкость, энергию и заряд одной
радиус, емкость, энергию и заряд одной
капли до слияния;![]()
радиус, емкость,
энергию и заряд большой капли. Приравняем
объем капель после и до слияния:
![]() ,
,
откуда
 ,
,
где
n
— число маленьких капель,
![]() — емкость шара.
— емкость шара.
Электрическая
энергия одной капли до слияния
 .
.
Энергия
n
капель в n
раз больше и равна
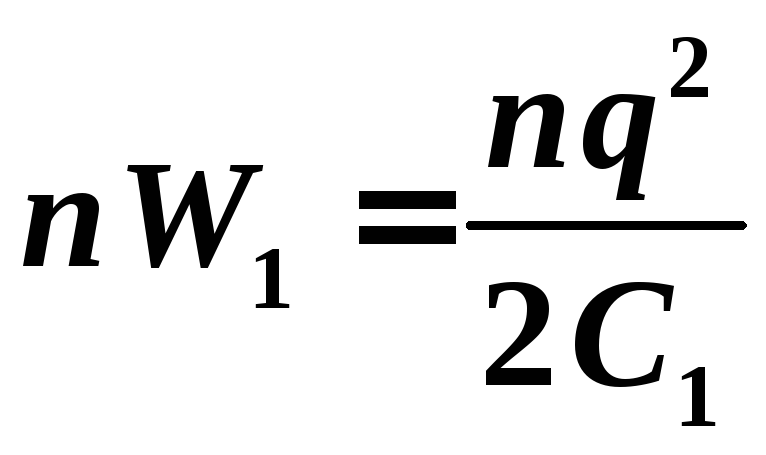 .
.
Энергия
капели после слияния равна
 .
.
Отношение
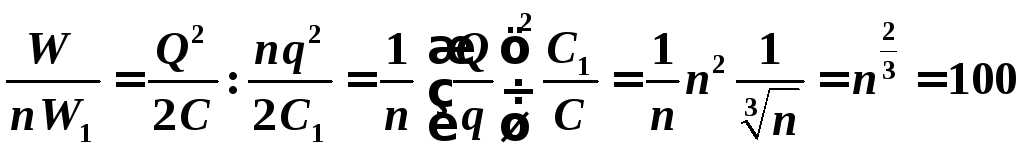 .
.
Энергия
увеличилась в 100 раз.
Задача
10.
Батарея
конденсаторов сделана из четырех
слюдяных пластинок толщиной d
= 0,1 мм и площадью
S
= 100 см2
каждая из
пластинок станиоля (проводник). Сколько
понадобилось пластинок станиоля (n)
при
параллельном
соединении батареи? Начертить схему
соединения. Определить емкость
батареи. Определить запас электрической
энергии, если
батарея
подключена к источнику напряжения
U
= 220 В.
Диэлектрическая
проницаемость слюды ε
= 7.



























Станиоль








Рис.
7
РЕШЕНИЕ
При
параллельном соединении конденсаторов
между собой соединяются все положительные
и все отрицательно заряженные пластинки
станиоля. Каждая пластинка станиоля
может служить обкладкой двух соседних
конденсаторов, как показано на втором
рисунке. Количество пластинок станиоля
n
= 5.
Общая
емкость C
= nC1
, где C1
— емкость одного конденсатора:
![]() .
.
Общая емкость![]() .
.
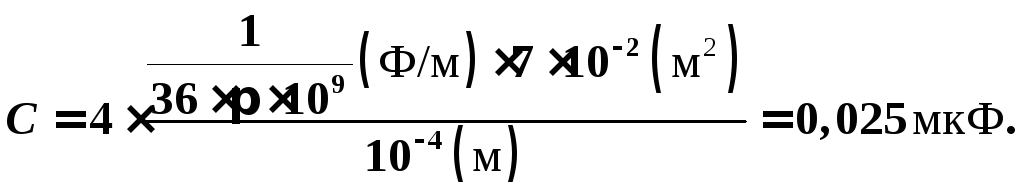
Энергия
батареи конденсаторов:
![]()
![]()
Соседние файлы в папке 1 семестр ФИЗИКА
- #
- #
- #
- #
- #
- #
Особый интерес в связи с проблемой единой шкалы кислотности (см. гл. IX) представляют данные об изменении энергии (изобарного потенциала) при переносе протона из неводного растворителя в воду и соответственно данные о коэффициентах активности y о отдельно протона. Для их оценки необходимы данные об изменении изобарного потенциала — химической энергии сольватации протона в различных неводных растворителях и в воде. [c.202]
В этой статье показано, что электростатический потенциал, создаваемый протонами молекулярного иона Ш в определенной области пространства между протонами остается почти постоянным. Можно ожидать, что для этой части пространства кинетическая энергия невелика, так как она связана со второй производной волновой функции. Следовательно, с энергетической точки зрения, имеются некоторые предпочтительные области, соответствующие химическим связям. [c.378]
Охарактеризуем энергетику процесса гидратации протона. Имеющиеся для этого данные относятся, к сожалению, не к химическим энергиям этих процессов, а к теплотам. Тем не менее качественно они характеризуют и изменение изобарного потенциала этих процессов. [c.195]
Как же сравнивать кислотность в двух различных растворителях Как решить вопрос о том, какой раствор кислее — водный с pH = 3 или спиртовой с тем же рНр = 3 Вопрос о сопоставлении кислотности представляет большие трудности как принципиального, таки экспериментального характера. Эти затруднения пытались решать разными методами. Самой правильной является постановка вопроса о кислотности неводных растворов Бренстеда. Бренстед предлагает во всех растворах считать мерой кислотности абсолютную активность протона или величину, ей пропорциональную, — химический потенциал протона [c.410]
Одной из важнейщих характеристик среды — ее кислотность, определяемая величиной pH раствора. pH пропорционален изменению химического потенциала протона при переходе его из стандартного раствора в заданный, т. е. [c.289]
Однако в отличие от обычных химических реакций в электрохимических процессах энергия активации может существенно изменяться в зависимости от потенциала электрода, как это происходит, например, при поляризации. Рассмотрим изменение потенциальной энергии, происходящее при разряде Н3О+, т. е. на стадии I. Здесь конечным состоянием является адсорбированный атом водорода. Этот атом имеет значительно меньший размер, чем гидратированный протон (ион гидроксония Н3О+). Поэтому равновесное расстояние, на котором атом находится от электрода, мало по сравнению с соответствующим расстоянием для Н3О+. При разряде протон получает от катода электрон и отрывается от Н3О+, а атом водорода адсорбируется на электроде. Такой переход невозможен без преодоления энергетического барьера, разделяющего адсорбированный атом водорода и Н3О+. Вершина барьера соответствует энергии переходного состояния. [c.270]
Здесь — стандартный химический потенциал иона I в фазе / — заряд иона е+ — заряд протона ф — внутренний (гальвани) потенциал, зависящий от расстояния I (от поверхности раздела фаз до данной точки). [c.133]
Пусть — химический потенциал водорода в адсорбированной фазе, — химический потенциал газообразного водорода и — химический потенциал протонов (гидратированных) в электролите. Если обозначить через скачок потенциала в двойном слое Гельмгольца обратимого электрода, через скачок потенциала в двойном слое второго электрода, то условие электрохимического равновесия получается в следующем виде [c.205]
Хемиосмотическая теория сопряжения окисления и фосфорилирования. Эта гипотеза предложена в 1961 г П. Митчеллом причем значительный вклад в ее доказательство был сделан В. П. Скулачевым с соавторами. Согласно этой теории, фактором, сопрягающим окисление с фосфорилированием, является электрохимический, протонный потенциал АцН , возникающий на внутренней мембране митохондрий в процессе транспорта электронов. При этом предполагается, что мембрана непроницаема для ионов, особенно протонов, их транслокация с внутренней стороны мембраны (из матрикса) на наружную сторону внутренней мембраны митохондрий осуществляется за счет процесса окисления в дыхательной цепи, т. е. транспорта высокоэнергетических электронов. Возникающий электрохимический потенциал АцН+ является аддитивным он складывается из химического потенциала АрН и электрического со знаком (+) на наружной стороне мембраны (Avj/) [c.203]
То, что в реакцию вступают протоны, дает возможность отрегулировать окисляющую или восстанавливающую способность полимеров, поддерживая определенную концентрацию водородных ионов в растворе. Следовательно, в распоряжении аналитика имеется метод регулирования потенциала в гетерогенных системах, основывающийся на законе действия масс. Очевидно, что диапазон потенциала можно также менять и химическим путем, вводя определенные заместители в хиноидное ядро или используя другие окислительновосстановительные группы. [c.92]
Так как протон заряжен, работа его удаления из данной среды будет зависеть от электрического состояния последней. Определение работы удаления заряженной частицы из раствора, в состав которого входят ионы, сопряжено с большими трудностями Условно принято относить потенциал кислотности к электрически нейтральной фазе. Таким образом, — работа, которая может быть получена при переносе протона из электрически нейтрализованного раствора в произвольно выбранное нормальное состояние. Электрическая нейтрализация производится без изменения системы в химическом отношении [c.154]
Разность энергий взаимодействия протона с молекулами аммиака и воды, или разность химических энергий сольватации протона в этих растворителях —А , определяет изменение электродного потенциала водорода в жидком аммиаке по сравнению с водой найден- [c.263]
Рассмотрены изменения под влиянием водородной связи RAH” BR частоты продольного колебания группы А—И и протонного химического сдвига в ЯМР, а также некоторые характеристики водородных связей, полученные путем расчетов. Анализ экспериментальных и расчетных данных подтверждает ожидание, что абсолютные значения этих величин в рядах сходных комплексов RAH-.-BR возрастают с уменьшением интеграла перекрывания дпя связи А—Н и с уменьшением потенциала ионизации молекулы BR. [c.287]
Одним из характерных химических свойств хинонов является их склонность к реакциям присоединения . Типичное для хинонов присоединение нуклеофильных агентов к атомам углерода можно рассматривать как присоединение к сопряженной цепи, включающей группу СО и С=С-связи хиноидного ядра. В этом отношении хиноны подобны а,Р-ненасыщенным кетонам и их винилогам. Своеобразие присоединения к хинонам состоит во вторичных превращениях, обусловленных тенденцией к ароматизации. Первоначально образующиеся при нуклеофильной атаке продукты присоединения стабилизируются далее путем отщепления вытесняемой группы в виде аниона (нуклеофильное замещение) или путем прототропного перехода в замещенный гидрохинон. Последний является конечным продуктом реакции, если вступающая группа обладает электроноакцепторными свойствами и повышает окислительно-восстановительный потенциал системы хинон — гидрохинон. В тех случаях, когда заместитель имеет электронодонорный характер, происходит дальнейшее окисление частью исходного хинона, восстанавливающего в гидрохинон. Применение дополнительного окислителя позволяет регенерировать исходное вещество и довести процесс до полного превращения в замещенный хинон. Конечный результат при этом состоит в замене атома водорода в молекуле хинона и часто интерпретируется как нуклеофильное замещение с удалением гидрид-иона, облегчаемое участием окислителя Поскольку механизм, допускающий гид-ридное перемещение, в данном случае не доказан, вопрос о том, рассматривать ли вторичное превращение продукта присоединения в замещенный хинон как перенос электронов с последующим переходом протона или как отщепление гидрид-иона, сопровождающееся его окислением, остается открытым. [c.5]
В случае свободного атома водорода волновые функции известны точно. Тем не менее для улучшения качества МО следует ввести ряд дополнительных функций с точкой центрирования на протоне. Известным обоснованием тому являются следующие соображения. Локальное поле, в котором движется электрон вблизи какого-либо из ядер в молекуле, не обладает сферической симметрией. Из этого потенциала можно выделить главную, сферически-симметричную часть и дополнительное слагаемое, присутствие которого вызывает деформацию (поляризацию) волновых функций, вычисленных для сферически<имметричного потенциала. формация волновых функций атома лития при образовании химической связи уже была учтена ранее при введении 2ро-функции. Аналогичным же образом можно добавить 2ра-поляризующую функцию и на атоме водорода. Добавление поляризующих функций на одном центре сопровождается, как правило, в практике расчета изменением числа базисных функций на другом центре. В примере молекулы LiH введения 2р(Н)-функций целесообразно сочетать с добавлением Зс -функций, центрированных на атоме Li. Проблема нахождения сбалансированного базиса представляет самостоятельную задачу. [c.223]
Здесь сплошные линии изображают электрохимические реакции, пунктирные — химические процессы, сопровождающие электровосстановление. Исходное нитросоединение /, присоединяя два электрона и два протона, образует промежуточное соединение диксо-ний II, которое распадается с образованием нитрозосоединения ///. В кислой среде нитрозосоединение не накапливается, так как потенциал, необходимый для его дальнейшего восстановления, более положителен, чем потенциал восстановления исходного нитросоединения. Первой ступенью восстановления нитрозосоединения является образование арилгидроксиламина IV, который при более отрицательном потенциале может быть восстановлен до амина V. [c.217]
Полярографию широко применяют для исследования поведения на катоде различных веществ в водных растворах [98— 103]. Как на потенциал полуволны, так и на предельный ток может влиять протонирование. На полярограммах восстановления антрацена (Ant) в растворах с увеличивающейся активностью протонов видны общие тенденции, наблюдаемые в экспериментах подобного типа (рис. 3.18). В неводпых растворах имеются две обратимые одноэлектронные полярографические волны, отвечающие последовательному образованию аниои-радикала и дианиона (рис. 3 18, кривая J). При увеличении коицеитрацин воды в растворе высота первой волны увеличивается, в то время как высота второй волны уменьшается, причем суммарная высота обеих волн остается приблизительно постоянной до тех пор, пока при высокой активности протонов обе волны не сольются в одну двухэлектрониую волну (рис. 3.18, кривая 5). Такое поведение может быть объяснено протеканием реакции по механизму ЕСЕ оы (уравнения 3.48—3.51). Увеличение высоты первой волны объясняется увеличением вклада химической стадии (уравнение 3.49), в результате которой образуется радикал Ant, восстанавливающийся легче субстрата [104]. [c.121]
Если следовать постулату о последовательном переносе э гек-тронов [18], то первичный электродный процесс при прямом окислеиии углеводорода представляет собой образование катион-радикала (уравнение 13 1) Однако вследствие высокой химической активности катион-радикалов обычно протекает быстрая реакция с нуклеофилами и (или) основаниями, присутствующими в электролите, которая приводит к образованию либо продукта присоединения катион-радикала к нуклеофилу (уравнение 13.2), либо продукта элиминирования протона от катнон-рэ дикала путем переноса его к основанию (уравнение 13 3) Образующиеся продукты являются нейтральными радикалами В не-которых случаях потенциал окисления образовавшегося ради кала менее положителен, чем потенциал окисления исходного субстрата. При этом возможен перенос иа аиод второго электрона (уравнения 13 4, 13 5) [c.399]
Система тилакоидных мембран хлоропласта превраш,а-ет энергию света в форму, которая может быть использована для осушествления химических реакций. Целиком процесс фотосинтеза был схематически представлен на рис. 10.1. В приводимом ниже обсуждении фотосинтеза рассматриваются три стадии. Первая стадия представляет собой световую реакцию — первичный процесс, с помош,ью которого энергия света поглощается светособирающими пигментами и переносится на фотохимические реакционные центры. На второй стадии поглощенная энергия света используется для осуществления транспорта электронов от воды до NADP+. В ходе электронного транспорта устанавливается градиент заряда, или концентрации протонов, через функциональные везикулы мембраны. Третья стадия представляет собой путь, по которому NADPH, образованный электронтранспортной системой, и АТР, генерируемый за счет различий электрохимического потенциала протонного градиента, используются для фиксации СО2 и синтеза углеводов. Хотя в целях упрощения процесс фотосинтеза разбит на три стадии, необходимо помнить, что поглощение света, транспорт электронов и генерация электрохимического градиента в действительности очень тесно сопряжены. [c.333]
Ч-электрон), за тщ следует D-атом (протон + нейтрон + электрон) и Т-атом (протон + 2 нейтрона + электрон). Далее идет атом Пе (2 протона + 2 нейтрона + 2 электрона) и т.д. Благодаря обменным взаимодействиям, происходящим при обркзовании ядра атома (комбинация протонов и нейтронов), выделяющаяся при этом энергия очень велика. Соответственно для разрушения ядра необходимо затратить такое же количество энергии. Например, для расщепления ядра дейтерия на протон и нейтрон нужно сообщить ядру энергию, равную 2,14 10 кДж- моль Ч При химических реакциях такое количество энергии никогда не выделяется, вследствие чего атомные ядра в химических превращениях выступают как неизменяющаяся комбинация протонов и нейтронов. Напротив, при объединении протона с электроном в атом водорода выделяется всего лишь 1310 кДж моль- . Такая же энергия необходима и для расщепления атома водорода на протон и электрон потенциал ионизации), причем эта величина имеет тот же порядок, что и количество энергии, выделяющееся в результате химических реакций. То же самое можно сказать и о величине энергии, необходимой для взаимодействия атома водорода с электроном, равной 72 кДж-моль срод- [c.50]
Из всех типов химических реакций, используемых в коли-чествеииом анализе, окислительно-восстановительные — наиболее сложные по механизму. Тем не менее можно установить некоторую аналогию для окислительно-восстановитель-ных реакций и реакций кислотио-осиовного взаимодействия обмен протонов при кислотно-основном взаимодействии и обмен электронов в окислительно-восстановительных реакциях, восстановитель—донор электронов аналогичен кислоте — донору протонов, окислитель — аналог основания, окисленная и восстановленная формы составляют сопряженную пару подобно кислотной и основной формам соотношение концентраций этих форм количественно характеризует окислительную способность системы (потенциал системы) и кислотность (pH) соответственно. [c.259]
Способность элемента к образованию полимеров совершенно отчетливо связана с его положением в периодической системе Д. И. Менделеева. Место, занимаемое элементом в периодической системе, связано со строоеием элемента, с его атомным весом и, следовательно, с числом электронов р протонов, входящих в состав данного элемента. Внешние электроны, как известно, определяют химические свойства элемента, его валентность, потенциал ионизации и, таким образом, способность вступать в различны ) соединения и разнообразные химические реакции. [c.324]
Если УФ-спектры снимались в ходе электролиза, первый пик — соединение (L)—появлялся вначале пик, соответствующий продуктам реакции с растворителем, появляется лищь на подъеме кривой ток — время. Это рассматривается как указание на то, что в ряду реакций (9.18), (9.20), (9.21) —(9.23), приводящих к образованию аммиака и соединения, поглощающего в ультрафиолете, скоростьопределяющей стадией является стадия (9.20). Было замечено, что последовательность стадий (9.18) — (9.20), (9.23) зависит от потенциала, если соединение (XLVIII) быстро теряет протон, что, по-видимому, возможно, с другой стороны, последовательность стадий (9.18) — (9.23) не должна зависеть от потенциала, если скоростьопределяющей является химическая реакция (9.20). Следовательно, при высоких потенциалах должен осуществляться первый механизм, а при низких потенциалах — второй, так как было показано, что аммиак окисляется в той же области потенциалов, что и пропиламин, и поэтому должен реагировать, поскольку при низком потенциале он действительно образуется. В самом деле, электролиз н-пропиламина при высоких потенциалах приводит к тому, что пик на кривой ток — время не наблюдается и выходы углеводородов значительно понижаются по сравнению с электролизом при более низких потенциалах. Это подтверждает предположение, что реакция осуществляется по двум механизмам, на один из которых потенциал влияет, а на другой не влияет. [c.266]
Способность группы А—и участвовать в специфическом взаимодействии с образованием комплекса RAH- -BR можно охарактеризовать электронной заселенностью о-связи, которую, в свою очередь, можно характеризовать величиной Sau — интеграла перекрывания орбиталей Is (Н) и пр (А) [1, 2]. Степень участия атома или группы В в перераспределении электронной плотности при образовании комплекса RAH- -BR связана в значительной мере с прочностью связей п (или л)-электронов В с его остовом. При заметном вкладе атомных орбиталей В в верхнюю заполненную орбиталь молекулы BR прочность этой связи можно характеризовать величиной первого потенциала ионизации молекулы /вк [3]. Если рассматривать различные величины А, характеризующие связь А—Н, например частоту продольных колебаний V группы А—Н, химический сдвиг в ЯМР б для протона, дипольный момент связи А х и т. п., то можно ожидать, что в ряду сходных комплексов RAH- -BR с уменьшением интеграла 5ан и потенциала ионизации молекулы /br будет наблюдаться возрастание абсолютных величин нриращзний A4 [1, 2, 4, 5]. Можно ожидать, что сходным образом изменяются также и другие характеристики К) водородной связи, такие, как ее энергия Ai , величина заряда A(/, перенесенного от BR к RAH, заселенность р связи Н—В. Наличие такой антибатной зависимости между АА и К, с одной стороны, и величинами и /ва- — с другой, подтверждается анализом соответствующих экспериментальных данных [3, 6—9] [c.50]
При теоретическом рассмотрении зависимости между потенциалами полуволн гетероциклических систем и их химической структурой был использован простой метод МО ЛКАО [85, 86]. Например, для восстановления альдегидов типа С4НзО(СН = = СН) СНО (производные фурана, п=0, I, 2) показана удовлетворительная корреляция между потенциалом полуволны, экстраполированным к рН = 0, и разностью энергий я-электронов начального и конечного состояний (конечным состоянием здесь является радикал, образующийся после присоединения к карбонильной группе электрона и протона). Справедливо следующее уравнение 1/2=—2,80 + 4,32(0 (значение со см. [86]). Аналогично было рассчитано влияние индуктивного эффекта на потенциал полуволны 1-, 2-, 3- и 4-метоксиксантонов [87]. Полученные таким образом потенциалы полуволн находятся в превосходном соответствии с ожидаемыми значениями, исключая 1-метоксиксантон, для которого предполагается наличие водородной связи. Однако для изомерных альдегидов пиридина указанная выше зависимость не имеет места. [c.273]
В световой, или фотохимической, реакции световая энергия превращается в химический потенциал . Анализ первых этапов, на которых энергия захваченных протонов стабилизируется в форме химического потенциала, читатель может найти в работе Кельвина [6]. Многие биологи считают световую реакцию тождественной с реакцией фотолиза воды, хотя такая концепция оспаривается (см. стр. 270). В настоящее время показано, что первыми стабильными химическими индивидуальными продуктами световой реакции в растениях являются НАДФ-Нг и АТФ. [c.260]
Одной из первых моделей элементарного акта электродной реакции, в частности реакции переноса протона, сыгравшей исключительно важную роль в развитии электрохимической и вообще химической кинетики, является теория Хориучи—Поляни [16]. Эта теория, во многом сохраняющая свое значение и по настоящее время, позволила объяснить ряд основных закономерностей электрохимической кинетики, таких, как зависимость скорости реакции от потенциала и от энергии адсорбции промежуточного продукта реакции. [c.6]
А И что она растет с увеличением приложенного напряжения. Структуру таких тонких пленок невозможно та очень трудно изучать обычными спектроскопическими методами (дифракция электронов, инфракрасное поглощение и т.д.), поэтому приходится проводить комплексные исследования на основе анализа кривых катодного восстановления и данных оже-спектроскопии или упомянутой в гл. 3 электронной спектроскопии для химического анализа. Интересные результаты получены при исследовании содержания воды в пленке пассивного состояния- Термический анализ и исследования с использованием сверхтяжелой воды (Т2О) показали, что при длительном воздействии потенциала происходит депротонизация (удаление протонов) поверхности, приводящая к ее стабилизации. Химический состав пленки не является постоянным, обычно наблюдается образование специфического геля, состоящего из частиц различных гидратированных оксидов металла. Можно считать, что для железа подходит формула Р 20з геН20, однако возможно и образование комплексов Ге сОНг либо (в зависимости от внешних условий) с ОН, что приводит к десорбции молекул Н2О. Именно такое специфическое связывание содержащейся на поверхности воды и является, по-видимому, основной причиной коррозионной стойкости пленки пассивного состояния. Для полного понимания картины необходимы более детальные исследования, в частности, следует изучить, как меняется степень гидратации поверхности во времени. [c.195]
потенциал протона
#10558
2012-04-24 20:41 GMT

при движении протона в электрическом поле из точки А в точку В его кинетическая энергия остается неизменной ,при движении из точки А в точку С -уменьшается. Сравните потенциалы точек: А…В… С.Больше меньше или равно
мое решение:когда протон движется из точки А в точку В кинетическая энергия неизменна значит и потенциальная тоже( правильно?), т.е потенциал в точке А равен потенциалу в точке В. когда протон движется из А в С потенциальная энергия начинает падать, значит потенциал в точке С меньше потенциала в точке В.исходя из формулы потенциал=W/q. что-то я совсем запутался, верно ли всё это??
#10564
2012-04-24 22:59 GMT
про точки А и В правильное рассуждение. ты рассуждал, исходя из закона сохранения энергия.
теперь давай рассмотрим точки А и С. кинетическая энергия протона уменьшилась. значит, потенциальная увеличилась! закон сохранения все-таки. потенциальная энергия в каком случае увеличится? в том случае, если он придет в точку с большим потенциалом.
Нет границ, а есть лишь препятствия! И каждое препятствие можно преодолеть!
#10594
2012-04-27 17:26 GMT

спасибо большое вам за помощь. )
