Лабораторная
работа № 319
ОПРЕДЕЛЕНИЕ
ПОТЕНЦИАЛА ВОЗБУЖДЕНИЯ АТОМОВ
(опыт Франка и
Герца)
ВВЕДЕНИЕ
Гипотеза Бора о
существовании состояний атомов с
дискретными значениями (уровнями)
энергии Е1,
Е2,
Е3,…
нашла эксперимкнтальное подтверждение
в опыте Франка и Герца (1914г.).
В своем опыте они
изучали изменение кинетической энергии
ускоренных в электрическом поле
электронов при соударениях их с атомами
разреженных газов. В качестве газа
использовались пары ртути.
В стеклянной колбе
(рис.1), заполненной парами ртути при
низком давлении (р<1 мм.рт.ст.), имелись
три электрода: катод К, сетка С и анод
А.
Электроны,
вылетевшие из разогретого катода,
ускорялись в электрическом поле с
разностью потенциалов U
между катодом и сеткой. Эта разность
потенциалов могла плавно изменяться с
помощью потенциометра П. Между сеткой
и анодом создавалось слабое электрическое
поле противоположного направления,
тормозащее движение электронов от сетки
к аноду. Чтобы начальные скорости
(кинетические энергии) электронов,
вылеттающих из катода, не влияли на
результаты измерений, температура
катода была невысокой.

На рисунке 2
показана зависимость анодного тока Iа
от напряжения U
между катодом и сеткой. Видно, что вначале
с ростом напряжения U
анодный ток возрастает, но, достигнув
максимума при напряжении U1,
резко уменьшается. С дальнейшим повышением
напряжения U
анодный ток вновь растет до второго
максимума при напряжении U2
и вновь падает.
Наблюдаемая
зависимость Iа
от U
может быть объяснена следующим образом.

Вследствие
дискретности энергетического спектра
атомы могут поглощать энергию возбуждения
только порциями ΔЕ1=Е2–Е1,
ΔЕ2=Е3–Е1
и т.д. Пока энергия электронов, приобретенная
в электрическом поле (еU)
меньше ΔЕ1,
соударения их с атомами носят упругий
характер, и внутренняя энергия атомов
не меняется. В этом случае ускоренные
электроны проходят через сетку,
преодолевают задерживающее электрическое
поле и достигают анода. С увеличением
напряжения U
число таких электронов возрастает,
стало быть, растет и анодный ток.
Когда энергия
электронов, накопленная в электрическом
поле, достигает значения ΔЕ1
(т.е. еU1
становится равным ΔЕ1)
атомы, поглощая энергию, переходят в
возбужденное состояние, т.е. соударения
электронов с атомами становятся
неупругими. Напряжение U1
принято называть критическим, или
резонансным напряжением. Электроны,
передавшие энергию атомам при соударении,
продолжают движение с малой кинетической
энергией, недостаточной для преодолевания
задерживающего поля между сеткой и
анодом. Такие электроны улавливаются
сеткой, образуя сеточный ток. Анодный
ток при этом уменьшается.
Аналогичные
явления имеют место и при напряжениях,
кратных U1.
Так, при напряжении U2=2U1
электроны могут дважды испытать неупругие
соударения с атомами между катодом и
сеткой, при U3=3U1
– трижды и т.д. При каждом неупруном
соударении атомам передается энергия
равная ΔЕ1.
Следовательно, ΔЕ1
– наименьшая возможная порция (наименьший
квант энергии), которая может быть
поглощена атомом.
Если понизить
давление газа, то длина свободного
пробега электронов возрастает. На
большой длине пробега электроны могут
приобретать энергию, равную ΔЕ2=Е3–Е1
и более.
Поэтому при сильных
разрежениях могут наблюдаться максимумы,
соответствующие более высоким энергиям
возбуждения атомов.
Таким образом,
результаты опыта Франка и Герца являются
прямым доказательством существования
состояний атомов с дискретными значениями
энергии.
Экспериментальная
установка
Внешний вид
экспериментальной установки показан
на рис.3.

Электрическая
схема аналогична изображенной на рис.1.
Основным элементом установки является
лампа Л типа ВМ-2. напряжение между
катодом и сеткой регулируется
потенциометром П и измеряется вольтметром
U.
Анодный ток измеряется микроамперметром
А. Тумблером К включается питание
установки.
Порядок выполнения
работы
1. Включить установку
в сеть напряжением 220В.
2. Перевести тумблер
К в верхнее положение и через 2–3 минуты
прогрева накала лампы приступить к
измерениям.
3. Устанавливая с
помощью потенциометра П значения
напряжения U,
указанные в таблице 1, измерить
соответствующие значения анодного тока
I
(в делениях шкалы прибора).
Т А Б Л И Ц А 1
|
U,B |
2 |
4 |
6 |
8 |
10 |
58 |
60 |
||||||
|
I(дел) |
4. Результаты
измерения анодного тока Iа
занести в табл.1.
5. Выключить тумблер
К и отключить установку от сети.
6. По данным таблицы
1 построить график зависимости анодного
тока Iа
от напряжения между катодом и сеткой
U.
7. Из построенного
графика найти критические напряжения
U1
и U2.
8. Полученное
значение U1
сравнить с потенциалами возбуждения
Uвозб
различных атомов, приведенными в таблице
2. Ответить на вопрос: каким газом
наполнена лампа?
Т А Б Л И Ц А 2
|
Атомы |
Hg |
Zn |
He |
Na |
|||
|
Uвозб,В |
4,9 |
4,1 |
19,75 |
2,1 |
9. Рассчитать
энергию возбуждения атомов, заполняющих
лампу, в джоулях
ΔЕ1=еU1 (е=1,6·10–19Кл)
10. Определить длину
волны излучения атомов при переходе их
из возбужденного в невозбужденное
состояние.
λ=с/ν=сh/ΔЕ1 h=6,6·10–34Дж·с
с=3·108м/c
ПОСТУЛАТЫ БОРА
1. атомы могут
находиться в стационарных состояниях,
не изменяющихся во времени без внешних
воздействий. В этих состояниях атом не
излучает и не поглощает электромагнитные
волны.
2. В стационарном
состоянии атома электрон, двигаясь по
круговой орбите, должен иметь дискретные,
квантованные значения момента импульса.
Ln=me
νr=nħ n=1,2,3…
Где me
– масса электрона, ν
– скорость электрона, r
– радиус круговой орбиты, ħ=h/2π
(h
– постоянная Планка), n
– главное квантовое число.
3. При переходе
атома из одного стационарного состояния
в другое испускается или поглощается
квант энергии, равный разности энергий
этих состояний. Величина светового
кванта равна
hν=Eni–
Enj,
где Eni,
Enj
– энергия атома в двух стационарных
состояниях.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Как формулируются
квантовые постулаты Бора?
2. Какова цель опыта
Франка и Герца?
3. Какова схема
опыта Франка и Герца?
4. Какова роль
термоэлектронной эмиссии в данном
опыте?
5. Почему, изменяя
напряжение между катодами и сеткой,
можно управлять кинетической энергией
электронов?
6. Какие удары
называются упругими и неупругими?
7. Почему столкновения
электронов с атомами носят различнй
характер (упругие и неупругиу) в
зависимости от кинетической энергии
электронов?
8. Как объяснить
образование максимумов и минимумов на
анодной характеристике лампы?
9. Почему анодный
ток в минимумах не спадает до нуля?
10. Что происходит
с атомами после неупругого соударения
с электроном? К какой области спектра
относится вычисленная в данной работе
длина волны излучения атомов?
11. Можно ли в опыте
Франка и Герца установить значения
потенциалов возбуждения атомов более
высоких порядков, чем первый? Если можно,
как это осуществить?
ЛИТЕРАТУРА
1. Савельев В.И.
«Курс общей физики» Т.3 М.:Наука 1977
2. Детлаф А.А.,Яворский
Б.М. «Курс общей физики» Т.3 М.:Высш.школа
1979
3. Кортнев А.В.,
Рублев Ю.В., Куценко А.Н. «Практикум по
физике» М.:Высш.школа 1965
4. ЗисмангА., Тодес
О.М. «Курс общей физики» Т.3 Физматгиз
1979
5. Майсова Н.Н.
«Практикум по курсу общей физики»
М.:Высш.школа 1970.
Соседние файлы в папке КВ_МЕХ
- #
12.03.20151.34 Mб261BAZA.XLS
- #
- #
- #
- #
- #
- #
12.03.20152.29 Mб252~WRL2109.tmp
- #
12.03.201599.84 Кб254КП.XLS
- #
Решение.
Частота волн спектральных линий водорода всех серий определяются формулой:
[ nu =frac{c}{lambda }=Rcdot ccdot (frac{1}{{{k}^{2}}}-frac{1}{{{n}^{2}}}) (1). ]
с = 3∙108 м/с, с – скорость света, R – постоянная Ридберга, R = 1,097737∙107 м-1.
Первый потенциал возбуждения U1 атома водорода соответствует переходу электрона с невозбужденного уровня k = 1 на n = 2. Из (1) определим частоту волны:
ν = 2,469∙1015 Гц.
Первый потенциал возбуждения U1 атома водорода определяется уравнением:
е∙U1 = А1 (2),
где А1 – работа удаления электрона с невозбужденной орбиты на первую возбужденную, е – модуль заряда электрона, е = 1,6∙10-19 Кл.
По второму постулату Бора:
[ {{A}_{1}}={{W}_{1}}-{{W}_{2}}=hcdot nu (3). ]
h = 6,63∙10-34 Дж∙с, h – постоянная Планка.
Подставим (3) в (2) определим потенциал возбуждения U1 атома водорода:
[ {{U}_{1}}=frac{hcdot nu }{e}. ]
U1 = 10,2155 В.
Ответ: 10,2155 В.
Excitation and Ionization Potential of an Atom
Excitation is the addition of a discrete amount of energy to a system such as an atomic nucleus, an atom, or a molecule. It is the result of energy being given to an electron moving it to a higher energy level. Ionization potential is the amount of energy required to remove the most loosely bound electron from a neutral, gaseous atom. If enough energy is given to the electron to remove it from the atom ionization has occurred.
According to Bohr’s theory, there are certain discrete orbits permitted for the motion of the electron. An electron can revolve in these orbits without radiating energy. An atom is said to be in the ground state when its energy is least. Before an atom can emit spectral radiation, the electron in it has to be raised to a higher orbit. This process is known as the excitation of the atom. The energy required to raise an atom from its normal state into an excited state is called the excitation potential energy of the atom. If the energy supplied to an electron is such that the electron is lifted from its ground state to one of the higher allowed orbits, the atom will be excited and the energy supplied is called excitation energy or excitation potential. For example, the energy required to transfer the electron in a hydrogen atom from the ground state to the first excited state = (13.6-3.4) = 10.2eV. The energy required to raise it to the second excited state = (13.6 – 1.51) = 12.09 eV. The potentials corresponding to these energies are called as the excitation potentials.
Excitation explains the movement of an electron from a lower energy level to a higher energy level. Ionization potential explains the removal of an electron from an energy level completely.
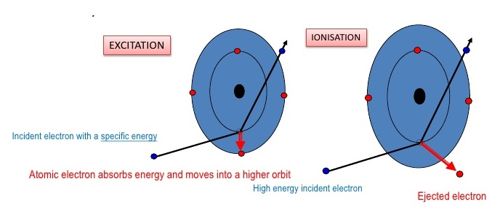
The ionization potential is that accelerating potential which makes the impinging electron acquires sufficient energy to knock out an electron from the atom and thereby ionize the atom. If the energy supplied to an electron is such that the electron is lifted from its ground state to an orbit at infinity, the atom is said ion ionized, and the energy supplied is called the ionization energy or ionization potential. For a hydrogen atom, the energy required to remove an electron from the first orbit to its outermost orbit (n=∞) 13.6-0=13.6eV. This energy is known as the ionization potential energy for a hydrogen atom. 13.6 V is the ionization potential of a hydrogen atom. The energy is so much that the electron disengages it from the atom but its kinetic energy outside the atom is zero.
The excitation potential and ionization potential are called the critical potentials of the atom. Excitation and ionization potential in chemistry are two terms used to explain the relationship between energy changes and the atomic behavior of chemical elements. The critical potential of an atom is defined as the minimum potential required to excite a free neutral atom from its ground state to a higher state.
