Как определить массовую долю раствора
Массовая доля раствора – это химический термин, который может пригодиться при решении задач во время контрольной или самостоятельной работы, а также при выполнении расчетной части практических заданий. Однако не следует думать, что если золотое учебное время закончено, то больше эти знания не пригодятся. Во-первых, подрастающее поколение может подойти к родителю с вопросом по данной теме. А во-вторых, расчет массовой доли может понадобиться, например, для определения концентрации лекарственных или пищевых растворов (уксуса). Не менее важно применять знания при расчете количества удобрений.

Вам понадобится
- Ручка, бумага, калькулятор
Инструкция
Массовая доля – это отношение массы растворенного вещества к массе раствора. Причем она может измеряться или в процентах, тогда для этого полученный результат нужно умножить на 100% или в массовых долях (в этом случае единиц измерения не имеет).
Любой раствор состоит из растворителя (вода – наиболее распространенный растворитель) и растворенного вещества. Например, в любом растворе соли растворителем будет вода, а в качестве растворенного вещества будет выступать сама соль.
Для расчетов необходимо знать хотя бы два параметра – массу воды и массу соли. Это даст возможность рассчитать массовую долю вещества в растворе, которая обозначается буквой w (омега).
Пример 1. Масса раствора гидроксида калия (KOH) 150 г, масса растворенного вещества (KOH) 20 г. Найдите массовую долю щелочи (KOH) в полученном растворе.
m (KOH) = 20 г
m (KOH) = 100 г
w (KOH) – ?Существует формула, по которой можно определить массовую долю вещества.
w (KOH) = m (KOH) / m (раствора (KOH) х 100%Теперь рассчитайте массовую долю растворенного вещества гидроксида калия (KOH):
w (KOH) = 20 г / 120 г х 100% = 16,6 %
Пример 2. Масса воды 100 г, масса поваренной соли 20 г. Найдите массовую долю хлорида натрия в растворе.
m (NaCl) = 20 г
m (воды) = 100 г
w (NaCl) – ?Имеется формула, по которой можно определить массовую долю вещества.
w (NaCl) = m (NaCl) / m (раствора NaCl) х 100%Прежде чем воспользоваться данной формулой, найдите массу раствора, которая состоит из массы растворенного вещества и массы воды. Следовательно: m (раствора NaCl) = m (растворенного вещества NaCl) + m (воды)Подставьте конкретные значения
m (раствора NaCl) = 100 г + 20 г = 120 гТеперь рассчитайте массовую долю растворенного вещества:
w (NaCl) = 20 г / 120 г х 100% = 16,7 %
Полезный совет
При расчете не путайте такие понятия, как масса растворенного вещества и массовая доля растворенного вещества
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Массовая доля соли
Найдите массовую долю соли в полученном растворе, если к раствору хлорида кальция (CaCl2) массой 140 грамм с массовой долей 10% добавили 10 грамм этой же соли и 25 миллилитров воды (H2O).
Решение задачи
Для удобства решения задачи я предлагаю исходный раствор обозначить как 1 раствор, а полученный как 2 раствор.
Итак, запишем общую формулу для нахождения массовой доли соли в полученном растворе:
![]()
Учитывая, что после добавления хлорида кальция (CaCl2) масса соли изменилась, получаем:
![]()
Используя формулу, нахождения массовой доли соли в исходном растворе:
![]()
найдем массу исходного вещества хлорида кальция (CaCl2) в 1 растворе по формуле:
![]()
m1 (вещества) = 140 ⋅ 0,1 = 14 (г).
Если раствор 10-процентный, то массовая доля соли хлорида кальция (CaCl2) в нем 0,1.
Найдем массу второго вещества хлорида кальция (CaCl2) во 2 растворе:
m2 (вещества) = 14 + 10 = 24 (г).
После добавления воды и хлорида кальция (CaCl2) изменилась масса полученного раствора:
![]()
Используя вышеуказанную формулу, вычислим массу полученного раствора:
m2 (раствора) = 140 + 25 + 10 = 175 (г).
Так как плотность воды (H2O) равна 1 г/мл, то объём будет численно равен массе.
Найдем массовую долю соли хлорида кальция (CaCl2) во 2 растворе:
![]()
Ответ:
массовая доля соли 0,14.
|
Yevgeniyaya 3 месяца назад
Для засолки огурцов используют 5 %-ный раствор поваренной соли (плотность 1,1 г/см³). Найдите массу и количество вещества соли, необходимые для приготовления 5 л такого раствора. (Габриелян. Химия. 8 класс. Параграф 22, №6) ПётрАлексаныч Корректна ли задача: не задано количество раствора в объёмных или весовых единицах. При этом спрашивается о количестве NaCl, необходимых для этого.
Грустный Роджер более месяца назад Процентная концентрация считается как отношение массы растворённого вещества к массе раствора. 5 литров раствора с плотностью 1,1 означает массу раствора в 5,5 кг. Значит, соли нужно взять 5% от этого количества, то есть 5,5*0,05 = 275 г. комментировать
в избранное
ссылка
отблагодарить Знаете ответ? |
Цель работы состоит в приготовлении раствора с заданной массовой долей путём растворения рассчитанной массы твёрдого вещества в определённом объёме воды.Рассчитайте массу твёрдого вещества, необходимого для приготовления раствора, в соответствии с вашим вариантом задания (табл. 3). На весах отмерьте рассчитанную массу твёрдого вещества и перенесите его в химический стакан.
Рассчитайте массу воды, необходимой для приготоления раствора. Поскольку плотность воды равна 1 г/мл, рассчитанная вами масса воды численно равна её объёму. С помощью мерного цилиндра отмерьте вычисленный объём воды и прилейте его к веществу в стакане. Перемешивая содержимое стакана стеклянной палочкой, добейтесь полного растворения вещества в воде.
Таблица 3
Варианты заданий для выполнения практической работы №3
| Вариант | Растворенное вещество | Масса раствора, г | Массовая доля растворенного вещества, % |
|---|---|---|---|
| 1 | Поваренная соль | 80 | 10 |
| 2 | Сахар | 150 | 5 |
| 3 | Сода питьевая | 50 | 2 |
| 4 | Натриевая селитра | 70 | 10 |

reshalka.com
ГДЗ учебник по химии 7 класс Габриелян. Практическая работа №3. Номер №1
Решение
1 вариант
Дано:
m (раствора) = 80 г
w (поваренной соли) = 10% = 0,1
Найти:
m (поваренной соли) = ?
m (
H
2
O
) = ?
Решение:
m (поваренной соли) = m (раствора) * w (поваренной соли) = 80 * 0,1 = 8 г
m (
H
2
O
) = 80 − 8 = 72 г
Ответ: m (поваренной соли) = 8 г ; m (
H
2
O
) = 72 г
2 вариант
Дано:
m (раствора) = 150 г
w (сахара) = 5% = 0,05
Найти:
m (сахара) = ?
m (
H
2
O
) = ?
Решение:
m (сахара) = m (раствора) * w (сахара) = 150 * 0,05 = 7,5 г
m (
H
2
O
) = 150 − 7,5 = 142,5 г
Ответ: m (сахара) = 7,5 г ; m (
H
2
O
) = 142,5 г
3 вариант
Дано:
m (раствора) = 50 г
w (питьевой соды) = 2% = 0,02
Найти:
m (питьевой соды) = ?
m (
H
2
O
) = ?
Решение:
m (питьевой соды) = m (раствора) * w (питьевой соды) = 50 * 0,02 = 1 г
m (
H
2
O
) = 50 − 1 = 49 г
Ответ: m (питьевой соды) = 1 г ; m (
H
2
O
) = 49 г
4 вариант
Дано:
m (раствора) = 70 г
w (натриевой селитры) = 10% = 0,1
Найти:
m (натриевой селитры) = ?
m (
H
2
O
) = ?
Решение:
m (натриевой селитры) = m (раствора) * w (натриевой селитры) = 70 * 0,1 = 7 г
m (
H
2
O
) = 70 − 7 = 63 г
Ответ: m (натриевой селитры) = 7 г ; m (
H
2
O
) = 63 г
ЗАДАЧИ на Вычисление массы
растворенного вещества
Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе. Элемент ЕГЭ: 4.3.1. Расчёты с использованием понятий «растворимость», «массовая доля вещества в растворе».
Расчёты с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Раствор — это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности. Растворы состоят из растворителя (например, воды) и растворенного вещества.
Массовой долей растворенного вещества (ω) называют отношение его массы m(В) к массе раствора m(p).
ω(В) = m(В) : m(p)
Это безразмерная величина, поэтому выражается в долях единицы (изменяется от 0 до 1), но иногда выражается в процентах (тогда изменяется от 0 до 100 %).
Обозначение ω(В) аналогично обозначению ω(р. в-ва) или ω(в-ва);
обозначение m(В) аналогично обозначению m(р. в-ва) или m(в-ва);
обозначение m(р) аналогично обозначению m(р-ра),
где р-ра – сокращение слова «раствора», а р. в-ва и в-ва – сокращения слов «растворенного вещества».
Обратите внимание также на следующие обозначения:
m(в) — масса безводного вещества;
m(р-ля) — масса растворителя.
Соотношения между величинами, характеризующими раствор


Следует учитывать, что любой способ выражения содержания растворенного вещества в растворе дается в расчете на безводное вещество, даже если для приготовления раствора использован кристаллогидрат. Если для приготовления растворов используют не безводное вещество, а его кристаллогидрат, B • nH20, то масса растворителя (воды) рассчитывается по формуле: m(H20) = m(р) – m(кр.), где m(кр.) — масса кристаллогидрата, в граммах. Следует учитывать, что количество (моль) кристаллогидрата равно количеству (моль) безводного вещества, т.е. m(кр.) : М(кр.) = m(в) : М(в).
Молярная концентрация характеризует количество растворенного вещества, выраженное, в молях, содержащееся в 1 л раствора. Молярная концентрация вычисляется по формуле С = v / V, где С — молярная концентрация (измеряется в моль/л), v — количество вещества, V — объем раствора, измеренный в литрах. Часто размерность молярной концентрации обозначают символом М. Например, раствор с концентрацией 1 М (одномолярный раствор) содержит 1 моль растворенного вещества в 1л раствора, 0,1 М (децимолярный раствор) — 0,1 моль растворенного вещества в 1 л раствора и т. д.
Титр (Т) определяет массу растворенного вещества (в г), содержащуюся в 1 мл раствора: T = m / V.
Растворимость характеризует способность вещества растворяться в том или ином растворителе. Растворимость обозначается символом S, она равна концентрации насыщенного при данной температуре раствора. Чаще всего растворимость измеряют числом граммов вещества, способных раствориться в 100 г растворителя при данной температуре. Важно не путать растворимость с массовой долей вещества в растворе, так как растворимость показывает, сколько граммов растворенного вещества содержится в 100 г растворителя, а массовая доля — сколько граммов растворенного вещества содержится в 100 г раствора. Растворимость веществ зависит от температуры. Растворимость твердых веществ при повышении температуры, как правило, увеличивается, растворимость газов — уменьшается.
Приготовление растворов. Способы приготовления растворов: 1) Разбавление раствора водой; 2) Выпаривание воды из раствора; 3) Сливание двух растворов; 4) Выпадение кристаллов.

Способы приготовления растворов в задачах на Вычисление массы растворенного вещества
РЕШЕНИЯ ЗАДАЧ с использованием понятий «растворимость»,
«массовая доля вещества в растворе»
Задача № 1.
Приготовить 400 г водного раствора с массовой долей хлорида натрия в нём 5 %.
Правильный ОТВЕТ: m(NaCl) = 20 г, m(H2O) = 380 г.
Смотреть РЕШЕНИЕ задачи в тетради
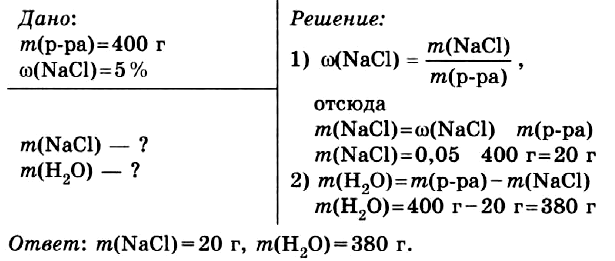
Задача № 2.
Найти массовую долю растворённого вещества (в %) в растворе, полученном при смешивании 450 г воды и 50 г сахара.
Правильный ОТВЕТ: ω(сах.) = 10%.
Смотреть РЕШЕНИЕ задачи в тетради

Задача № 3.
Вычислите молярную концентрацию 4%-ного раствора поваренной соли, плотность которого равна 1,027 г/мл.
Правильный ОТВЕТ: C(NaCl) ≈ 0,7 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 4.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 5.
При 25 °С растворимость хлорида калия в воде составляет 25 г соли на 100 г воды. Вычислите массовую долю соли в насыщенном растворе и его молярную концентрацию, если плотность насыщенного раствора равна 1,132 г/мл.
Правильный ОТВЕТ: ω(KCl) = 20%, С(KCl) = 3,04 моль/л.
Смотреть РЕШЕНИЯ заданий в тетради

Задача № 6.
Массовая доля соли в растворе, насыщенном при температуре 40 °С, равна 35%. При охлаждении 300 г этого раствора до температуры 10 °С в осадок выпадает 45 г соли. Определите растворимость соли при 10 °С.
Правильный ОТВЕТ: S10°С = 30,77 г.
Смотреть РЕШЕНИЯ заданий в тетради

Задачи с ответами
на Вычисление массы растворенного вещества
Задача № 7.
Масса нитрата калия, которую следует растворить в 150 г раствора с массовой долей этой соли 10% для получения раствора с массовой долей 12%, равна ______. (Записывайте ответ с точностью до десятых.)
Правильный ОТВЕТ: 3,4 г.
Задача № 8.
Плотность 10% -ного раствора хлорида калия составляет 1,063 г/мл. Определите массу (г) хлорида калия, который содержится в 750 мл такого раствора.
Правильный ОТВЕТ: 75,0 г.
Задача № 9.
Рассчитайте массовую долю (%) нитрата натрия в растворе, полученном при смешивании 250 г 10%-ного и 750 г 15%-ного растворов этой соли.
Правильный ОТВЕТ: 13,75 %.
Задача № 10.
Найдите массовую долю гидроксида натрия в растворе, молярная концентрация которого равна 3,08 моль/л, а плотность 1,12 г/мл.
Правильный ОТВЕТ: ω(NaOH) = 11%.
Задача № 11.
В 125 г воды растворили 25 г азотной кислоты. Вычислите титр образовавшегося раствора, если его плотность равна 1,095 г/мл.
Правильный ОТВЕТ: T(HNO3) = 0,182 г/мл.
Задача № 12.
Титр раствора сульфата аммония равен 0,223 г/мл, а его плотность — 1,115 г/мл. Рассчитайте массовую долю сульфата аммония в данном растворе и молярную концентрацию раствора.
Правильный ОТВЕТ: ω((NH4)2SO4) = 20%, C((NH4)2SO4) = 1,689 моль/л.
(с) В учебных целях использованы цитаты из пособий: «Химия / Н. Э. Варавва, О. В. Мешкова. — Москва, Эксмо (ЕГЭ. Экспресс-подготовка)» и «Химия : Новый полный справочник для подготовки к ЕГЭ / Е.В. Савинкина. — Москва, Издательство АСТ».
Вы смотрели Справочник по химии «ЗАДАЧИ на Вычисление массы растворенного вещества, содержащегося в определенной массе раствора с известной массовой долей; вычисление массовой доли вещества в растворе». Выберите дальнейшее действие:
- Перейти к Списку конспектов по химии (по классам)
- Найти конспект в Кодификаторе ОГЭ по химии
- Найти конспект в Кодификаторе ЕГЭ по химии
