Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического»
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой
(эта), измеряется в процентах или долях.
Также для расчётов может использоваться количественный выход:
I. Первый тип задач
Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
| 1. Записываем краткое условие задачи |
Дано: m (Mg) = 1,2 г m практическая(MgSO4) = 5,5 г _____________________ Найти: |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(Mg) = 24 г/моль M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль |
| 5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим |
II. Второй тип задач
Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
|
1. Записываем краткое условие задачи |
Дано: m(CaO) = 16,8 г
___________________ Найти: m практ (CaC2) = ? |
|
2. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
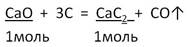 |
|
3. Находим по ПСХЭ молярные массы подчёркнутых веществ |
M(CaO) = 40 + 16 = 56 г/моль M(CaC2) = 40 + 2 · 12 = 64г/моль |
|
4. Находим количество вещества реагента по формулам |
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль |
|
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции |
|
|
6. Находим массовую (объёмную) долю выхода продукта по формуле |
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г Ответ: m практич (CaC2) = 15,36 г |
III. Третий тип задач
Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
| 1. Записываем краткое условие задачи |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = 28,56 л = 85% или 0,85 ____________________ Найти: m(Na2CO3) =? |
| 2. Находим по ПСХЭ молярные массы веществ, если это необходимо | M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль |
|
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы: |
Vтеоретич(CO2) = = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль |
|
4. Запишем УХР. Расставим коэффициенты. Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции. |
|
| 5. Находим количество вещества реагента по УХР |
По УХР:
ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
6. Определяем массу (объём) реагента по формуле: m = ν · M V = ν · Vm |
m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г |
IV. Решите задачи
Задача №1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
Задача №2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
Задача №3. Определите, какая масса меди вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
Задача №4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Задачи на выход продукта химической реакции. Как решать задачи на выход продукта реакции. Что такое выход продукта химической реакции. Теоретическое и практическое количество продукта химической реакции.
При решении задач на расчеты по уравнениям химических реакций мы принимаем, что в ходе реакции образуется точно рассчитанное количество продукта, исходя из мольного соотношения реагентов и продуктов. Количество продукта реакции, которое должно получится из реагентов согласно стехиометрическим расчетам — это теоретическое количество (масса, объем) или теоретический выход продукта реакции nтеор.
Однако на практике это соотношение не выполняется, и в большинстве случаев образуется меньшее количество продукта реакции, чем было рассчитано — практическое количество (масса, объем) или практический выход продукта реакции nпр.
Практический и теоретический выход не совпадают в силу разных причин — неэффективные соударения реагирующих частиц, побочные процессы, потери в ходе проведения реакции и т.д.
Обратите внимание! Понятия теоретического или практического количества реагента не существует. Ведь мы всегда берем определенное количество реагентов. А вот вступать в реакцию не полностью реагенты могут.
Массовая (мольная, объемная) доля выхода продукта реакции η или ω — это соотношение массы (количества вещества, объема) продукта, которая практически получена в ходе реакции, mпр., к массе (количеству, объему) продукта, которая рассчитана теоретически, mтеор.:
η = mпр./mтеор.
Массовую (мольную, объемную) долю выхода продукта реакции можно выражать в долях, а можно в процентах:
η = mпр./mтеор.·100%
Рассмотрим несколько задач на определение и использование выхода продукта реакции.
1. Какое количество вещества аммиака получится при действии избытка раствора гидроксида натрия на 500 г сульфата аммония, если выход в данной реакции 70%?
Решение.
2NaOH + (NH4)2SO4 = Na2SO4 + 2NH3 + 2H2O
Количество вещества сульфата аммония:
n((NH4)2SO4) = m/M = 500/132 = 3,79 моль
Теоретическое количество аммиака:
nтеор.(NH3) = 2·n((NH4)2SO4) = 2·3,79 = 7,58 моль
Зная мольную долю выхода продукта реакции, определим практический выход аммиака:
nпр.(NH3) = η·nтеор.(NH3) = 0,7·7,58 = 5,3 моль
Ответ: nпр.(NH3) = 5,3 моль
2. При хлорировании метана объемом 112 л (н. у.) получен дихлорметан массой 255 г. Определите долю выхода дихлорметана.
Решение.
CH4 + 2Cl2 = CH2Cl2 + 2HCl
Количество вещества метана:
n(CH4) = V/Vm = 112/22,4 = 5 моль
Теоретическое количество дихлорметана:
nтеор.(CH2Cl2) = n(CH4) = 5 моль
mтеор.(CH2Cl2) = M·nтеор.(CH2Cl2) = 85 г/моль·5 моль = 425 г
Масса дихлорметана, которая приведена в условии задачи — это практический выход дихлорметана.
Доля выхода дихлорметана:
η = mпр./mтеор. = 255/425 = 0,6 или 60%
Ответ: выход продукта реакции 60%
3. Определите массу оксида меди (II), которая потребуется для получения 500 г нитрата меди, если доля выхода в реакции взаимодействия оксида меди с HNO3 составляет 92%?
4. Определите объем (н.у., л) аммиака, который получится при действии избытка раствора гидроксида натрия на 48 г карбоната аммония, если выход в реакции составляет 70%?
5. Определите массу соли, г, которая образуется при растворении в избытке азотной кислоты 80 г оксида меди (II), если выход в реакции составляет 80%?
6. При термическом разложении 1700 г нитрата натрия было получено 174,4 л кислорода (н.у.). Определите массовую долю выхода в этой реакции.
7. Рассчитайте массу оксида магния, которая образуется при разложении гидроксида магния массой 50 г, если реакция разложений прошла с выходом 95,5%.
8. Какая масса бензола (кг) может получиться из 369,6 м3 (н.у.) ацетилена, если доля выхода бензола составила 65% от теоретически возможного?
9. Определите массу спирта, полученного при гидратации 40 л пропилена (н.у.), если доля выхода продукта реакции составляет 65% от теоретически возможного.
10. Определите долю выхода в реакции каталитического окисления аммиака кислородом, если при окислении 10 моль аммиака образуется 200 л оксида азота (II) при н.у.?
11. Пары брома объемом 20 л смешали с избытком водорода, в результате из смеси выделили 32 л бромоводорода. Определите долю выхода, %, если объемы газов измерялись при одинаковых условиях.
12. Оксид кальция массой 0,64 кг нагрели до 1200° С с достаточной массой оксида кремния (IV). Масса образовавшегося силиката кальция оказалась равной 1,024 кг. Определите выход (%) реакции соединения.
13. Из 36 г метанола было получено 24 г диметилового эфира. Рассчитайте выход реакции дегидратации
14. Углекислый газ объемом 6 л (н.у.) пропустили над раскалённым углем, продукт реакции пропустили через избыток известковой воды, после чего собрали 7,2 л (н.у.) газа. Определите степень превращения углекислого газа, %.
15. Определите массу, г нитрата аммония, которая содержалась в растворе, если при действии на этот раствор избытка гидроксида кальция выделилось 6 г аммиака. Реакция прошла с выходом 88,2 %.
16. При термическом разложении не загрязненного примесями карбоната кальция образовалось 20 г оксида кальция. Известно, что реакция прошла с выходом 85%. Вычислите массу карбоната кальция, взятого для проведения реакции разложений и объем (н.у.) образовавшегося углекислого газа.
17. Какой объем пропана (н.у.) потребуется для получения 42 г пропена, если доля выхода продуктов реакции составляет 60% от теоретически возможного?
18. При бромировании пентена-2 массой 8,4 г получен 2,3-дибромпентан массой 24,3 г. Определите долю выхода продукта реакции.
19. Из 69 г этанола получен бутадиен-1,3 массой 36,85 г. Определите массовую долю выхода продукта реакции.
20. При бромировании 5,4 г дивинила избытком брома образуется 28,2 г 1,2,3,4-тетрабромбутана. Определите выход продукта реакции.
21. Определите, какая масса 2-метилбутана необходима для получения 46,24 г изопрена, если доля выхода продукта реакции составляет 85%?
22. Определите объем метана, который потребуется для получения 63 л ацетилена (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
23. Определите, какую массу уксусного альдегида можно получить по реакции Кучерова из 11,2 л ацетилена (н. у.), если доля выхода продуктов реакции составляет 80% от теоретически возможного?
24. При действии избытка воды на 48 г технического карбида кальция, содержащего 10% примесей, образовался ацетилен объемом 10,08 л (н.у.). Определите долю выхода продукта реакции.
25. Определите массу технического карбида алюминия, содержащего 7% примесей, необходимого для получения 56 л метана (н.у.), если доля выхода продуктов реакции составляет 70% от теоретически возможного.
26. Из 179,2 л бутана (н.у.) с объемной долей примесей 25% двухстадийным синтезом получен бутанол-2 массой 159,84 г. Доли выхода продуктов на первой и второй стадиях одинаковы. Определите доли выхода продуктов реакций.
27. Циклогексан массой 16 г сожгли в избытке кислорода и полученный углекислый газ пропустили через избыток раствора гидроксида кальция, в результате чего выпал осадок массой 90 г. Определите массовую долю негорючих примесей в циклогексане, если доля выхода продуктов горения составляет 90% от теоретически возможного.
28. При нитровании 46,8 г бензола получен нитробензол массой 66,42 г. Определите выход продуктов реакции.
Здравствуйте! Друзья!
Сегодня
мы познакомимся и научимся решать ещё один тип расчетных задач, связанных с
вычислениями по уравнению химической реакции. Это расчетные задачи типа
«Определение выхода продукта реакции в процентах от теоретического».
На
уроке нам понадобятся:
1.
Периодическая система химических элементов Д. И. Менделеева.
2.
Калькулятор.
3.
И, как всегда, огромное желание научиться чему-то новому!
Желаю вам успехов!
Задачи
на вычисление выхода продукта реакции от теоретически возможного
Признак
В условии задачи встречается слово
«выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём,
практическая масса или объём» могут быть использованы только для
веществ-продуктов.
Массовая доля выхода продукта обозначается
буквой h (эта), измеряется в процентах или долях,
объёмная доля выхода продукта может обозначаться в различных источниках h (эта)
Также для расчётов может использоваться
отношения количеств веществ:
Первый
тип задач – Известны масса (объём) исходного
вещества и масса (объём) продукта реакции. Необходимо определить выход продукта
реакции в %.
Задача
1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили
соль массой 5, 5 г. Определите выход продукта реакции (%).
|
1. |
Дано: m(Mg) = 1,2 г mпрактическая (MgSO4) = 5,5 _____________________ Найти:
|
|
2. Запишем Под |
|
|
3. |
M(Mg) = 24 г/моль M(MgSO4) = 24 |
|
4. |
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 |
|
5. По |
m = ν · M mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) = = 120 г/моль · 0,05 моль = 6 г |
|
6. Находим |
Ответ: Выход сульфата магния составляет |
Второй
тип задач – Известны масса (объём) исходного
вещества (реагента) и выход (в %) продукта реакции. Необходимо найти
практическую массу (объём) продукта реакции.
Задача
2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид
кальция массой 16,8 г, если выход составляет 80%.
|
1. |
Дано: m(CaO) = 16,8 г
____________________ Найти: mпракт (CaC2) = ? |
|
2. Запишем Под |
|
|
3. |
M(CaO) = 40 + 16 = 56 M(CaC2) = 40 + |
|
4. |
ν(CaO) = 16,8 (г) / 56 |
|
5. По |
|
|
6. Находим |
mпрактич (CaC2) = 0,8 Ответ: mпрактич (CaC2) = 15,36 |
Третий
тип задач – Известны масса (объём) практически
полученного вещества и выход этого продукта реакции. Необходимо вычислить массу
(объём) исходного вещества.
Задача
3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу
карбоната натрия нужно взять для получения оксида углерода (IV)
объёмом 28,56 л (н. у.). Практический выход продукта 85%.
|
1. |
Дано: н. у. Vm = 22,4 л/моль Vпрактич(CO2) = φ = 85% или 0,85 _____________________ Найти: m(Na2CO3) =? |
|
2. Находим |
M (Na2CO3) =2·23 + |
|
3. |
Vтеоретич(CO2) = Vпрактич(CO2) / 0,85 = 28,56 л / 0,85 = 33,6 л ν(CO2) = 33,6 |
|
4. Запишем Под |
|
|
5. |
По УХР: , следовательно ν(Na2CO3) = ν(CO2) = 1,5 моль |
|
5. Определяем m V |
m = ν · M m (Na2CO3) = 106 |
Урок №20. Расчетные задачи типа «Определение выхода продукта реакции в процентах от теоретического».
Признак
В условии задачи встречается слово «выход». Теоретический выход продукта всегда выше практического.
Понятия «теоретическая масса или объём, практическая масса или объём» могут быть использованы только для веществ-продуктов.
Доля выхода продукта обозначается буквой (эта), измеряется в процентах или долях.
m практическая х100%
= m теоретичееская
V практический х100%
= V теоретичееский
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
1. Записываем краткое условие задачи
Дано:
m (Mg) = 1,2 г
m практическая (MgSO4) = 5,5 г
_____________________
Найти: =?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(Mg) = 24 г/моль
M(MgSO4) = 24 + 32 + 4 · 16 = 120 г/моль
4. Находим количество вещества реагента по формулам
ν(Mg) = 1,2 г / 24(г/моль) = 0,05 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
m = ν · M
mтеор (MgSO4) = M(MgSO4) · νтеор (MgSO4) =
= 120 г/моль · 0,05 моль = 6 г
6. Находим массовую (объёмную) долю выхода продукта по формуле
(MgSO4)=(5,5г ·100%)/6г=91,7%
Ответ: Выход сульфата магния составляет 91,7% по сравнению с теоретическим
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
1. Записываем краткое условие задачи
Дано:
m(CaO) = 16,8 г
=80% или 0,8
_________________
Найти:
m практ (CaC2) = ?
2. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
3. Находим по ПСХЭ молярные массы подчёркнутых веществ
M(CaO) = 40 + 16 = 56 г/моль
M(CaC2) = 40 + 2 · 12 = 64г/моль
4. Находим количество вещества реагента по формулам
ν(CaO)=16,8 (г) / 56 (г/моль) = 0,3 моль
5. По УХР вычисляем теоретическое количество вещества (νтеор) и теоретическую массу (mтеор) продукта реакции
6. Находим массовую (объёмную) долю выхода продукта по формуле
m практич (CaC2) = 0,8 · 19,2 г = 15,36 г
Ответ: m практич (CaC2) = 15,36 г
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
1. Записываем краткое условие задачи
Дано: н. у.
Vm = 22,4 л/моль
Vпрактич(CO2) = 28,56 л
= 85% или 0,85
____________________
Найти:
m(Na2CO3) =?
2. Находим по ПСХЭ молярные массы веществ, если это необходимо
M (Na2CO3) =2·23 + 12 + 3·16 = 106 г/моль
3. Вычисляем теоретически полученный объём (массу) и количество вещества продукта реакции, используя формулы:
Vтеоретич(CO2) =
= 28,56 л / 0,85 = 33,6 л
ν(CO2) = 33,6 (л) / 22,4 (л/моль) = 1,5 моль
4. Запишем УХР. Расставим коэффициенты.
Под формулами (из дано) напишем стехиометрические соотношения, отображаемые уравнением реакции.
5. Находим количество вещества реагента по УХР
По УХР:
, следовательно
ν(Na2CO3) = ν(CO2) = 1,5 моль
5. Определяем массу (объём) реагента по формуле:
m = ν · M
V = ν · Vm m = ν · M m(Na2CO3) = 106 г/моль · 1,5 моль = 159 г
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
ДЗ
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Первый тип задач – Известны масса (объём) исходного вещества и масса (объём) продукта реакции. Необходимо определить выход продукта реакции в %.
Задача 1. При взаимодействии магния массой 1,2 г с раствором серной кислоты получили соль массой 5, 5 г. Определите выход продукта реакции (%).
Второй тип задач – Известны масса (объём) исходного вещества (реагента) и выход (в %) продукта реакции. Необходимо найти практическую массу (объём) продукта реакции.
Задача 2. Вычислите массу карбида кальция, образовавшегося при действии угля на оксид кальция массой 16,8 г, если выход составляет 80%.
Третий тип задач – Известны масса (объём) практически полученного вещества и выход этого продукта реакции. Необходимо вычислить массу (объём) исходного вещества.
Задача 3. Карбонат натрия взаимодействует с соляной кислотой. Вычислите, какую массу карбоната натрия нужно взять для получения оксида углерода (IV) объёмом 28,56 л (н. у.). Практический выход продукта 85%.
ДЗ
№1. При взаимодействии натрия количеством вещества 0, 5 моль с водой получили водород объёмом 4,2 л (н. у.). Вычислите практический выход газа (%).
№2. Металлический хром получают восстановлением его оксида Cr2O3 металлическим алюминием. Вычислите массу хрома, который можно получить при восстановлении его оксида массой 228 г, если практический выход хрома составляет 95 %.
№3. Определите, какая масса мели вступит в реакцию с концентрированной серной кислотой для получения оксида серы (IV) объёмом 3 л (н.у.), если выход оксида серы (IV) составляет 90%.
№4. К раствору, содержащему хлорид кальция массой 4,1 г, прилили раствор, содержащий фосфат натрия массой 4,1 г. Определите массу полученного осадка, если выход продукта реакции составляет 88 %.
Решение задач по теме
«Практическое применение объемов многогранников»»
Цели урока:
-
Закрепить умение решать задачи на вычисление объемов многогранников.
-
Показать практическое применение математических знаний в жизни.
-
Развивать пространственное воображение, интерес к предмету
Оборудование: компьютер, проектор, экран
Ход урока.
-
Организационный момент.
Тема нашего урока Практическое применение объемов многогранников. Откройте, пожалуйста, тетради, запишите число, классная работа, тема урока. В этом году вы оканчиваете школу, вам предстоит выбрать профессию, и вы должны знать, как вам может помочь геометрия в вашей профессиональной деятельности. Сегодня на уроке мы рассмотрим , как на практике можно использовать полученные вами знания по теме «Объемы многогранников».
-
Повторение и систематизация пройденного материала.
Фронтальный опрос, но сначала давайте вспомним
-
Перечислите свойства объема.
-
По какой формуле вычисляется объем прямоугольного параллелепипеда?
-
Назовите формулу, с помощью которой мы можем найти объем куба.
-
По какой формуле вычисляется объем прямой призмы? V = Sосн
H
-
Решение задач устно. Представьте, что вы находитесь на строительной площадке, работаете прорабом. Вам привезли кирпичи, сложенные в штабели
-
Как определить количество кирпичей, сложенных в штабель прямоугольной формы, если все кирпичи уложены в одну сторону?
-
Вы шеф – повар детского санатория. Вам выдали кусок масла в виде куба со стороной 15см.Вы должны разрезать его на маленькие кубики с ребром 3 см.Хватит ли вам этого масла, чтобы получилось 112 порций? /125/.
-
Вы директор продуктовой базы. Завод – производитель предложил вам определенное количество мороженого с большой скидкой. Как вы сможете определить полезную емкость 4-камерного ледяного склада, если каждая камера имеет форму прямоугольного параллелепипеда с внутренними размерами 6×5×3? /360 м3/.
-
Работа по карточкам.
Проверка работ по карточкам.
Мыслитель древности П. Рамус сказал: «Геометрия – это наука хорошо измерять».
Многогранники и тела вращения имеют широкое распространение в окружающем нас мире. Геометрия вышла из практических нужд человека, связанных с измерением земельных участков, вычислением площадей и объёмов фигур. Этот мир геометрии окружает нас с самого рождения. Ведь всё, что мы видим вокруг: прямоугольник – окна, дома-параллелепипеды, загадочный узор снежинки, капля воды – всё так или иначе относится к геометрии, ничто не ускользает от её внимательного взгляда. Вспомним известные архитектурные изображения.
Слайд Александрийский маяк. В 285 году до н.э.на острове Фарос архитектор Сострат Книдский приступил к строительству маяка. Маяк строился пять лет и получился в виде трехэтажной башни высотой 120 метров. В основании он был квадратом со стороной тридцать метров, первый 60-метровый этаж башни был сложен из каменных плит и поддерживал 40-метровую восьмигранную башню, облицованную белым мрамором. На третьем этаже, в круглой, обнесенной колоннами башне, вечно горел громадный костер, отражавшийся сложной системой зеркал.
Египетские пирамиды. Почти пять тысяч лет стоит эта огромная пирамида. Высота её достигала 147 м (сейчас из-за обвала вершины её высота равна 137 м), а каждая из сторон по длине составляет 233 м. Для того чтобы обойти пирамиду Хуфу кругом, нужно пройти около километра. Вплоть до конца XIX в. пирамида Хуфу являлась самым высоким сооружением на земле. Её грандиозные размеры поражали всех, кто был в Египте. Недаром первые русские путешественники, попавшие в Египет, называли пирамиды “рукотворными горами”.
Башня Сююмбике. Главная достопримечательность казанского Кремля – семиярусная проездная башня Сююмбике высотой 58 метров
Она относится к «падающим» башням (как, например, Пизанская башня), так как имеет заметный наклон в северо-восточную сторону. На сегодняшний день отклонение её шпиля от вертикали составляет 1,98 м
Башня построена царицей Сююмбике в память своего мужа Сафа-Гирея, умершего в 1549 году.
Мечеть Кул-Шариф Кул-Шариф – главная мечеть Казани и Татарстана. Расположена в западной части Кремлевского комплекса, во дворе бывшего Юнкерского училища. Самая высокая в Европе. Ориентация мечети на Мекку была определена с точностью до сотой доли секунды через спутник. 57-метровые минареты уступают по высоте главному символу Казанского кремля – башне Сююмбике всего два метра. По замыслу архитекторов купол напоминает “казанскую шапку” – корону казанских ханов, которая хранится в Оружейной палате в Москве.
Но наши дома должны быть не только красивы, но и удобны для жителей. Когда человеку уютно, приятно, спокойно, он говорит что ему комфортно.
Оказывается, комфортность определяется формой помещения, его линейными размерами. Коэффициент комфортности можно найти по формуле:
K = 36πV2 / S3 , где K – изопериметрический коэффициент комфортности, V – объем жилища, S – полная поверхность жилища, включая и пол. Если вам предстоит работать в риэлтерской фирме, то эта формула может стать настоящим помощником при продаже жилья.
И чем меньше этот коэффициент, тем комфортнее жилище. Сейчас мы найдем коэффициент комфортности этого кабинета
-
Решение задач.
-
Кабинет имеет линейные размеры 6
м3.Найти коэффициент комфортности.
Решение: К = 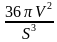
V = 6
S = 2Sосн + РН
S = 2


К = 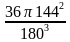
Ответ: 0,4
Домашнее задание: вычислить коэффициент комфортности своей квартиры покомнатно.
Скажите, пожалуйста, ребята, как вы думаете, представителю какой профессии может быть полезна эта формула? (архитектору, риэлтору)
-
Строителям необходимо вырыть канал. Перпендикулярное сечение канала – равнобедренная трапеция с основаниями 6м и 14м. Участок канала между шлюзами длиной 2км вмещает 6
104 м3 воды. Определите глубину канала.
Р


Sосн = 6

h=30: (6 + 14)
ответ: 3м.
-
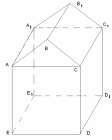
К
акое количество зерна вмещает склад, имеющий размеры пола 8м*30 м, максимальная высота склада 5м, минимальная высота склада 3м.Плотность зерна 666 кг/куб.м
Решение:
Дано: пятиугольная призма,
ED=8 м, DD1=30м, BH=5м, CD=3м, ρ=666 кг/м3
Найти: m
Решение: V=Sосн∙H, Sосн= Sпрям+ S
Sпрям=3∙8=24 (м2), 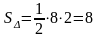
V=32∙30=960 м3,
m= ρ∙V, m=666∙960=639360 кг=639,36 т.
Ответ: 639,36 т.
А в заключение я хочу сказать: «Если у вас плохое настроение, вы устали, возьмите интересную геометрическую задачу, сделайте большой и красивый чертёж и …». Поверьте, хорошая геометрическая задача может прекрасно заменить самого лучшего психотерапевта.
Вариант 1 Фамилия_________________________________________
-
Выберите неверное утверждение.
-
За единицу измерения объемов принимается куб, ребро которого равно единице измерения отрезков;
-
Тела, имеющие равные объемы, равны;
-
Объем прямоугольного параллелепипеда равен произведению трех его измерений;
-
Объем куба равен кубу его ребра.
-
Площадь полной поверхности куба равна 150см2. Найдите объем куба.
-
150см3 b)25см3 c)250 см3 d)105 см3 e)125 см3
-
Как изменится объем правильной четырехугольной призмы, если ее высоту увеличить в n раз?
-
Не изменится; Увеличится в n раз; Уменьшится в n раз; Уменьшится в 2n раз.
-
Запишите формулу для вычисления площади полной поверхности прямой призмы
-
Запишите формулу для вычисления площади прямоугольника
________________________________________________
Вариант 2.Фамилия________________________________________
-
Выберите верное утверждение.
-
За единицу измерения объемов принимается квадрат, сторона которого равна единице измерения отрезков;
-
Если тело составлено из нескольких тел, имеющих общие внутренние точки, то его объем равен сумме объемов этих тел;
-
Объем прямоугольного параллелепипеда равен произведению трех его измерений на длину диагонали параллелепипеда;
-
Равные тела имеют равные объемы.
-
Объем куба равен 27м3. Найдите площадь полной поверхности куба.
-
36 см2;
-
9 см2;
-
108 см2;
-
27 см2;
-
54 см2.
-
Как изменится объем правильной четырехугольной призмы, если ее высоту уменьшить в n раз?
-
Не изменится;
-
Увеличится в n раз;
-
Уменьшится в n раз;
-
Уменьшится в 2n раз.
-
Запишите формулу для вычисления площади полной поверхности прямоугольного параллелепипеда
_________________________________________________________________
-
Запишите формулу для вычисления площади трапеции
___________________________________________________

А D
Объем призмы.
49. Что значит, измерить объём тела? /Выразить его числом/.
50. Почему мы считаем, что объёмы двух одинаковых спичечных коробков равны?
51. Из скольких кубиков с ребром 3 см каждый можно составить куб с ребром 15 см2 ? /125/.
52. Определите полезную емкость 4-камерного ледяного склада на 60 т, если каждая камера имеет форму прямоугольного параллелепипеда с внутренними размерами 6×5×3. /360 м3/.
53. Как определить количество кирпичей, сложенных в штабель прямоугольной формы?
54. Два свинцовых куба с ребрами 6 см и 5 см переплавлены в один куб. Определите ребро этого куба. /7 см/.
55. Объём куба 27 м3. Найти его поверхность. /54 м2/.
56. Найдите ребро такого куба, у которого полная поверхность и объем численно равны. /6/.
57. Поверхность куба 150см2. Найдите его объем. /125 м3/.
Объем пирамиды
69. Сколько достаточно иметь данных, чтобы определить объём правильной четырехугольной пирамиды. /2/.
70. Диагональное сечение правильной четырехугольной пирамиды – равносторонний треугольник со стороной 6 см. Найти объём пирамиды. /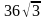
71. Определите объём правильной четырехугольной пирамиды, каждое ребро которой равно 6 см. /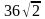
72. Сколько можно построить правильных пятиугольных пирамид заданного объема, зная высоту пирамиды? /Одну/.
73. Равновелики ли две пирамиды с равными высотами, если их основаниями являются четырехугольники с соответственно равными сторонами?
/Нет/.
Как сказал мыслитель древности П. Рамус: «Геометрия это наука хорошо измерять». Мы продолжим сегодня измерять цилиндр и покажем, что целесообразно измерить в той или иной ситуации, и зачем это нужно делать.
На прошлом уроке группа учащихся получила следующее задание: Молокозавод решил сделать новую, более экономичную упаковку для молока. Требуется сделать пакет для 1 литра молока, истратив на это как можно меньше материала. Какой формы пакет выгоднее сделать? Предложены следующие варианты: в форме куба, в форме шара, в форме цилиндра с квадратным осевым сечением, в форме конуса с осевым сечением в виде правильного треугольника, в форме правильного тетраэдра.
Итог урока.
1). Вопросы к учащимся: Что делали вы на уроке?
Что было самым интересным?
Что было главным на уроке?
Что понравилось?
. На столе находятся модели геометрических тел, накрытые скатертью. Это различного вида призмы, параллелепипеды, пирамиды, конусы, цилиндры, шары, сферы.
Вызываются к доске по одному человеку от каждой команды (обычно это студенты базового уровня знаний) и предлагается осмотреть набор моделей в течение одной минуты. После осмотра набор моделей вновь накрывается скатертью. Играющие должны выполнить “инвентаризацию”, то есть записать на доске названия фигур и выполнить от руки их изображения. (На составление списка и выполнение изображений отводится 3-4 минуты
I. Кто быстрее?
А) Слова на букву «К»
1.Геометрическая фигура.
2.Произведение гипотенузы на косинус прилежащего угла.
3.Прямая, имеющая с окружностью только одну общую точку.
4.Отношение прилежащего катета к гипотенузе.
Б) Слова на букву «П»
1)Наука, изучающая свойства фигур на плоскости.
2)Если 36см2 = S кв, то 24 см – ?
3)Геометрическая фигура, все углы которой равны.
4)Отрезок, соединяющий основание наклонной и перпендикуляра.
II. Кто больше? (За 2 мин записать формулы для вычисления площади
треугольника и прямоугольника).
Решить задачи.
1.В шар радиуса R вписан прямоугольный параллелепипед, диагональ которого составляет с одной из граней угол α , угол между диагональю этой грани и стороной основания 60°.Найдите объем параллелепипеда.
(R3√3cosαsin2α)
2.В прямоугольном параллелепипеде помещены 2 шара радиуса k так, что каждый касается другого шара и пяти граней параллелепипеда. Найдите объем параллелепипеда. (16k³)
УЭ – 8 Самостоятельная работа (по вариантам).
I вариант
1) Объем прямоугольного параллелепипеда равен 96 см³, боковое ребро 8 см.
Чему равна площадь основания?
2) Диагонали куба 20 см. Найдите объем куба.
3) Основанием прямого параллелепипеда является квадрат со стороной 8√2 см. Диагональ боковой грани образует с плоскостями оснований угол α. Найдите объем параллелепипеда.
II вариант
1) Объем прямоугольного параллелепипеда равен 100 см³, площадь основания 25 см². Найдите высоту параллелепипеда.
2) Диагональ куба равна 10 см. Найдите объем куба.
3) В прямоугольном параллелепипеде основанием является квадрат. Диагональ параллелепипеда равна 6 дм и образует угол α с боковым ребром, имеющим с ней общее начало. Найдите объем прямоугольного параллелепипеда.
V = 6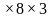
S = 2Sосн + РН
S = 2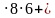


К = 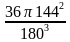
Ответ: 0,4

















 акое количество зерна вмещает склад, имеющий размеры пола 8м*30 м, максимальная высота склада 5м, минимальная высота склада 3м.Плотность зерна 666 кг/куб.м
акое количество зерна вмещает склад, имеющий размеры пола 8м*30 м, максимальная высота склада 5м, минимальная высота склада 3м.Плотность зерна 666 кг/куб.м