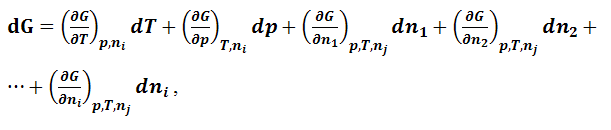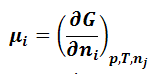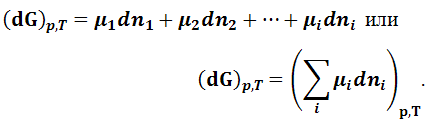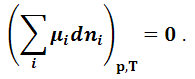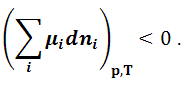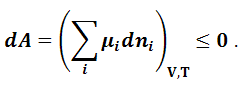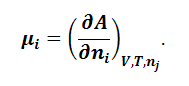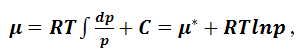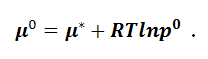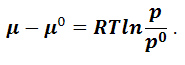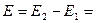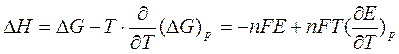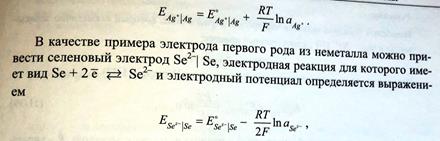При
протекании многих процессов количества
веществ в системе изменяются. Это
происходит, например, при фазовых
превращениях или в химических реакциях.
В таких процессах термодинамические
потенциалы (энергии Гиббса или Гельмгольца)
представляют собой функции не только
температуры, давления или объема, но и
количества веществ:
|
|
(1.9.1) |
где
n1,
n2,…ni
– количества компонентов в системе.
Полный дифференциал функции (1.9.1)
через частные производные можно выразить
в виде следующей суммы:
|
|
(1.9.2) |
где
индекс ni
при частных производных означает
постоянное количество всех компонентов,
а nj
– постоянное количество всех компонентов,
кроме того, изменение которого
рассматривается.
Частные производные
энергии Гиббса по количествам компонентов
в уравнении (1.9.2) называют химическими
потенциалами:
|
|
(1.9.3) |
–
химический потенциал i–го компонента.
Из последнего
выражения следует, что химический
потенциал i-го компонента равен приращению
энергии Гиббса при добавлении одного
моль этого компонента к большому объему
системы при постоянных температуре и
давлении.
Термин «большой
объем системы» означает, что состав
системы практически не изменяется после
добавления одного моль компонента. При
постоянных давлении и температуре два
первых слагаемых в уравнении (1.9.2)
обращаются в нуль. Поэтому получаем:
|
|
(1.9.31) |
Так
как при равновесии (dG)p,T = 0,
то условием равновесия в системе с
переменным количеством компонентов
будет:
|
|
(1.9.4) |
Условие
самопроизвольного протекания процесса:
|
|
(1.9.5) |
Для
других термодинамических потенциалов
(A,
U, H)
аналогично можно получить условия
самопроизвольного протекания процесса
и равновесия при соответствующих
постоянных условиях. Так, например, для
энергии Гельмгольца:
|
|
(1.9.6) |
При
этом химический потенциал определяется
как частная производная энергии
Гельмгольца по количеству компонента:
|
|
(1.9.7) |
Для
того чтобы получить взаимосвязь
химического потенциала с параметрами
состояния воспользуемся уравнением
(1.8.13).
При постоянной температуре оно будет
иметь вид:
|
|
(1.9.8) |
Для
одного моль вещества:
|
|
(1.9.9) |
После
интегрирования уравнения (1.9.9) будем
иметь:
|
|
(1.9.10) |
где
C – постоянная интегрирования, не
зависящая от давления, но зависящая от
температуры. Чтобы избавиться от
интеграла в уравнении (1.9.10), необходимо
знать зависимость между объемом и
давлением при постоянной температуре.
Для одного моль идеального газа эта
зависимость определяется уравнением
состояния: V
= RT/p.
После подстановки в (1.9.10) получим:
|
|
(1.9.11) |
где
μ*
– новая постоянная интегрирования.
При
р
=1 μ = μ*=μ0,
где μ0
– стандартный химический потенциал. При
этом за стандартное состояние принимают
состояние газа, в котором его давление
равно 1 атм, а температура – 298,15 К. В
системе SI стандартное давление равно
р0 = 1,013•105
Па, и стандартный химический потенциал
будет равен:
|
|
(1.9.12) |
Вычтем
уравнение (1.9.12) из (1.9.11):
|
|
(1.9.13) |
Обозначим
–
относительное давление, тогда уравнение
(1.9.13) запишется следующим образом:
|
|
(1.9.14) |
Последнее
уравнение справедливо для расчета
химического потенциала одного моль
идеального газа, если давление выражать
в любых единицах измерения. При этом
стандартное давление p0
необходимо выразить в тех же самых
единицах. Данное уравнение справедливо
также для расчета химического потенциала
компонента идеальной газовой смеси,
так как компоненты в идеальной газовой
смеси между собой не взаимодействуют,
и общий объем равен сумме объемов
отдельных газов, а общее давление –
сумме парциальных давлений. Для каждого
i-го компонента можно записать уравнение:
|
|
(1.9.15) |
Химический
потенциал неидеального газа можно
вычислить двумя способами. Первый
состоит в том, что для решения уравнения
(1.9.10) объем газа выражают через давление,
используя одно из уравнений неидеального
газа. При этом получаются громоздкие
уравнения, содержащие большое количество
постоянных, которые определяются опытным
путем.
Другой способ
предложил в 1901 году американский ученый
Льюис. В этом способе используются те
же выражения, что и для идеального газа,
но вместо давления в них подставляют
переменную f, называемую летучестью.
Летучесть определяют экспериментальным
путем различными способами.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Химический потенциал
Химический потенциал (mi), термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц. В случае системы, состоящей из i компонентов, химический потенциал определяется как приращение внутренней энергии U системы при добавлении к системе бесконечно малого количества молей i-того компонента, отнесённое к этому количеству вещества, при постоянных объёме V, энтропии S и количествах молей каждого из остальных компонентов nj (j ¹ i). В общем случае химический потенциал может быть определён как приращение любого из остальных потенциалов термодинамических системы при различных постоянных параметрах: гиббсовой энергии G — при постоянных давлении р, температуре Т и nj; гельмгольцевой энергии А — при постоянных V, Т и nj; энтальпии Н — при постоянных S, р и nj. Таким образом:
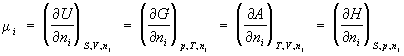
Химический потенциал зависит как от концентрации данного компонента, так и от вида и концентрации др. компонентов системы (фазы). Только в простейшем случае — смеси идеальных газов — mi зависит лишь от концентрации рассматриваемого компонента и от температуры:
mi = mi 0+ RT In pi,
где pi — парциальное давление компонента i в смеси, R — газовая постоянная, mi0 — значение mi при pi = 1 атм. Для смеси неидеальных газов в равенстве (2) должна стоять фугитивность этого компонента. Химический потенциал характеризует способность рассматриваемого компонента к выходу из данной фазы (путём испарения, растворения, кристаллизации, химического взаимодействия и т.д.). В многофазных (гетерогенных) системах переход данного компонента может происходить самопроизвольно только из фазы, в которой его химический потенциал больше, в фазу, для которой его химический потенциал меньше. Такой переход сопровождается уменьшением химического потенциала этого компонента в 1-й фазе и увеличением во 2-й. В результате разность между химическими потенциалами данного компонента в этих двух фазах уменьшается и при достижении равновесия химический потенциал компонента становится одинаковым в обеих фазах. В любой равновесной гетерогенной системе химический потенциал каждого компонента одинаков во всех фазах.
Если в различных фазах или в разных местах одной фазы химический потенциал какого-либо компонента неодинаков, то в системе самопроизвольно (без затраты энергии извне) происходит перераспределение частиц, сопровождающееся выравниванием химического потенциала.
Из условий термодинамического равновесия систем, в которых возможны химические реакции, фазовые переходы и др. процессы перераспределения частиц, и уравнения, учитывающего баланс частиц, вытекают важнейшие термодинамические соотношения: действующих масс закон, фаз правило Дж. У. Гиббса, основные законы разбавленных растворов (см. Вант-Гоффа закон, Рауля законы, Генри закон и др.) и т.д.
Химический потенциал в качестве нормировочной постоянной входит в распределение Больцмана, а также в распределения по энергиям Бозе — Эйнштейна и Ферми — Дирака для частиц идеального газа (см. Статистическая физика). Химический потенциал вырожденного газа электронов (ферми-газа) тождественно совпадает с граничной ферми энергией.
Химический потенциал был введён Гиббсом, численно выражается в единицах энергии на единицу количества вещества (дж/моль) или на единицу массы (дж/кг).
Лит. см. при статьях Термодинамика, Статистическая физика.
И. А. Кузнецов.
Величина ΔG 0 р-ции позволяет определить, будет ли данная реакция, находящаяся в стандартных условиях, протекать самопроизвольно в прямом или обратном направлении. Аналогично теплоте образования, энергии Гиббса образования простых веществ равны нулю.
Энергия Гельмгольца системы с определенной внутренней энергией (U), энтропией (S) при абсолютной температуре (Т) определяется уравнением:
Изменение энергии Гельмгольца для процессов (при постоянных температуре и объеме) можно определить соотношением:
ΔA — величина, которая не зависит от пути, а зависит только от исходного и конечного состояния системы, т.е. ΔA также, как и другие рассмотренные термодинамические величины, является функцией состояния.
Энергия Гельмгольца подобно энергии Гиббса связана с самопроизвольностью протекания процесса. Если допустить, что система изолирована, а объем и температура постоянны, то самопроизвольно будут протекать только те процессы, при которых А уменьшается.
а при ΔA=0 система находится в состоянии равновесия.
Энергию Гельмгольца и энергию Гиббса в стандартных состояниях можно связать с константой равновесия:
Где R– универсальная газовая постоянная, K – константа равновесия, Т – абсолютная температура.
Если K>>1, т.е. реакция идет в прямом направлении, то ΔG 0 ˂˂0.
В случае химической реакции, протекающей в гальваническом элементе при стандартных условиях ΔG 0 можно связать с ЭДС гальванического элемента следующим соотношением:
E 0 – электродвижущая сила, при условии что все вещества, принимающие участие в реакции, находятся в стандартном состоянии.
При самопроизвольном протекании процесса, его ΔG 0.
Порог реакционной способности веществ для большинства реакций имеет значение ΔG 0 ≈41 кДж/моль.
То есть, если ΔG 0 0 >+41 кДж/моль, то процесс неосуществим в любых реальных и стандартных условиях.
Характеристические функции. Уравнения Гиббса-Гельмгольца
Функция называется характеристической, если с помощью этой функции и ее частных производных можно определить все термодина-мические свойства системы (p, V, T, S и др.)
Наиболее часто употребляемыми в химической термодинамике из характеристических функций U, H, F, Z являются энергия Гиббса (G) и энергия Гельмгольца (F).
Рассмотрим энергию Гиббса как функцию давления и температуры т.е. G = f (T, p).
Полный дифференциал функции двух переменных можно записать как сумму частных производных этой функции по независимым переменным, умноженных на дифференциалы независимых переменных, т.е.
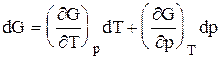
Но из уравнения (6.123)
Приравнивая коэффициенты при дифференциалах dT и dp в выражениях (6.123) и (6.126), получаем

Эти выражения (6.127) показывают, что частные производные от G дают в простом и явном виде такие свойства системы как S и V.
Аналогично для свободной энергии Гельмгольца, если ее рассматривать как функцию объема и температуры F = f (V,T).
Сравнивая это выражение с уравнением (17), получаем

Рассматривая энтальпию Н, как функцию давления и энтропии, т.е. H = f (p,S) и учитывая, что
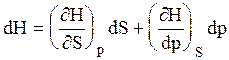
а также используя выражение (16)

Аналогично для внутренней энергии U = f (S,V)

С другой стороны dU = TdS – pdV.

Полученные выражения (6.127)-(6.130) показывают сущность метода характеристических функций, т.е. частные производные от функции состояния системы при соответствующем выборе независимых переменных дают в простом и явном виде термодинамические параметры системы.
Соотношения (6.127-6.130) имеют большое значение при решении различных физико-химических задач.
Для запоминания характеристических функций можно воспользова-ться диаграммами, так называемыми мнемоническим кругом и мнемоническим квадратом, представленными на рис. 6.17.

Рис. 6.17. Мнемонический квадрат и мнемонический круг для определения
частных производных характеристических функций
Характеристические функции F (T,V), G (T,p), H (S,p) и U (S,V) обладают следующими свойствами:
а) все они являются функциями состояния, т.е. изменение этих функций при переходе системы из одного состояния в другое не зависит от пути перехода, а определяется значениями этих функций в начальном и конечном состоянии, т.е.
б) функции F, G, H, U являются аддитивными, т.е. значения их зависят от размеров системы, пропорциональны числу моль или массе;
в) все они имеют размерность энергии, т.е. измеряются в Дж, Дж/моль, кДж;
г) физический смысл изменения характеристических функций – есть работа некоторого процесса при определенных условиях, согласно выражениям (6.114), (6.116), (6.118) и (6.119);
д) при переходе системы в состояние равновесия характеристические функции принимают экстремальное значение;
е) характеристические функции взаимосвязаны.
Последнее свойство имеет большое значение для физико-химических исследований.
Взаимосвязь функций U, F, G, H хорошо видна на диаграмме соотношений между ними (рис. 6.18)

Рис. 6.18. Соотношение между характеристическими функциями
На рис. 6.18 характеристические функции изображены в виде отрезков, длины которых находятся из следующих соотношений
H = U + pV = G + TS = F + pV + TS
F = U – TS = G – pV (6.131)
G = H – TS = U + pV – TS
Используя соотношения (6.131) и значения частных производных (6.127), (6.128) можно получить уравнения Гиббса-Гельмгольца, которые также отражают взаимосвязь характеристических функций.
Получим уравнения Гиббса-Гельмгольца.
По определению G = H – TS, (6.113), но из (6.117) имеем
Подставляя (6.127) в (6.113) получаем 
т.е. связь таких термодинамических функций, как энергия Гиббса и энтальпия системы.
Если рассматривать изменение этих функций в каком-либо процессе, то получим первое уравнение Гиббса-Гельмгольца, а именно

Соотношение (6.132) устанавливает связь между тепловым эффектом химической реакции, протекающей при постоянном давлении и макси-мальной полезной работе изобарно-изотермического процесса, т.е.
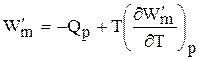
Аналогично для свободной энергии Гельмгольца, согласно (6.115)

Подставляя (6.128) в (6.115), получаем: 
т.е. связь свободной энергии Гельмгольца (F) и внутренней энергии системы (U), а также

Выражение (6.134) устанавливает связь между тепловым эффектом химической реакции, протекающей при постоянном объеме, и максимальной полезной работой изохорно-изотермического процесса, т.е.


т.к. DU = QV, а –DF = W¢m (согласно 40)
Теплоты Qp и QV в выражениях (6.133) и (6.135) относятся не к процессам, которым соответствует работа W¢m.
W¢m – это работа обратимого процесса, а Qp = DH и Q = DU- тепловые эффекты химических реакций или физико-химических процессов, когда они совершаются предельно необратимо, но между теми же начальным и конечным состояниями системы.
Теплоты же равновесного процесса равные Qобр = TDS, выражаются последними членами уравнений 6.132, 6.133, 6.134, 6.135.
Исходя из изложенного, можно записать
Уравнения 6.133 и 6.134 можно привести к виду, удобному для интегрирования.
Для этого разделим обе части уравнений на Т 2 и выполним преобразования:
Тогда получаем
или 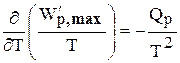
Интегрирование уравнений (6.136) дает следующие выражения:
Соотношения (6.137) позволяют вычислить максимальную полезную работу изобарического (W¢p,max) и изохорического (W¢V,max) процессов, зная его теплоту Qp или QV, если возможно найти постоянную интегрирования.
Уравнения Гиббса-Гельмгольца широко используются в физико-химических расчетах, например, для вычисления тепловых эффектов химических реакций по опытным значениям электродвижущих сил электрохимических элементов, для вычисления DS и других термодинами-ческих величин.
Основные понятия химического равновесия и процессы прогнозирования свойств получаемых материалов
Общие соотношения, вытекающие из второго закона термодина-мики, позволяют определить условия химического равновесия. Более простым случаем является равновесие при химических реакциях, протекающих без фазовых превращений, т.е. реакциях, когда исходные вещества и продукты находятся в одной фазе. Например, реакции между газами или реакции в растворах.
Химические процессы, играющие важную роль при создании материалов, как правило, не протекают до полного исчезновения исходных веществ, и останавливаются, достигая определенного состояния химии-ческого равновесия.
Основной целью синтеза любого материала является максимальное достижение выхода конечных продуктов, поэтому важно уметь характе-ризовать равновесие и найти параметры, от которых оно зависит, чтобы управлять процессом в целом.
Одним из важных вопросов химической термодинамики является вопрос о возможности и направленности протекания самопроизвольного процесса и условии равновесия.
Возможность, направление и предел самопроизвольного протекания процессов перехода энергии или вещества от одной части системы к другой зависят только от соотношения факторов интенсивности. Такими факторами являются температура (критерий перехода теплоты), давление (критерий перехода газа), потенциал заряда (критерий перехода электричества) и т.д.
Критерием самопроизвольного перехода данного компонента из одной фазы в другую является химический потенциал данного компонента, который тоже относится к факторам интенсивности. При умножении его на изменение количества этого компонента дает изменение соответствующего вида энергии. Согласно II закону термодинамики самопроизвольное протекание процессов взаимодействия между разными частями системы возможно только в направлении выравнивания фактора интенсивности (температуры, давления, химического потенциала и т.д.) для всех частей системы.
Достижение одинакового значения этого фактора является пределом самопроизвольного течения процессов в данных условиях и, следовательно, условием равновесия. Так, условием равновесия между фазами a и b компонента i служит равенство химического потенциала этого компонента в обеих фазах.
Этот вывод относится к любому компоненту, входящему в состав фаз, и к любым фазам системы.
Таким образом, из какого бы числа компонентов и из какого бы числа фаз ни состояла гетерогенная система условием равновесия между фазами в ней является то, что химический потенциал любого данного компонента должен быть одинаковым во всех фазах системы.
Химический потенциал
До сих пор мы рассматривали системы, сохраняющие постоянной массу, в которых изменение энергии было следствием сообщения или отнятия теплоты или результатом совершения работы.
Течение многих процессов сопровождаются изменением числа моль компонентов в системе. Так, например, любая гомогенная химическая реакция протекает с уменьшением числа моль исходных веществ и увеличением продуктов реакции, при фазовых переходах один компонент переходит из одной фазы в другую, в результате количество его уменьшается в одной фазе и увеличивается в другой. С помощью эксперимента установлено, что любое химическое изменение системы зависит от природы реагентов, состава исходных веществ и продуктов реакции, от концентрации реагентов и от внешних условий (Т, Р).
А любое изменение химического состава системы с термодинамической точки зрения является результатом перераспределения масс отдельных компонентов в системе. Термодинамическое описание таких систем, в которых происходит изменение массы взятых веществ, имеет большое практическое значение.
Изменение количества вещества в системе (появление или удаление его) приводит к изменению энергии системы.
Допустим, что увеличивается масса одного лишь компонента на dn1, тогда внутренняя энергия (U) увеличивается на величину, пропорциональную dn1. Коэффициент пропорциональности обозначим через m (его размерность 
При изменении числа моль компонентов в системе внутренняя энергия будет меняться на величину mdn.
Основное уравнение термодинамики с переменным составом будет выглядеть так:
или DU = TDS – pDV + mDn (6.140)
Решив его относительно коэффициента m получим важное соотношение:
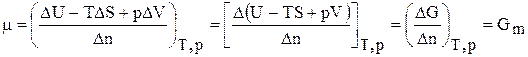
где Gm – мольное значение функции G для данного вещества, которое для чистого вещества является его химическим потенциалом.
Химический потенциал вещества зависит от межмолекулярных сил в системе, а в индивидуальном веществе проявляются силы взаимодействия между одинаковыми молекулами А-А. Если система представляет смесь веществ А и В, то возможны и другие взаимодействия между молекулами А-В и В-В.
Если система, в которой происходит изменение числа моль компонентов, не совершает никаких других видов работы, кроме работы расширения, то из сравнения уравнения (6.139) и уравнения:
dU = TdS – pdV – dW¢max
Следовательно, величина midni имеет смысл химической работы, которая совершается при протекании химической реакции.
Любой вид работы можно представить в виде произведения фактора интенсивности (силы, давления, поверхностного натяжения и т.д.), не зависящего от массы, на изменение фактора экстенсивности (емкости):
dWэлектрич. = – EdP (P – поляризация)
dWобраз. единицы поверхности = – sdS; (где S – поверхность)
Таким образом, dn – изменение фактора экстенсивности, а m – фактор интенсивности. Во всех случаях взаимодействия систем с различными потенциалами происходит их выравнивание за счет изменения соответствующих факторов емкостей. Например, давление выравнивается за счет изменения объема и т. д. Выравнивание химических потенциалов происходит за счет изменения масс веществ. Но в отличие от Р и Т, которые могут быть измерены, химический потенциал не может быть измерен непосредственно. Тем не менее, химический потенциал – важная термодинамическая функция, которую применяют для изучения равновесия в различных термодинамических системах. Понятие о химическом потенциале введено в химию Дж. Гиббсом в 1878 году.
Если рассматривать смеси переменного состава и записать уравнения других термодинамических потенциалов:
то из этих уравнений также следует, что химический потенциал можно выразить через любую характеристическую функцию:


где ni – постоянное количество всех компонентов;
nj – постоянное количество всех компонентов, кроме рассматриваемого; i ¹ j .
Т.е. химический потенциал данного вещества равен частной производной от любого термодинамического потенциала по числу моль данного вещества при соответствующих условиях.
Чаще всего изучаются системы при p, T = const, поэтому в дальнейшем химический потенциал i-того компонента будем определять как приращение энергии Гиббса при добавлении одного моль этого компонента к большому объему системы при постоянных температуре и давлении.
Понятие «большой объем системы» означает, что состав системы практически не изменяется после добавления одного моль компонента. Как уже указывалось, химический потенциал чистого вещества равен энергии Гиббса одного моль этого вещества: mi = Gi, т.к. при изменении количества чистого вещества на один моль, энергия Гиббса изменится на величину, равную энергии Гиббса одного моль вещества. Если в системе содержится “n” моль компонента, то
Итак, во всех практически важных расчетах вычисление химическо-го потенциала связано с определением функции G для изучаемой системы.
Рассмотрим условия равновесия и самопроизвольности процессов, связанных с изменением состава. Запишем основное уравнение термо-динамики таких систем, когда в системе содержится k компонентов
Т.к. в изобарно-изотермической системе условием самопроизвольности является dG
Правило знаков ЭДС элементов и электродных потенциалов
1. Основополагающее правило – ЭДС положительна, если внутри гальванического элемента положительное электричество (катионы) перемещается слева направо (Стокгольм, международная конференция 1953г.)
2. Выводы. При разряде ионов на правом электроде – процесс восстановления (электрод заряжается положительно), а сам электрод – положительный полюс г.э. (катод); на левом электроде – процесс окисления (отрицательный полюс, анод).
3. Соответствие знака ЭДС системе знаков теории хим. сродства а)
б) 

53. Электрохимическая форма уравнения Гиббса-Гельмгольца. Зависимость ЭДС гальванического элемента от температуры. Температурный коэффициент ЭДС и его связь с энтропией химической реакции в гальваническом элементе.
Уравнение Гиббса-Гельмгольца применительно к электрохимической цепи:

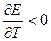

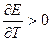
n – число электронов участвующих в электрохимической реакции;
ΔG – изменение энергии Гиббса для химической реакции, протекающей в гальваническом элементе.
Производная ΔG по температуре дает значения энтропии ΔS:
где ΔS – изменение энтропии для химической реакции, протекающей в гальваническом элементе;

Измерив э.д.с. элемента и ее температурный коэффициент, можно найти ΔG и ΔS для суммарного процесса, протекающего в элементе.
Изменение энтальпии для химической реакции в элементе вычисляют, используя уравнение Гиббса-Гельмгольца:
Классификация электродов. Окислительно-восстановительные электроды, потенциал которых не зависит от концентрации ионов водорода. Приведите пример, электродную реакцию и уравнение Нернста для расчёта потенциала электрода указанного типа.
1) Электроды 1-го рода
2) Электроды 2-го рода
3) Электроды 3-го рода
4) Газовые электроды
5) Ионоселективные электроды
6) Окислительно-восстановительные электроды
Про окислительно-восстановительные электроды см. 60.
Электроды первого рода. Примеры. Вывод и анализ уравнения, связывающего потенциал электрода с активностями потенциалопределяющих ионов.
См. п.56
Электроды первого рода, обратимые по катиону: определение, примеры, уравнение, связывающее потенциал электрода с активностями веществ, участников электродной полуреакции (уравнение Нернста). Амальгамные электроды.
Электрод первого рода – это металл (или неметалл), погруженный в раствор, содержащий ионы этого же металла (неметалла).
Таким образом, потенциал электрода первого рода определяется активностью катионов металла в растворе или активностью анионов неметалла. Ионы, от активности которых непосредственно зависит потенциал электрода, называются потенциалопределяющими.
Примерами электродов первого рода, обратимых по катиону, могут служить металлы в растворах их растворимых солей (Ag в растворе AgNO3, Cu в растворе CuSO4).
Так, для серебряного электрода Ag + |Ag электродная реакция имеет вид: Ag + +е =Ag
Электродный потенциал определяется выражением:
Приведите пример электрода второго рода. Запишите электродную реакцию и уравнение Нернста для выбранного электрода. Влияние концентрации потенциалопределяющих ионов на потенциал электрода.
Электрод второго рода – металл, покрытый слоем его малорастворимого соединения (соли/оксида/гидроксида) и погруженный в раствор электролита, который содержит тот же анион, что и малорастворимое соединение.
Таким образом, потенциал электрода второго рода определяется активностью анионов: такие электроды обратимы по аниону.
Электрод, представляющий собой ртуть, покрытую пастой из смеси каломели Hg2Cl2 cо ртутью, находящуюся в контакте с раствором хлорида калия: Cl – | Hg2Cl2|Hg, называют каломельным электродом.
Ввиду низкой растворимости каломели в воде активность хлорид-ионов считают практически равной активности хлорид-ионов, образуемых при диссоциации хлорида калия, поэтому концентрация хлорида калия в растворе должна быть точно известна. Наиболее часто используют каломельные электроды, в которых концентрация KCl отвечает насыщению (насыщенный) или равна 0,1 или 1,0 моль/л. Каломельные электроды (особенно насыщенный) удобны тем, что диффузионный потенциал, возникающий в электрохимической цепи на границе насыщенный раствор хлорида калия – данный раствор, незначителен и во многих случаях (не требующих большой точности) им можно пренебречь.
Потенциалы электродов зависят, в первую очередь, от соотношения активностей (концентраций) потенциалопределяющих ионов в растворе. Увеличение концентрации окисленной формы (или уменьшение концентрации восстановленной формы) приводит к возрастанию потенциала электрода. Вместе с тем, ионы (вещества), не участвующие в электродных реакциях (индифферентные), изменяют ионную силу раствора, а, следовательно, и коэффициент активности и активность потенциалопределяющих ионов. Это опять же приводит к изменению потенциала электрода. Те вещества, которые вступают в химическое взаимодействие с потенциалопределяющими ионами, также влияют на потенциалы электродов.
[spoiler title=”источники:”]
http://lektsia.com/5×3883.html
http://megaobuchalka.ru/15/3528.html
[/spoiler]