Химическая природа – вещество
Cтраница 1
Химическая природа вещества иногда совершенно изменяется при растворении его в жидком аммиаке. Однако интересно отметить, что такое изменение может быть часто предсказано, если рассматривать азотсодержащие соединения как аналоги соответствующих кислородсодержащих веществ. Такие соединения, как мочевина, цйанимид и гуанидин, являются азотными аналогами угольной кислоты. Их поведение в водных растворах значительно различается, однако в жидком аммиаке все они ведут себя как кислоты. Это справедливо также и для амидов кислот и амидинов. Действительно, в жидком аммиаке эти вещества ведут себя как азотные аналоги карбоновых кислот. Нитрилы, например, представляют собой анаммониды аммонокарбоновых кислот. Первичные и вторичные амины являются спиртами в аммиачной системе соединений, тогда как третичные амины являются аналогами эфиров. Следует еще раз подчеркнуть, что эти аналогии не являются чисто формальными. Они были практически использованы при изучении поведения этих аммоносоединений в жидком аммиаке.
[1]
Химическая природа веществ, рекомендуемых к применении в качестве моющих присадок к маслам, весьма разнообразна. В недавно вышедшей монографии В. А. Каличевского [17] приводится более 300 патентов на моющие присадки; перечисление даже важнейших из них заняло бы слишком много места.
[3]
Химическая природа веществ оказывает огромное влияние на скорость реакции. Так, разложение некоторых взрывчатых веществ протекает в десятитысячные доли секунды. С другой стороны, ряд процессов в земной коре длится сотни тысяч и более лет.
[4]
Химическая природа вещества в первую очередь определяется его составом. Ввиду этого изучение элементарного состава нефти и определение ближайших ее составных частей являются первой естественной – ступенью в химическом познании нефтей. Эти же данные должны лечь в основу их химической классификации.
[5]
Химическая природа веществ, образующихся при термической обработке диалкилдитиофосфатов металлов, изучена еще недостаточно.
[7]
Химическая природа вещества имеет относительно небольшое значение для механизма усадки, разобранного Кларком и Уайтом; характер кривых усадки поликомпонентных изоляционных кирпичей типа пористого фарфора обычно соответствует расчетному. На них отчетливо выражен предел текучести материала. Это обстоятельство имеет особое значение, так как в данном случае при температуре выше 1400 С образование линз безусловно происходит в присутствии жидкой фазы. Однако это явление принципиально не отличается от текучести глинозема или окиси магния высокой степени чистоты, и текучесть которых почти полностью сходна с текучестью твердых веществ. Капиллярные силы, а не характер состояния текущего материала, существенны для процессов усадки.
[8]
Химическая природа вещества в первую очередь определяется его составом. Ввиду этого изучение элементарного состава нефти и определение ближайших ее составных частей являются первой естественной ступенью в химическом познании нефтей. Эти же данные должны лечь в основу их химической классификации.
[9]
Если химическая природа вещества не имеет значения для количества поглощенной энергии, то выход радикалов при поглощении одного и того же количества энергии сильно зависит от строения молекул, поглощающих энергию.
[10]
Выяснена химическая природа вещества колхицерин, выделенного ранее из клубнелуковиц безвременника великолепного. Колхицерин является молекулярным соединением алкалоидов колхицина и колхамина в равномолекулярном соотношении.
[11]
По химической природе веществ, участвующих в гетерогенных окислительно-восстановительных процессах, принято различать следующие типы электродов: электроды первого, второго и третьего рода, окислительно-восстановительные, газовые электроды.
[13]
Вопрос о химической природе вещества, содержащегося в моче при алкаптонурии, был решен Волковым и Бауманом.
[14]
До тех пор пока химическая природа асфальтоподобных веществ it асфальтенов точно не установлена, аналитическое определение их неизбежно-основывается на совершенно произвольных условностях.
[15]
Страницы:
1
2
3
4

Добавил:
Upload
Опубликованный материал нарушает ваши авторские права? Сообщите нам.
Вуз:
Предмет:
Файл:
физико-химические методы анализа.pdf
Скачиваний:
209
Добавлен:
14.04.2015
Размер:
3.95 Mб
Скачать
Раздел 3
|
Вэн |
Eисп |
h испNисп |
исп |
Вкв |
|||
|
Eпогл |
h поглNпогл |
погл |
|||||
Поскольку обычно исп < погл, то Вэн < Вкв Квантовый выход люминесценции не зависит от возб вплоть до
некоторой , находящейся в области наложения спектров поглощения и испускания, после чего резко уменьшается. Энергетический выход зависит от возб: вначале он увеличивается прямо пропорциональновозб , затем на некотором интервале не изменяет своей величины, после чего резко уменьшается (закон Вавилова).
21.2.4. Влияние различных факторов на интенсивность флуоресценции растворов
Люминесценция и, в частности, флуоресценция в гораздо большей степени подвержена влиянию различных факторов, чем поглощение света. Интенсивность флуоресценции зависит от:
природы вещества;
концентрации вещества в растворе;
условий, в которых находится флуоресцирующее вещество
(температура, растворитель, рН, наличие в растворе других веществ, способных влиять на флуоресценцию).
Природа вещества
Неорганические соединения (за исключением некоторых соединений урана, лантанидов) обычно не способны флуоресцировать в растворе. В то же время среди органических соединений флуоресцирующих веществ достаточно много.
Необходимым (но не достаточным!) условием для фотолюми-
несценции является способность вещества поглощать электромагнитное излучение УФили видимого диапазона. Обычно веще-
ства, обладающие интенсивной флуоресценцией, имеют длинную систему сопряжённых связей. Наиболее часто флуоресцирующие вещества встречаются среди ароматических соединений. Введение в бен-
зольное кольцо электронодонорных заместителей увеличивает способность вещества флуоресцировать. Например, многие фенолы и ароматические амины обладают интенсивной флуоресценцией. Вве-
дение электроноакцепторных заместителей, за некоторым исключением, уменьшает флуоресценцию. Атомы тяжёлых галогенов
(Br, I) увеличивают скорость интеркомбинационной конверсии и, тем самым, уменьшают квантовый выход флуоресценции. Однако вве-
дение тяжёлых галогенов увеличивает способность вещества фосфо-
ресцировать. Способность вещества к флуоресценции в растворе
272

Инструментальные методы анализа
увеличивается при конденсации ароматических колец и увеличении «жёсткости» молекулы. Например
|
O |
O |
O |
O |
O |
|
флуоресцирует |
||||
|
флуоресцеин |
COO |
COO фенолфталеин |
Концентрация вещества
Зависимость между интенсивностью флуоресценции и концентрацией флуоресцирующего вещества в растворе более сложная, чем между поглощением света и концентрацией. Это связано с тем, что процесс излучения является вторичным и зависит от предшествующего ему процесса поглощения света.
Рассмотрим простейший случай, когда в растворе находится только одно флуоресцирующее вещество.
|
If kNf |
kQNпогл |
I) |
I I0 10 |
C |
||
|
Nпогл k I k (I0 |
Таким образом:
If kk QI0 (1 10 C )
Следовательно, зависимость между интенсивностью флуо-
ресценции и концентрацией флуоресцирующего вещества не является линейной.
Функцию 10 C можно разложить в ряд Маклорена
10 С 1 2,3 C (2,3 C)2 (2,3 C)3 …
2! 3!
Если произведение С (оптическая плотность раствора) неве-
лико, то 10 С 1 2,3 C и тогда
If 2,3kk QI0 C KC
Таким образом, при малых значениях оптической плотности (при возб) зависимость интенсивности флуоресценции от концентрации можно считать линейной, что и используется в количест-
венном анализе. При более высоких значениях A зависимость интенсивности флуоресценции от концентрации становится более сложной и отклоняется от линейной. При A = 0,01 отклонение от линейности составляет 1%, 0,05 – 5%; 0,5 – около 35% (рис. 21.4).
273
|
Раздел 3 |
|||||||
|
область, в которой I I |
I |
1 |
|||||
|
можно считать |
|||||||
|
прямо пропорциональной А |
2 |
||||||
0,0 0,1 0,2
A
Рис. 21.4. Зависимость между интенсивностью флуоресценции и оптической плотностью раствора
1) рассчитанная по упрощённой формуле I = KC; 2) реальная
Влияние оптической плотности раствора на интенсивность флуоресценции называется «эффектом внутреннего фильтра». Этот эффект обусловлен двумя причинами:
поглощением возбуждающего света, вследствие чего частицы,
находящиеся дальше от источника излучения, будут получать меньше возбуждающего излучения;
поглощением одними частицами вещества излучения, испускаемого другими частицами этого же вещества.
Условия, в которых находится флуоресцирующее вещество
Растворитель может оказывать влияние на величину разности между max спектра поглощения вещества (или спектра возбуждения флуоресценции) и спектра испускания. При увеличении диэлектрической проницаемости растворителя эта разность, называемая Стоксовым сдвигом, увеличивается. Растворитель влияет также и на величину квантового выхода флуоресценции, увеличивая её или уменьшая. Например, квантовый выход флуоресценции эозина в воде равен 0,2, а в ацетоне – близок к 1.
Влияние рН сказывается на флуоресценции тех веществ, в молекулах которых имеются функциональные группы, склонные к ки- слотно-основному взаимодействию. Например, фенол и его производные флуоресцируют в кислой среде, при ионизации фенольного гидроксила флуоресценция исчезает. Органические вещества, цвет и интенсивность флуоресценции которых изменяется при изменении рН, могут быть использованы в качестве кислотно-основных индикаторов (флуоресцеин, хинин и т.п.).
274

Инструментальные методы анализа
При повышении температуры увеличивается вероятность безызлучательных переходов, поэтому интенсивность флуоресценции уменьшается. Однако, у некоторых веществ свечение прекращается уже при -100 С, другие продолжают слабо флуоресцировать даже при >100 С. Если поместить флуоресцирующее вещество в специальную среду и охладить до температуры кипения жидкого азота (или даже жидкого гелия), то можно добиться того, что спектр флуоресценции органического вещества станет линейчатым. Такое явление называется эффектом Шпольского. Использование данного эффекта значительно повышает избирательность анализа и снижает предел обнаружения.
Интенсивность флуоресценции вещества и её квантовый выход могут снижаться в присутствии в растворе других веществ, называемых тушителями. Существуют, так называемые, универсальные тушители (например, O2), которые уменьшают флуоресценцию большинства веществ. Однако, чаще тушитель влияет на флуоресценцию одного вещества и не влияет на флуоресценцию другого (например, хлориды уменьшают интенсивность флуоресценции хинина), поскольку эффект тушения в разных случаях имеет различный механизм. Влияние концентрации тушителя на интенсивность флуоресценции вещества описывается уравнением Штерна-Фольмера
IIq 1 kCq
где Iq – интенсивность флуоресценции в присутствии тушителя, Сq – концентрация тушителя, k – константа тушения.
21.2.5. Измерение аналитического сигнала
Для измерения интенсивности флуоресценции используют спектрофлуориметры и флуориметры (на рис. 21.5).
В качестве источника излучения используют ртутную, ксеноновую и другие лампы. В последнее время для возбуждения флуоресценции применяют лазеры.
Для выделения нужного спектрального интервала в флуориметрах, как и в фотоэлектроколориметрах, используют светофильтры, а в спектрофлуориметрах, также как и в спектрофотометрах – монохроматоры (дифракционные решётки или призмы). Светофильтр (монохроматор), используемый для выделения необходимого возбуждающего излучения, называется первичным, а для выделения наиболее интенсивного излучения из спектра испускания – вторичным.
275

|
Раздел 3 |
|||||||||||||
|
устройство для выделения |
|||||||||||||
|
источник |
|||||||||||||
|
спектрального интервала |
|||||||||||||
|
излучения |
|||||||||||||
|
из возбуждающего излучения |
|||||||||||||
устройство для выделения спектрального интервала из испускаемого излучения
регистрирующее детектор устройство
Рис. 21.5. Принципиальная схема прибора для измерения интенсивности флуоресценции
Измерение флуоресценции, в отличие от измерения поглощения,
чаще всего проводят под прямым углом к направлению возбуж-
дающего света. Такой приём позволяет избежать наложения возбуждающего света на излучаемый. При измерении интенсивности фосфоресценции, либо при большом Стоксовом сдвиге, можно использовать схему, при которой источник возбуждения, образец и детектор находятся на одной оптической оси. В данном случае возбуждающий свет не мешает определению, так как при измерении интенсивности фосфоресценции измерение проводят после прекращения действия возбуждающего света, а при большом Стоксовом сдвиге возб и исп настолько различаются, что возбуждающий свет задерживается монохроматором и не попадает на детектор. В случае сильно поглощающих растворов, полупрозрачных и твёрдых образцов используют фронтальный способ, при котором измерение флуоресценции проводится под углом 45 относительно возбуждающего излучения.
При измерении флуоресценции имеют дело со слабым излучением, поэтому в качестве детектора используют не фотоэлементы, как
вспектрофотометрии, а фотоумножители.
21.2.6.Практическое применение и основные приёмы люминесцентного анализа
Клюминесцентной спектроскопии относят:
флуоресцентный метод анализа (флуориметрия),
фосфоресцентный метод анализа (фосфориметрия),
хеми- и биолюминесцентный метод анализа (люминометрия) и
др.
276

Инструментальные методы анализа
Наиболее широкое применение среди перечисленных люминесцентных методов анализа имеет флуориметрия. По сравнению со спектрофотометрией флуориметрия обладает:
большей избирательностью (не все вещества, поглощающие УФ- и видимое излучение, способны флуоресцировать);
более низким пределом обнаружения (измерить абсолютную величину малого сигнала всегда легче, чем разность между двумя большими сигналами);
удобным временным диапазоном.
Поглощение света – это практически мгновенный процесс (10-15 – 10-16 с), флуоресценция длится около 10 нс (а фосфоресценция значительно дольше). За это время с молекулой могут произойти различные процессы, которые влияют на характеристики флуоресценции. Данное свойство широко используется в биохимии для изучения строения мембран, диффузии биомолекул, динамики связывания антигенов и антител. Влияние вращения молекул антигенов (лекарств, ядов), меченых флуоресцеином, на поляризацию флуоресценции последнего лежит в основе поляризационного флуороиммуноанализа, одного из современных методов анализа биологических объектов.
Флуоресцентный анализ используют для обнаружения и для количественного определения веществ. В качественном анализе чаще всего используется способность вещества флуоресцировать тем или иным цветом. При этом в качестве источника возбуждения обычно используют УФ-лампу, а наличие или отсутствие флуоресценции определяют визуально. Таким образом, например, обнаруживают флуоресцирующие вещества на плоскостных хроматограммах.
Вколичественном анализе используют зависимость интенсивности флуоресценции от концентрации флуоресцирующего вещества либо, реже, зависимость уменьшения интенсивности флуоресценции от концентрации тушителя, в роли которого выступает вещество, концентрацию которого необходимо определить.
Вфлуоресцентном анализе используется:
измерение собственной флуоресценции вещества;
получение флуоресцирующих продуктов, в том числе и экстракционная флуориметрия;
определения, основанные на тушении флуоресценции;
титрование с флуоресцентными индикаторами и др.
Флуориметрическое определение, основанное на собственной флуоресценции, используется для определения хинина, берберина, рибофлавина, фторхинолонов, флуоресцеина и т.д.
277
|
Раздел 3 |
||||||
|
HO |
HO |
|||||
|
N |
||||||
|
HO |
||||||
|
OH |
H3CO |
хинин |
||||
|
HO |
O |
|||||
|
N |
F |
COOH |
||||
|
H3C |
N |
N |
O |
|||
|
N |
H3C N N |
O |
N |
|||
|
H3C |
N |
H |
CH3 |
|||
|
рибофлавин O |
||||||
|
офлоксацин |
Обратите внимание на особенности структуры флуоресцирующих веществ – наличие в составе их молекул конденсированных ароматических систем.
В основе реакций получения флуоресцирующих продуктов могут лежать различные процессы: окисления, конденсации, образование комплексных соединений, ионных ассоциатов и др. Если образующийся продукт мало растворим в воде, неустойчив в водном растворе, либо избыток реагента мешает определению или влияет на устойчивость продукта, применяют экстракционную флуориметрию. Иногда вещество не флуоресцирует или слабо флуоресцирует в водной среде, но интенсивно флуоресцирует в среде органического растворителя.
|
экстракт флуоресцирует ярко |
экстракция бутанолом |
|
голубым светом (430-435 нм) |
|
CH3 |
CH3 |
||||||||||||||||||
|
N |
N |
||||||||||||||||||
|
K3[Fe(CN)6] |
N |
N |
|||||||||||||||||
|
H3C N NH2 S CH2CH2OH |
H3C N N S CH2CH2OH |
||||||||||||||||||
|
тиамин |
тиохром |
Флуориметрическое определение, основанное на тушении флуоресценции, применяют для определения сульфаниламидов (тушат флуоресценцию 9-хлоракридина), -лактамных антибиотиков (тушат флуоресценцию меркурохрома) и т.д.
Кновым подходам в люминесцентной спектроскопии относятся:
производная спектрофлуориметрия;
синхронная спектрофлуориметрия;
спектроскопия, основанная на эффекте Шпольского;
флуоресцентная спектроскопия узких линий,
фосфориметрия при комнатной температуре и др.
278

Инструментальные методы анализа
ГЛАВА 22
22.1. Общая характеристика
Хроматография – метод разделения смесей веществ или частиц, основанный на различии в скоростях их перемещения в системе, состоящей из несмешивающихся и движущихся друг относительно друга фаз.
Хроматография – гибридный метод анализа, включающий разделение веществ и их последующее определение при помощи специальных устройств – детекторов.
Вкачестве неподвижной фазы в хроматографическом процессе выступает твёрдое вещество (сорбент) или плёнка жидкости, нанесённая на твёрдый носитель, а в качестве подвижной фазы – жидкость или газ, протекающий через неподвижную фазу.
Вотличие от статических методов разделения – сорбции и экс-
тракции хроматография является динамическим процессом. При перемещении через неподвижную фазу подвижная фаза встречает на своём пути всё новые и новые слои сорбента, что сопровождается многократными повторениями актов сорбции и десорбции разделяемых веществ. Хроматографическое разделение обладает большей эффективностью по сравнению со статическими методами.
“Схвати,  подержи и отпусти”
подержи и отпусти”
22.2. Классификация хроматографических методов
Существует более 50 различных хроматографических методов и вариантов. В основу их классификации могут быть положены:
279
Раздел 3
агрегатное состояние подвижной и неподвижной фазы,
геометрическая форма неподвижной фазы,
преобладающий механизм разделения,
цель проведения,
способ получения хроматограммы и т.д.
АГРЕГАТНОЕ СОСТОЯНИЕ ПОДВИЖНОЙ ФАЗЫ
|
подвижная |
газовая |
жидкостная подвижная |
||
|
фаза – газ |
фаза – |
|||
|
жидкость |
||||
|
газо- |
газо- |
жидкость- |
жидкость- |
жидкость- |
|
твёрдофазная |
жидкостная |
жидкостная |
твёрдофазная |
гелевая |
ВИД НЕПОДВИЖНОЙ ФАЗЫ
В названии хроматографического метода первым указывается агрегатное состояние подвижной фазы, а вторым – неподвижной
ГЕОМЕТРИЧЕСКАЯ ФОРМА НЕПОДВИЖНОЙ ФАЗЫ
колоночная
 хроматографический
хроматографический 
процесс проходит
в пределах
протяжённого
цилиндрического пространства
капиллярная
диаметр проходного сечения пространства соизмерим с диаметром частиц неподвижной фазы, которая нанесена на стенки капилляра в виде тонкой
плёнки
плоскостная
 хроматографический
хроматографический 
процесс проходит в тонком слое
|
|
Колоночный вариант используется как в |
жидкостной, так и в газовой хроматографии, а плоскостной – только в жидкостной.
Классификация хроматографических методов в зависимости от преобладающего механизма разделения, приведена в табл. 22.1.
Реальный процесс обычно включает в себя несколько механизмов, обуславливающих разделение веществ, поэтому данная классификация условна.
280

Инструментальные методы анализа
Табл. 22.1.
Классификация хроматографических методов в зависимости от преобладающего процесса, лежащего в основе разделения веществ
|
Вид хроматографии |
Преобладающий механизм разделения |
|
адсорбционная |
различная адсорбируемость разделяемых ве- |
|
ществ неподвижной фазой |
|
|
адсорбционно- |
образование (в подвижной фазе или на поверх- |
|
комплексообразовательная |
ности неподвижной фазы) различных по устой- |
|
чивости комплексных соединений |
|
|
аффинная |
различная способность разделяемых веществ к |
|
биоспецифическим взаимодействиям |
|
|
ионообменная |
различная способность разделяемых веществ к |
|
ионному обмену |
|
|
осадочная |
образование осадков, различающихся по рас- |
|
творимости |
|
|
распределительная |
различная растворимость разделяемых веществ |
|
в неподвижной фазе или в подвижной и непод- |
|
|
вижной фазах |
|
|
эксклюзионная |
различия в размерах и форме молекул разделяе- |
|
мых веществ |
ЦЕЛЬ ПРОВЕДЕНИЯ
|
информационная |
технологическая |
|
Цель – получение информации о |
Целью является само |
|
составе объекта (аналитическая |
разделение. Применяется |
|
хроматография) либо о его |
для выделения целевого |
|
физико-химических свойствах |
компонента из смеси либо |
|
(физико-химическая |
для его очистки. |
|
хроматография) |


По способу получения хроматограммы хроматография бывает элюентной, фронтальной и вытеснительной (табл 22.2).
281
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Современная химия достигла такого уровня развития, что существует целый ряд ее специальных разделов, являющихся самостоятельными науками. В зависимости от атомарной природы изучаемого вещества, типов химических связей между атомами различают неорганическую, органическую и элементоорганическую химии. Объектом неорганической химии являются все химические элементы и их соединения, другие вещества на их основе. Органическая химия изучает свойства обширного класса соединений, образованных посредством химических связей углерода с углеродом и другими органогенными элементами водородом, азотом, кислородом, серой, хлором, бромом и йодом. Элементоорганическая химия находится на стыке неорганической и органической химии. Эта третья химия относится к соединениям, включающим химические связи углерода с остальными элементами периодической системы, не являющимися органогенами. Молекулярная структура, степень агрегации (объединения) атомов в составе молекул и крупных молекул — макромолекул привносят свои характерные особенности в химическую форму движения материи. Поэтому существуют химия высокомолекулярных соединений, кристаллохимия, геохимия, биохимия и другие науки. Они изучают крупные объединения атомов и гигантские полимерные образования различной природы. Везде центральным вопросом для химии является вопрос о химических свойствах. Предметом изучения являются также физические, физико-химические и биохимические свойства веществ. Поэтому не только интенсивно разрабатываются собственные методы, но и привлекаются к изучению веществ другие науки. Так важными составными частями химии являются физическая химия и химическая физика, исследующие химические объекты, процессы и сопровождающие их явления с помощью расчетного аппарата физики и физических экспериментальных методов. Сегодня эти науки объединяют целый ряд других квантовая химия, химическая термодинамика (термохимия), химическая кинетика, электрохимия, фотохимия, химия высоких энергий, компьютерная химия и др. Только перечень фундаментальных наук химического направления уже говорит об исключительном разнообразии проявления химической формы движения материи и влиянии ее на пашу повседневную [c.14]
Комплексные соединения составляют наиболее обширный и разнообразный класс неорганических веществ. К ним принадлежат также многие элементоорганические соединения, связывающие воедино ранее разобщенные неорганическую химию и органическую химию. Многие комплексные соединения — витамин В12, гемоглобин, хлорофилл и другие — играют большую роль в физиологических и биохимических процессах. Исследование свойств и пространственного строения комплексных соединений оказалось чрезвычайно плодотворным для кристаллохимии, изучающей зависимость физико-химических свойств веществ от структуры образуемых ими кристаллов, и породило новые представления о природе химической связи. К ценным результатам привело применение комплексных соединений и в аналитической химии. [c.354]
Катализатор вступает в химическое взаимодействие с одним или обоими реагирующими веществами, образуя при этом промежуточное соединение (АХ) и входя в состав активированного комплекса. После каждого элементарного химического акта он регенерируется и может вступать во взаимодействие с новыми молекулами реагентов. Таким образом, катализатор направляет химическую реакцию по принципиально новому пути, который отличается от некаталитического числом и природой промежуточных соединений, составом и строением переходного комплекса. Природа сил, вызывающих взаимодействие катализатора и реагентов, та же, что и для обычных химических соединений. Это прежде всего ковалентная связь, донорно-акцеп-торное и кулоновское взаимодействие, водородная связь. Для возникновения химической связи требуется определенное соответствие молекулярных орбиталей реагирующих молекул и катализатора до энергии и симметрии, поэтому катализаторы обладают свойством ус- [c.617]
Органические соединения — это углеводороды и их многочисленные производные, в состав которых могут входить многие элементы периодической системы. Органические соединения обладают рядом характерных особенностей, которые отличают их от неорганических. Почти все они (за редким исключением) горючи, большинство из них не диссоциируют на ионы, что обусловлено природой ковалентной связи — основной химической связи в органических веществах. [c.52]
Бинарные соединения, несмотря на кажущуюся простоту их химического состава, представляют собой следующий после простых веществ принципиально важный объект изучения природы вещества.. С химической точки зрения этот класс веществ обладает и качественно иными характеристиками, с которыми не приходится сталкиваться при изучении простых веществ. Во-первых, помимо внешних факторов, влияющих на состояние и свойства вещества (температура и давление), здесь появляется и внутренний фактор — состав, и связанная с ним проблема постоянства и переменности состава, имеющая фундаментальное значение в химии. Во-вторых, при описании бинарных соединений впервые формируются такие базисные понятия, как валентность, степень окисления, поляризация химической связи. Здесь в отличие от простых веществ появляются гетерополярная составляющая химической связи и все эффекты, связанные с разностью электроотрицательностей компонентов. [c.47]
Надо сказать, что ковалентная (гомеополярная) и ионная (гетерополярная) связь — предельные виды химической связи. Вес ионных структур в неионизированных молекулах некоторых соединений может быть достаточно велик, чтобы отозваться на свойствах вещества. Нельзя также отрицать и влияние растворителя и его природы на характер химической связи в молекулах растворенного вещества. [c.82]
ПРИРОДА ВЕЩЕСТВА СОЕДИНЕНИЯ И ХИМИЧЕСКИЕ СВЯЗИ [c.41]
Природа вещества соединения и химические связи 43 [c.43]
Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворенным веществом ,— писал Менделеев в этой книге. Мы теперь знаем природу этих сил. Химическая связь между ионами растворенного вещества и растворителем возникает по донорно-акцепторному механизму (см. стр. 63). Ионы присоединяют полярные молекулы воды, в результате образуются гидратированные ионы (поэтому, например, в растворе ион меди (II) — голубой, в безводном сульфате меди — бесцветный). Во многих случаях такие соединения непрочны и легко разлагаются при выделении их в свободном виде. Однако в ряде случаев образуются прочные соединения, которые можно легко выделить из раствора путем кристаллизации. Из раствора выпадают кристаллы, содержащие молекулы воды. [c.115]
Существенные сведения относительно природы химической связи в металлах можно получить на основании двух характерных особенностей по сравнению с ковалентными и ионными соединениями. Металлы, во-первых, отличаются от других веществ высокой электропроводностью и теплопроводностью, во-вторых, в обычных условиях являются кристаллическими веществами (за исключением ртути), структуры которых характеризуются высокими координационными числами. [c.104]
Учение о химической связи — центральная проблема современной химии. Не зная природу взаимодействия атомов в веществе, нельзя понять причины многообразия химических соединений, представить механизм их образования, их состав, строение и реакционную способность. Создание надежной модели, отражающей строение атомов, молекул и природу сил между ними, позволит рассчитать свойства веществ, не прибегая к эксперименту. [c.41]
Многие важные экспериментальные данные, количественно характеризующие химические свойства твердых веществ, были получены исследователями процесса сорбции, т. е. процесса поглощения твердым веществом жидких, растворенных или газообразных веществ. Лэнгмюр (1915 г.) рассматривал химическую сорбцию, как химическую реакцию с участием твердого вещества, продуктом которой является мономолекулярный слой, состоящий из молекул или атомов сорбированного вещества, связанных с атомами поверхности твердого тела валентными связями. Этот взгляд на природу сорбционных соединений разделяли почти все позднейшие исследователи. [c.10]
Свойства более сложного по составу элементов, чем простое вещество, бинарного соединения сильно зависят от природы образующих его двух элементов. Важнейшим фактором является расположение этих эле.ментов в периодической системе относится ли каждый из них к металлам, неметаллам или находится на границе между металлами и неметаллами. При этом важное значение имеет степень различия элементов по электроотрицательности, размерам и другим факторам, влияющим на природу возникающей между ними химической связи. [c.340]
Л. Г. Гурвич 1 рассматривает адсорбцию как проявление физико-химической силы притяжения между молекулами. За меру этой силы Л. Г. Гурвич принимает теплоту смачивания последняя зависит от природы жидкости и адсорбента. При одном и том же адсорбенте больше всего выделяют тепла вещества с двойными связями, за ними соединения, содержащие кислород, азот и серу, меньше всего тепла выделяют алканы и цикланы. Среднее место занимают ароматические углеводороды. Иллюстрацией тому служат следующие данные Л. Г. Гурвича о теплоте адсорбции разных растворителей на поверхности алюмосиликатного адсорбента. [c.145]
Следует учитывать, что периодическая зависимость свойств простых веществ, а тем более бинарных и других соединений от порядкового номера элемента проявляется менее четко, чем у свободных атомов элементов (рис. 4,2). Здесь важное значение приобретает изменение структуры веществ, природы химической связи и условий образования. [c.84]
Теория химического строения А. М. Бутлерова. В 1861 г. русский химик А. М. Бутлеров выдвинул теорию, сущность кото рой можно сформулировать следующим образом а) атомы в молекуле соединяются друг с другом в определенном порядке б) соединение атомов происходит в соответствии с их валентностью согласно теории А. М. Бутлерова, валентность атома определяется числом образуемых им химических связей. Этим определением пользуются и сейчас в) свойства вещества зависят не только от природы составляющих их атомов и их числа, но и от их взаимного расположения, т. е. от химического строения молекул. [c.57]
В соответствии с (19.4) обратная реакция разрыва химической связи имеет энергию активации, равную тепловому эффекту реакции, т. е. энергии разрыва связи. Последнее обстоятельство вместе с выводами, сделанными в конце 19.4, позволяет оценить устойчивость химических соединений в зависимости от энергии разрыва связей Б этих соединениях. Действительно, соединение заведомо теряет устойчивость, если в нем с измеримой скоростью начинает разрываться хотя бы одна нз химических связей. Поэтому при комнатной температуре могут существовать вещества, энергии разрыва связей в молекулах которых не ниже ПО кДж/моль. Например, могут существовать пероксиды, содержащие связь О—О, прочность которой в зависимости от природы соединения лежит в пределах 130—210 кДж/моль. Из тех же оценок следует, что при 600 К пероксиды разлагаются. При 1000 К устойчив метан, энергия разрыва связи С—Н в молекулах которого равна 420 кДж/моль, но уже становится неустойчивым этап, имеющий С—С-связь с энергией разрыва 350 кДж/моль. [c.362]
Дело в том, что стехиометрический принцип эквивалентности паев, которым руководствовались все до-бутлеровские теории и который явился лишь одним из исходных принципов теории химического строения, требует тождественности всех межатомных связей. Но если бы природа соблюдала эти требования, то энергия каждой простой межатомной связи, образованной за счет замыкания двух единиц сродства , была бы одинакова а это означало бы, что все химические превращения происходят с одинаковой энергией активации, одинаковой скоростью и при определенных условиях являются идеально обратимыми. Химическая активность всех соединений в одних и тех же условиях была бы одинаковой Однако в действительности дело обстоит иначе есть вещества самой различной активности, и А. М. Бутлеров это обстоятельство не только отметил, но и объяснил различием их химического строения, понимая под этим различием, во-первых, бесчисленные возможности изменения свойств одного п того же элемента при переходе его из соединения в соединение под влиянием других элементов и, во-вторых, широко варьируемую энергетическую неэквивалентность (сродствоемкость) химических связей. Поэтому идеи об энергетической неэквивалентности химических связей, обусловленной взаимным влиянием атомов, являются главным содержанием теории А. М. Бутлерова. [c.87]
Как Вам известно, различают простые и сложные вещества. Приведите определения этих видов веществ. Почему число элементов в Периодической системе значительно меньше, чем число существующих- простых веществ Все ли простые вещества присутствуют в литосфере, гидросфере и атмосфере Земли Различаются ли с химической точки зрения следующие простые вещества а) орто- и параводород, б) твердая и газообразная сера, в) протий, дейтерий и тритий, г) серое и белое олово Можно ли все простые вещества считать химическими соединениями Дайте определение понятию химическое соединение и укажите природу сил, которыми связаны атомы и (или) молекулы в твердых простых веществах а) аргон, б) литий, [c.150]
Исследования показали, что в растворе могут существовать три типа молекул молекулы растворителя, растворенного вещества и продуктов их взаимодействия. Последние имеют различный состав в зависимости от природы исходных компонентов, концентрации раствора и температуры. Д. И. Менделеев назвал такие соединения гидратами (для водных растворов) и сольватами (для любых растворителей), Образование такой системы в сильной степени зависит от природы (типа химической связи) исходных компонентов. Несомненно, что в водных растворах при этом не последнюю роль играет наличие полярных молекул воды. [c.67]
Учение о химической связи относится к важнейшим проблемам современной химии. Знание природы взаимодействия атомов в веществе позволяет понять причины многообразия химических соединений, строение и механизм их образования. Основополагающий вклад в учение о строении химических соединений внес русский химик А. М. Бутлеров. Согласно теории Бутлерова, свойства химических соединений определяются природой атомов, их количеством и строением. Теория Бутлерова получила дальнейшее подтверждение и развитие и является одним из фундаментальных законов современной химии. Строение химических соединений в основном определяется природой химической связи. [c.31]
Неметаллические элементы в природе встречаются главным образом в виде соединений, что объясняется их высокой химической активностью. Благородные газы встречаются в свободном состоянии их простые вещества одноатомны, что связано с особенностями строения их атомов. [c.230]
Основой для изучения неорганической химии служит периодический закон и периодическая система элементов Д. И. Менделеева, учение о строении вещества. Основой органической химии является учение о природе химической связи, теория химического строения А. М. Бутлерова в ее современном понимании. На этой основе, как это сделано в учебнике, рассматриваются основные классы неорганических и органических соединений, их значение в народном хозяйстве. [c.355]
В книге изложены основные идеи теории строения, современные представления о природе химических связей в органических молекулах, о стереохимии и конформаци-онном анализе. На этой основе рассматриваются важнейшие типы и механизмы химических реакций электрофиль-ные, нуклеофильные и радикальные. Книга включает в себя материал о фотохимических превращениях, поведении биоорганических веществ в ней применены принципы кдрреляционного и информационного анализа органических соединений. [c.2]
За последние десятилетия неорганическая химия значительно изменилась качественно и количественно. Экспериментальные методы исследования структуры и квантовохимические расчеты позво- лили выяснить расположение атомов и природу химической связи в очень многих соединениях. Достижения химии координациоипых соедпнений, разработка новых методов неорганического синтеза (особенно реакций в неводных средах), исследование плазмы привели к открытию огромного числа новых веществ. Если раньше считали что неорганическая химия, в отличие от органической, бедна соединениями, то теперь положение коренным образом из менилось. [c.295]
Содер>кание дисциплины Задача flannofi дисциплины – освоение студентами теоретических основ химии и химии элементов и их соединение . В связи с этим программа состоит из двух разделов. Первы содержит основы теории, без которых невозможно понимание свойств и превращений- неорганических веществ современные представления о природе химической связи, строении ве-вещства и межмолекулярном взаимодействии общие закономерности протекания химических процессов изгалаются с привлечением химической термодинамики и кинетики. Второй раздел поввящен систематическому обзору свойств химических элементов и их соединений и включает общую характеристику элементов, способы получения и свойства элементарных веществ, а также некото Я1х соединений, применяемых в различных отраслях народного хозяйства, особенно в нефтеперерабатывающей промышленности. [c.178]
Выделение органической химии в самостоятельный раздел химической науки вызвано многими причинами. Во-первых, это связано с многочисленностью органических соединений (в настоящее время известно свыше трех миллионов органических Еси еств, а неорганических— около 150 тыс.). Вл дряя причина состоит в сложности и своеобразии органических веществ по сравнению с неорганическими. Например, их температуры плавления и кипения имеют более низкие значения они легко разрушаются при воздействии на них даже сравнительно невысоких температур (часто не превышающих 100°С), в то время как неорганические вещества свободно выдерживают очень высокие температуры. Большинство химических реакций с участием органических соединений протекает гораздо медленнее, чем ионные реакции неорганических веществ, что обусловлено природой основной химической связи в органических веществах — ковалентной связью. Углерод, входящий в состав органических веществ, обладает особой способностью соединяться не только с несколькими другими углеродными атомами, но и почти со всеми элементами периодической системы (кроме инертных газов). Следует подчеркнуть, что выход продукта в органической реакции, как правило, ниже, чем при реакции неорганических веществ. Кроме того, в области органической химии приходится сталкиваться с новыми понятиями и явлениями органический радикал, функциональная группа, изомерия и гомология, а также взаимное влияние атомов и атомных групп в молекуле. [c.5]
В. В. Марковников, Н. А. Меншуткин, А. Кекуле и др. Значительные успехи физики и химии в конце XIX и на протяжении XX вв. оказали огромное влияние на развитие X. с. т. во всех ее направлениях. Особенно большое значение для развития X. с. т. имело электронное истолкование природы химической связи, а теория электронных смещений является прямым дальнейшим развитием класспческой теории химического строения органических веществ. Одновременно X. с. т. развивается в связи с возникновением квантовой химии. Но несмотря на новые пути развития X. с. т. в старой, классической форме не потеряла своего значения для установления химической природы и порядка связи во всяком новом органическом соединении. [c.275]
Галидами называют соединения галогенов с металлами и неметаллами, в которых степень окисления галогенов равна —1. Тип химической связи, структура и свойства галидов зависят от химической природы как галогена, так и элемента, непосредственно с ним соединенного. Галиды щелочных металлов (за исключением — Г), щелочноземельных металлов (за исключением Ве — Г), большинства лантаноидов и некоторых актиноидов относятся к ионным соединениям. В галидах неметаллов и переходные металлов смешанные ионноковалентные связи. Галиды щелочных и щелочноземельных металлов — кристаллические вещества, не подвергающие-” ся гидролизу, так как представляют собой соли сильных кислот и сильных оснований. Галиды получают непосредственным д взаимодействием галогенов с металлом. [c.242]
Возможц ость взаимодействия реагирующих веществ в окислительно-восстановительной реакции определяется также устойчивостью и прочностью возникающих химических связей в образующихся соединениях, что зависит не только от природы компонентов, входящих в данное вещество, но и от внешних условий и от среды, в которой протекает процесс. [c.147]
Для того, чтобы узнать химический состав вещества, можно использовать самые различные способы и методики. Одной из самых популярных методик сегодня является метод спектрального анализа или спектроскопия.
По названию, вроде как, уже понятно, что речь должна пойти про работу со спектрами. Но не совсем ясно, как можно соотнести химический состав и эти самые спектры.
Вспоминаем понятие “Спектр”
Когда мы рассматривали природу формирования цвета предметов, то обозначили, что цвет любого объекта является результатом отражения от него пучков определённой длины волны.
Длина волны и формирует в нашем мозгу восприятие соответствующего цвета. Ну а если пропустить белый цвет через трехгранную прозрачную призму, то мы получим радугу. Этот фокус придумал ещё Ньютон и тем самым доказал, что белый цвет – это результат воздействия суммы всех монохроматических излучений.
Радужная картинка, получаемая в результате прохождения белого света (вспомните, что такое свет с точки зрения физики) через призму и есть спектр. Радуга – это тоже спектр. Ну а вообще – спектр есть просто распределение значений физической величины.
Как собственно применить понятие спектра для идентификации вещества? Физический принцип работы
При использовании спектрального анализа используется ключевой термин “спектр“. Это название общего типа понятия, на котором и базируется вся методика.
Если разложить белый цвет на спектр, то получим радугу. Белый цвет содержит 7 излучений, входящих в его состав. Если же разложить не белый цвет, а другое излучение, то и вместо радуги мы получим другой вариант спектра.
Известно, что каждый химический элемент испускает и поглощает характерный только для него световой спектр.
Раскладывать поток излучения можно или призмой, или дифракционной решеткой. Это уже не столь важно. Важна логика работы. Ну и тут не сложно догадаться, что у разных химических элементов эти спектры будут разными, потому что они излучают разные типа излучений.
Под спектральными наблюдениями понимают обычно наблюдения в интервале от инфракрасных до ультрафиолетовых лучей.
Но как тут заставить материал “светиться”? Ведь в обычном состоянии тот же металлический нож, вроде как, и не светится.
Варианты активации веществ для наблюдения спектра
Наибольшее распространение сегодня имеют два разных принципиальных подхода к активации химических элементов. Первый основан на эмиссии (испускании), а второй на абсорбции (поглощении).
Для того, чтобы исследуемое вещество начало что-то испускать и происходила эмиссия, его можно, как вариант, нагреть! Нагревать можно самыми разными способами. Молекулы разделяются на атомы, а атомы, получившие избыточную энергию, излучают её в виде света. Само собой, у каждого атома “свой свет”, разложение которого даст свой спектр.
Из этого положения следует, что одним из главных ограничений метода является невозможность выявлять молекулярный состав. Только химический анализ атомарного типа. В результате эксперимента мы увидим, что в теле есть, скажем, Na и Cl. Но какая там молекула или фаза из них срастется мы можем только предполагать.
Следующий вариант – это наоборот облучать чем-то исследуемое вещество. Так работает абсорбционная логика эксперимента. Атомы облучаются внешним источником излучения. Некоторая часть поглощается атомами вещества, а некоторая отражается обратно. По соотношению поглощения и отражения делается вывод о химическом составе.
Как разобраться во всем этом винегрете?
Но как понять, какой именно элемент что испускает? Ведь происходит излучение целого светового потока. Из него нужно как-то вычленить, что есть в составе такой-то химический элемент и такой-то.
Световой поток суммируется от всех присутствующих в пробе веществ. Но на помощь приходит обстоятельство, что для каждого конкретного химического элемента были уже когда-то зарегистрированы характерные спектры. Значит, остается найти лишь характерные группы спектров в этой общей каше.
С учетом того, что сегодня компьютер анализирует получаемые спектры, это всё совсем просто. Сами спектральные аппараты служат разделительным элементом системы спектроскопии. Они и выявляют чего и сколько.
Как понять какое количество элемента содержится в химическом составе?
Тут тоже всё довольно логично. Чем ярче светится, тем больше элемента. Есть экспериментальные данные, которые выявлены для чистых веществ и распределение интенсивностей позволяет сделать в итоге не только выводы о химическом составе, но и о процентном содержании каждого элемента в общей массе.
Спектральный анализ в изучении космоса
Нехитрая на первый взгляд методика позволила получить невероятные результаты в изучении космических пространств.
Так, стало возможно определить элементный состав солнца или любого другого светила, исходя из разложения на спектры его излучения. Ведь тело это само по себе уже горячее и частички там активированы.
Значит, остается просто их зарегистрировать по факту и сделать выводы. Соответственно, подобный подход позволяет найти хим.состав.
Аналогичным образом можно применить и абсорбционные методы, исходя из описанных выше положений.
Остались вопросы или нужна консультация?
Школа Инженерных знаний Юрия Трифонова
————
Понравилась статья? Обязательно оцените её лайком и подпишитесь на проект! Ведь алгоритмы дзена преимущественно продвигают другие тематики 🙁
————-
Советую также прочитать на нашем канале:
—–
Смотрите нас на YouTube и присоединяйтесь к нашему Телеграм!
Содержание
- химическая природа
- Смотреть что такое «химическая природа» в других словарях:
- Химическое вещество
- Содержание
- Различие между веществом и полем
- Свойства вещества
- Разнообразие веществ
- Индивидуальные вещества и смеси
- Агрегатные состояния
- Кристаллы
- Вещество
- Содержание
- Различие между веществом и полем
- Свойства вещества
- Классификация веществ
- Химическая классификация
- Индивидуальные вещества и смеси
- Неорганические вещества
- Органические вещества
- Физическая классификация
- Агрегатные состояния
- Вещества и их свойства. Физические и химические явления.
- Разнообразие веществ
- Агрегатное состояние вещества
- Физические явления. Физические свойства веществ.
- Кристаллические и аморфные вещества
- Химические явления. Химическая реакция.
химическая природа
Словарь синонимов ASIS. В.Н. Тришин . 2013 .
Смотреть что такое «химическая природа» в других словарях:
химическая природа — cheminė prigimtis statusas T sritis chemija apibrėžtis Medžiagos cheminių savybių visuma. atitikmenys: angl. chemical nature rus. химическая природа … Chemijos terminų aiškinamasis žodynas
Химическая связь — … Википедия
Химическая кинетика — Эта статья или раздел нуждается в переработке. Пожалуйста, улучшите статью в соответствии с правилами написания статей … Википедия
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА — рассматривает взаимосвязи между работой и энергией применительно к химическим превращениям. Поскольку химическое превращение обычно сопровождается высвобождением или поглощением определенного количества теплоты, оно, как и другие явления природы… … Энциклопедия Кольера
Химическая связь — взаимное притяжение атомов, приводящее к образованию молекул и кристаллов. Принято говорить, что в молекуле или в кристалле между соседними атомами существуют Х. с. Валентность атома (о чём подробнее сказано ниже) показывает число связей … Большая советская энциклопедия
Химическая связь — совокупность сил и типов взаимодействий, которые обусловливают существование молекул, кристаллов, молекулярных ионов и радикалов. Природа сил, определяющих химическую связь, является ку лоновской (электрической) и не может быть описана в рамках… … Начала современного естествознания
Кинетика химическая — Химическая кинетика или кинетика химических реакций раздел химии, изучающий механизмы протекания химических реакций, порядок химической реакции, а также закономерности протекания химических реакций во времени. Содержание 1 Скорость химической… … Википедия
Связь химическая — Химическая связь явление взаимодействия атомов, обусловленное перекрыванием электронных облаков, связывающихся частиц, которое сопровождается уменьшением полной энергии системы. Термин «химическое строение» впервые ввёл А. М. Бутлеров в 1861… … Википедия
Синтез и природа фотографических эмульсий — Эту страницу предлагается переименовать в Исследование фотографических эмульсий в СССР. Пояснение причин и обсуждение на странице Википедия:К переименованию/21 июня 2011. Возможно, её текущее название не соответствует нормам… … Википедия
Одноэлектронная химическая связь — Одноэлектронная химическая связь это простейшая химическая связь, обуславливающая существование молекулярных соединений посредством кулоновского удерживания двух атомных ядер одним электроном. Главные отличительные черты одноэлектронной… … Википедия
Источник
Химическое вещество
Вещество́ — форма материи, в отличие от поля, обладающая массой покоя. Вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы, молекулы, кристаллы и т. д.
В биологии Вещество́ — форма материи, образующая ткани организмов, входящая в состав органелл клеток.
Содержание
Различие между веществом и полем
Поле, в отличие от веществ, характеризуется непрерывностью, известны электромагнитное и гравитационное поля, поле ядерных сил, волновые поля различных элементарных частиц.
Современное естествознание нивелирует различие между веществом и полем, считая, что и вещества, и поля состоят из различных частиц, обладающих корпускулярно-волновой (двойственной) природой. Выявление тесной взаимосвязи между полем и веществом привело к углублению представлений о единстве всех форм и структуры материального мира.
Однородное вещество характеризуется плотностью — отношением массы вещества к его объёму:
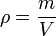
где ρ — плотность вещества, m — масса вещества, V — объём вещества.
Физические поля такой плотностью не обладают.
Свойства вещества
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства.
Разнообразие веществ
Число веществ в принципе неограниченно велико; к известному числу веществ всё время добавляются новые вещества, как открываемые в природе, так и синтезируемые искусственно.
Индивидуальные вещества и смеси
В химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов, связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента).
Агрегатные состояния
Все вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
При переходе от идеальных моделей твёрдого, жидкого и газообразного состояний к реальным состояниям вещества обнаруживается несколько пограничных промежуточных типов, общеизвестными из которых являются аморфное (стеклообразное) состояние, состояние жидкого кристалла и высокоэластичное (полимерное) состояние. В связи с этим часто пользуются более широким понятием «фаза».
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизированное состояние, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
Кристаллы
Кристаллы — это твёрдые вещества, имеющие естественную внешнюю форму правильных симметричных многогранников, основанную на их внутренней структуре, то есть на одном из нескольких определённых регулярных расположений составляющих вещество частиц (атомов, молекул, ионов). Кристаллическая структура, будучи индивидуальной для каждого вещества, относится к основным физико-химическим свойствам. Составляющие данное твёрдое вещество частицы образуют кристаллическую решётку. Если кристаллические решётки стереометрически (пространственно) одинаковы или сходны (имеют одинаковую симметрию), то геометрическое различие между ними заключается, в частности, в разных расстояниях между частицами, занимающими узлы решётки. Сами расстояния между частицами называются параметрами решётки. Параметры решётки, а также углы геометрических многогранников определяются физическими методами структурного анализа, например методами рентгеновского структурного анализа.
Часто твёрдые вещества образуют (в зависимости от условий) более чем одну форму кристаллической решётки; такие формы называются полиморфными модификациями. Например, среди простых веществ известны ромбическая и моноклинная сера, графит и алмаз, которые являются гексагональной и кубической модификациями углерода, среди сложных веществ — кварц, тридимит и кристобалит представляют собой различные модификации диоксида кремния.
Источник
Вещество
Вещество в химии — физическая субстанция со специфическим химическим составом. В философском словаре Григория Теплова в 1751 году словом вещество переводился латинский термин Substantia.
Вещество в современной физике как правило понимается как вид материи, состоящий из фермионов или содержащий фермионы наряду с бозонами; обладает массой покоя, в отличие от некоторых типов полей, как например электромагнитное [1] . Обычно (при сравнительно низких температурах и плотностях) вещество состоит из частиц, среди которых чаще всего встречаются электроны, протоны и нейтроны. Последние два образуют атомные ядра, а все вместе — атомы (атомное вещество), из которых — молекулы, кристаллы и т. д. В некоторых условиях, как например в нейтронных звездах, могут существовать достаточно необычные виды вещества.
Содержание
Различие между веществом и полем
Исторически в физике делалось фундаментальное различие между веществом и полем. Поле, в отличие от вещества, мыслилось непрерывным и проницаемым, в то время как частицы вещества представлялись дискретными, или по крайней мере достаточно локализованными. Известные в классической физике поля, такие как электромагнитное и гравитационное, противопоставлялись массивным и иногда электрически заряженным частицам вещества.
Современная физика нивелирует различие между веществом и полем, считая, что все частицы (в том числе и частицы вещества, равно как и частицы, относящиеся к классическим полям) есть квантовые возбуждения различных фундаментальных полей, и так или иначе все частицы проявляют такие типично полевые свойства, как делокализованность и подчинение уравнениям движения по сути не отличающимся от полевых (о чем можно говорить как о волновых свойствах всех частиц, в том числе и частиц вещества). Выявление тесной взаимосвязи между полем и веществом привело к углублению представлений о единстве всех форм и структуры физической картины мира.
Впрочем в контексте задач, относящихся к классической физике, а иногда и несколько шире, бывает иногда довольно удобно пользоваться и старой терминологией, хотя в контексте физики в целом она уже и выглядит анахронизмом. Например, если речь идет о взаимодействии заряженных частиц с электромагнитным полем, довольно удобно, следуя традиции называть одно «полем», а другое «веществом», особенно если вещество рассматривается или чисто классически, или — если квантово — то в терминах волновых функций (что позволяет избежать чисто терминологически неудобного пересечения понятий).
Свойства вещества
Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства.
Классификация веществ
Число веществ в принципе неограниченно велико; к известному числу веществ всё время добавляются новые вещества, как открываемые в природе, так и синтезируемые искусственно.
Химическая классификация
Индивидуальные вещества и смеси
В химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов, связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента).
Неорганические вещества
Органические вещества
Физическая классификация
Агрегатные состояния
Все химические вещества в принципе могут существовать в трёх агрегатных состояниях — твёрдом, жидком и газообразном. Так, лёд, жидкая вода и водяной пар — это твёрдое, жидкое и газообразное состояния одного и того же химического вещества — воды H2O. Твёрдая, жидкая и газообразная формы не являются индивидуальными характеристиками химических веществ, а соответствуют лишь различным, зависящим от внешних физических условий состояниям существования химических веществ. Поэтому нельзя приписывать воде только признак жидкости, кислороду — признак газа, а хлориду натрия — признак твёрдого состояния. Каждое из этих (и всех других веществ) при изменении условий может перейти в любое другое из трёх агрегатных состояний.
При переходе от идеальных моделей твёрдого, жидкого и газообразного состояний к реальным состояниям вещества обнаруживается несколько пограничных промежуточных типов, общеизвестными из которых являются аморфное (стеклообразное) состояние, состояние жидкого кристалла и высокоэластичное (полимерное) состояние. В связи с этим часто пользуются более широким понятием «фаза».
В физике рассматривается четвёртое агрегатное состояние вещества — плазма, частично или полностью ионизированное состояние, в котором плотность положительных и отрицательных зарядов одинакова (плазма электронейтральна).
При некоторых условиях (обычно достаточно отличающихся от обычных) те или иные вещества могут переходить в такие особые состояния, как сверхтекучее и сверхпроводящее.
Источник
Вещества и их свойства. Физические и химические явления.
Разнообразие веществ
За последние 200 лет человечество изучило свойства веществ лучше, чем за всю историю развития химии. Естественно, количество веществ так же стремительно растет, это связано, прежде всего, с освоением различных методов получения веществ.
В повседневной жизни мы сталкиваемся с множеством веществ. Среди них – вода, железо, алюминий, пластмасса, сода, соль и множество других. Вещества, существующие в природе, например, кислород и азот, содержащиеся в воздухе, вещества, растворенные в воде, и имеющие природное происхождение, называются природными веществами. Алюминия, цинка, ацетона, извести, мыла, аспирина, полиэтилена и многих других веществ в природе не существует.
Их получают в лаборатории, и производит промышленность. Искусственные вещества не встречаются в природе, их создают из природных веществ. Некоторые вещества, существующие в природе, можно получить и в химической лаборатории.
Так, при нагревании марганцовки выделяется кислород, а при нагревании мела – углекислый газ. Ученые научились превращать графит в алмаз, выращивают кристаллы рубина, сапфира и малахита. Итак, наряду с веществами природного происхождения существует огромное множество и искусственно созданных веществ, не встречающихся в природе.
Вещества, не встречающиеся в природе, производятся на различных предприятиях: фабриках, заводах, комбинатах и т.п.
В условиях исчерпания природных ресурсов нашей планеты, сейчас перед химиками стоит важная задача: разработать и внедрить методы, при помощи которых можно искусственно, в условиях лаборатории, или промышленного производства, получать вещества, являющиеся аналогами природных веществ. Например, запасы топливных ископаемых в природе на исходе.
Может настать тот момент, когда нефть и природный газ закончатся. Уже сейчас ведутся разработки новых видов топлива, которые были бы такими же эффективными, но не загрязняли окружающую среду. На сегодняшний день человечество научилось искусственно получать различные драгоценные камни, например, алмазы, изумруды, бериллы.
Агрегатное состояние вещества
Вещества могут существовать в нескольких агрегатных состояниях, три из которых вам известны: твердое, жидкое, газообразное. Например, вода в природе существует во всех трех агрегатных состояниях: твердом (в виде льда и снега), жидком (жидкая вода) и газообразном (водяной пар). Известны вещества, которые не могут существовать в обычных условиях во всех трех агрегатных состояниях. Например, таким веществом является углекислый газ. При комнатной температуре это газ без запаха и цвета. При температуре –79°С данное вещество «замерзает» и переходит в твердое агрегатное состояние. Бытовое (тривиальное) название такого вещества «сухой лед». Такое название дано этому веществу из-за того, что «сухой лед» превращается в углекислый газ без плавления, то есть, без перехода в жидкое агрегатное состояние, которое присутствует, например, у воды.
Таким образом, можно сделать важный вывод. Вещество при переходе из одного агрегатного состояния в другое не превращается в другие вещества. Сам процесс некоего изменения, превращения, называется явлением.
Физические явления. Физические свойства веществ.
Явления, при которых вещества изменяют агрегатное состояние, но при этом не превращаются в другие вещества, называют физическими. Каждое индивидуальное вещество обладает определенными свойствами. Свойства веществ могут быть различными или сходными друг с другом. Каждое вещество описывают при помощи набора физических и химических свойств. Рассмотрим в качестве примера воду. Вода замерзает и превращается в лед при температуре 0°С, а закипает и превращается в пар при температуре +100°С. Данные явления относятся к физическим, так как вода не превратилась в другие вещества, происходит только изменение агрегатного состояния. Данные температуры замерзания и кипения – это физические свойства, характерные именно для воды.
Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
Испарение спирта, как и испарение воды – физические явления, вещества при этом изменяют агрегатное состояние. После проведения опыта можно убедиться, что спирт испаряется быстрее, чем вода – это физические свойства этих веществ.
К основным физическим свойствам веществ можно отнести следующие: агрегатное состояние, цвет, запах, растворимость в воде, плотность, температура кипения, температура плавления, теплопроводность, электропроводность. Такие физические свойства как цвет, запах, вкус, форма кристаллов, можно определить визуально, с помощью органов чувств, а плотность, электропроводность, температуру плавления и кипения определяют измерением. Сведения о физических свойствах многих веществ собраны в специальной литературе, например, в справочниках. Физические свойства вещества зависят от его агрегатного состояния. Например, плотность льда, воды и водяного пара различна.
Газообразный кислород бесцветный, а жидкий – голубой Знание физических свойств помогает «узнавать» немало веществ. Например, медь – единственный металл красного цвета. Соленый вкус имеет только поваренная соль. Иод – почти черное твердое вещество, которое при нагревании превращается в фиолетовый пар. В большинстве случаев для определения вещества нужно рассматривать несколько его свойств. В качестве примера охарактеризуем физические свойства воды:
- цвет – бесцветная (в небольшом объеме)
- запах – без запаха
- агрегатное состояние – при обычных условиях жидкость
- плотность – 1 г/мл,
- температура кипения – +100°С
- температура плавления – 0°С
- теплопроводность – низкая
- электропроводность – чистая вода электричество не проводит
Кристаллические и аморфные вещества
При описании физических свойств твердых веществ принято описывать структуру вещества. Если рассмотреть образец поваренной соли под увеличительным стеклом, можно заметить, что соль состоит из множества мельчайших кристаллов. В соляных месторождениях можно встретить и весьма крупные кристаллы. Кристаллы – твердые тела, имеющие форму правильных многогранников Кристаллы могут иметь различную форму и размер. Кристаллы некоторых веществ, таких как поваренная соль – хрупкие, их легко разрушить. Существуют кристаллы довольно твердые. Например, одним из самых твердых минералов считается алмаз. Если рассматривать кристаллы поваренной соли под микроскопом, можно заметить, что все они имеют похожее строение. Если же рассмотреть, например, частицы стекла, то все они будут иметь различное строение – такие вещества называют аморфными. К аморфным веществам относят стекло, крахмал, янтарь, пчелиный воск. Аморфные вещества – вещества, не имеющие кристаллического строения
Химические явления. Химическая реакция.
Если при физических явлениях вещества, как правило, лишь изменяют агрегатное состояние, то при химических явлениях происходит превращение одних веществ в другие вещества. Приведем несколько простых примеров: горение спички сопровождается обугливанием древесины и выделением газообразных веществ, то есть, происходит необратимое превращение древесины в другие вещества. Другой пример: со временем бронзовые скульптуры покрываются налетом зеленого цвета. Дело в том, что в состав бронзы входит медь. Этот металл медленно взаимодействует с кислородом, углекислым газом и влагой воздуха, в результате на поверхности скульптуры образуются новые вещества зеленого цвета Химические явления – явления превращений одних веществ в другие Процесс взаимодействия веществ с образованием новых веществ называют химической реакцией. Химические реакции происходят повсеместно вокруг нас. Химические реакции происходят и в нас самих. В нашем организме непрерывно происходят превращения множества веществ, вещества реагируют друг с другом, образуя продукты реакции. Таким образом, в химической реакции всегда есть реагирующие вещества, и вещества, образовавшиеся в результате реакции.
- Химическая реакция – процесс взаимодействия веществ, в результате которого образуются новые вещества с новыми свойствами
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образовавшиеся в результате химической реакции
Химическая реакция изображается в общем виде схемой реакции РЕАГЕНТЫ -> ПРОДУКТЫ
- реагенты – исходные вещества, взятые для проведения реакции;
- продукты – новые вещества, образовавшиеся в результате протекания реакции.
Любые химические явления (реакции) сопровождаются определенными признаками, при помощи которых химические явления можно отличить от физических. К таким признакам можно отнести изменение окраски веществ, выделение газа, образование осадка, выделение тепла, излучение света.
Многие химические реакции сопровождаются выделением энергии в виде тепла и света. Как правило, такими явлениями сопровождаются реакции горения. В реакциях горения на воздухе вещества реагируют с кислородом, содержащимся в воздухе. Так, например, металл магний вспыхивает и горит на воздухе ярким слепящим пламенем. Именно поэтому вспышку магния использовали при создании фотографий в первой половине ХХ века. В некоторых случаях возможно выделение энергии в виде света, но без выделения тепла. Один из видов тихоокеанского планктона способен испускать ярко-голубой свет, хорошо заметный в темноте. Выделение энергии в виде света – результат химической реакции, которая протекает в организмах данного вида планктона.
Итог статьи:
- Существуют две большие группы веществ: вещества природного и искусственного происхождения
- В обычных условиях вещества могут находиться в трех агрегатных состояниях
- Свойства веществ, которые определяют измерениями или визуально при отсутствии превращения одних веществ в другие, называют физическими
- Кристаллы – твердые тела, имеющие форму правильных многогранников
- Аморфные вещества – вещества, не имеющие кристаллического строение
- Химические явления – явления превращений одних веществ в другие
- Реагенты – вещества, вступающие в химическую реакцию
- Продукты – вещества, образующиеся в результате химической реакции
- Химические реакции могут сопровождаться выделением газа, осадка, тепла, света; изменением окраски веществ
- Горение – сложный физико-химический процесс превращения исходных веществ в продукты сгорания в ходе химической реакции, сопровождающийся интенсивным выделением тепла и света (пламени)
Источник
