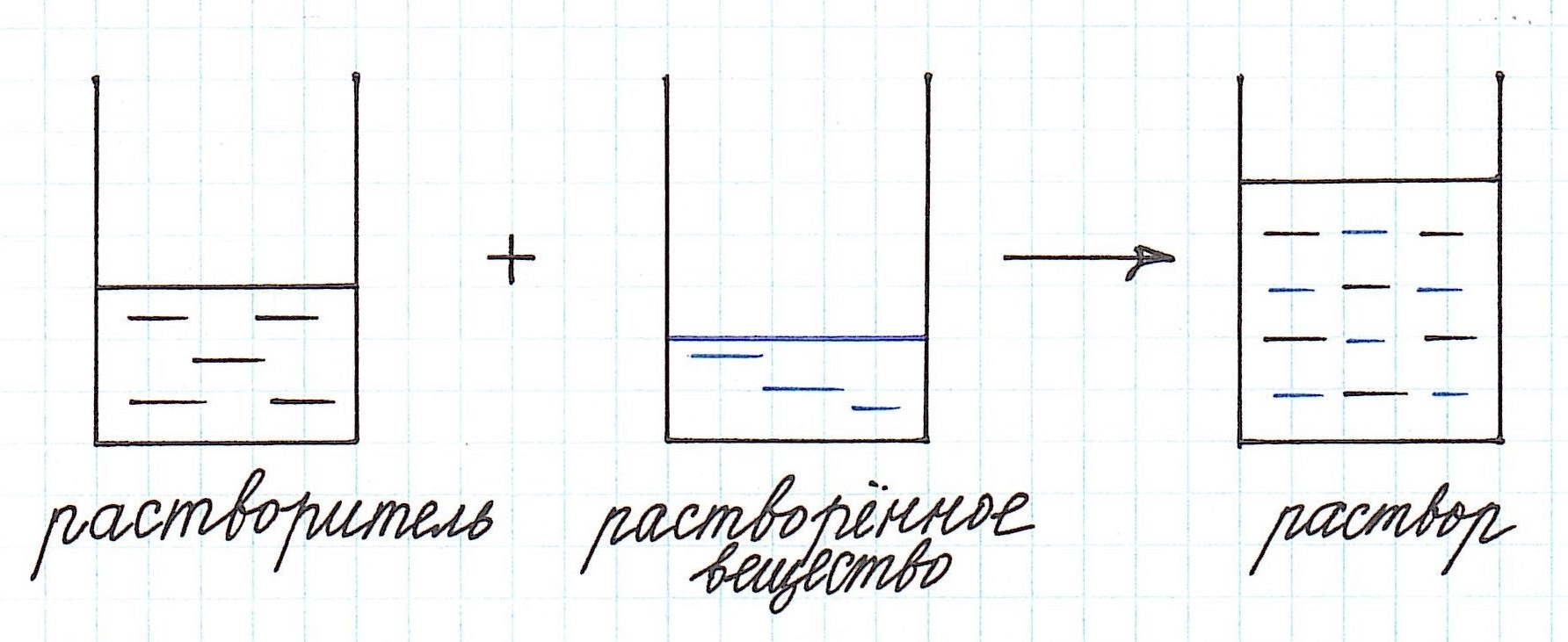
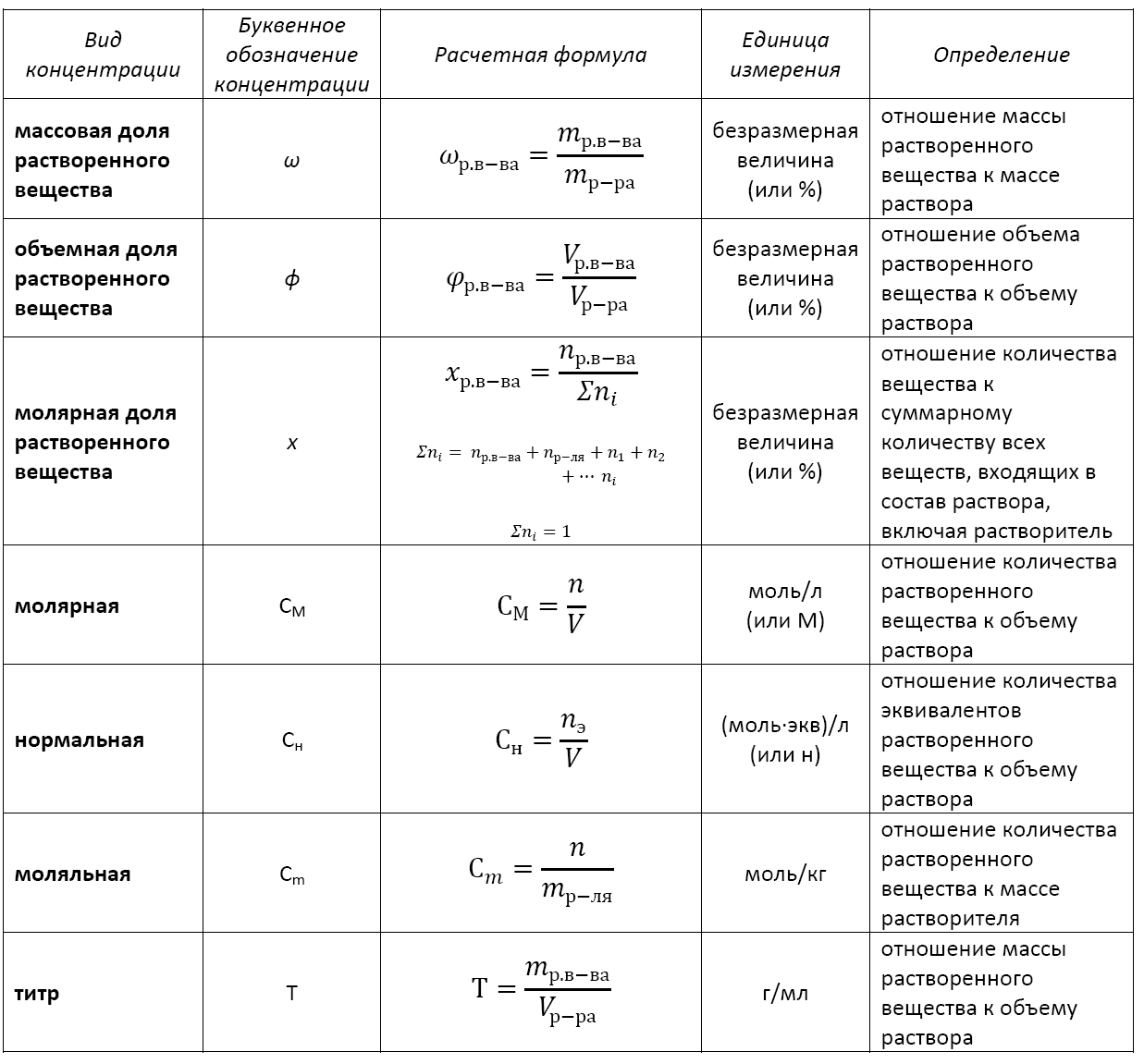
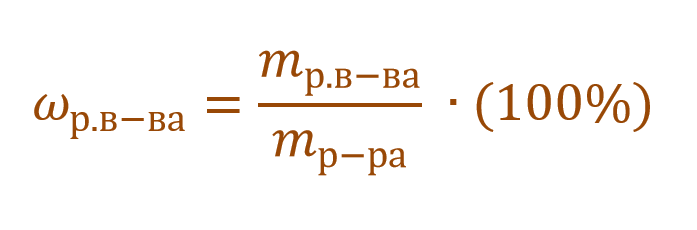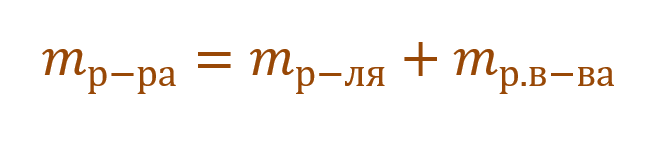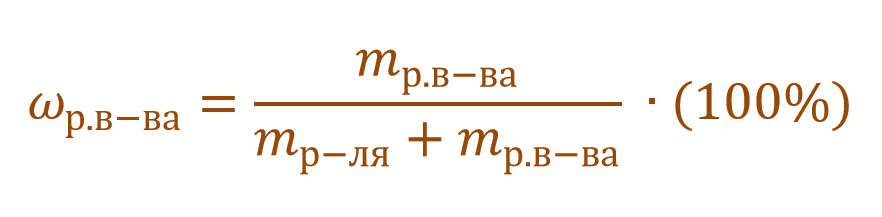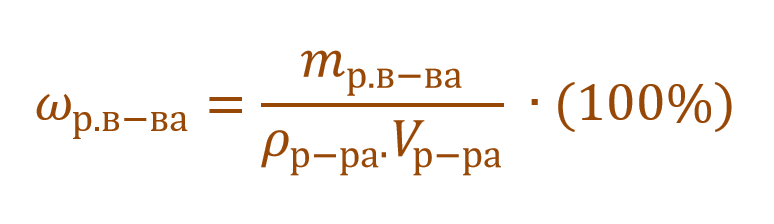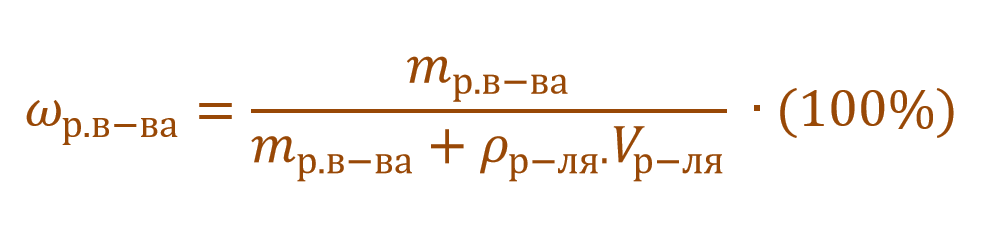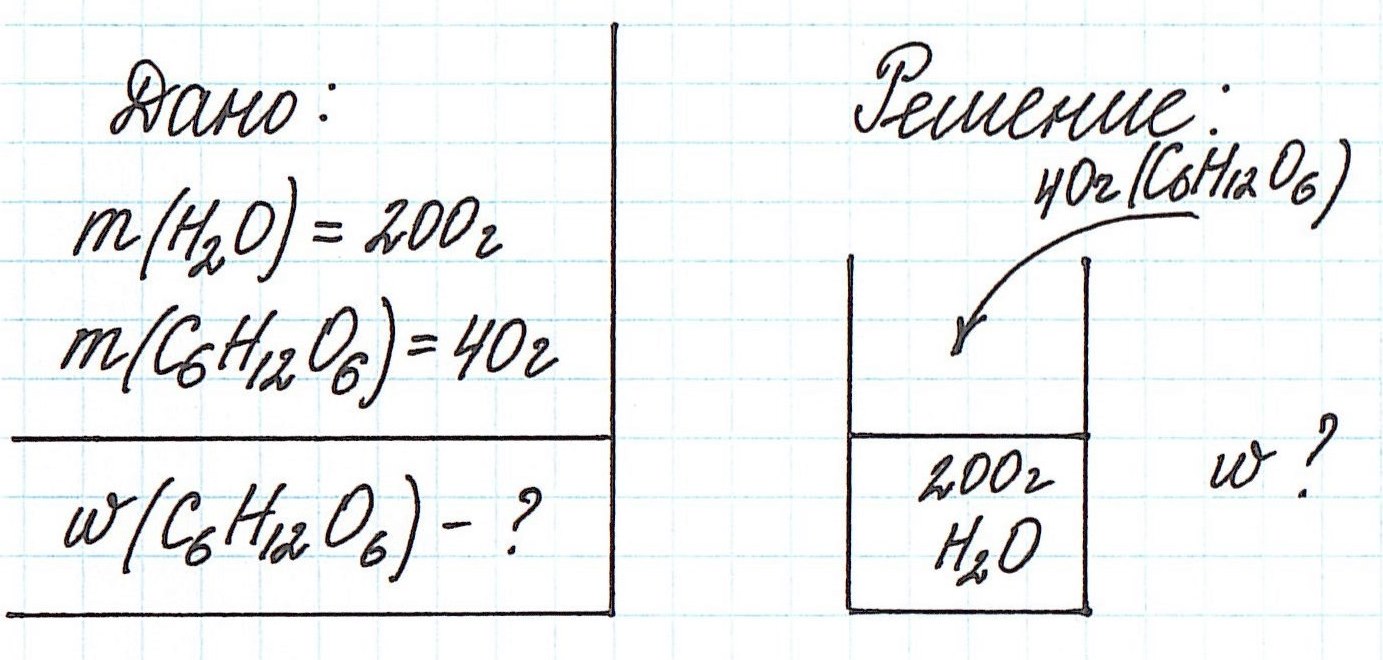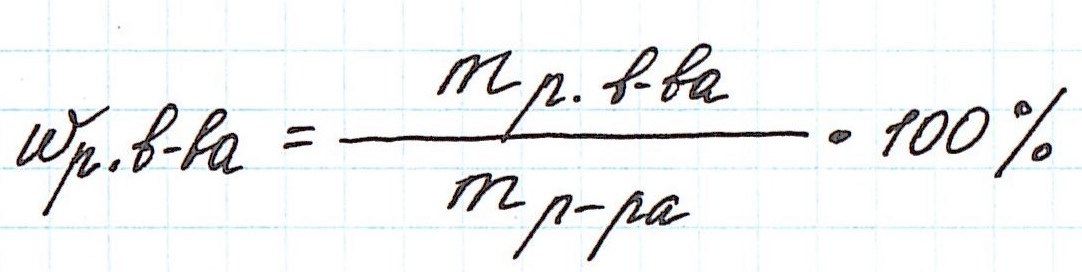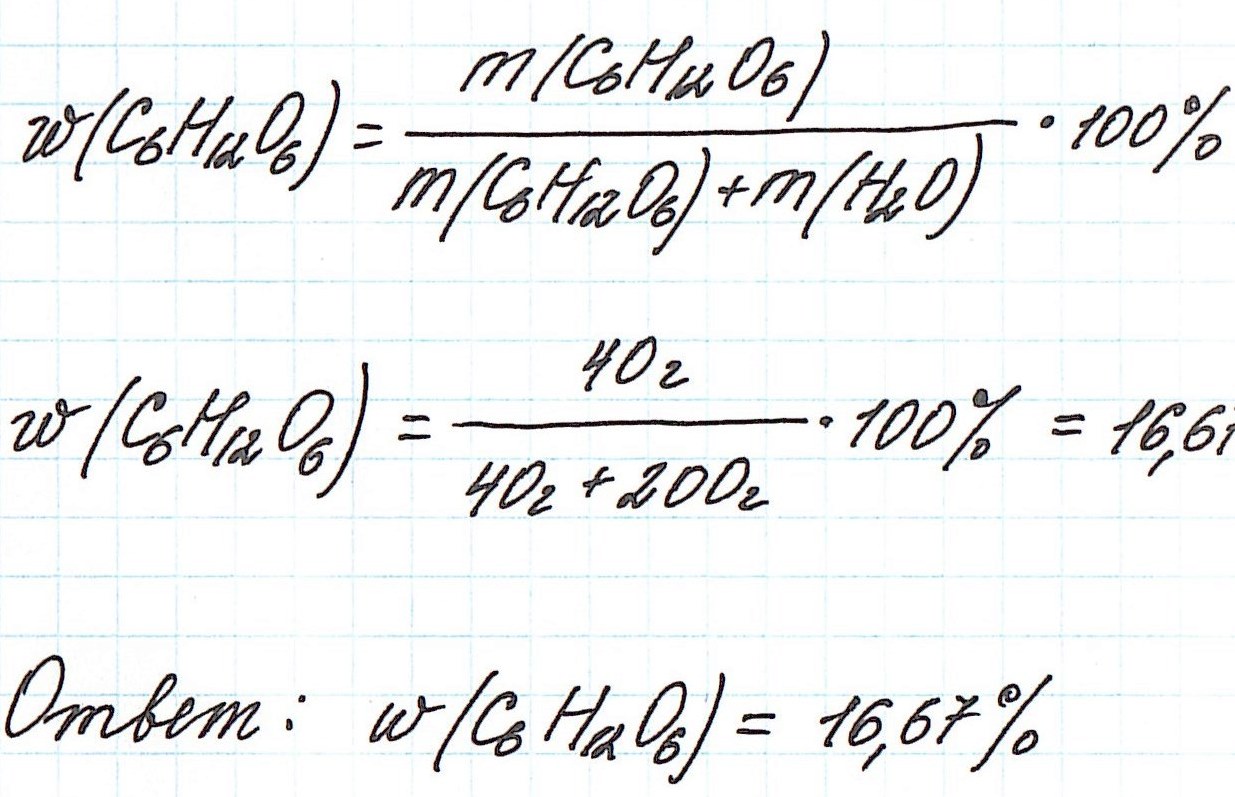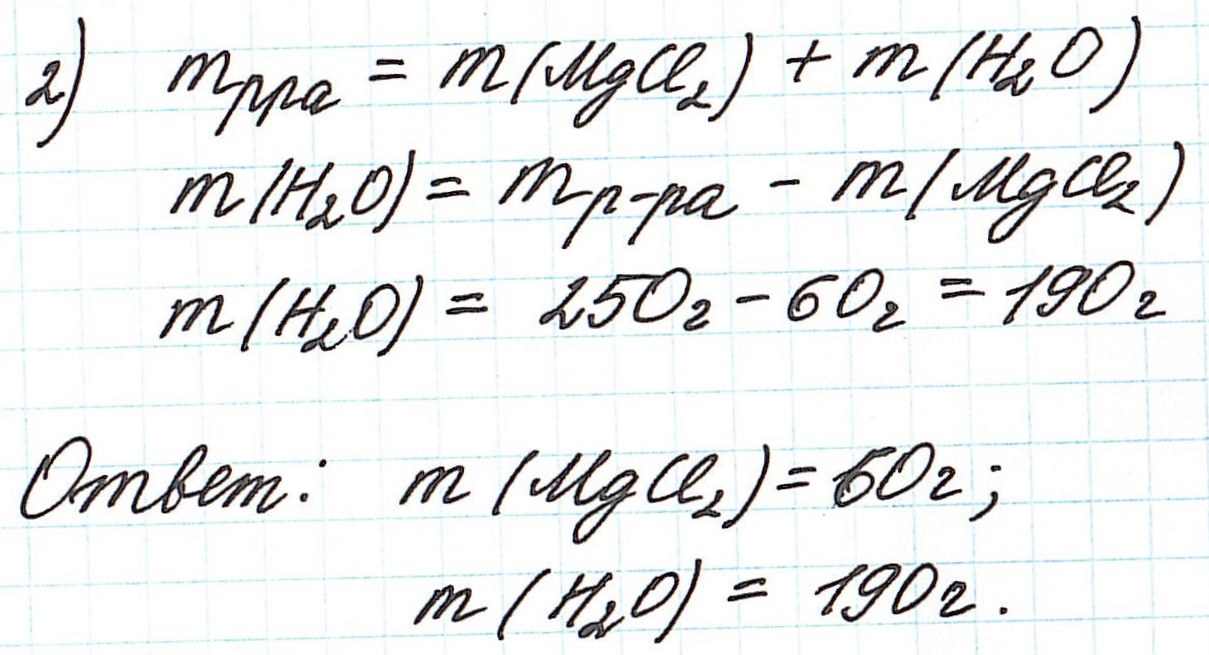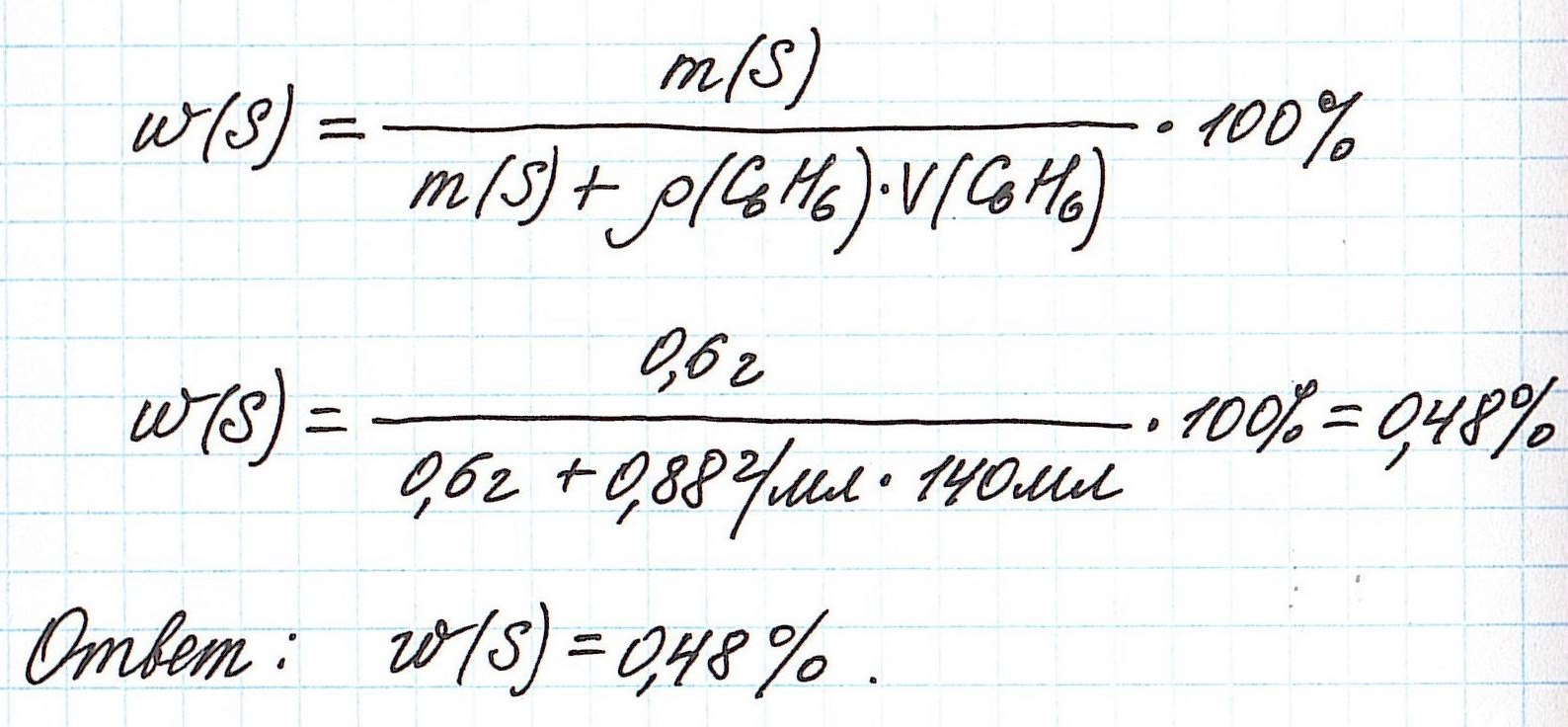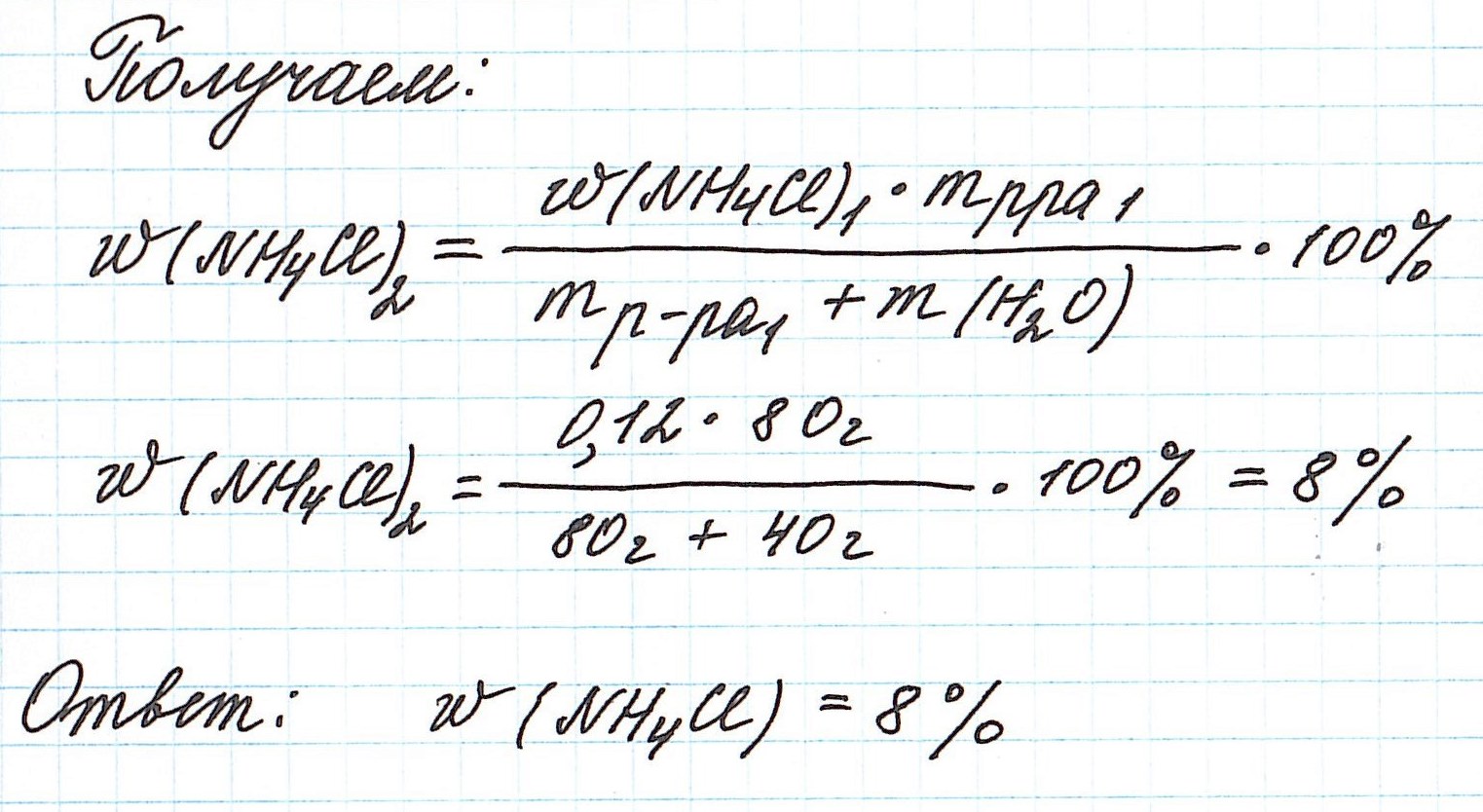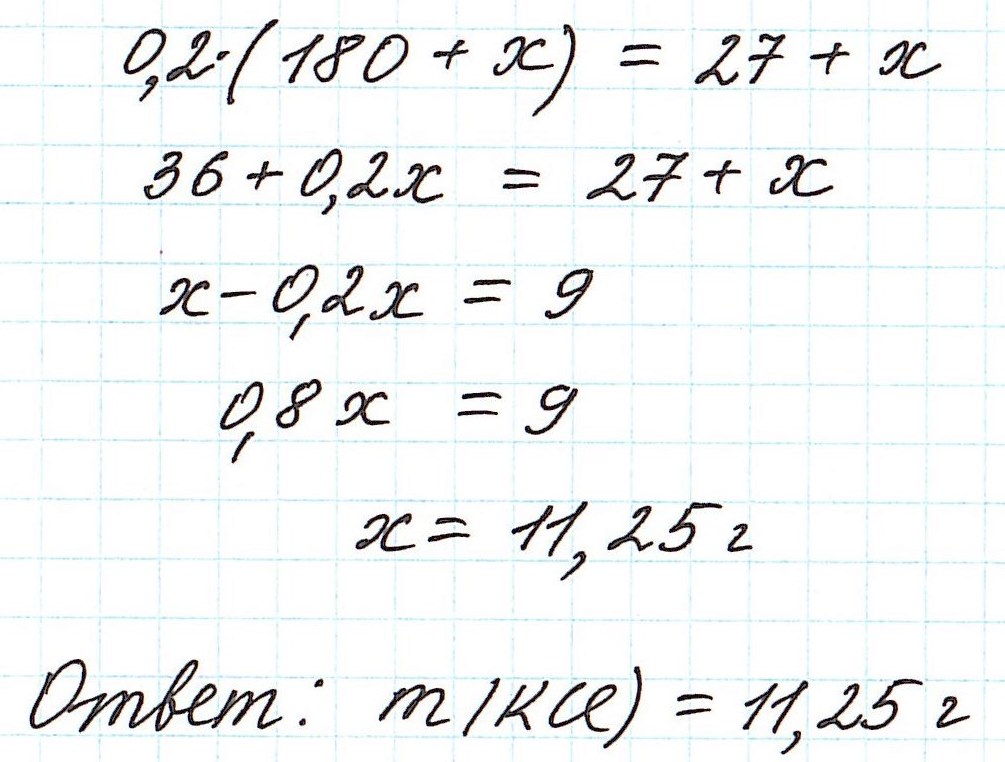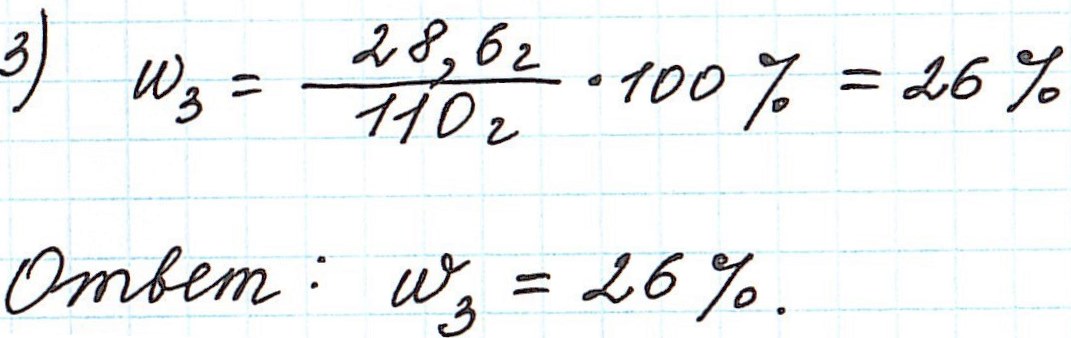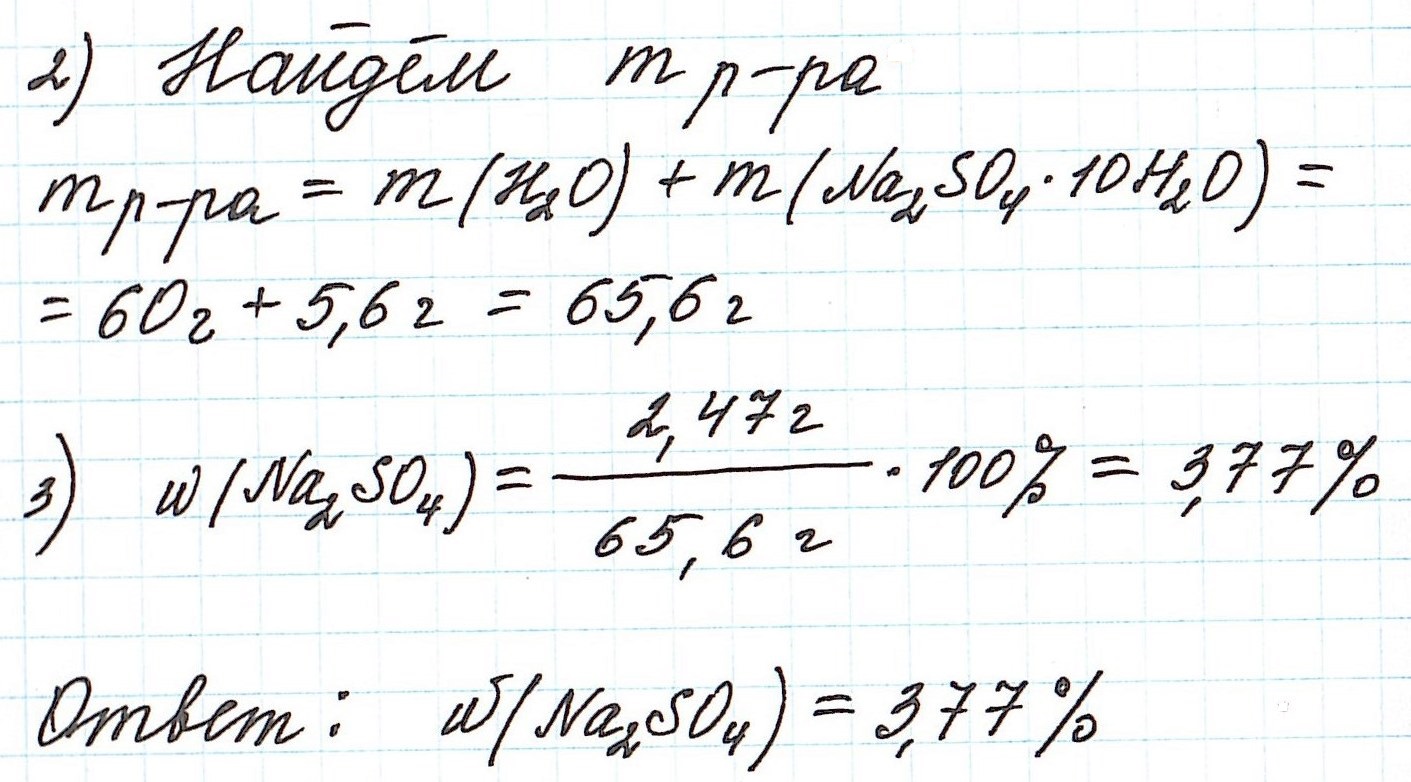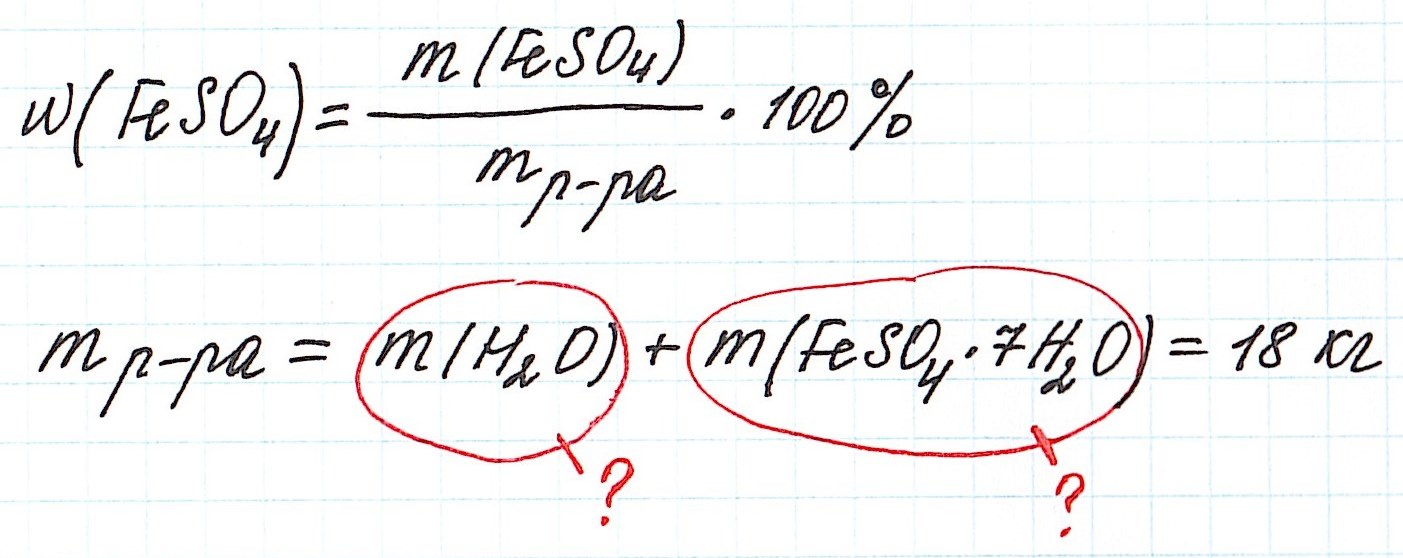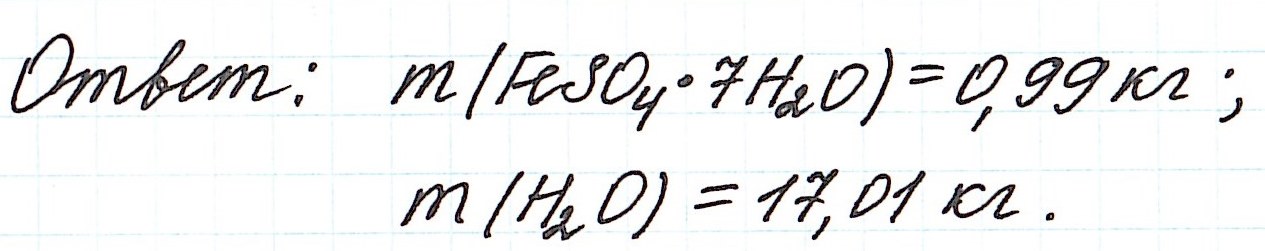Отношение количества
или массы вещества, содержащегося в
системе, к объему или массе этой системы
называется концентрацией.
Рассмотрим несколько
способов выражения концентрации.
Процентная
концентрация
(массовая доля растворенного вещества)
(ω) показывает, сколько единиц массы
растворенного вещества содержится в
100 единицах массы раствора. Массовая
доля – безразмерная величина, ее выражают
в долях единицы или процентах:
,
где ω – массовая
доля (%) растворенного вещества; m1
– масса растворенного вещества, г; m
– масса раствора, г.
Масса раствора
равна произведению объема раствора V
(мл) на его плотность r
(г/см3):
,
тогда
.
Молярная
концентрация (молярность)
раствора – показывает, сколько молей
растворенного вещества содержится в
1л раствора.
Молярную концентрацию
(моль на литр) выражают формулой
,
где m1
– масса растворенного вещества, г; М –
молярная масса растворенного вещества,
г/моль; V
– объем раствора, л.
Количество вещества
в молях определяется по формуле:
n
= m1
/М, тогда
Нормальная
концентрация (нормальность раствора)
показывает, сколько грамм-эквивалентов
растворенного вещества содержится в 1
л раствора (моль на литр):
,
где m1
– масса растворенного вещества, г; V
– объем раствора, л.
Э – эквивалентная
масса растворенного вещества (г/моль),
которую рассчитывают по формуле:
Э=(г/моль),
где М – мольная
масса вещества, n
– количество катионов (анионов), В
– валентность. Валентность – это
способность атомов элемента присоединять
определенное число атомов другого
элемента. Эквивалент кислоты можно
определить по формуле: Э = М (кислоты)
/ основность (число атомов водорода).
Например: Э
Н2SO4==49г/моль;
эквивалент основания по формуле: Э = М
(основания) / кислотность (число ОН–
групп), так Э
Fe(OH)3==35,6г/моль;
эквивалент соли по формуле: Э = М(соли)
/ число атомов металла * валентность
металла,
Э Al2(SO4)3==114г/моль.
Моляльность
раствора Сm
показывает
количество растворенного вещества,
находящееся в 1 кг растворителя:
,
где m2
– масса растворителя, кг; n
– количество растворенного вещества,
моль.
Пример
1.
Вычислить молярность и нормальность
40 %-го раствора фосфорной кислоты,
плотность которого 1,25 г/см3.
Объем раствора 1л.
Решение.
Для расчета молярности и нормальности
раствора найдем массу фосфорной кислоты
в 1 л (1000 мл) 40 %-го раствора:
w
= m1
· 100/V
∙ r;
.Молярная
масса Н3РO4
равна 98 г/моль, следовательно,
=
500/98 = 5,1 моль/л.
Молярная
масса эквивалента Н3РO4
равна 98/3 = 32,7 г/моль.
Тогда
СН
= 500/32,7 =
1,53 моль/л.
Пример
2.
Вычислить
массовую долю КОН в 2н. растворе, плотность
которого 1,08 г/см3.
Решение.
Поскольку
нормальность рассчитывается на 1 л
раствора, найдем массу растворенного
вещества в 1 л:
СН=
m1/Э∙V;
ЭKOH
= 56 г/моль;
mКОН=2∙56∙1=112
г.
Теперь
вычислим массовую доли КОН в растворе,
содержащем 112
г
гидроксида калия:
w=
m1∙100/V∙r=112∙100/1000∙1,08=10,4
%.
Пример 3.
На нейтрализацию 50 см3
раствора кислоты израсходовано 25 см3
0,5 н. раствора щелочи. Чему равна молярная
концентрация эквивалентов кислоты?
Решение.
Так как вещества взаимодействуют между
собой в эквивалентных соотношениях, то
растворы равной молярной концентрации
эквивалентов реагируют в равных объемах.
При разных молярных концентрациях
эквивалентов объемы растворов реагирующих
веществ обратно пропорциональны их
нормальностям, т.е.
V1:
V2
= С2
: С1
или V1∙
С1
= V2
∙
С2
50С1
= 25 • 0,5; откуда С1
= 25 • 0,5 / 50 = 0,25н.
Задание:
решить следующие задачи, принимая объем
раствора равным
1 л:
|
Вариант |
Вещество |
Концентрация |
Плотность |
Вычислить |
|
121 |
Na2CO3 |
0,30 |
1,030 |
Процентную |
|
122 |
HNO3 |
9,0 |
1,275 |
Процентную |
|
123 |
NH4Cl |
10 |
1,028 |
Молярную |
|
124 |
Al2(SO4)3 |
0,55 |
1,176 |
Процентную |
|
125 |
HNO3 |
2 |
– |
Нормальную |
|
126 |
HCl |
15,0 |
1,073 |
Нормальную |
|
127 |
H2SO4 |
13,0 |
1,680 |
Процентную |
|
128 |
H3PO4 |
44,0 |
1,285 |
Нормальную |
|
129 |
HClO4 |
9,0 |
1,150 |
Процентную |
|
130 |
H2SO4 |
2 |
– |
Нормальную |
|
131 |
CH3COOH |
34,0 |
1,043 |
Молярную |
|
132 |
BaCl2 |
2,30 |
1,203 |
Процентную |
|
133 |
K2CO3 |
4 |
– |
Нормальную |
|
134 |
CuSO4 |
14,0 |
1,155 |
Нормальную |
|
135 |
FeCl3 |
1,90 |
– |
Нормальную |
|
136 |
K2CO3 |
6,0 |
1,567 |
Процентную |
|
137 |
NaCl |
3 |
– |
Молярную |
|
138 |
NaCl |
20 |
1,148 |
Молярную |
|
139 |
HClO4 |
4,0 |
1,230 |
Процентную |
|
140 |
K2CO3 |
3 |
– |
Нормальную |
Задание: решить
следующие задачи
|
№ задачи |
|
|
141 |
На |
|
142 |
Смешали |
|
143 |
Определить |
|
144 |
Смешали |
|
145 |
Для |
|
146 |
Смешали |
|
147 |
На |
|
148 |
Смешали |
|
149 |
На |
|
150 |
Вычислить |
|
151 |
Определить |
|
152 |
Вычислить |
|
153 |
Определить |
|
154 |
Определить |
|
155 |
Вычислить |
|
156 |
Вычислить |
|
157 |
Определить |
|
158 |
Смешали |
|
159 |
Определить |
|
160 |
Вычислить |
Соседние файлы в папке му по химии
- #
- #
- #
- #
- #
- #
- #
Как вычислить процентную концентрацию раствора
Задания на вычисление процентной концентрации растворов приходится выполнять не только при изучении раздела химии. Умение проводить соответствующие расчеты могут сослужить хорошую службу в повседневной жизни, например, при перерасчете концентрации раствора уксусной кислоты в период консервирования овощей.

Вам понадобится
- – калькулятор.
Инструкция
Любой раствор состоит из растворенного вещества и растворителя. В большинстве случаев растворителем выступает вода. Чтобы вычислить процентную концентрацию (или массовую долю растворенного вещества) необходимо воспользоваться формулой:W = m (растворенного вещества) / m (раствора) х 100 %W – массовая доля растворенного вещества (или процентная концентрация), %Из этой же формулы можно вывести и массу растворенного вещества, если известны масса раствора и процентная концентрация раствора.
Пример № 1. Вычислите массовую долю (в процентах) поваренной соли (NaCl), если масса (NaCl) 5 г, а масса раствора (NaCl) 100 г.В данной задаче остается только подставить в формулу предложенные в условии параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (NaCl) = m (NaCl) / m (раствора NaCl) х 100 %W (NaCl) = 5 г / 100 г х 100 % = 5 %Ответ: W (NaCl) = 5 %
Пример № 2. Вычислите массовую долю (в процентах) бромида калия (KBr), если масса соли (KBr) 10 г, а масса воды 190 г.Прежде чем работать с формулой на вычисление процентной концентрации, рассчитайте массу раствора, который состоит из воды и растворенного вещества:m (раствора) = m (растворенного вещества) + m (воды) Следовательно:m (р-ра KBr) = 10 г + 190 г = 200 гПодставьте в основную формулу найденные и указанные в условии параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (KBr) = m (KBr) / m (раствора KBr) х 100 %W (KBr) = 10 г / 200 г х 100 % = 5 %Ответ: W (KBr) = 5 %
Пример № 3. Вычислите процентную концентрацию уксусной кислоты (СН3СООН), если масса кислоты (СН3СООН) 30 г, а масса воды 170 г.Рассчитайте массу раствора, который состоит из воды и уксусной кислоты:m (раствора) = m (растворенного вещества) + m (воды) Следовательно:m (р-ра СН3СООН) = 30 г + 170 г = 200 гПодставьте в формулу необходимые параметры:W = m (р. в-ва) / m (р-ра) х 100 %W (СН3СООН) = m (СН3СООН) / m (раствора СН3СООН) х 100 %W (СН3СООН) = 30 г / 200 г х 100 % = 15 %Ответ: W (СН3СООН) = 15 %
Источники:
- процентная доля раствора
- Решение задач на понятия “процентное содержание
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Формула концентрации раствора. Их множество. И каждая соответствует тому или иному способу выражения концентрации. А в химии их применяются достаточно: массовая доля растворенного вещества, молярная, нормальная, моляльная, титр и др.
Зачем так много? Ответ на этот вопрос очень прост. Каждый вид концентрации удобен в том или ином случае, когда применение другого вида концентрации неуместно.
Например, при исследовании содержания массы вещества в очень небольшом объеме раствора удобно пользоваться титром. А в каких-то технологиях вообще концентрация заменяется другими количественными характеристиками раствора. Так, в технологии посола рыбы для расчета необходимой концентрации тузлука (раствора поваренной соли) используют не его процентную концентрацию, а плотность.
Содержание:
1. Концентрация – что это такое
2. Формула концентрации раствора: основные виды
3. Массовая доля растворенного вещества и примеры ее вычисления
- разбавление раствора водой
- концентрирование раствора путем упаривания
- концентрирование раствора путем добавления растворенного вещества
- смешивание двух растворов
- применение кристаллогидратов для приготовления раствора (задачи на кристаллогидраты)
4. Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Концентрация – что это такое
Любой раствор имеет различные характеристики: качественные и количественные. Одной из важнейших количественных характеристик является концентрация раствора.
Концентрация раствора – это количество растворенного вещества, содержащееся в определенном количестве раствора.
Как видно из приведенного определения, основными компонентами раствора являются:
— растворитель;
— растворенное вещество.
Растворенного вещества в растворе всегда меньше, а растворителя больше.
И вот именно с вычислением количественного содержания растворенного вещества чаще всего и связаны все расчеты, основанные на применении формулы концентрации раствора.
Существует несколько видов концентрации раствора:
— массовая доля растворенного вещества;
— объемная доля растворенного вещества;
— молярная доля растворенного вещества;
— молярная (или молярность);
— моляльная (или моляльность);
— нормальная (или эквивалентная);
— титр.
Формула концентрации раствора: основные виды
Применение того или иного вида концентрации уместно в каждом конкретном случае. Не существует какой-то универсальной концентрации или универсальной формулы концентрации раствора.
Кстати, с помощью математических преобразований можно перейти от одной концентрации к другой или найти взаимосвязь между разными их видами.
Основные расчетные формулы концентрации раствора приведены в таблице:
Массовая доля растворенного вещества и примеры ее вычисления
Массовая доля растворенного вещества – это отношение массы растворенного вещества к массе раствора.
Ее расчетная формула выглядит так:
где ωр.в-ва – массовая доля растворенного вещества, mр.в-ва – масса растворенного вещества, mр-ра – масса раствора.
ωр.в-ва представляет собой долю или от единицы или от 100%. Так, например, имеется двухпроцентный раствор NaCl. Его концентрация будет записана в первом случае ω(NaCl) = 0,02, а во втором – ω(NaCl) = 2%. Форма записи основной сути не меняет. Можно записывать и так, и так.
Что же означает выражение ω(NaCl) = 0,02 или ω(NaCl) = 2%? Буквально следующее: в 100 г водного раствора поваренной соли содержится 2 г этой соли и 98 г воды.
Необходимо помнить, что раствор состоит из растворителя и растворенного вещества. Поэтому масса раствора будет состоять из массы растворителя и массы растворенного вещества:
Тогда основную расчетную формулу для массовой доли растворенного вещества можно преобразовать:
Очень часто в расчетах с процентной концентрацией используются плотность и объем раствора:
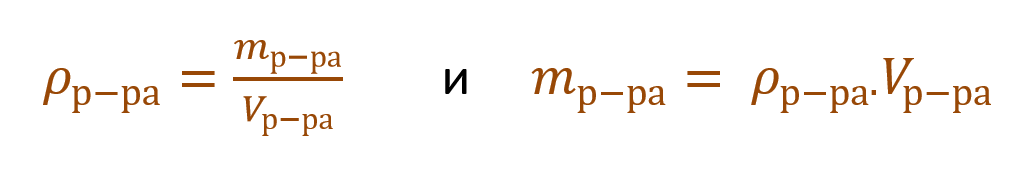
В других ситуациях могут использоваться объем и плотность не раствора, а растворителя. Тогда основная формула для расчета концентрации будет выглядеть так:
На практике бывает необходимо не только приготовить раствор с какой-либо определенной концентрацией, но и увеличить, либо уменьшить ее значение. Это достигается различными приемами:
— упариванием раствора;
— добавлением растворенного вещества;
— добавлением к раствору растворителя (например, воды).
Кроме того, приходится часто смешивать друг с другом растворы разных концентраций.
Разберем все возможные случаи.
Мы рекомендуем задачи, в которых речь идет о растворах, решать с использованием схематических рисунков. Это очень наглядно, особенно, когда речь идет о смешивании растворов.
Начнем с самого простого: вычислим концентрацию раствора.
Пример 1. В 200 г воды растворили 40 г глюкозы. Вычислите массовую долю глюкозы в полученном растворе.
Обратите внимание, что речи о каком-либо химическом взаимодействии не идет! Поэтому записывать уравнения реакций не требуется!
Запишем общую формулу для расчета массовой доли растворенного вещества:
В данной задаче глюкоза (C6H12O6) – растворенное вещество, а вода (H2O) – растворитель. Масса раствора будет складываться из массы глюкозы и массы воды:
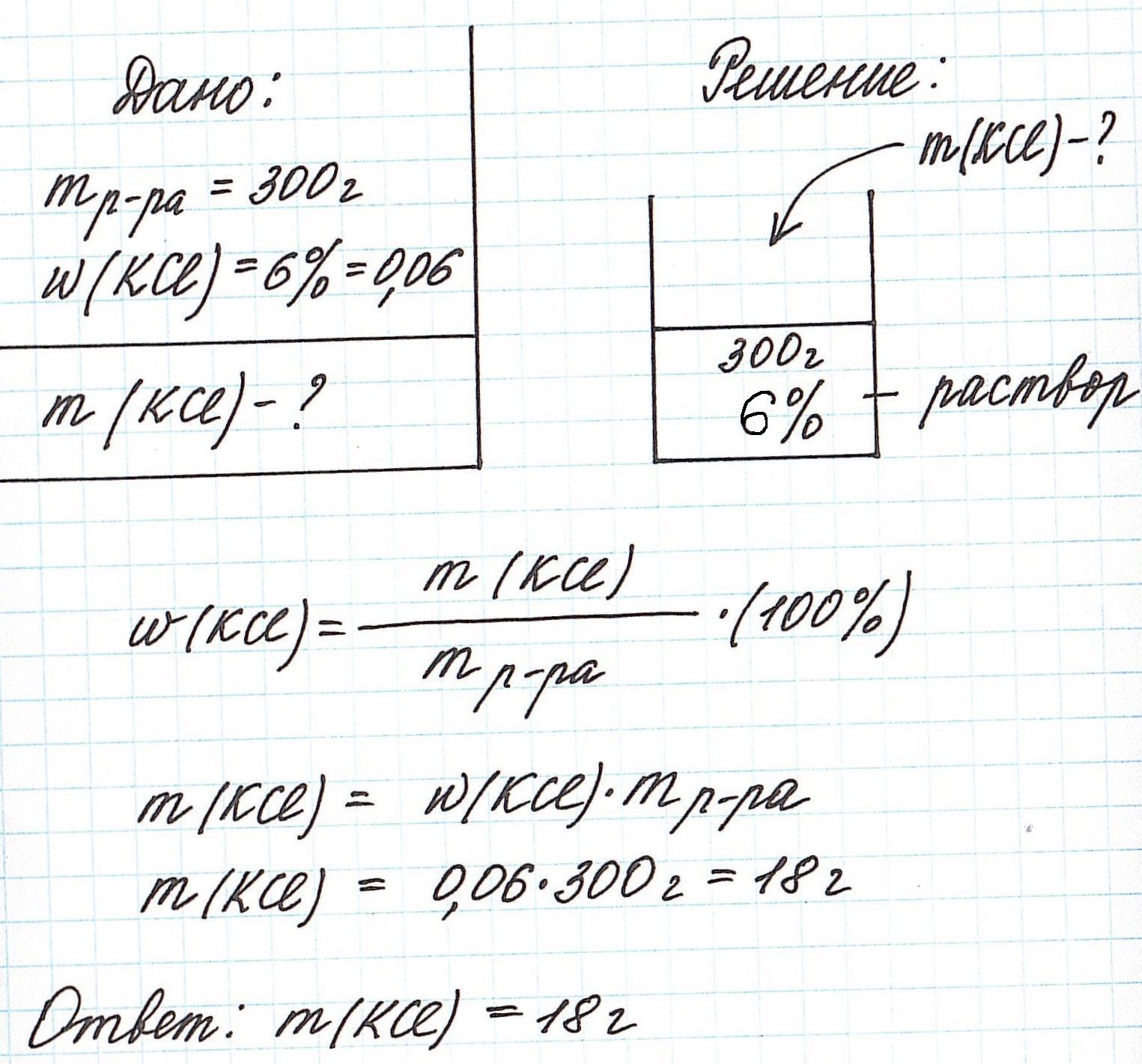
Пример 2. Рассчитайте, сколько потребуется хлорида калия, чтобы приготовить 300 г раствора с массовой долей соли 6%.
Обратите внимание, для того, чтобы расчеты были менее громоздкими, будем использовать выражение концентрации не в %, а в долях от единицы.
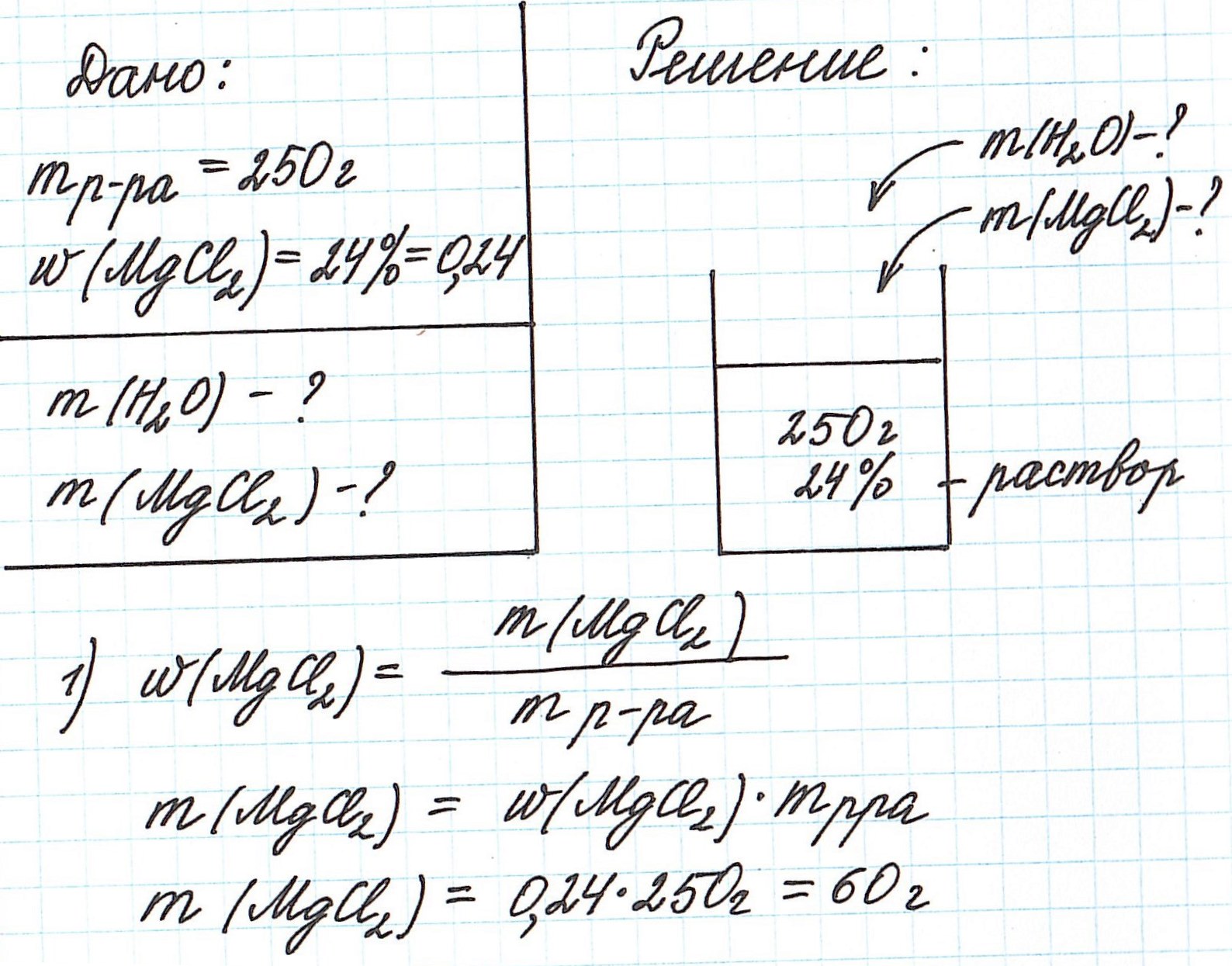
Пример 3. Необходимо приготовить 250 г раствора с массовой долей хлорида магния 24%. Рассчитайте массу требуемых воды и соли.
Так как раствор готовится из хлорида магния и воды, то и масса раствора равна сумме масс хлорида магния и воды:
Рассмотрим задачу, в которой в качестве растворителя выступает не вода, а другое вещество.
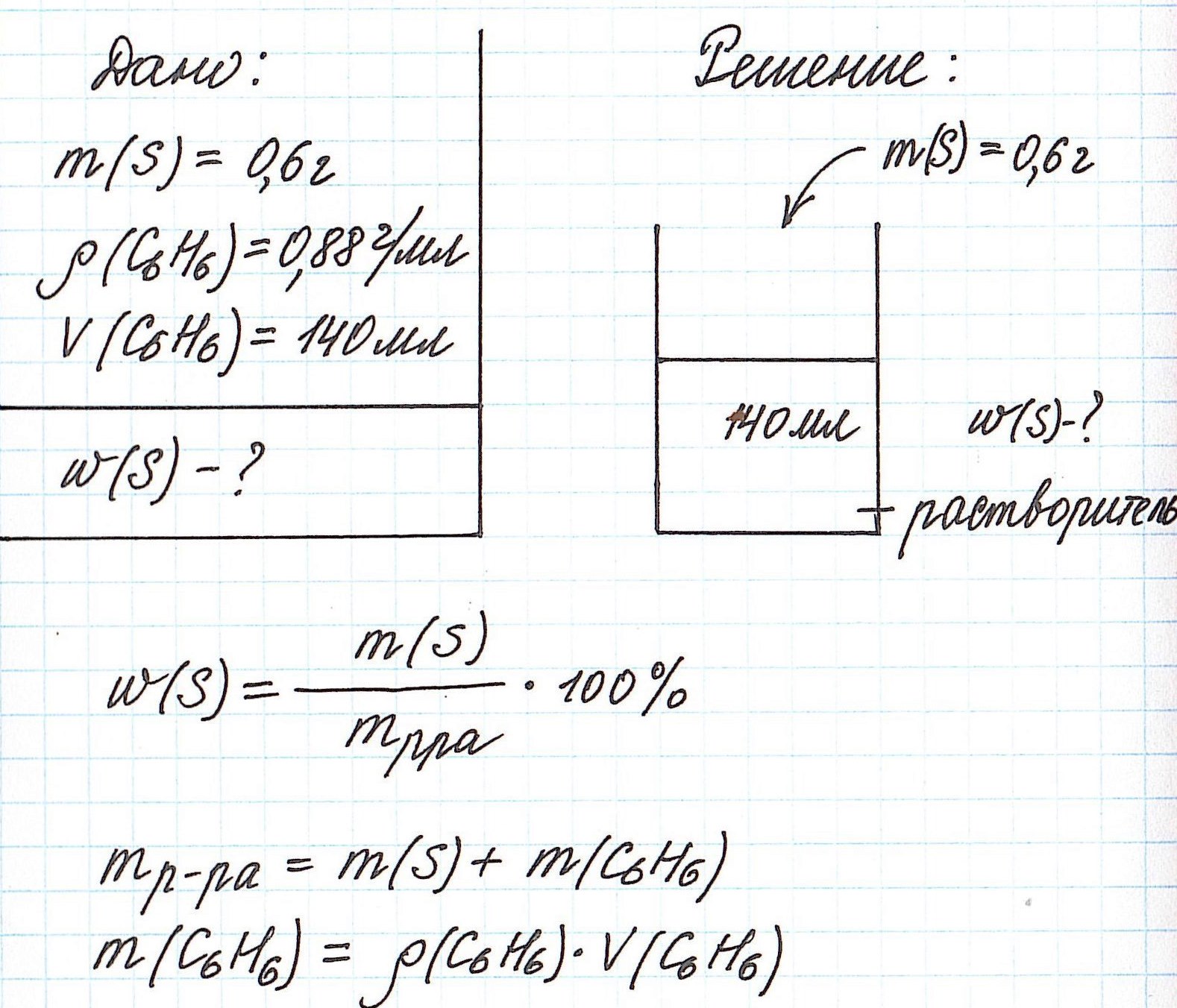
Пример 4. В органическом растворителе бензоле объемом 140 мл растворили серу массой 0,6 г. Вычислите массовую долю серы в полученном растворе, если плотность бензола составляет 0,88 г/мл.
Обратите внимание, что здесь:
— масса раствора не известна;
— масса растворителя (бензола) не известна;
— известны объем и плотность растворителя (бензола), что позволяет нам найти его массу;
— масса раствора состоит из массы растворителя (бензол) и массы растворенного вещества (сера).
Объединим все расчетные формулы в одну и подставим в нее имеющиеся численные значения:
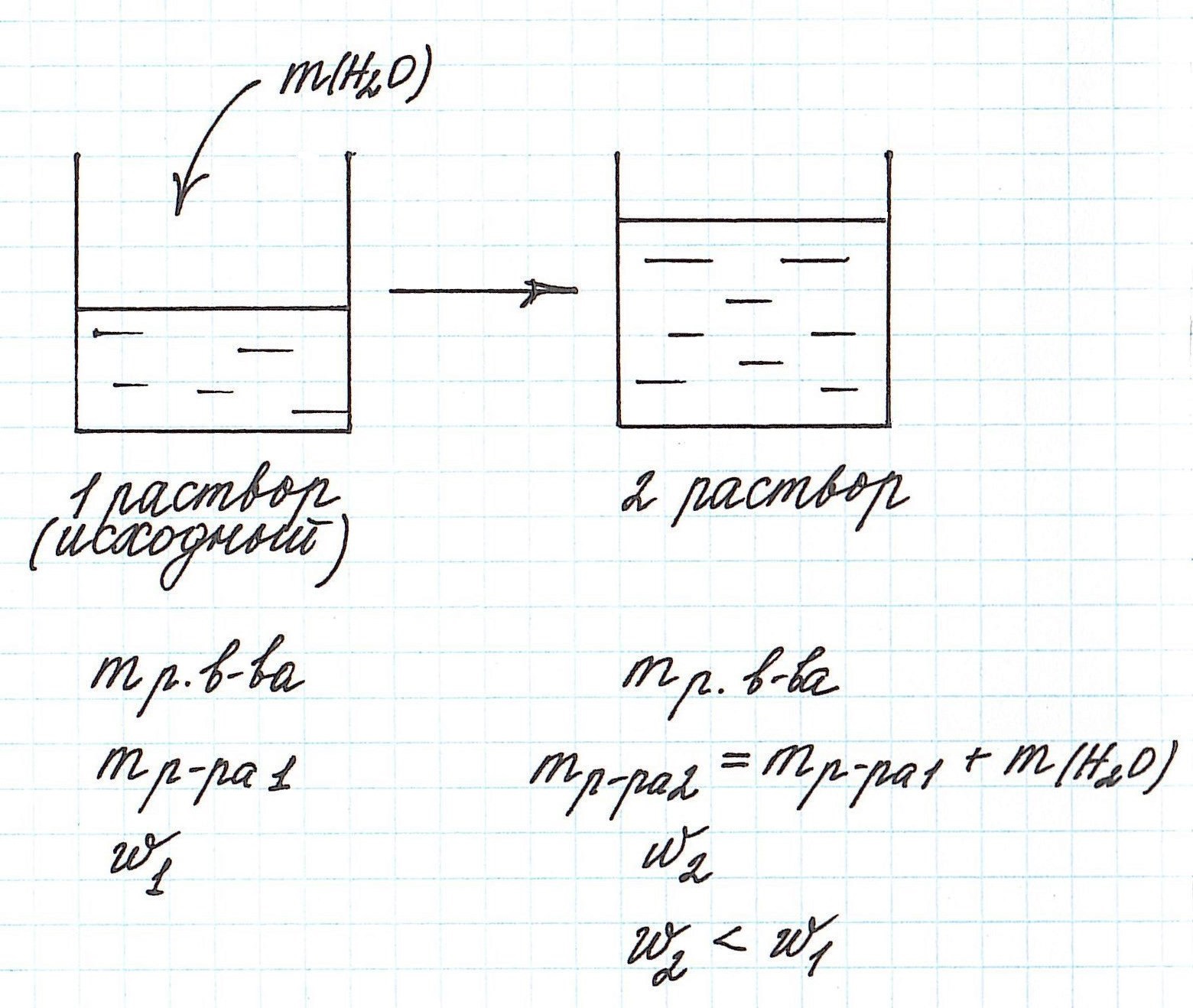
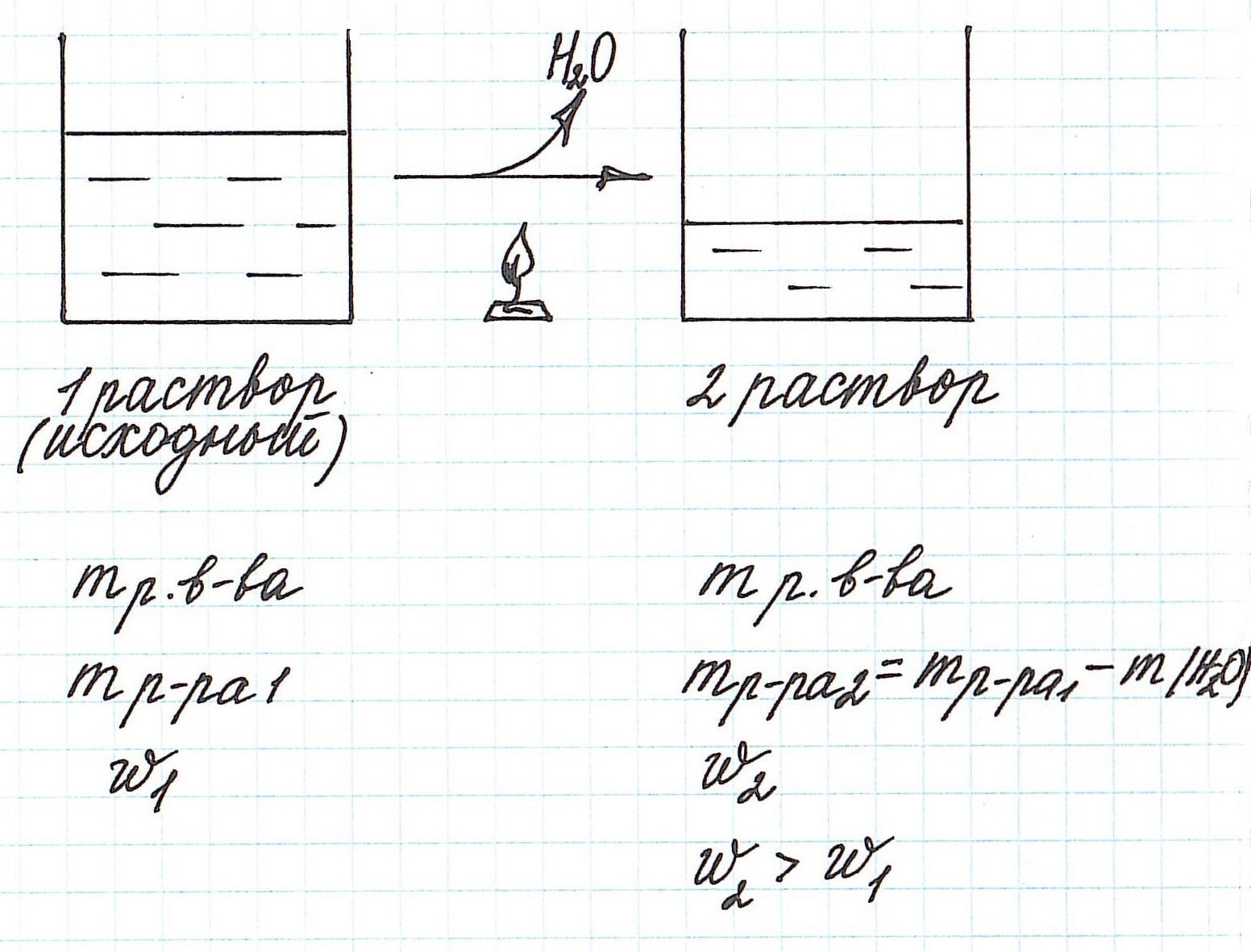
Вычисление массовой доли растворенного вещества при разбавлении раствора водой
Разбавление раствора водой приводит к уменьшению его концентрации.
Запомним, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворителя;
— масса растворенного вещества остается постоянной.
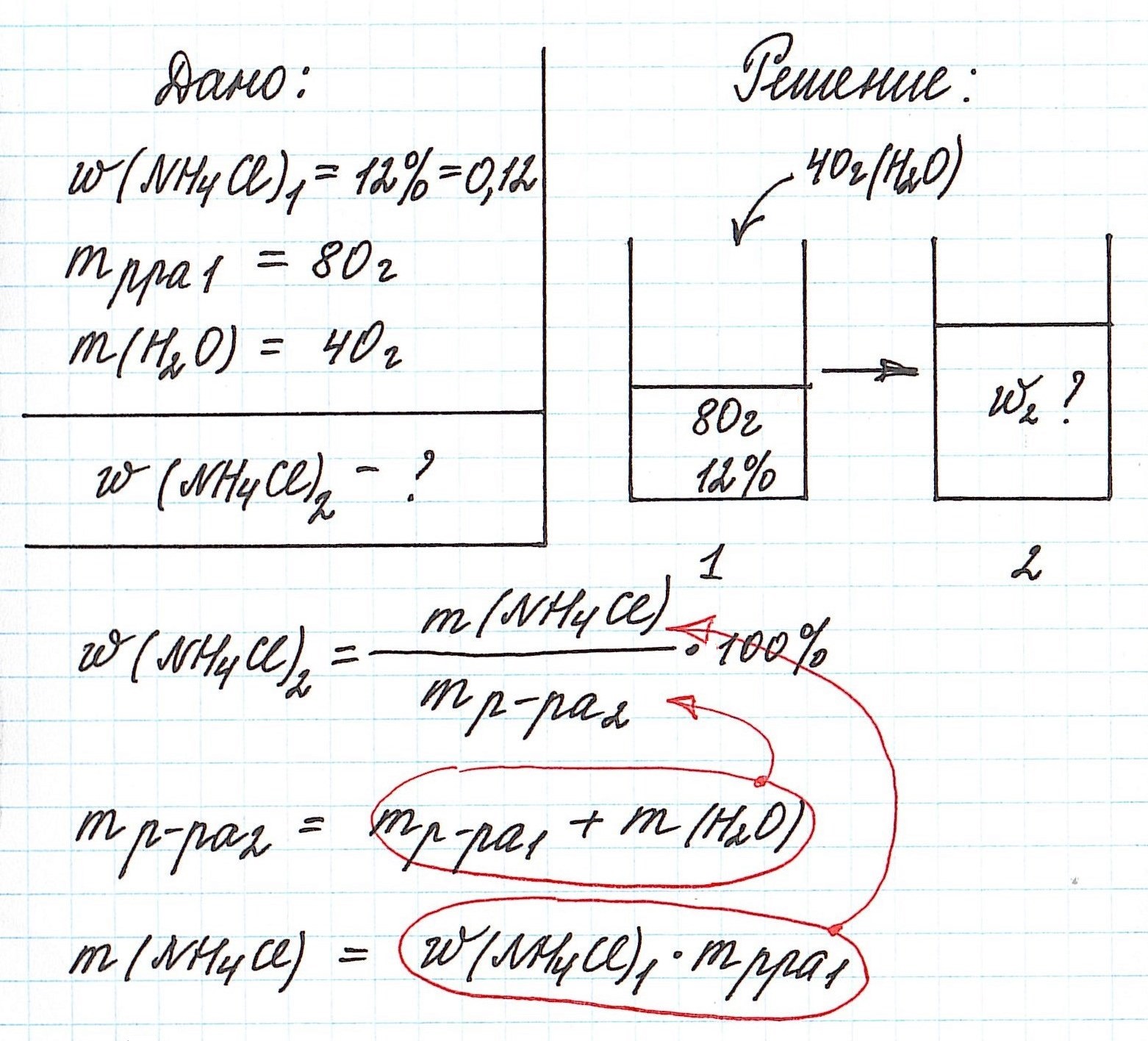
Пример 5. К 80 г раствора с массовой долей NH4Cl 12% добавили 40 г воды. Вычислите массовую долю хлорида аммония в полученном растворе.
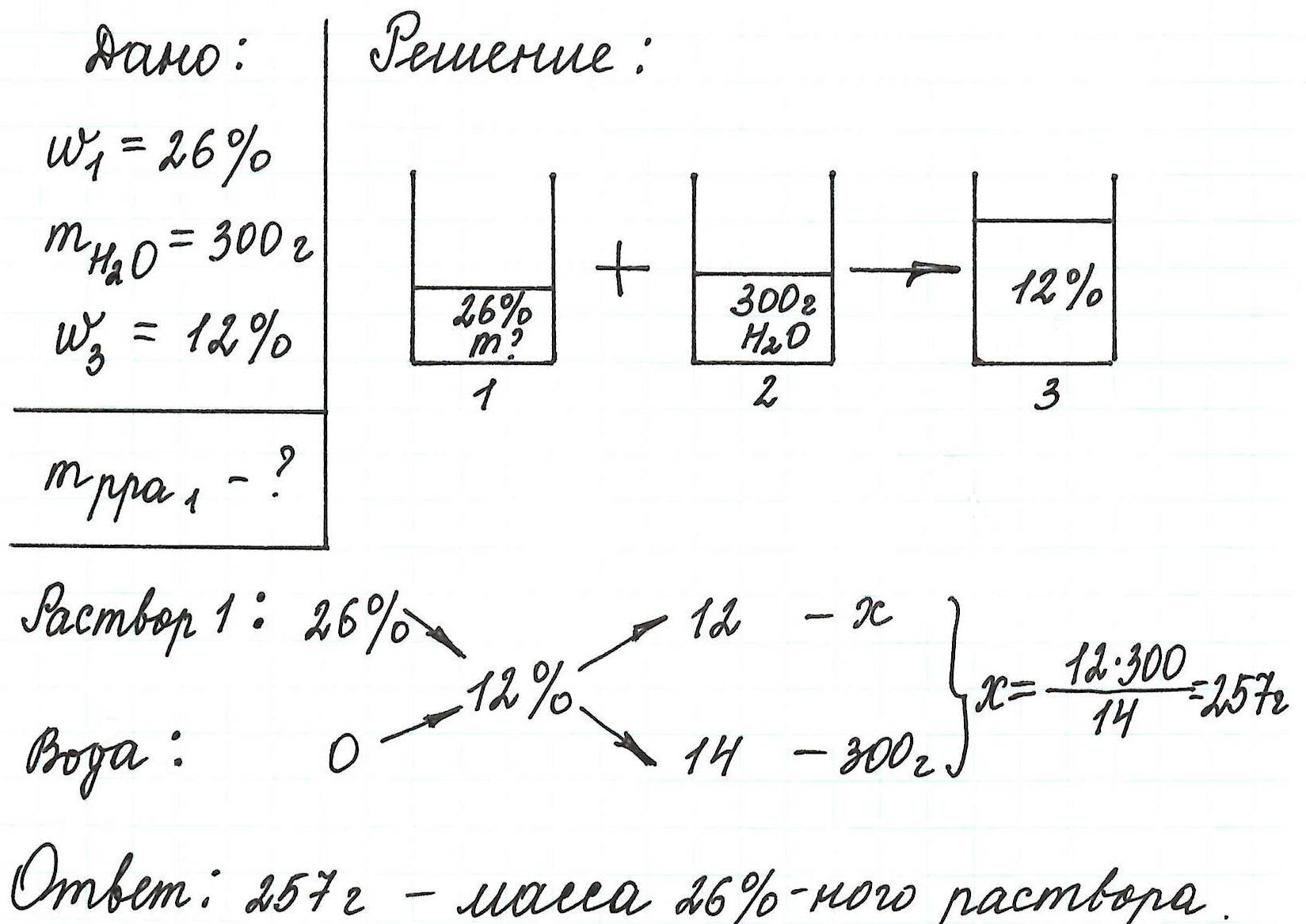
Объединим все полученные формулы в одну и подставим имеющиеся данные:
Пример 6. Рассчитайте объем раствора фосфорной кислоты (массовая доля кислоты 12%, плотность 1,065 г/мл), который потребуется для приготовления раствора с массовой долей H3РO4 4% объемом 250 мл (плотность 1,02 г/мл).
В данной задаче речь напрямую о разбавлении раствора не идет. Но судя по тому, что исходный раствор имел концентрацию 12%, а конечный – 4%, становится ясно: последний раствор можно получить путем разбавления первого водой.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем упаривания
Упаривание раствора, т.е. его нагревание, при котором происходит испарение воды, приводит к увеличению концентрации.
Учтите, что при этом:
— уменьшается масса раствора;
— уменьшается масса растворителя;
— масса растворенного вещества остается постоянной (при условии, что растворенное вещество не разлагается при данной температуре).
Пример 7. Из 200 г 27%-ного раствора глюкозы выпарили 20 г воды. Определите массовую долю глюкозы в полученном растворе.
Вычисление массовой доли растворенного вещества при концентрировании раствора путем добавления растворенного вещества
Добавление к уже существующему раствору новой порции растворенного вещества приводит к увеличению концентрации раствора.
Помните, что в таких случаях:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества.
Пример 8. Определите массу хлорида калия, который надо добавить к 180 г 15%-ного раствора этой соли, чтобы получить 20%-ный раствор.
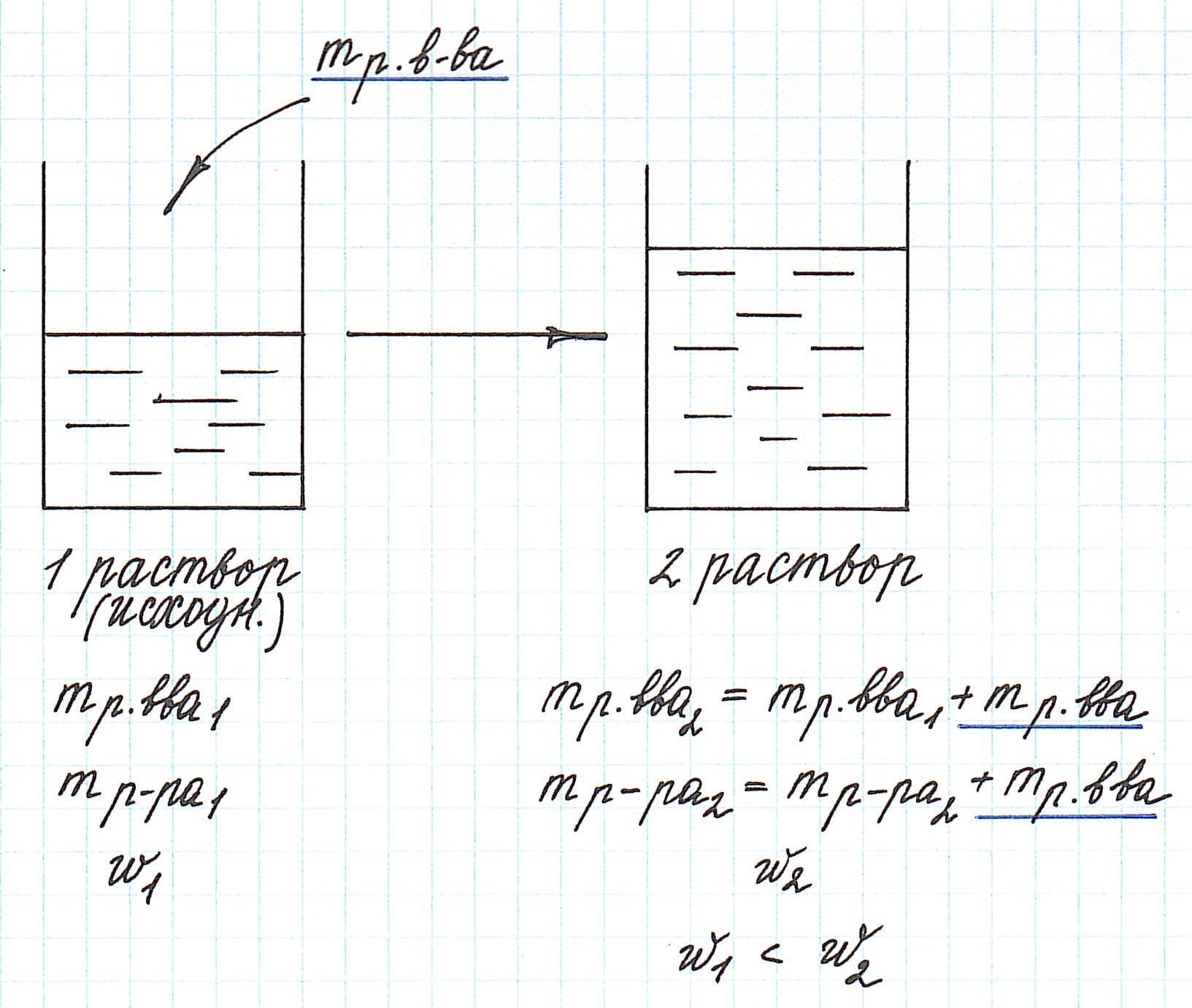
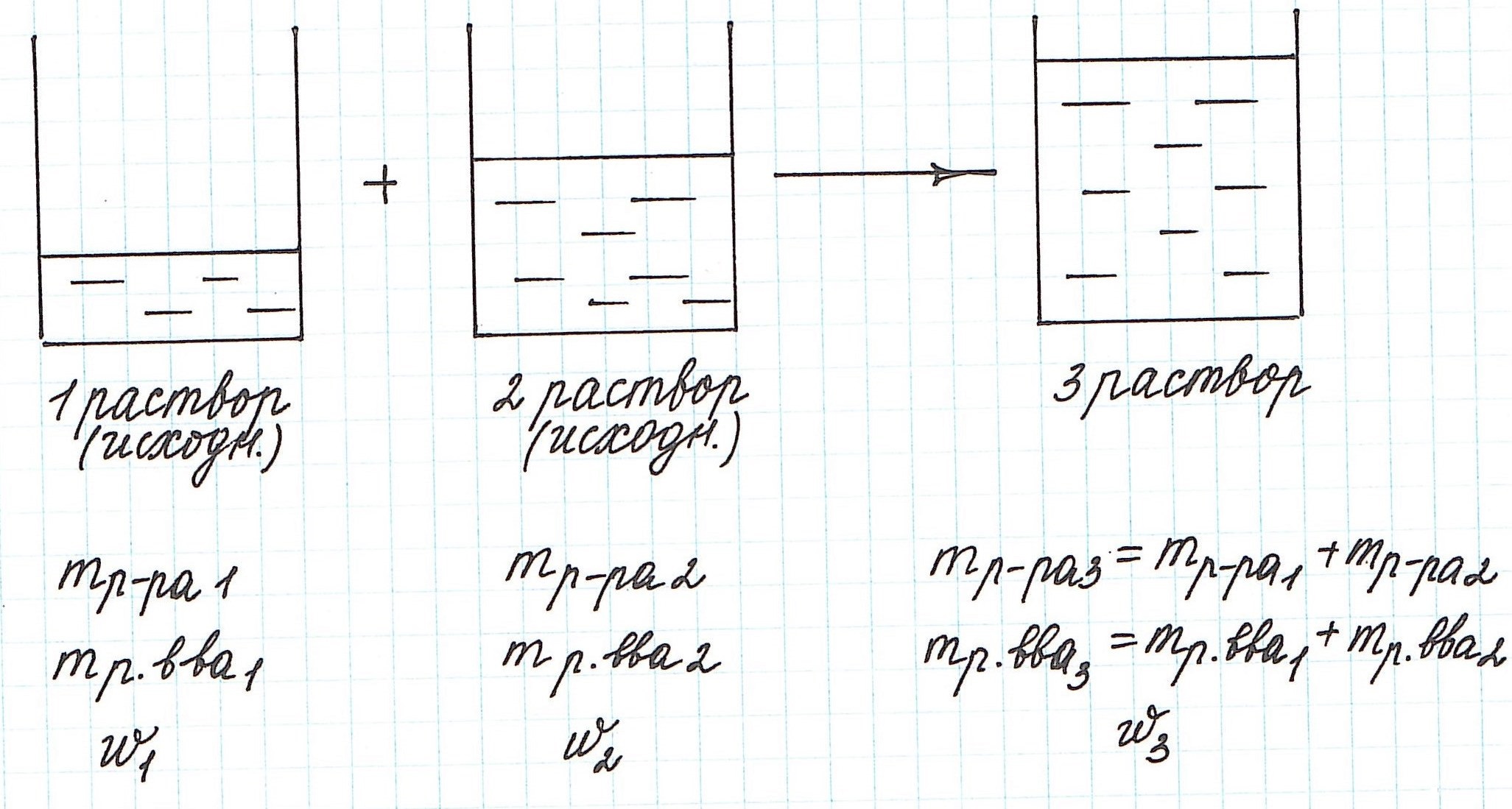
Вычисление массовой доли растворенного вещества при смешивании двух растворов
При смешивании двух растворов (речь о растворах одного и того же вещества конечно же) изменяются все количественные характеристики:
— увеличивается масса раствора;
— увеличивается масса растворенного вещества;
— изменяется массовая доля растворенного вещества.
Пример 9. Смешали 80 г 32%-ного раствора и 30 г 10%-ного раствора нитрата меди (II). Какова концентрация соли в полученном растворе?
Вычисление массовой доли растворенного вещества с применением кристаллогидратов для приготовления раствора
Кристаллогидраты используются для приготовления растворов довольно часто. Кристаллогидраты представляют собой вещества, в состав которых помимо основного вещества входят молекулы воды. Например:
CuSO4·5H2O – кристаллогидрат сульфата меди (II) (или медный купорос);
Na2SO4·10H2O – кристаллогидрат сульфата натрия (или глауберова соль).
Больше примеров здесь.
Вода, входящая в состав кристаллогидрата, называется кристаллизационной.
Кристаллогидраты различаются прочностью связи между основным веществом и кристаллизационной водой. Одни из них теряют воду при комнатной температуре с течением времени и перестают быть кристаллогидратами (например, Na2СO3·10H2O). Другие – обезвоживаются только при сильном нагревании (например, CuSO4·5H2O).
При расчете концентрации с использованием кристаллогидратов для получения растворов часто приходится учитывать и кристаллизационную воду.
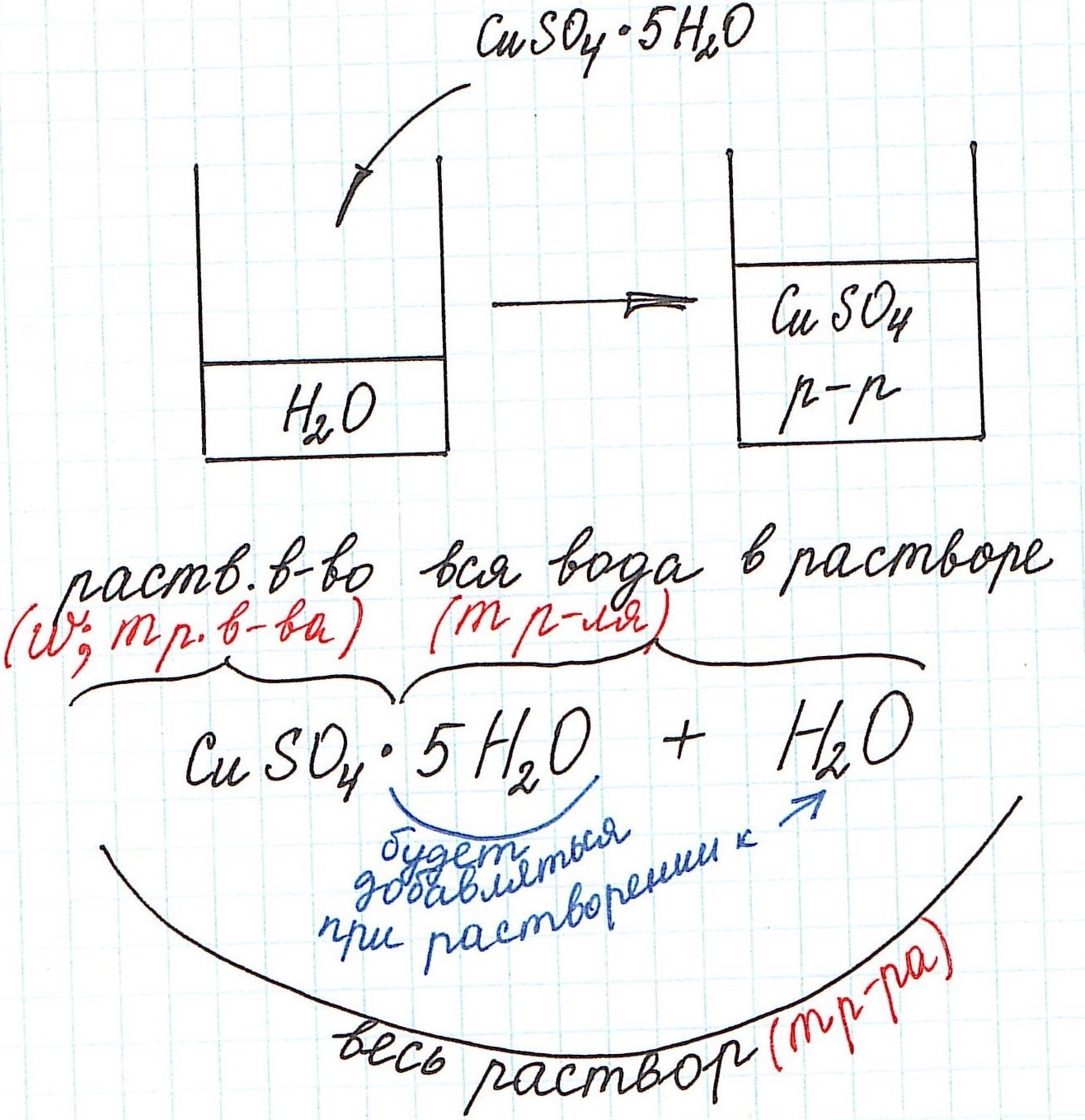
Но сначала поясним некоторые нюансы на конкретном примере:
1) Формула CuSO4·5H2O означает, что 1 моль CuSO4·5H2O содержит 1 моль CuSO4 и 5 моль H2O. Это можно было бы записать так:
n(CuSO4) = n(CuSO4·5H2O); n(H2O) = 5n(CuSO4·5H2O)
2) Относительная молекулярная (и численно молярная) масса будет складываться из относительной молекулярной массы вещества и относительной молекулярной массы воды. Например:
Mr(CuSO4·5H2O) = Mr(CuSO4) + 5·Mr(H2O) = 160 + 5·18 = 250 и, соответственно,
M(CuSO4·5H2O) = M(CuSO4) + 5·M(H2O) = 160 + 5·18 = 250 г/моль.
3) Еще одну особенность поясним с помощью рисунка:
Итак, разберем несколько типичных задач.
Пример 10. В 60 г воды растворили глауберову соль Na2SO4·10H2O массой 5,6 г. Какова массовая доля сульфата натрия в полученном растворе?
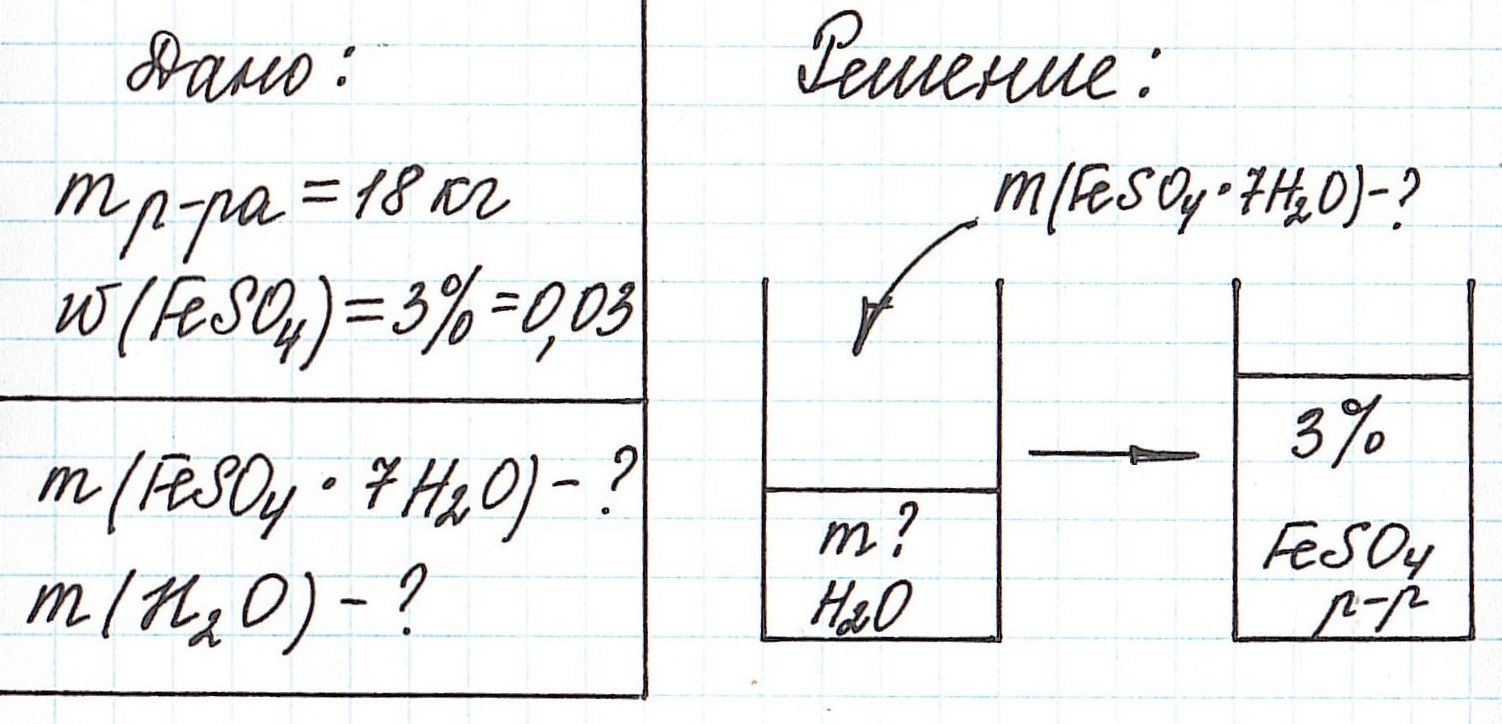
Пример 11. Какая масса железного купороса FeSO4·7H2O и воды потребуется для приготовления 18 кг раствора сульфата железа (II) с массовой долей FeSO4 3%?
Обратите внимание, что масса раствора дана не в граммах (г), а в килограммах (кг). Для того, чтобы привести в ходе расчетов все единицы измерения к единой системе, можно перевести килограммы в граммы и вычислять как обычно.
Но есть более простой способ. Можно считать количество вещества не в моль, а в киломоль (кмоль). Молярную массу вычислять не в г/моль, а в кг/кмоль. В этом случае ответ в задаче мы сразу получим в килограммах.
Пример 12. Вычислите массу кристаллогидрата сульфата никеля NiSO4·7H2O, который надо добавить к 180 г раствора с массовой долей сульфата никеля 1,5%, чтобы получить раствор с массовой долей соли 6%?
Правило «креста» в химии растворов как метод решения задач на процентную концентрацию растворов
Правилом «креста» (или «квадратом Пирсона») очень удобно пользоваться в расчетах, связанных с разбавлением или смешиванием растворов.
Общая схема вычислений выглядит так:
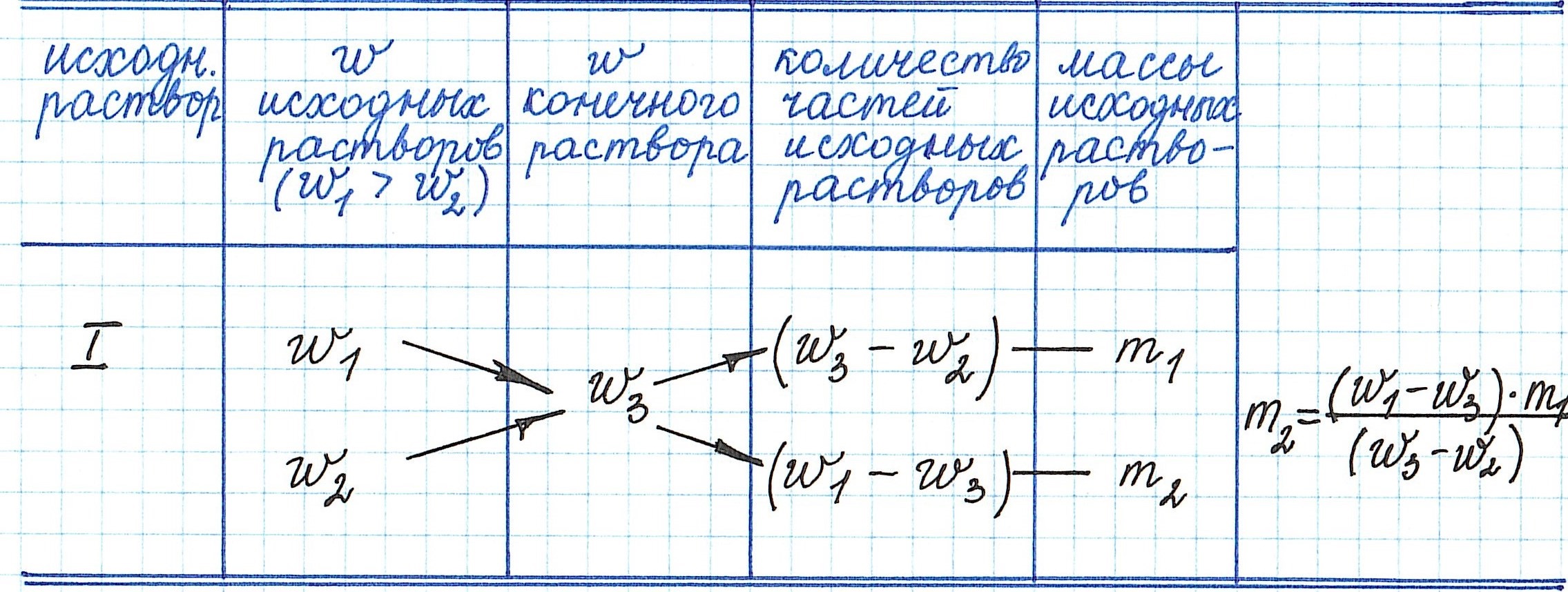
Пример 13. Какую массу 5%-ного раствора глюкозы надо добавить к 70 г 21%-ного раствора этого же вещества, чтобы получить 12%-ный раствор?
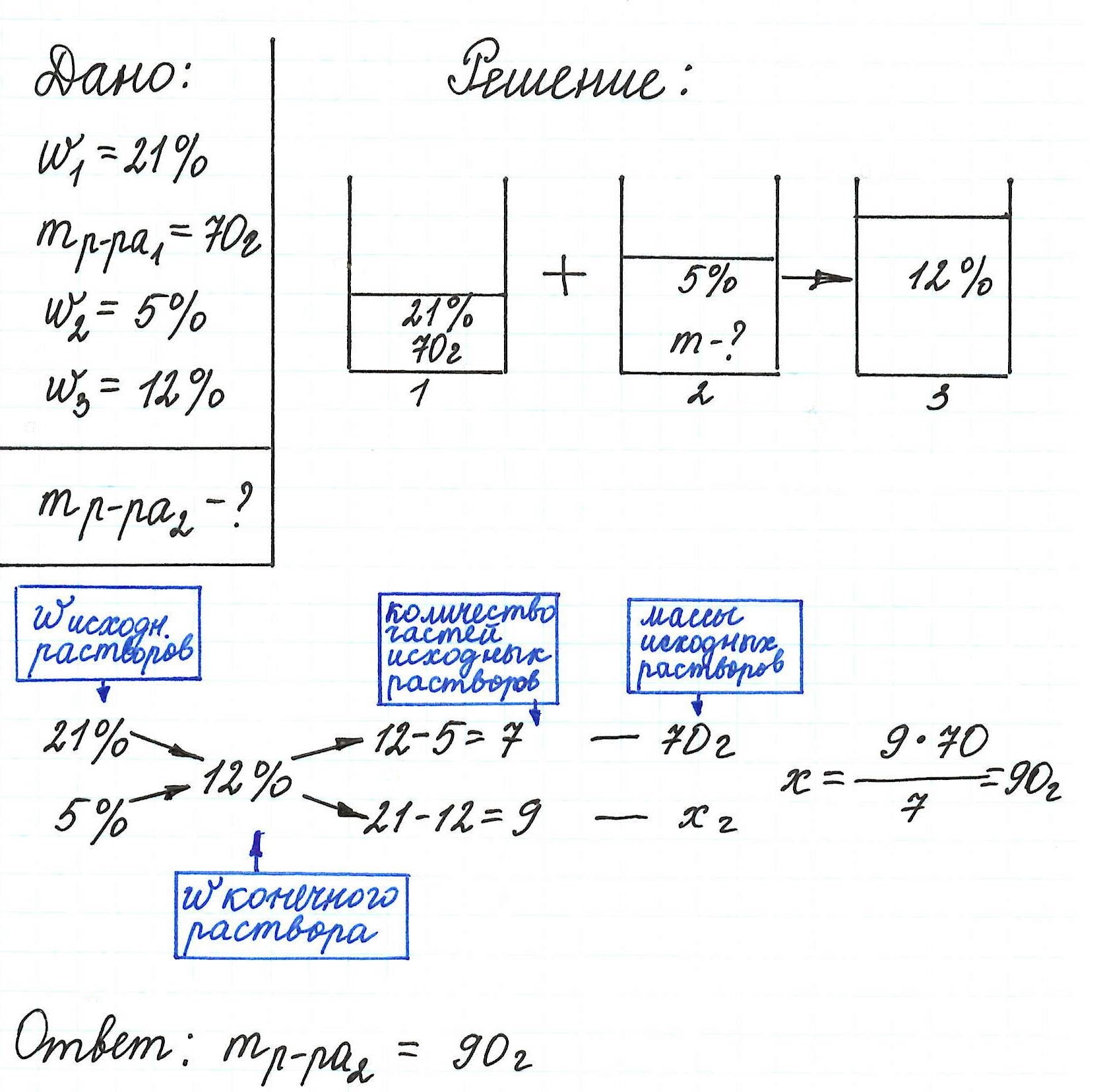
Еще примеры с применением правила «креста» можно посмотреть здесь.
Мы рассмотрели достаточно примеров расчетов, где используется формула такой концентрации раствора как массовая доля растворенного вещества. Как видим, ситуаций, в которых требуется ее применение, множество. Однако, есть достаточно случаев, когда более приемлемыми являются формулы других концентраций (молярной, нормальной, титра и т.д.). Об этом читайте в других статьях.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
или на Одноклассниках
Пожалуйста, оцените публикацию. Большая просьба, если вы оцениваете публикацию от 1 до 3 звезд, обязательно оставьте свой комментарий с указанием того, что не так с этой публикацией. Мы постараемся устранить недостатки.
Ваше мнение для нас важно!
Загрузить PDF
Загрузить PDF
В химии концентрация раствора показывает, как много растворенного вещества содержится в растворителе. Согласно стандартной формуле C = m/V, где C — концентрация, m — масса растворенного вещества и V — общий объем раствора. При малых концентрациях удобнее вычислять концентрацию в миллионных долях (ppm). Во время лабораторной работы вас могут попросить также вычислить молярность, или молярную концентрацию раствора.
-
1
Найдите массу растворенного вещества. Это вещество добавляют в растворитель, чтобы получить раствор. Если в условии дана масса растворенного вещества, запишите ее и укажите соответствующие единицы измерения. Если эту массу необходимо найти, взвесьте то вещество, которое вы собираетесь растворить, на лабораторных весах и запишите результат измерений.[1]
- Если растворенное вещество имеет жидкую форму, можно вычислить массу с помощью формулы для плотности D = m/V, где m — масса жидкости и V — ее объем. Чтобы найти массу, умножьте плотность жидкости на объем.
Совет: если необходимо использовать весы, вычтите из общей массы массу емкости, в которой находится взвешиваемая жидкость, чтобы получить правильный результат.
-
2
Запишите общий объем раствора. Этот объем равен сумме объема растворителя и растворенного вещества. Если необходимо измерить объем в лаборатории, приготовьте раствор в мерной пробирке или мензурке и определите объем. Чтобы получить более точный результат, определите объем по верхнему краю поверхности раствора (мениска). Запишите найденную величину.[2]
- Если вы не измеряете объем раствора самостоятельно, возможно, потребуется вычислить его по массе и плотности.
- Например, если следует найти концентрацию 3,45 грамма соли, растворенной в 2 литрах воды, можно определить объем по формуле для плотности. Найдите плотность соли в справочнике или интернете и решите уравнение относительно массы m. В данном случае плотность соли составляет 2,16 г/мл (грамма на миллилитр). Получаем 2,16 г/мл = (3,45 г)/V. Умножим обе части равенства на V и получим V(2,16 г/мл) = 3,45 г. После этого поделим каждую часть на 2,16 и найдем объем: V = (3,45 г)/(2,16 г/мл) = 1,60 мл.
- Прибавьте к объему растворенного вещества объем растворителя. В нашем примере имеем 2 л + 1,6 мл = 2000 мл + 1,6 мл = 2001,6 мл. Можно оставить найденный объем в миллилитрах или перевести его в литры: 2,002 л.
-
3
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора. Не забудьте записать в ответе правильные единицы измерения.[3]
- В нашем примере для концентрации 3,45 грамма соли в 2 литрах воды имеем C = (3,45 г)/(2,002 л) = 1,723 г/л.
- В некоторых задачах требуется найти концентрацию в определенных величинах. Не забудьте перевести значения в соответствующие единицы измерения, прежде чем подставлять их в конечную формулу.
Реклама
-
1
Найдите массу растворенного вещества в граммах. Измерьте массу того вещества, которое вы собираетесь добавить в раствор. Не забудьте вычесть массу емкости, если вы используете ее при взвешивании, чтобы получить правильный результат.[4]
- Если растворяемое вещество находится в жидкой форме, можно вычислить его массу с помощью формулы D = m/V, где D — плотность жидкости, m — ее масса и V — объем. Найдите плотность жидкости в справочнике или интернете и решите уравнение относительно массы.
-
2
Определите общую массу раствора в граммах. Общая масса равна сумме масс растворенного вещества и растворителя. Измерьте эти массы с помощью лабораторных весов или переведите объем растворителя в массу с помощью формулы для плотности D = m/V. Сложите массы растворенного вещества и растворителя, чтобы найти общую массу.[5]
- Например, если вы хотите найти концентрацию 10 граммов порошка какао в 1,2 литра воды, определите массу воды по формуле для плотности. Плотность воды составляет 1000 г/л, поэтому получаем 1000 г/л = m/(1,2 л). Умножим обе стороны равенства на 1,2 литра и найдем массу в граммах: m = 1,2 л×1000 г/л = 1200 г. Прибавим массу порошка какао и получим 1210 г.
-
3
Поделите массу растворенного вещества на общую массу раствора. Определим концентрацию как C = масса растворенного вещества/общая масса раствора. Подставьте в это уравнение значения, чтобы найти концентрацию раствора.[6]
- В нашем примере C = (10 г)/(1210 г) = 0,00826.
-
4
Умножьте ответ на 100, если хотите найти концентрацию в процентах. Если требуется определить концентрацию в процентах, умножьте найденный ответ на 100. Запишите полученный результат со знаком процентов.[7]
- В нашем примере концентрация в процентах составляет 0,00826×100 = 0,826 %.
-
5
Умножьте концентрацию на 1000000, чтобы найти миллионные доли. Возьмите найденное значение концентрации и умножьте его на 1000000, или 106. В результате вы найдете, сколько миллионных долей растворенного вещества содержится в растворе. Укажите в ответе единицы измерения в ppm.[8]
- В нашем примере количество миллионных долей ppm = 0,00826×1000000 = 8260 ppm.
Совет: миллионные доли обычно используют для очень малых концентраций, когда легче записать и понять ответ в них, а не в процентах.
Реклама
-
1
Сложите атомные массы растворенного вещества, чтобы найти молярную массу. Посмотрите, из каких химических элементов состоит данное растворенное вещество. Выпишите атомную массу каждого элемента, поскольку атомная и молярная массы равны. Сложите все атомные массы элементов растворенного вещества, чтобы найти общую молярную массу. Укажите в полученном результате, что это г/моль (количество граммов на моль).[9]
- Например, если в качестве растворенного вещества дан гидроксид калия, найдите атомные массы калия, кислорода и водорода и сложите их. В результате получится молярная масса = 39 +16 + 1 = 56 г/моль.
- Молярность используется в химии в основном тогда, когда известен химический состав растворенного вещества.
-
2
Поделите массу растворенного вещества на его молярную массу, чтобы определить количество молей. При необходимости измерьте массу растворенного вещества с помощью лабораторных весов. Не забудьте вычесть массу емкости, чтобы получить правильный результат. Поделите найденную массу на молярную массу, в результате вы узнаете количество молей. Укажите возле ответа «моль».[10]
- К примеру, если вы хотите найти, сколько молей содержится в 25 граммах гидроксида калия (KOH), уравнение будет выглядеть следующим образом: число молей = (25 г)/(56 г/моль) = 0,45 моль.
- Переведите массу растворенного вещества в граммы, если она указана в других единицах измерения.
- Моли показывают количество молекул в растворе.
-
3
Переведите объем раствора в литры. Определите объем растворителя, прежде чем приготовить раствор. Если объем не дан в условии задачи, используйте мерную пробирку или мензурку. Если вы получите результат в миллилитрах, поделите его на 1000, чтобы перевести в литры.[11]
- В рассматриваемом примере если вы используете 400 миллилитров воды, поделите эту величину на 1000, и у вас получится 0,4 литра.
- Если объем растворителя уже указан в литрах, данный шаг можно пропустить.
Совет: обычно нет необходимости учитывать объем растворенного вещества, так как он, как правило, не сильно влияет на общий объем. Однако если объем заметно изменится после того, как вы добавите растворимое вещество, используйте общий объем раствора.
-
4
Поделите количество молей растворенного вещества на объем раствора в литрах. Запишите молярность следующим образом: M = mol/V, где mol — количество молей растворенного вещества и V — объем растворителя. Найдите ответ и поставьте возле него букву «M».[12]
- В нашем примере M = (0,45 моль)/(0,4 л) = 1,125 M.
Реклама
Советы
- Если вы находитесь в лаборатории и не знаете, сколько растворенного вещества было добавлено, можно титровать раствор другими реактивами. При этом необходимо знать, как записывать химические уравнения в стехиометрическом виде.
Реклама
Об этой статье
Эту страницу просматривали 226 882 раза.
Была ли эта статья полезной?
Как рассчитать процентную концентрацию раствора?
Процентный состав по массе (%) Это масса растворенного вещества, деленная на массу раствора (масса растворенного вещества плюс масса растворителя), умноженная на 100.
Как рассчитать концентрацию вещества?
Поделите массу растворенного вещества на общий объем раствора. Запишите уравнение C = m/V, где m — масса растворенного вещества и V — общий объем раствора. Подставьте величины массы и объема и выполните деление, чтобы определить концентрацию раствора.
Как сделать 5% раствор?
Чтобы приготовить 5% раствор нужно 5 г марганцовки и 100 мл воды. Первым делом наливаем воду в приготовленную ёмкость, следом добавляем кристаллы. Затем все это перемешать до равномерного и насыщенного фиолетового окраса жидкости.
Как определить процентное содержание вещества в растворе?
Если известно процентное содержание вещества, то его концентрация находится по формуле: К=р/100% к – концентрация вещества; р – процентное содержание вещества (в процентах).
Как определить скольки процентный раствор?
Процентная концентрация (С%) вещества в растворе численно равна массовой доле растворенного вещества, выраженной в процентах. Определяется по формуле: С% вещества = (m вещества/ m раствора.) * 100%. Величина процентной концентрации показывает, сколько грамм вещества содержится в 100 г раствора.
Как определить концентрацию солевого раствора?
Солевой раствор. Солевой раствор –это количество соли в 100 г раствора или количество граммов соли на 100 г воды, но при этом концентрация будет разная. Например: если в 100 г солевого раствора содержится 25 г соли и 75 г воды, то концентрация соли равна 25 * 100 / 100 = 25 %;
Как сделать 10% раствор соли?
10–процентный раствор — это девять частей воды и одна часть соли. Например, на 10 граммов соли вам понадобится 90 граммов воды. Воду лучше брать чуть теплую, чтобы соль быстрее растворилась.
Как получить 3% раствор?
Для ранневесеннего опрыскивания (до распускания почек) готовят 3%-й раствор: 300 г медного купороса и 225 г гашеной извести-пушонки на 10 литров воды. Получается пропорция 1:0,75, хотя очень часто берут и 1:1 (300 г медного купороса и 300 г гашеной извести-пушонки на 10 литров воды).
Как определить плотность солевого раствора?
Ареометр общего назначения АОН-1 1360-1420 кг/м³ Ареометр АОН-1 подходит для измерения плотности любой жидкости (в том числе солевых растворов, кислот, солей, нефтепродуктов, химических соединений), а также растворов (например, цемент, бетон, строительные смеси и т. д.).
Как рассчитать количество вещества в растворе?
Количество растворенного вещества : = c•V, где c – молярная концентрация растворенного вещества в моль/л, V – объем раствора в л. где m(р-ра) – масса раствора в г, – массовая доля растворенного вещества.
Как можно найти массу раствора?
Масса раствора определяется по формуле m (раствора)= m (масса растворенного вещества)/ w (массовая доля растворенного вещества). Или m = r (плотность раствора – г/см3) * V (объем раствора). А как найти массу раствора, если изветны только массы воды и растворённого вещества?
Как приготовить раствор с заданной концентрацией?
ПРИГОТОВЛЕНИЕ РАСТВОРА ЗАДАННОЙ КОНЦЕНТРАЦИИ СМЕШИВАНИЕМ РАСТВОРОВ БОЛЕЕ ВЫСОКОЙ И БОЛЕЕ НИЗКОЙ КОНЦЕНТРАЦИИ. Раствор можно готовить, непосредственно вводя рассчитанное количество вещества в растворитель, или путем разбавления более концентрированных растворов до требуемого значения концентрации.
Как сделать 1 процентный раствор?
Как приготовить раствор Если вы хотите получить 1–процентный раствор любого вещества, то растворяете 10 г вещества в литре воды (или 100 г в 10 литрах). Соответственно, 2-процентный раствор содержит 20 г вещества в литре воды (200 г в 10 литрах) и так далее.
Что называют насыщенным раствором?
Насыщенным называют такой раствор, в котором при данной температуре вещество больше не растворяется. Если же при этой температуре в 100 г воды растворить хлорида калия меньше, чем 34,4 г, то раствор будет ненасыщенным.
Что необходимо для приготовления раствора?
Для приготовления раствора с определённой массовой долей растворённого вещества надо:
- вычислить массу растворённого вещества;
- вычислить массу (или объём) растворителя;
- взвесить вещество;
- отмерить растворитель;
- смешать вещества.
Как получить 10% раствор?
10-процентный раствор — это девять частей воды и одна часть соли. Например, на 10 граммов соли вам понадобится 90 граммов воды. Воду лучше брать чуть теплую, чтобы соль быстрее растворилась.
Что понимается под раствором?
Раство́р — однородная (гомогенная) система, в состав которой входят молекулы (атомы, ионы) двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах.
Какая система называется раствором?
Растворы – это гомогенные (однофазные) системы переменного состава, состоящие из двух или более веществ (компонентов). По характеру агрегатного состояния растворы могут быть газообразными, жидкими и твердыми.
Как изменяется растворимость веществ с изменением температуры?
При повышении температуры растворимость твердых веществ обычно увеличивается, а газов – уменьшается.
Что такое растворимость какая существует зависимость между изменением температуры?
Растворимость – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре. С повышением температуры растворимость большинства твердых веществ увеличивается, а растворимость газов снижается.
Что такое растворимость От каких факторов зависит?
Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры. Все вещества в той или иной степени растворимы в растворителях.
Какой фактор увеличивает растворимость?
Растворимость большинства твердых веществ в воде увеличивается с повышением температуры, растворимость газов, наоборот растворимость газов, наоборот уменьшится. На растворимость жидкостей, как смешивающихся, так и не смешивающихся с водой, температура практически не влияет.
Как влияет температура на взаимную растворимость жидких веществ и нерастворимых веществ в воде?
На растворимость жидкостей температура практически не влияет.