Как определить процентную концентрацию раствора
Процентная концентрация раствора – это величина, показывающая отношение массы растворенного вещества к общей массе раствора. Иными словами, это – массовая доля вещества в растворе, выраженная в процентах.

Инструкция
Самый простой вариант определения процентной концентрации – когда вам известна первоначальная масса сухого вещества, впоследствии растворенного. Предположим, изначально имелось 15 граммов какой-то соли. Потом ее полностью растворили в воде. Требуется вычислить процентную концентрацию.
Сначала взвесьте емкость с раствором. Например, у вас будет 800 граммов. Потом перелейте раствор и взвесьте пустую емкость. Предположим, она весит 550 граммов. А дальше задача решается элементарно: 15/(800 – 550) = 0.06, или 6%. Вот такова концентрация раствора.
Немного усложним задачу. Возьмите 20 граммов поваренной соли (хлорида натрия) и растворите ее в некотором количестве воды. Потом, перелив раствор в мерный цилиндр и осторожно добавляя воду, доведите объем до 200 миллилитров. Какова процентная концентрация полученного раствора?
Казалось бы, задача – проще некуда. Плотность воды равна 1, следовательно, в 200 миллилитрах – 200 граммов, и процентная концентрация будет 20/200 = 0.1, или 10%. Но не торопитесь с выводами. Ведь у вас не 200 миллилитров чистой воды, а 200 миллилитров раствора, плотность которого отличается от единицы.
Поэтому вам, как в вышеописанном случае, надо узнать общую массу раствора М, сначала взвесив сосуд с ним, а потом – пустой сосуд. И тогда, разделив 20 (массу соли) на М, и умножив результата на 100%, вы получите ответ.
Ну, а если у вас почему-то нет возможности ни взвешивать, ни замерять объем? Как тогда определить процентную концентрацию раствора? Вот, например, имеется какое-то количество водного раствора серной кислоты – хорошо известного вещества. Перед вами поставлена задача – вычислить его процентную концентрацию, не пользуясь ни весами, ни мерной посудой.
На первый взгляд задача очень трудная. А на самом деле решить ее – пара пустяков. Дело в том, что практически для любого вещества, находящего применение в различных отраслях промышленности, существуют так называемые «таблицы плотностей раствора». Ну а серная кислота – настолько широко применяемое вещество, что найти такую таблицу для нее не представляет труда. Она есть в большинстве справочников по химии.
Прежде всего вам необходимо измерить плотность серной кислоты с помощью устройства под названием «плотномер» (по-другому оно может называться «денситометр»). Предположим, полученная величина равна 1.303 грамм/миллилитр. По таблице плотностей определите: раствору какой процентной концентрации соответствует эта величина. Это 40%-й раствор серной кислоты. Задача решена.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Разбавленная и концентрированная серная кислота – это настолько важные химические продукты, что в мире их вырабатывается больше, чем любых других веществ. Экономическое богатство страны может быть оценено по объему производимой в ней серной кислоты.
Процесс диссоциации
Серная кислота находит применение в виде водных растворов различной концентрации. Она подвергается реакции диссоциации в два этапа, производя H+-ионы в растворе.
H2SO4 = H+ + HSO4– ;
HSO4– = H + + SO4-2 .
Серная кислота является сильной, и первый этап ее диссоциации происходит настолько интенсивно, что практически все исходные молекулы распадаются на H+-ионы и HSO4 -1 -ионы (гидросульфата) в растворе. Последние частично распадаются дальше, выделяя другой H+-ион и оставляя сульфат-ион (SO4-2 ) в растворе. Однако гидросульфат, будучи слабой кислотой, все же превалирует в растворе над H+ и SO4-2 . Полная диссоциация его происходит только, когда плотность раствора серной кислоты приближается к плотности воды, т. е при сильном разбавлении.
Свойства серной кислоты
Она является особенной в том смысле, что может действовать как обычная кислота или как сильный окислитель – в зависимости от ее температуры и концентрации. Холодный разбавленный раствор серной кислоты реагирует с активными металлами с получением соли (сульфата) и выделением газа водорода. Например, реакция между холодной разбавленной Н2SO4 (в предположении ее полной двухэтапной диссоциации) и металлическим цинком выглядит так:
Zn + Н2SO4 = ZnSO4 + H2.
Горячая серная кислота концентрированная, плотность которой около 1,8 г/см3, может действовать в качестве окислителя, реагируя с материалами, которые обычно инертны к кислотам, такими, например, как металлическая медь. В процессе реакции медь окисляется, а масса кислоты уменьшается, образуется раствор сульфата меди (II) в воде и газообразная двуокись серы (SO2) вместо водорода, чего можно было бы ожидать при взаимодействии кислоты с металлом.
Cu + 2Н2SO4 = CuSO4 + SO2 + 2H2 O.

Как вообще выражается концентрация растворов
Собственно, концентрация любого раствора может быть выражена различными способами, но наиболее широко используется весовая концентрация. Она показывает количество граммов растворенного вещества в определенной массе или объеме раствора или растворителя (обычно 1000 г, 1000 см3, 100 см3 и 1 дм3). Вместо массы вещества в граммах можно брать его количество, выраженное в молях, – тогда получается молярная концентрация на 1000 г или 1 дм3 раствора.
Если молярная концентрация определена по отношению не к количеству раствора, а только к растворителю, то она носит название моляльности раствора. Для нее характерна независимость от температуры.
Зачастую весовую концентрацию указывают в граммах на 100 г растворителя. Умножая этот показатель на 100 %, получают ее в весовых процентах (процентная концентрация). Именно этот способ является наиболее часто употребляемым в применении к растворам серной кислоты.
Каждой величине концентрации раствора, определенной при данной температуре, соответствует вполне конкретная его плотность (например, плотность раствора серной кислоты). Поэтому иногда раствор характеризуют именно ею. Например, раствор Н2SO4, характеризующийся процентной концентрацией 95,72 %, имеет плотность 1,835 г/см3 при t = 20 °С. Как же определить концентрацию такого раствора, если дана только плотность серной кислоты? Таблица, дающая такое соответствие, является неотъемлемой принадлежностью любого учебника по общей или аналитической химии.
Пример пересчета концентрации
Попробуем перейти от одного способа выражения концентрации раствора к другому. Предположим, что мы имеем раствор Н2SO4 в воде с процентной концентрацией 60 %. Сначала определим соответствующую плотность серной кислоты. Таблица, содержащая процентные концентрации (первый столбец) и соответствующие им плотности водного раствора Н2SO4 (четвертый столбец), приведена ниже.
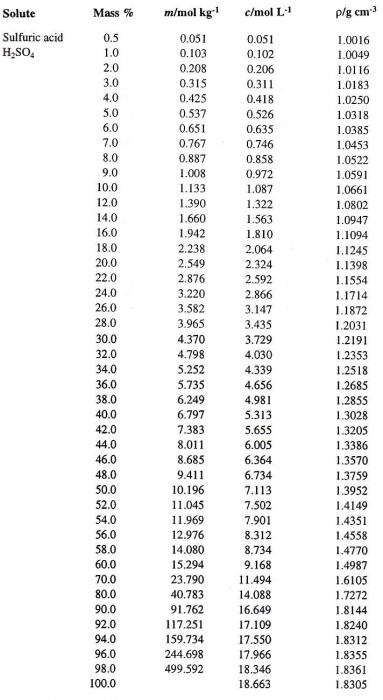
По ней определяем искомую величину, которая равна 1,4987 г/см3. Вычислим теперь молярность данного раствора. Для этого необходимо определить массу Н2SO4 в 1 л раствора и соответствующее ей число молей кислоты.
Объем, который занимают 100 г исходного раствора:
100 / 1,4987 = 66,7 мл.
Так как в 66,7 миллилитрах 60%-ного раствора содержится 60 г кислоты, то в 1 л ее будет содержаться:
(60 / 66,7) х 1000 = 899, 55 г.
Молярный вес серной кислоты равен 98. Отсюда число молей, содержащихся в 899,55 г ее граммах, будет равно:
899,55 / 98 = 9,18 моль.
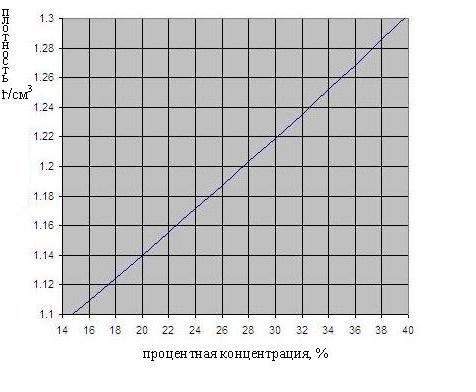
Зависимость плотности серной кислоты от концентрации приведена на рис. ниже.
Использование серной кислоты
Она применяется в различных отраслях промышленности. В производстве чугуна и стали она используется для очистки поверхности металла, прежде чем он покрывается другим веществом, участвует в создании синтетических красителей, а также других типов кислот, таких как соляная и азотная. Она также применяется в производстве фармпрепаратов, удобрений и взрывчатых веществ, а еще является важным реагентом при удалении примесей из нефти в нефтеперерабатывающей промышленности.
Это химическое вещество является невероятно полезным и в быту, и легко доступно как раствор серной кислоты, используемый в свинцово-кислотных аккумуляторных батареях (например, тех, что стоят в автомобилях). Такая кислота, как правило, имеет концентрацию примерно от 30% до 35% H2SO 4 по весу, остальное – вода.
Для многих бытовых приложений 30% Н2SO4 будет более чем достаточно, чтобы удовлетворить свои потребности. Однако в промышленности требуется и значительно более высокая концентрация серной кислоты. Обычно в процессе производства она сначала получается достаточно разбавленной и загрязненной органическими включениями. Концентрированную кислоту получают в два этапа: сначала ее доводят до 70 %, а затем – на втором этапе – поднимают до 96-98 %, что является предельным показателем для экономически рентабельного производства.
Плотность серной кислоты и ее сорта
Хотя почти 99%-ную серную кислоту можно получить кратковременно при кипении, но последующая потеря SO3 в точке кипения приводит к снижению концентрации до 98,3%. Вообще, разновидность с показателем 98% более устойчива в хранении.
Товарные сорта кислоты различаются по ее процентной концентрации, причем для них выбраны те ее значения, при которых минимальны температуры кристаллизации. Это сделано для уменьшения выпадения кристаллов серной кислоты в осадок при транспортировке и хранении. Основные сорта таковы:
- Башенная (нитрозная) – 75 %. Плотность серной кислоты этого сорта равна 1670 кг/м3. Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.
- Контактная – 92,5-98,0 %. Плотность серной кислоты 98%-ной этого сорта равна 1836,5 кг/м3. Получают ее также из обжигового газа, содержащего SO2, причем процесс включает окисление двуокиси до ангидрида SO3 при ее контакте (отсюда и название сорта) с несколькими слоями твердого ванадиевого катализатора.
- Олеум – 104,5 %. Плотность его равна 1896,8 кг/м3. Это раствор SO3 в H2SO4, в котором первого компонента содержится 20 %, а кислоты – именно 104,5 %.
- Высокопроцентный олеум – 114,6 %. Его плотность – 2002 кг/м3.
- Аккумуляторная – 92-94 %.
Как устроен автомобильный аккумулятор
Работа этого одного из самых массовых электротехнических устройств полностью основана на электрохимических процессах, происходящих в присутствии водного раствора серной кислоты.
Автомобильный аккумулятор содержит разбавленный серно-кислотный электролит, а также положительный и отрицательный электроды в виде нескольких пластин. Положительные пластины выполнены из красновато-коричневого материала – диоксида свинца (PbO2), а отрицательные – из сероватого «губчатого» свинца (Pb).
Поскольку электроды изготовлены из свинца или свинцовосодержащего материала, то этот тип батареи часто называют свинцово-кислотным аккумулятором. Работоспособность его, т. е. величина выходного напряжения, напрямую определяется тем, какова в данный момент времени плотность серной кислоты (кг/м3 или г/см3), залитой в аккумулятор в качестве электролита.
Что происходит с электролитом при разряде аккумулятора
Электролит свинцово-кислотного аккумулятора представляет собой раствор аккумуляторной серной кислоты в химически чистой дистиллированной воде с процентной концентрацией по 30 % при полной зарядке. Чистая кислота имеет плотность 1,835 г/см3, электролит – около 1,300 г/см3. Когда аккумулятор разряжается, в нем происходят электрохимические реакции, в результате которых из электролита отбирается серная кислота. Плотность от концентрации раствора зависит практически пропорционально, поэтому она должна уменьшаться вследствие снижения концентрации электролита.
До тех пор, пока ток разряда протекает через аккумулятор, кислота вблизи его электродов активно используется, и электролит становится все более разбавленным. Диффузия кислоты из объема всего электролита и к электродным пластинам поддерживает примерно постоянную интенсивность химических реакций и, как следствие, выходное напряжение.
В начале процесса разряда диффузия кислоты из электролита в пластины происходит быстро потому, что образующийся при этом сульфат еще не забил поры в активном материале электродов. Когда сульфат начинает формироваться и заполнять поры электродов, диффузия происходит более медленно.
Теоретически можно продолжить разряд до тех пор, пока все кислота не будет использована, и электролит будет состоять из чистой воды. Однако опыт показывает, что разряды не должны продолжаться после того, как плотность электролита упала до 1,150 г/см3.
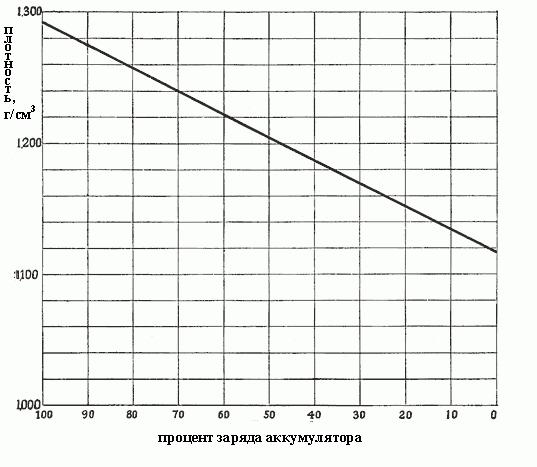
Когда плотность падает от 1,300 до 1,150, это означает, что столько сульфата было сформировано в процессе реакций, и он заполняет все поры в активных материалах на пластинах, т. е. из раствора уже отобрана почти вся серная кислота. Плотность от концентрации зависит пропорционально, и точно так же от плотности зависит заряд аккумулятора. На рис. ниже показана зависимость заряда аккумулятора от плотности электролита.
Изменение плотности электролита является лучшим средством определения состояния разряда аккумулятора, при условии, что он используется надлежащим образом.
Степени разряда автомобильного аккумулятора в зависимости от плотности электролита
Плотность его должна измеряться каждые две недели и постоянно должна вестись запись показаний для использования в будущем.
Чем плотнее электролит, тем больше кислоты он содержит, и тем более заряжен аккумулятор. Плотность в 1,300-1,280 г/см3 указывает на полный заряд. Как правило, различаются следующие степени разряда аккумулятора в зависимости от плотности электролита:
- 1,300-1,280 – полностью заряжен:
- 1,280-1,200 – более чем наполовину разряжен;
- 1,200-1,150 – заряжен менее чем наполовину;
- 1,150 – практически разряжен.
У полностью заряженного аккумулятора перед подключением его автомобильной сети напряжение каждой ячейки составляет от 2,5 до 2,7 В. Как только подключается нагрузка, напряжение быстро падает примерно до 2,1 В в течение трех или четырех минут. Это происходит из-за формирования тонкого слоя сульфата свинца на поверхности отрицательных электродных пластин и между слоем перекиси свинца и металлом положительных пластин. Окончательное значение напряжения ячейки после подключения к автомобильной сети составляет около 2,15-2,18 вольт.
Когда ток начинает протекать через аккумулятор в течение первого часа работы, происходит падение напряжения до 2 В, объясняемое ростом внутреннего сопротивления ячеек из-за формирования большего количества сульфата, который заполняет поры пластин, и отбора кислоты из электролита. Незадолго до начала протекания тока плотность электролита максимальна и равна 1,300 г/см3. Поначалу его разрежение происходит быстро, но затем устанавливается сбалансированное состояние между плотностью кислоты вблизи пластин и в основном объеме электролита, отбор кислоты электродами поддерживается поступлением новых частей кислоты от основной части электролита. При этом средняя плотность электролита продолжает неуклонно уменьшаться по зависимости, показанной на рис. выше. После первоначального падения напряжение уменьшается более медленно, скорость его снижения зависит от нагрузки аккумулятора. Временной график процесса разряда показан на рис. ниже.
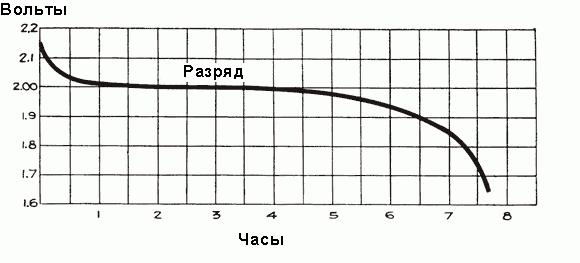
Контроль состояния электролита в аккумуляторе
Для определения плотности используется ареометр. Он состоит из небольшой запаянной стеклянной трубки с расширением на нижнем конце, заполненным дробью или ртутью, и градуированной шкалой на верхнем конце. Эта шкала помечена от 1,100 до 1,300 с различными промежуточными значениями, как показано на рис. ниже. Если этот ареометр помещается в электролит, то он будет опускаться до определенной глубины. При этом он будет вытеснять определенный объем электролита, и когда будет достигнуто равновесное положение, вес вытесненного объема просто будет равен весу ареометра. Поскольку плотность электролита равна отношению его веса к объему, а вес ареометра известен, то каждый уровень его погружения в раствор соответствует определенной его плотности.
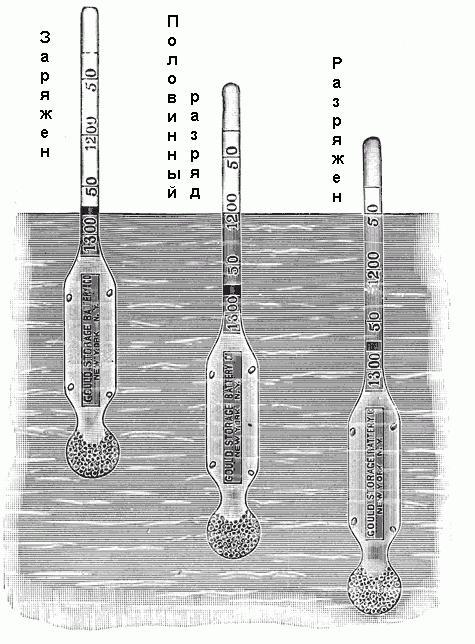
Некоторые ареометры не имеют шкалы со значениями плотности, но помечены надписями: «Заряжен», «Половинный разряд», «Полный разряд» или им подобными.
Формула простая. 1 моль H2SO4 = 2+ 32 + 16*4 = 98 грамм
То есть если взять 98 грамм кислоты и долить водой до 1 литра, то получим одномолярный раствор серной кислоты.
Пересчитаем на проценты.
Кода говорят о процентной концентрации, то обычно и чаще всего имеют ввиду весовые проценты, есть еще проценты объемные, но тогда так и говорят – “объемные проценты”.
Итак делим массу растворенной кислоты (98 грамм) на общую массу раствора.
И получаем первую загвоздку – серная кислота тяжелее воды, поэтому расчетики придется сопровождать поисками плотности используемой серной кислоты в таблицах.
А вот дальше телепатия отказала – 17.34 это что? молярность раствора, проценты, объемные проценты, моляльность?
м.и.Оракул (59224)
13 лет назад
Алексй спасибо за участие, дело в том что необходимо сделать раствор в котором цитирую: следующем соотношении компонентов, моль/л:
Серная кислота 17,340-19,200
сколько чего надо смешать не совсем яно, поскольку в школу ходил давно. Продают Н2SO4 по госту 98% плотность 1.83….
Не знаю подходит по концентрации или нет, надо олеум добавлять или наоборот разбавить водой.
тут походу запятая не там стоит, 1.7340 г. см3 наверно так?

Концентрация растворов. Растворы неэлектролитов. Растворимость
Задача:
Расчеты по процентной концентрации растворов. Формула, выражающая процентную концентрацию раствора —
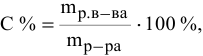
где 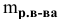 — масса растворенного вещества;
— масса растворенного вещества;
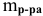 — масса раствора,
— масса раствора, 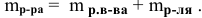
Задача:
Рассчитать процентную концентрацию раствора, полученного растворением 80 г сахара в 160 г воды.
Решение: 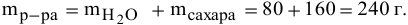
Задача:
Рассчитать массы поваренной соли и воды, необходимые для приготовления 250 г 2,5%-ного раствора.
Решение: 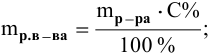
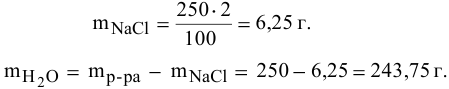
Задача:
Рассчитать концентрацию раствора, полученного смешением З00 г 10%-ного раствора хлороводорода и 400г 20%-ного раствора хлороводорода.
Решение:
Определяем массы растворенной 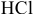 в каждом растворе:
в каждом растворе:

После смешивания
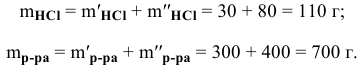
Определяем концентрацию полученного раствора:
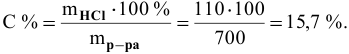
Задача:
Какова концентрация серной кислоты в растворе, полученном смешиванием 200г 10%-ного раствора серной кислоты и 100г 5%-ного раствора сульфата натрия?
Решение:
Масса полученного раствора определяется как сумма масс смешанных растворов:
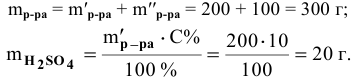
Далее определим концентрацию серной кислоты в полученном растворе:
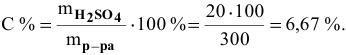
Задача:
Расчеты по молярной концентрации (молярности) раствора.
Формула для расчета молярности раствора —
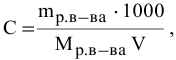
где С — молярность раствора, моль/л;
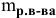 — масса растворенного вещества, г;
— масса растворенного вещества, г;
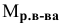 — молярная масса растворенного вещества, г/моль;
— молярная масса растворенного вещества, г/моль;
V — объем раствора, мл; если объем выражается в литрах, тогда в формуле исчезает коэффициент 1000.
Задача:
Какая масса серной кислоты необходима для приготовления 2 л 2-молярного раствора?
Решение: 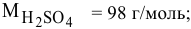
Задача:
250 мл раствора содержат 7г КОН. Какова молярность этого раствора?
Решение: 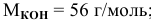
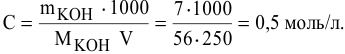
Задача:
Расчеты по нормальной концентрации (нормальности) раствора.
Для расчета нормальности пользуемся следующей формулой:
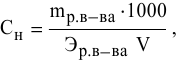
где 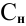 — нормальная концентрация раствора;
— нормальная концентрация раствора;
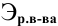 — эквивалентная масса растворенного вещества.
— эквивалентная масса растворенного вещества.
Задача:
Какая масса фосфорной кислоты необходима для приготовления 2 л 0,1 н раствора?
Решение:
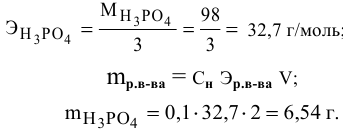
Задача:
Расчеты по разбавлению растворов.
Выведем формулу для расчетов при разбавлении растворов, учитывая, что концентрация как исходного, так и приготовленного растворов может быть выражена любым способом  , а также исходя из того, что при разбавлении растворов постоянной остается масса растворенного вещества.
, а также исходя из того, что при разбавлении растворов постоянной остается масса растворенного вещества.
Для раствора, концентрация которого выражена в процентах,
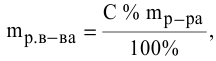
а так как 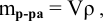
то
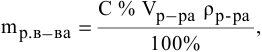
где 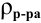 — плотность раствора, г/мл.
— плотность раствора, г/мл.
Для молярной концентрации
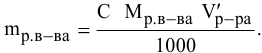
Для нормальной концентрации
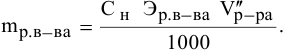
Приравниваем правые части уравнений:
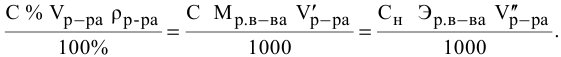
Задача:
Сколько миллилитров 98%-ного раствора серной кислоты
(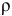 = 1,84 г/мл) необходимо для приготовления 300 мл 3 н раствора этой кислоты?
= 1,84 г/мл) необходимо для приготовления 300 мл 3 н раствора этой кислоты?
Решение:
Воспользуемся первым членом приведенного выше уравнения для концентрированного исходного раствора кислоты и третьим членом — для приготовления разбавленного раствора серной кислоты:
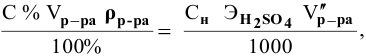
где С% = 98 %;
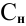 = 3 экв/л;
= 3 экв/л;
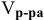 — неизвестный объем исходного раствора;
— неизвестный объем исходного раствора;
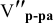 = 300 мл;
= 300 мл;
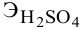 = 49 г/моль.
= 49 г/моль.
Отсюда
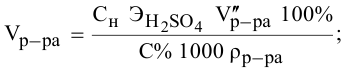
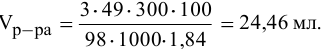
Задача:
Расчеты по переходу от одного способа выражения концентрации данного раствора к другому.
При переходе от одной концентрации данного раствора к другой остаются постоянными не только масса растворенного вещества, но и объем раствора, т.е.
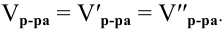
Предыдущая формула принимает следующий вид:
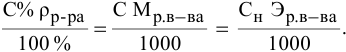
Задача:
Определить молярность 36,5%-ного раствора соляной кислоты (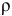 =1,18 г/мл).
=1,18 г/мл).
Решение:
Воспользуется первым и вторым членами последнего уравнения и выведем выражение для определения молярности:
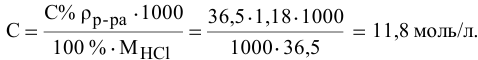
Задача:
Расчеты по законам Рауля. Давление паров разбавленного раствора.
По закону Рауля, понижение давления пара 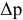 над раствором прямо пропорционально мольной доле растворенного вещества:
над раствором прямо пропорционально мольной доле растворенного вещества:
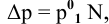
где 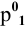 — давление пара чистого растворителя;
— давление пара чистого растворителя;
N — мольная доля растворенного вещества,
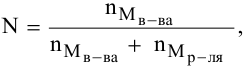
где  — число молей растворенного вещества и растворителя.
— число молей растворенного вещества и растворителя.
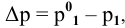
где 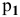 — давление паров растворителя над раствором.
— давление паров растворителя над раствором.
Отсюда
Задача:
Определить давление насыщенных паров раствора, содержащего 45 г глюкозы 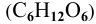 в 720 г воды при 25°С. Давление насыщенного пара воды при 25°С равно 3153,4 Па.
в 720 г воды при 25°С. Давление насыщенного пара воды при 25°С равно 3153,4 Па.
Решение:
Рассчитываем мольную долю растворенного вещества:
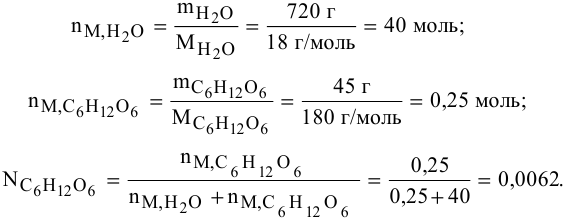
Определяем давление паров воды над раствором:
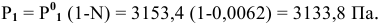
Задача:
Расчеты по понижению температуры замерзания растворов.
По закону Рауля понижение температуры замерзания прямо пропорционально моляльной концентрации раствора:
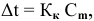
где 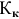 — криоскопическая постоянная растворителя;
— криоскопическая постоянная растворителя;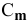 — моляльная концентрация раствора (число молей растворенного вещества
— моляльная концентрация раствора (число молей растворенного вещества 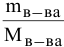 в 1000 г растворителя),
в 1000 г растворителя),
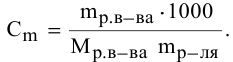
Отсюда
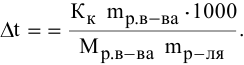
Задача:
Рассчитать температуру замерзания 3%-ного водного раствора этиленгликоля 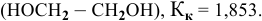
Решение:
Выведем формулу для перехода от процентной концентрации к моляльности раствора.
Для процентной концентрации
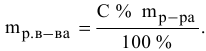
Для моляльности
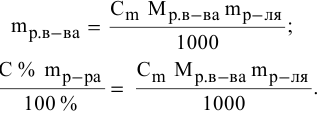
Отсюда
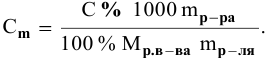
Если принять 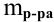 за 100, тогда
за 100, тогда 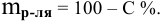
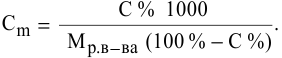
Находим моляльность рассматриваемого раствора:
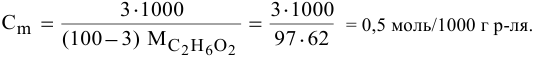
Рассчитаем понижение температуры замерзания раствора:
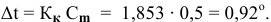
Температура замерзания водного раствора
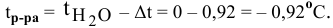
Задача:
Рассчитать температуру кипения 0,1 молярного водного раствора глюкозы (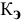 = 0,516).
= 0,516).
Решение:
Формула для перехода от молярной концентрации к моляльной —
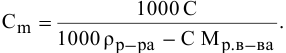
Так как раствор разбавленный, то принимаем 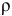 = 1 г/мл, тогда
= 1 г/мл, тогда
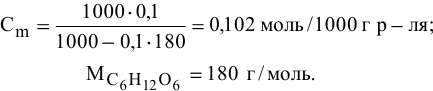
Определяем повышение температуры кипения раствора:
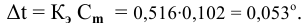
Температура кипения этого раствора
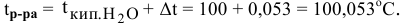
Задача:
Расчеты по уравнению химической реакции, протекающей в растворе.
Для химического уравнения общего вида
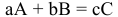
верно следующее соотношение числа эквивалентов:
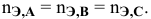
Если участвующие в реакции вещества взяты в виде растворов и если их концентрации выражены:
а) для вещества А — С %;
б) для вещества В — С (молярность);
в) для вещества С — 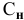 (нормальность),
(нормальность),
тогда массы и число эквивалентов каждого из веществ, находящихся в определенных объемах растворов этих веществ, определяются по формулам:
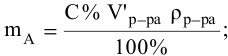

Так как числа эквивалентов, участвующих в реакции веществ, равны между собой, то можно записать:
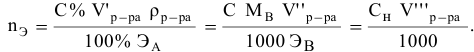
Если концентрации участвующих в реакции веществ выражены в нормальности, то формула для расчетов приобретает вид:
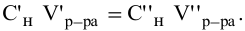
Задача:
Какой объем 0,2 н раствора щелочи необходим для осаждения 2,708 г хлорида трехвалентного железа в виде гидроксида железа?
Решение:
Предложенный метод не требует обязательного написания уравнения реакции для осуществления таких расчетов.
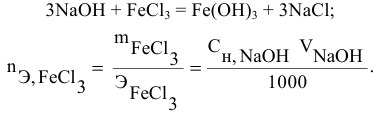
Отсюда
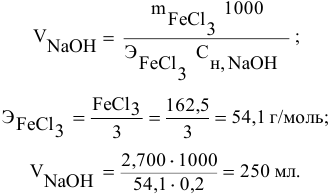
Задача:
Для нейтрализации 20 мл 2-молярного раствора 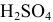 необходимо 8 мл раствора щелочи. Какова нормальность щелочи ?
необходимо 8 мл раствора щелочи. Какова нормальность щелочи ?
Решение:
Формула для расчета —
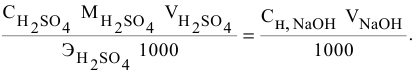
Так как 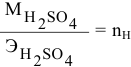 — числу атомов водорода, участвующих в реакции, то формула примет вид
— числу атомов водорода, участвующих в реакции, то формула примет вид
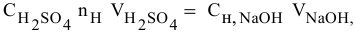
откуда
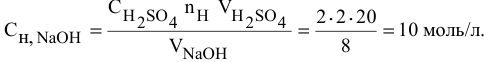
Задача:
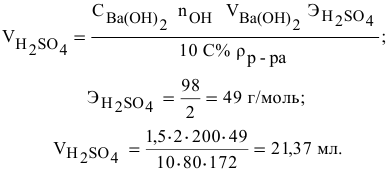
Какой объем 80 %-ного раствора 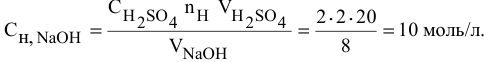 (
( = 1,72 г/мл) необходим для реакции с 200 мл 1,5-молярного раствора
= 1,72 г/мл) необходим для реакции с 200 мл 1,5-молярного раствора  ?
?
Решение:
Формула для расчета —
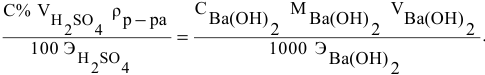
Так как 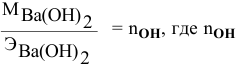 — число групп ОН, участвующих в реакции, то
— число групп ОН, участвующих в реакции, то
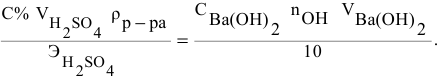
Отсюда
Задача:
Какой объем 0,2 н раствора щелочи необходим для реакции осаждения 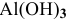 с 200 мл 0,6 н раствора
с 200 мл 0,6 н раствора 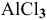 ?
?
Решение:
Формула для расчета —
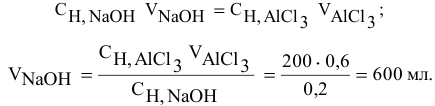
Задача:
Смешивается 300 мл 0,5 М раствора хлорида бария со 100 мл 6 %-ного раствора серной кислоты (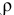 = 1,04 г/мл). Какова масса полученного осадка?
= 1,04 г/мл). Какова масса полученного осадка?
Решение:
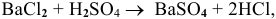 , полученный осадок — сульфат бария.
, полученный осадок — сульфат бария.
Так как указаны количества обоих реагирующих веществ, то необходимо определить вещество, взятое в избытке.
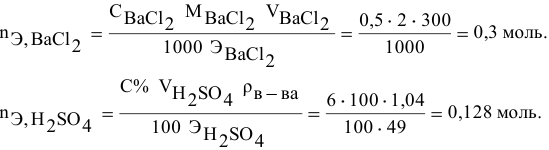
Таким образом,  взято в избытке:
взято в избытке:
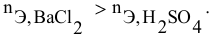
Дальнейший расчет производим по веществу, взятому в недостатке, т.е. по серной кислоте.
Так как 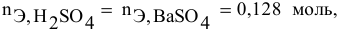
находим массу 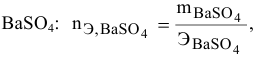
откуда
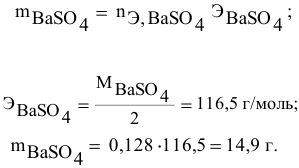
Задача:
Для приготовления насыщенного раствора К.С1 при 40°С взято 50г воды и 20г КС1. Какова растворимость К.С1 в воде при данной температуре?
Решение:
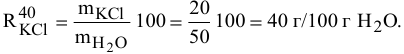
Задача:
В 300г горячей воды растворено 219г 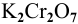 . Найти массу кристаллов
. Найти массу кристаллов 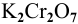 , полученных при охлаждении приготовленного горячего раствора до 20°С. Известно, что растворимость
, полученных при охлаждении приготовленного горячего раствора до 20°С. Известно, что растворимость 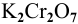 при 20°С равна 13,1 г на 100 г воды.
при 20°С равна 13,1 г на 100 г воды.
Решение:
Определяем, сколько может быть растворено 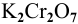 в 300 г воды при 20°С:
в 300 г воды при 20°С:
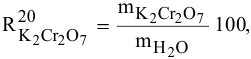
Откуда
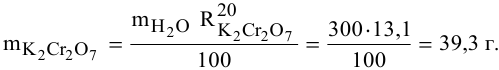
Масса кристаллов — это разность массы растворенного вещества в горячем растворе и массы растворенного вещества в охлажденном растворе (рис.З):
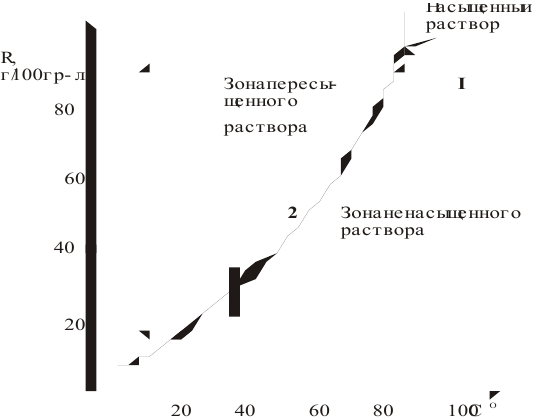
Рис. 3 — Графическое изображение процесса выпадения кристаллов при охлаждении раствора:
1 — участок охлаждения ненасыщенного раствора от заданной температуры до температуры образования насыщенного раствора;
2 — участок охлаждения насыщенного раствора до заданной температуры с уменьшением растворимости вещества, что приводит к его кристаллизации (в данном случае мы предполагаем, что пересыщенный раствор не образуется).
Эти задачи взяты со страницы решения задач по неорганической химии:
Задачи с решением по неорганической химии
Возможно эти страницы вам будут полезны:

Я все понимаю, я знаю, что там есть серная кислота и знаю концентрацию (высчитал по плотности), просто я люблю все проверять опытным путем, а не просто прочитать. Это же только частный случай, а значие и умение метода определения серной кислоты помогут мне определять ее в любых других растворах. Ладно это электролит, но если я захочу ее сделать какой нибудь реакцией в домашних условиях, то не факт, что она у меня будет после этой реакции и я смогу проверить – есть там она или нет. Я сейчас привел только часный случай с электролитом, а мне это нужно будет вообще, я с ней сейчас активно занимаюсь. Ну вот.
А как мне определить концентрачию серной кислоты в растворе? У меня есть метилвиолет (индикатор концентрации кислоты), у меня, когда я насыпал несколько кристалликов в серную к., он стал прозрачным белым. Это что нибудь значит? (я просто мерил с помощью метилвиолета только кислоты с концентрачией меньше 10 %, а с большими концентрациями у меня с ним опыта нет)
