Фазовые переходы
-
Темы кодификатора ЕГЭ: изменение агрегатных состояний вещества, плавление и кристаллизация, испарение и конденсация, кипение жидкости, изменение энергии в фазовых переходах.
-
Плавление и кристаллизация
-
График плавления
-
Удельная теплота плавления
-
График кристаллизации
-
Парообразование и конденсация
-
Кипение
-
График кипения
-
График конденсации
Автор статьи — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ Игорь Вячеславович Яковлев
Темы кодификатора ЕГЭ: изменение агрегатных состояний вещества, плавление и кристаллизация, испарение и конденсация, кипение жидкости, изменение энергии в фазовых переходах.
Лёд, вода и водяной пар — примеры трёх агрегатных состояний вещества: твёрдого, жидкого и газообразного. В каком именно агрегатном состоянии находится данное вещество — зависит от его температуры и других внешних условий, в которых оно находится.
При изменении внешних условий (например, если внутренняя энергия тела увеличивается или уменьшается в результате нагревания или охлаждения) могут происходить фазовые переходы — изменения агрегатных состояний вещества тела. Нас будут интересовать следующие фазовые переходы.
• Плавление (твёрдое тело жидкость) и кристаллизация (жидкость
твёрдое тело).
• Парообразование (жидкость пар) и конденсация (пар
жидкость).
к оглавлению ▴
Плавление и кристаллизация
Большинство твёрдых тел являются кристаллическими, т.е. имеют кристаллическую решётку — строго определённое, периодически повторяющееся в пространстве расположение своих частиц.
Частицы (атомы или молекулы) кристаллического твёрдого тела совершают тепловые колебания вблизи фиксированных положений равновесия — узлов кристаллической решётки.
Например, узлы кристаллической решётки поваренной соли — это вершины кубических клеток «трёхмерной клетчатой бумаги» (см. рис. 1, на котором шарики большего размера обозначают атомы хлора (изображение с сайта en.wikipedia.org.)); если дать испариться воде из раствора соли, то оставшаяся соль будет нагромождением маленьких кубиков.

Рис. 1. Кристаллическая решётка
Плавлением называется превращение кристаллического твёрдого тела в жидкость. Расплавить можно любое тело — для этого нужно нагреть его до температуры плавления, которая зависит лишь от вещества тела, но не от его формы или размеров. Температуру плавления данного вещества можно определить из таблиц.
Наоборот, если охлаждать жидкость, то рано или поздно она перейдёт в твёрдое состояние. Превращение жидкости в кристаллическое твёрдое тело называется кристаллизацией или отвердеванием. Таким образом, плавление и кристаллизация являются взаимно обратными процессами.
Температура, при которой жикость кристаллизуется, называется температурой кристаллизации. Оказывается, что температура кристаллизации равна температуре плавления: при данной температуре могут протекать оба процесса. Так, при лёд плавится, а вода кристаллизуется; что именно происходит в каждом конкретном случае — зависит от внешних условий (например, подводится ли тепло к веществу или отводится от него).
Как происходят плавление и кристаллизация? Каков их механизм? Для уяснения сути этих процессов рассмотрим графики зависимости температуры тела от времени при его нагревании и охлаждении — так называемые графики плавления и кристаллизации.
к оглавлению ▴
График плавления
Начнём с графика плавления (рис. 2). Пусть в начальный момент времени (точка на графике) тело является кристаллическим и имеет некоторую температуру
.

Рис. 2. График плавления
Затем к телу начинает подводиться тепло (скажем, тело поместили в плавильную печь), и температура тела повышается до величины — температуры плавления данного вещества. Это участок
графика.
На участке тело получает количество теплоты
где — удельная теплоёмкость вещества твёрдого тела,
— масса тела.
При достижении температуры плавления (в точке ) ситуация качественно меняется. Несмотря на то, что тепло продолжает подводиться, температура тела остаётся неизменной. На участке
происходит плавление тела — его постепенный переход из твёрдого состояния в жидкое. Внутри участка
мы имеем смесь твёрдого вещества и жидкости, и чем ближе к точке
, тем меньше остаётся твёрдого вещества и тем больше появляется жидкости. Наконец, в точке
от исходного твёрдого тела не осталось ничего: оно полностью превратилось в жидкость.
Участок соответствует дальнейшему нагреванию жидкости (или, как говорят, расплава). На этом участке жидкость поглощает количество теплоты
где — удельная теплоёмкость жидкости.
Но нас сейчас больше всего интересует — участок фазового перехода. Почему не меняется температура смеси на этом участке? Тепло-то подводится!
Вернёмся назад, к началу процесса нагревания. Повышение температуры твёрдого тела на участке есть результат возрастания интенсивности колебаний его частиц в узлах кристаллической решётки: подводимое тепло идёт на увеличение кинетической энергии частиц тела (на самом деле некоторая часть подводимого тепла расходуется на совершение работы по увеличению средних расстояний между частицами — как мы знаем, тела при нагревании расширяются. Однако эта часть столь мала, что её можно не принимать во внимание.).
Кристаллическая решётка расшатывается всё сильнее и сильнее, и при температуре плавления размах колебаний достигает той предельной величины, при которой силы притяжения между частицами ещё способны обеспечивать их упорядоченное расположение друг относительно друга. Твёрдое тело начинает «трещать по швам», и дальнейшее нагревание разрушает кристаллическую решётку — так начинается плавление на участке .
С этого момента всё подводимое тепло идёт на совершение работы по разрыву связей, удерживающих частицы в узлах кристаллической решётки, т.е. на увеличение потенциальной энергии частиц. Кинетическая энергия частиц при этом остаётся прежней, так что температура тела не меняется. В точке кристаллическая структура исчезает полностью, разрушать больше нечего, и подводимое тепло снова идёт на увеличение кинетической энергии частиц — на нагревание расплава.
к оглавлению ▴
Удельная теплота плавления
Итак, для превращения твёрдого тела в жидкость мало довести его до температуры плавления. Необходимо дополнительно (уже при температуре плавления) сообщить телу некоторое количество теплоты для полного разрушения кристаллической решётки (т.е. для прохождения участка
).
Это количество теплоты идёт на увеличение потенциальной энергии взаимодействия частиц. Следовательно, внутренняя энергия расплава в точке больше внутренней энергии твёрдого тела в точке
на величину
.
Опыт показывает, что величина прямо пропорциональна массе тела:
Коэффициент пропорциональности не зависит от формы и размеров тела и является характеристикой вещества. Он называется удельной теплотой плавления вещества. Удельную теплоту плавления данного вещества можно найти в таблицах.
Удельная теплота плавления численно равна количеству теплоты, необходимому для превращения в жидкость одного килограмма данного кристаллического вещества, доведённого до температуры плавления.
Так, удельная теплота плавления льда равна кДж/кг, свинца —
кДж/кг. Мы видим, что для разрушения кристаллической решётки льда требуется почти в
раз больше энергии! Лёд относится к веществам с большой удельной теплотой плавления и поэтому весной тает не сразу (природа приняла свои меры: обладай лёд такой же удельной теплотой плавления, как и свинец, вся масса льда и снега таяла бы с первыми оттепелями, затопляя всё вокруг).
к оглавлению ▴
График кристаллизации
Теперь перейдём к рассмотрению кристаллизации — процесса, обратного плавлению. Начинаем с точки предыдущего рисунка. Предположим, что в точке
нагревание расплава прекратилось (печку выключили и расплав выставили на воздух). Дальнейшее изменение температуры расплава представлено на рис. (3).

Рис. 3. График кристаллизации
Жидкость остывает (участок ), пока её температура не достигнет температуры кристаллизации, которая совпадает с температурой плавления
.
С этого момента температура расплава меняться перестаёт, хотя тепло по-прежнему уходит от него в окружающую среду. На участке происходит кристаллизация расплава — его постепенный переход в твёрдое состояние. Внутри участка
мы снова имеем смесь твёрдой и жидкой фаз, и чем ближе к точке
, тем больше становится твёрдого вещества и тем меньше — жидкости.Наконец,вточке
жидкостинеостаётсявовсе—онаполностьюкристаллизовалась.
Следующий участок соответствует дальнейшему остыванию твёрдого тела, возникшего в результате кристаллизации.
Нас опять-таки интересует участок фазового перехода : почему температура остаётся неизменной, несмотря на уход тепла?
Снова вернёмся в точку . После прекращения подачи тепла температура расплава понижается, так как его частицы постепенно теряют кинетическую энергию в результате соударений с молекулами окружающей среды и излучения электромагнитных волн.
Когда температура расплава понизится до температуры кристаллизации (точка ), его частицы замедлятся настолько, что силы притяжения окажутся в состоянии «развернуть» их должным образом и придать им строго определённую взаимную ориентацию в пространстве. Так возникнут условия для зарождения кристаллической решётки, и она действительно начнёт формироваться благодаря дальнейшему уходу энергии из расплава в окружающее пространство.
Одновременно начнётся встречный процесс выделения энергии: когда частицы занимают свои места в узлах кристаллической решётки, их потенциальная энергия резко уменьшается, за счёт чего увеличивается их кинетическая энергия — кристаллизующаяся жидкость является источником тепла (часто у проруби можно увидеть сидящих птиц. Они там греются!). Выделяющееся в ходе кристаллизации тепло в точности компенсирует потерю тепла в окружающую среду, и потому температура на участке не меняется.
В точке расплав исчезает, а вместе с завершением кристаллизации исчезает и этот внутренний «генератор» тепла. Вследствие продолжающегося рассеяния энергии во внешнюю среду понижение температуры возобновится, но только остывать уже будет образовавшееся твёрдое тело (участок
).
Как показывает опыт, при кристаллизации на участке выделяется ровно то же самое количество теплоты
, которое было поглощено при плавлении на участке
.
к оглавлению ▴
Парообразование и конденсация
Парообразование — это переход жидкости в газообразное состояние (в пар). Существует два способа парообразования: испарение и кипение.
Испарением называется парообразование, которое происходит при любой температуре со свободной поверхности жидкости. Как вы помните из листка «Насыщенный пар», причиной испарения является вылет из жидкости наиболее быстрых молекул, которые способны преодолеть силы межмолекулярного притяжения. Эти молекулы и образуют пар над поверхностью жидкости.
Разные жидкости испаряются с разными скоростями: чем больше силы притяжения молекул друг к другу — тем меньшее число молекул в единицу времени окажутся в состоянии их преодолеть и вылететь наружу, и тем меньше скорость испарения. Быстро испаряются эфир, ацетон, спирт (их иногда называют летучими жидкостями), медленнее — вода, намного медленнее воды испаряются масло и ртуть.
Скорость испарения растёт с повышением температуры (в жару бельё высохнет скорее), поскольку увеличивается средняя кинетическая энергия молекул жидкости, и тем самым возрастает число быстрых молекул, способных покинуть её пределы.
Скорость испарения зависит от площади поверхности жидкости: чем больше площадь, тем большее число молекул получают доступ к поверхности, и испарение идёт быстрее (вот почему при развешивании белья его тщательно расправляют).
Одновременно с испарением наблюдается и обратный процесс: молекулы пара, совершая беспорядочное движение над поверхностью жидкости, частично возвращаются обратно в жидкость. Превращение пара в жидкость называется конденсацией.
Конденсация замедляет испарение жидкости. Так, в сухом воздухе бельё высохнет быстрее, чем во влажном. Быстрее оно высохнет и на ветру: пар сносится ветром, и испарение идёт более интенсивно
В некоторых ситуациях скорость конденсации может оказаться равной скорости испарения. Тогда оба процесса компенсируют друг друга и наступает динамическое равновесие: из плотно закупоренной бутылки жидкость не улетучивается годами, а над поверхностью жидкости в этом случае находится насыщенный пар.
Конденсацию водяного пара в атмосфере мы постоянно наблюдаем в виде облаков, дождей и выпадающей по утрам росы; именно испарение и конденсация обеспечивают круговорот воды в природе, поддерживая жизнь на Земле.
Поскольку испарение — это уход из жидкости самых быстрых молекул, в процессе испарения средняя кинетическая энергия молекул жидкости уменьшается, т.е. жидкость остывает. Вам хорошо знакомо ощущение прохлады и порой даже зябкости (особенно при ветре), когда выходишь из воды: вода, испаряясь по всей поверхности тела, уносит тепло, ветер же ускоряет процесс испарения (nеперь понятно, зачем мы дуем на горячий чай. Кстати сказать, ещё лучше при этом втягивать воздух в себя, поскольку на поверхность чая тогда приходит сухой окружающий воздух, а не влажный воздух из наших лёгких ;-)).
Ту же прохладу можно почувствовать, если провести по руке кусочком ваты, смоченным в летучем растворителе (скажем, в ацетоне или жидкости для снятия лака). В сорокаградусную жару благодаря усиленному испарению влаги через поры нашего тела мы сохраняем свою температуру на уровне нормальной; не будь этого терморегулирующего механизма, в такую жару мы бы попросту погибли.
Наоборот, в процессе конденсации жидкость нагревается: молекулы пара при возвращении в жидкость разгоняются силами притяжения со стороны находящихся поблизости молекул жидкости, в результате чего средняя кинетическая энергия молекул жидкости увеличивается (сравните это явление с выделением энергии при кристаллизации расплава!).
к оглавлению ▴
Кипение
Кипение — это парообразование, происходящее по всему объёму жидкости.
Кипение оказывается возможным потому, что в жидкости всегда растворено какое-то количество воздуха, попавшего туда в результате диффузии. При нагревании жидкости этот воздух расширяется, пузырьки воздуха постепенно увеличиваются в размерах и становятся видимы невооружённым глазом (в кастрюле с водой они осаждают дно и стенки). Внутри воздушных пузырьков находится насыщенный пар, давление которого, как вы помните, быстро растёт с повышением температуры.
Чем крупнее становятся пузырьки, тем большая действует на них архимедова сила, и определённого момента начинается отрыв и всплытие пузырьков. Поднимаясь вверх, пузырьки попадают в менее нагретые слои жидкости; пар в них конденсируется, и пузырьки сжимаются опять. Схлопывание пузырьков вызывает знакомый нам шум, предшествующий закипанию чайника. Наконец, с течением времени вся жидкость равномерно прогревается, пузырьки достигают поверхности и лопаются, выбрасывая наружу воздух и пар — шум сменяется бульканьем, жидкость кипит.
Пузырьки, таким образом, служат «проводниками» пара изнутри жидкости на её поверхность. При кипении наряду с обычным испарением идёт превращение жидкости в пар по всему объёму — испарение внутрь воздушных пузырьков с последующим выводом пара наружу. Вот почему кипящая жидкость улетучивается очень быстро: чайник, из которого вода испарялась бы много дней, выкипит за полчаса.
В отличие от испарения, происходящего при любой температуре, жидкость начинает кипеть только при достижении температуры кипения — именно той температуры, при которой пузырьки воздуха оказываются в состоянии всплыть и добраться до поверхности. При температуре кипения давление насыщенного пара становится равно внешнему давлению на жидкость (в частности, атмосферному давлению). Соответственно, чем больше внешнее давление, тем при более высокой температуре начнётся кипение.
При нормальном атмосферном давлении ( атм или
Па) температура кипения воды равна
. Поэтому давление насыщенного водяного пара при температуре
равно
Па. Этот факт необходимо знать для решения задач — часто он считается известным по умолчанию.
На вершине Эльбруса атмосферное давление равно атм, и вода там закипит при температуре
. А под давлением
атм вода начнёт кипеть только при
.
Температура кипения (при нормальном атмосферном давлении) является строго определённой для данной жидкости величиной (температуры кипения, приводимые в таблицах учебников и справочников — это температуры кипения химически чистых жидкостей. Наличие в жидкости примесей может изменять температуру кипения. Скажем, водопроводная вода содержит растворённый хлор и некоторые соли, поэтому её температура кипения при нормальном атмосферном давлении может несколько отличаться от ). Так, спирт кипит при
, эфир — при
, ртуть — при
. Обратите внимание: чем более летучей является жидкость, тем ниже её температура кипения. В таблице температур кипения мы видим также, что кислород кипит при
. Значит, при обычных температурах кислород — это газ!
Мы знаем, что если чайник снять с огня, то кипение тут же прекратится — процесс кипения требует непрерывного подвода тепла. Вместе с тем, температура воды в чайнике после закипания перестаёт меняться, всё время оставаясь равной . Куда же при этом девается подводимое тепло?
Ситуация аналогична процессу плавления: тепло идёт на увеличение потенциальной энергии молекул. В данном случае — на совершение работы по удалению молекул на такие расстояния, что силы притяжения окажутся неспособными удерживать молекулы неподалёку друг от друга, и жидкость будет переходить в газообразное состояние.
к оглавлению ▴
График кипения
Рассмотрим графическое представление процесса нагревания жидкости — так называемый график кипения (рис. 4).

Рис. 4. График кипения
Участок предшествует началу кипения. На участке
жидкость кипит, её масса уменьшается. В точке
жидкость выкипает полностью.
Чтобы пройти участок , т.е. чтобы жидкость, доведённую до температуры кипения, полностью превратить в пар, к ней нужно подвести некоторое количество теплоты
. Опыт показывает, что данное количество теплоты прямо пропорционально массе жидкости:
Коэффициент пропорциональности называется удельной теплотой парообразования жидкости (при температуре кипения). Удельная теплота парообразования численно равна количеству теплоты, которое нужно подвести к 1 кг жидкости, взятой при температуре кипения, чтобы полностью превратить её в пар.
Так, при удельная теплота парообразования воды равна
кДж/кг. Интересно сравнить её с удельной теплотой плавления льда (
кДж/кг) — удельная теплота парообразования почти в семь раз больше! Это и не удивительно: ведь для плавления льда нужно лишь разрушить упорядоченное расположение молекул воды в узлах кристаллической решётки; при этом расстояния между молекулами остаются примерно теми же. А вот для превращения воды в пар нужно совершить куда большую работу по разрыву всех связей между молекулами и удалению молекул на значительные расстояния друг от друга.
к оглавлению ▴
График конденсации
Процесс конденсации пара и последующего остывания жидкости выглядит на графике симметрично процессу нагревания и кипения. Вот соответствующий график конденсации для случая стоградусного водяного пара, наиболее часто встречающегося в задачах (рис. 5).

Рис. 5. График конденсации
В точке имеем водяной пар при
. На участке
идёт конденсация; внутри этого участка — смесь пара и воды при
. В точке
пара больше нет, имеется лишь вода при
. Участок
— остывание этой воды.
Опыт показывает, что при конденсации пара массы (т. е. при прохождении участка
) выделяется ровно то же самое количество теплоты
, которое было потрачено на превращение в пар жидкости массы
при данной температуре.
Давайте ради интереса сравним следующие количества теплоты:
• , которое выделяется при конденсации
г водяного пара;
• , которое выделяется при остывании получившейся стоградусной воды до температуры, скажем,
.
Имеем:
Дж;
Дж.
Эти числа наглядно показывают, что ожог паром гораздо страшнее ожога кипятком. При попадании на кожу кипятка выделяется «всего лишь» (кипяток остывает). А вот при ожоге паром сначала выделится на порядок большее количество теплоты
(пар конденсируется), образуется стоградусная вода, после чего добавится та же величина
при остывании этой воды.
Благодарим за то, что пользуйтесь нашими материалами.
Информация на странице «Фазовые переходы» подготовлена нашими авторами специально, чтобы помочь вам в освоении предмета и подготовке к ЕГЭ и ОГЭ.
Чтобы успешно сдать необходимые и поступить в высшее учебное заведение или техникум нужно использовать все инструменты: учеба, контрольные, олимпиады, онлайн-лекции, видеоуроки, сборники заданий.
Также вы можете воспользоваться другими статьями из данного раздела.
Публикация обновлена:
08.05.2023
График плавления и отвердевания тела показывает нам
все этапы процесса. Из него мы можем извлечь информацию о температуре плавления
тела, например, о том, как долго это тело потребовалось нагревать, чтобы
достичь той или иной температуры. Для понимания того, как строятся подобные
графики, рассмотрим некоторые примеры.
На рисунке представлен график плавления и отвердевания
железа.
В начальный момент времени, температура была равна
1200 оС, и пока она не достигла 1539 оС, плавление не
началось. Молекулы сохраняли свой порядок, что характерно для твёрдого тела. По
достижении температуры плавления, порядок нарушается, поскольку тело переходит
в жидкое состояние. Его температура какое-то время остаётся постоянной, о чем
свидетельствует горизонтальный участок графика. После того, как железо
полностью расплавилось, температура снова начала увеличиваться. Порядок
полностью нарушился, поскольку этот участок графика соответствует периоду,
когда железо было полностью жидким. Достигнув отметки 1880 оС,
железо перестали нагревать, и температура начала падать. Достигнув температуры
кристаллизации, железо начало твердеть. Это заняло какое-то время, в течение
которого температура вновь не менялась, начал восстанавливаться порядок. После
этого, температура стала ниже температуры отвердевания, и железо вновь стало
полностью твёрдым, а порядок молекул восстановился. Этому соответствует
последний участок графика.
Упаржнения.
1. Построить график
плавления олова. Температура плавления составляет 232 оС, а
начальная температура 200 оС. За 5 мин олово достигнет температуры
плавления, и ещё 5 мин будет плавиться. 2,5 мин занимает нагревание олова от
температуры плавления до 250 оС, и столько же займет охлаждение до
232 оС.
Итак, возьмём 20 оС за одну клетку по
вертикали и 2,5 мин за одну клетку по горизонтали. Тогда первая точка будет
иметь координаты 0 минут и 200 градусов, а вторая — 5 минут и 232 градуса.
Соединим эти две точки. В этой точке начинается плавление длительностью 5
минут. Температура не меняется, поэтому координаты третьей точки будет 10 минут
и 232 градуса. После этого, олово нагревается до 250 градусов за 2,5 минуты,
поэтому координаты четвёртой точки будут 12,5 минут и 250 градусов. Это точка
является пиком графика, поскольку в этот момент олово достигло наивысшей
температуры. Дальше график симметричен, поэтому абсолютно аналогичным способом
достраиваем и вторую часть графика.
Для построения этого графика мы использовали некую
начальную информацию о теле. Значит, из готового графика можно извлечь
информацию.
2. На рисунке представлен график
плавления и отвердевания для какого-то вещества.
И нам надо найти ответы на вопросы:
— Какой самой высокой температуры достигло вещество?
Итак, смотрим на график. Вертикальная ось
соответствует температуре, следовательно, наивысшая температура соответствует
пику графика. Это 1250 оС.
— Какова температура плавления данного вещества?
Температуре плавления соответствуют горизонтальные
участки графика, поскольку температура остаётся неизменной во время плавления
или кристаллизации. На графике видно, что горизонтальные участки соответствуют
температуре 1000 оС, поэтому, это и есть температура плавления.
— Сколько времени заняло плавление, и сколько времени
заняла кристаллизация?
На графике мы видим, что по горизонтальной оси,
соответствующей времени между отметкой 0 и отметкой 40 — две клетки. Длина
горизонтальных отрезков тоже составляет две клетки. Поэтому, и плавление, и
кристаллизация заняли по 40 минут.
— Какова скорость нагревания данного вещества в
твердом состоянии, и какова скорость нагревания в жидком состоянии?
По вертикальной оси расстояние между отметкой 1000 и
отметкой 1250 — одна клетка. Следовательно, расстояние в две клетки
соответствует пятистам градусам. Тогда, в начальный момент времени, температура
составляла 500 градусов. Мы видим на графике, что температура достигла
температуры плавления за 40 минут. Поэтому, скорость нагревания в твердом
состоянии равна 500 оС за 40 минут, т.е. 12,5 оС/мин.
На графике видно, что вещество в жидком состоянии
нагрелось от 1000 оС до 1250 оС. По горизонтальной оси,
длина этого процесса соответствует одной клетке, а, значит, двадцати минутам,
т.к. 40 минут — это две клетки. Значит, скорость нагревания в жидком состоянии
равна 250 оС за 20 минут, т.е. 12,5 оС/мин.
Следует помнить о том, что нагревание вещества в
твердом состоянии на самом деле может происходить не с той же скоростью, что и
нагревание вещества в жидком состоянии. Да и зависимость скорости нагревания
или остывания от температуры может быть нелинейной. Несмотря на это, даже из
такого графика можно извлечь, некоторую информацию.
Данный график предполагает достаточно сложные математические
операции для подробного анализа, с которыми мы познакомимся намного позже.
Однако, у нас достаточно знаний, чтобы ответить на следующие вопросы:
— Какая максимальная температура была достигнута
данным веществом?
Опять же, обращаемся к самой высокой точке. Она
соответствует 450 оС.
Держалась ли в какой-нибудь момент времени постоянная
температура свыше 315 оС?
Постоянной температуре будет соответствовать
горизонтальный участок графика. На данном графике, такой участок только один.
Исходя из того, что отметка 450 оС находится на расстоянии 3 клетки
от нулевой отметки по оси температуры, одна клетка соответствует 150 оС,
а 2 клетки — 300 оС. Мы видим, что наш горизонтальный участок
находится ниже отметки оС градусов, следовательно, температура выше
315 оС не держалась.
— Определите, нагревалось тело или остывало в первые
12 минут?
Одна клетка по горизонтальной оси соответствует 20
минутам. Мы видим, что на промежутке, более длительном, чем 12 минут,
температура увеличивалась с течением времени. Следовательно, тело нагревалось.
Определите среднюю скорость нагревания в период с 40
до 100 минут.
Итак, отмечаем на графике интервал от 40 до 100 минут.
Мы видим, что в этот период температура менялась по какому-то сложному закону.
Однако, мы знаем, что бы ни происходило в этот период, температура возросла от
150 оС до 450 оС за 60 минут. Поэтому, в среднем, тело
нагревалось со скоростью 300 оС в час или 5 оС в минуту.
При построении графиков помните, что очень важно
соблюдать масштабирование, т.е. равные интервалы, относящиеся к одной и той же
величине, обозначать равным количеством клеток.
Wiki-учебник
Поиск по сайту
Реклама от партнёров:
График плавления
Одно и тоже вещество в реальном мире в зависимости от окружающих условий может находиться в различных состояниях. Например, вода может быть в виде жидкости, в идее твердого тела – лед, в виде газа – водяной пар.
- Эти состояния называются агрегатными состояниями вещества.
Молекулы вещества в различных агрегатных состояниях ничем не отличаются друг от друга. Конкретное агрегатное состояние определяется расположением молекул, а так же характером их движения и взаимодействия между собой.
Газ – расстояние между молекулами значительно больше размеров самих молекул. Молекулы в жидкости и в твердом теле расположены достаточно близко друг к другу. В твердых телах еще ближе.
Чтобы изменить агрегатное состояние тела, ему необходимо сообщить некоторую энергию. Например, чтобы перевести воду в пар её надо нагреть.Чтобы пар снова стал водой, он должен отдать энергию.
Переход из твердого состояния в жидкое
Переход вещества из твердого состояние в жидкое называется плавлением. Для того чтобы тело начало плавиться, его необходимо нагреть до определенной температуры. Температура, при которой вещество плавится, называют температурой плавления вещества.
Каждое вещество имеет свою температуру плавления. У каких-то тел она очень низкая, например, у льда. А у каких-то тел температура плавления очень высокая, например, железо. Вообще, плавление кристаллического тела это сложный процесс.
График плавления льда
Ниже на рисунке представлен график плавления кристаллического тела, в данном случае льда.

- График показывает зависимость температуры льда от времени, которое его нагревают. На вертикально оси отложена температура, по горизонтальной – время.
Из графика, что изначально температура льда была -20 градусов. Потом его начали нагревать. Температура начала расти. Участок АВ это участок нагревания льда. С течением времени, температура увеличилась до 0 градусов. Эта температура считается температурой плавления льда. При этой температуре лед начал плавиться, но при этом перестала возрастать его температура, хотя при этом лед также продолжали нагревать. Участку плавления соответствует участок ВС на графике.
Затем, когда весь лед расплавился и превратился в жидкость, температура воды снова стала увеличиваться. Это показано на графике лучом C. То есть делаем вывод, что во время плавления температура тела не изменяется, вся поступающая энергия идет на плвление.
Нужна помощь в учебе?

Предыдущая тема: Агрегатное состояние вещества
Следующая тема: Удельная теплота плавления
| Нравится | Нравится |
Если вещество в твердом состоянии будет получать энергию — оно будет нагреваться. При этом с определенной температуры начинает происходить процесс плавления — тело переходит из твердого состояния в жидкое.
Если же жидкость будет отдавать энергию, то с определенной температуры начнется процесс отвердевания (кристаллизации). Жидкость перейдет в твердое состояние.
Процесс плавления кристаллического тела довольно сложный. Для того чтобы более детально его изучить, мы рассмотрим график зависимости температуры твердого тела от времени его последовательного нагревания и охлаждения.
График плавления льда и отвердевания воды
В качестве кристаллического тела будем рассматривать лёд. График плавления льда и отвердевания воды изображен на рисунке 1. Здесь по горизонтальной оси отложено время, а по вертикальной — температура льда. Для нагревания льда будем использовать обычную горелку.
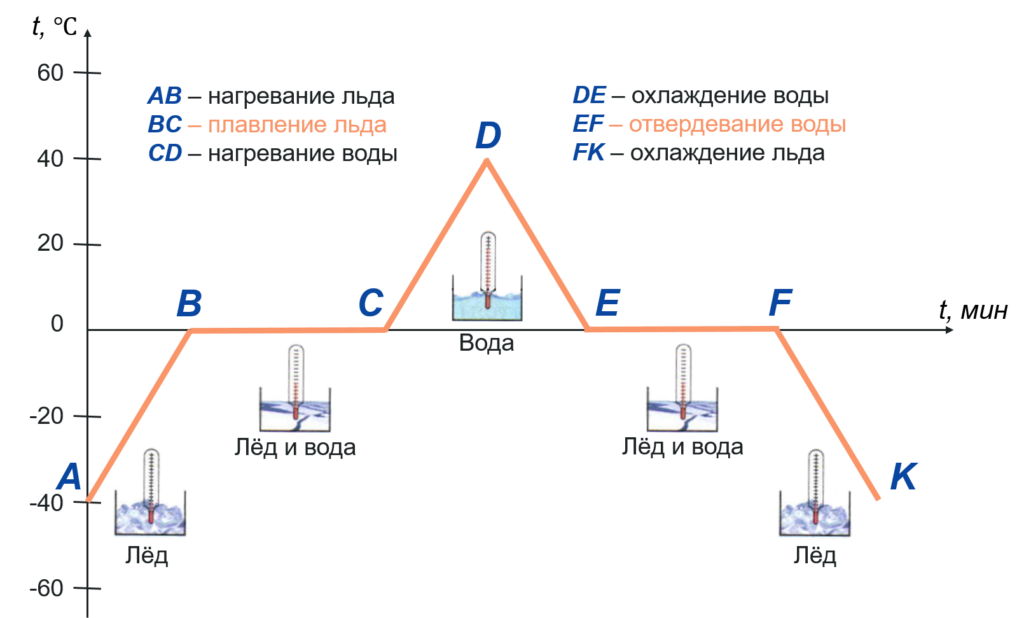
Разберем каждый участок графика.
- Точка A
Это наша начальная точка, начало наблюдения за процессом. Здесь температура льда была равна $-40 degree C$
- Участок AB
Идет нагревание льда, его температура увеличивается с $-40 degree C$ до $0 degree C$
- Точка B
Достигнув температуры $0 degree C$, лед начинает плавится. Это его температура плавления.
- Участок BC
Лед плавится, но его температура в это время не увеличивается. Процессу плавления соответствует именно этот участок графика.
Отметим, что
В течение всего времени плавления температура льда не меняется, хотя мы продолжаем его нагревать
- Точка C
В этот момент весь лед расплавился и превратился в воду
- Участок CD
На это участке графика идет нагревание воды до $+40 degree C$
- Точка D
Вода имеет температуру $+40 degree C$. В этот момент мы выключаем горелку
- Участок DE
Температура воды снижается, она охлаждается
- Точка E
Температуры воды достигает $0 degree C$. Начинается ее отвердевание (кристаллизация)
- Участок EF
На этом участке графика идет процесс отвердевания (кристаллизации) воды.
Пока вся вода не затвердеет, ее температура не изменится
- Точка F
В этот момент вся вода превратится в лёд
- Участок FK
Температура льда понижается
Графики плавления олова и свинца
На графиках часто указывают какой-то один процесс (либо отвердевание, либо плавление), но для нескольких веществ. Это делается для наглядного сравнениях их свойств.
Подобный график представлен на рисунке 2.
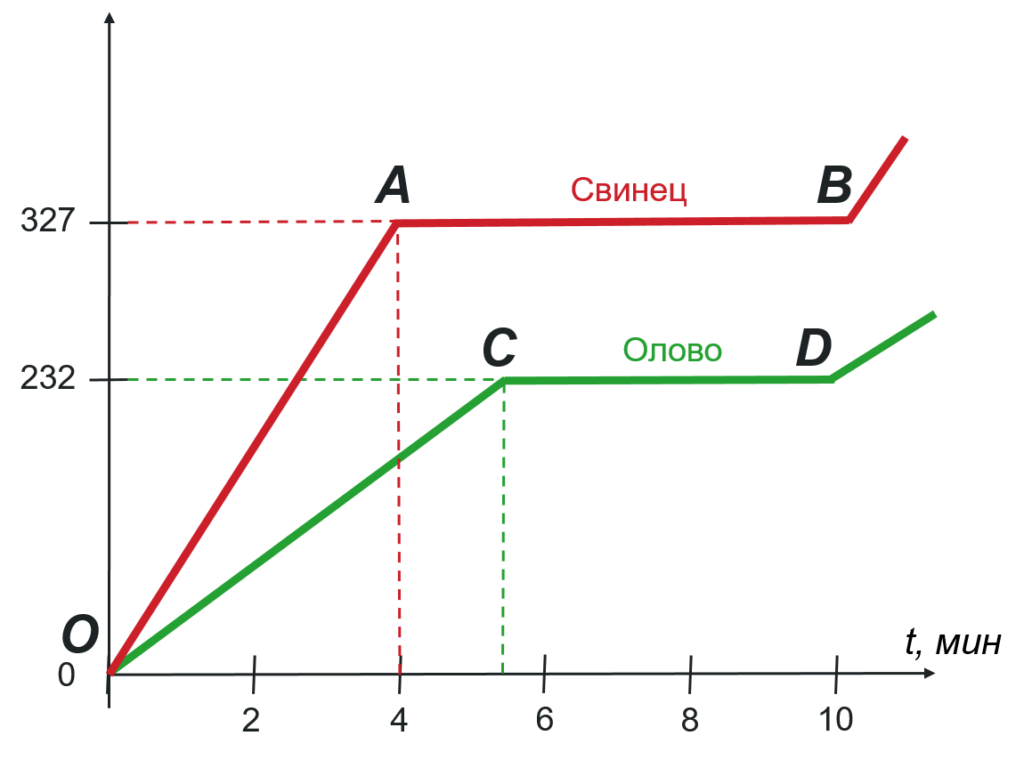
Процесс плавления олова соответствует участку CD, а процесс плавления свинца — участку AB.
Участок AB находится выше участка CD. Это означает, что свинец имеет большую температуру плавления, чем олово. На графике отмечены эти температуры. Для свинца это $327 degree C$, а для олова $232 degree C$.
Также мы можем судить о времени процесса плавления. Участок AB имеет большую длину, чем участок CD. Значит, свинец плавился большее время, чем олово. При этом, свинец начал плавиться раньше.
Переход
тела из кристаллического состояния в
жидкое называют плавлением.
Обратный процесс – кристаллизацией.
Если твердое тело нагревать, то его
внутренняя
энергия, складывающаяся из кинетической
энергии тепловых колебаний частиц
в узлах кристаллической решетки и
потенциальной энергии взаимодействия
этих частиц, возрастает.
При температуре плавления амплитуда
колебаний частиц увеличивается
настолько, что кристаллическая решетка
начинает разрушаться, т.е. происходит
плавление тела.
Температура Tпл
остается постоянной до тех
пор, пока весь кристалл не расплавится,
и только тогда температура жидкости
вновь начнет повышаться. Количество
теплоты, необходимое
для расплавления 1 кг вещества, называется
удельной
теплотой плавления.
Примерное изменение температуры со
временем приведен
на рис.1.
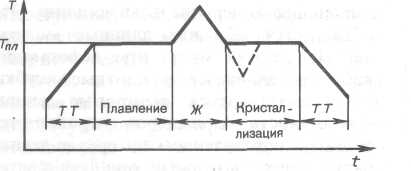
Рис.1.
Если
получившуюся жидкость охлаждать, то
процесс протекает
в обратном направлении (рис.
1): сначала температура жидкости
понижается,
затем при постоянной температуре,
равной Tпл,
начинается кристаллизация,
после ее завершения температура кристалла
начинает понижаться. При кристаллизации
происходит выделение теплоты фазового
перехода. Для кристаллизации
вещества необходимо наличие
так называемых центров
кристаллизации
— кристаллических зародышей, которыми
могут быть не только кристаллики
образующегося вещества, но и примеси,
а также пыль, сажа и т. д. Отсутствие
центров кристаллизации в чистой жидкости
затрудняет образование микроскопических
кристалликов, и вещество, оставаясь
в жидком состоянии, охлаждается
до температуры, меньшей температуры
кристаллизации, при этом образуется
переохлажденная жидкость (на рис.
1 соответствует пунктирная кривая).
При сильном переохлаждении начинается
спонтанное образование центров
кристаллизации и вещество кристаллизуется
довольно быстро.
Обычно
переохлаждение расплава происходит
на величину от долей до десятков градусов,
но для ряда веществ может достигать
сотен градусов. Ввиду большой вязкости
сильно переохлажденные жидкости теряют
текучесть, сохраняя, как и твердые
тела, свою форму. Эти тела получили
название аморфных
твердых тел; к ним
относятся смолы, воск, сургуч, стекло.
Аморфные тела, являясь переохлажденными
жидкостями, изотропны,
т. е. их свойства во всех направлениях
одинаковы; для них, как и для
жидкостей, характерен ближний
порядок
в расположении
частиц; в них в отличие
от жидкостей подвижность частиц довольно
мала. Особенностью
аморфных тел
является отсутствие у них определенной
точки плавления,
т. е. невозможно указать
определенную температуру, выше которой
можно было бы констатировать жидкое
состояние, а ниже — твердое. Из опыта
известно, что в аморфных телах со временем
может наблюдаться процесс кристаллизации,
например в стекле появляются
кристаллики; оно, теряя прозрачность,
начинает мутнеть и превращаться в
поликристаллическое тело.
Необходимо
отметить, что существует также переход
вещества из кристаллической фазы в
газообразную, минуя жидкую фазу, который
называется сублимацией
или возгонкой.
Одно
и то же вещество в зависимости
от соотношения между средней кинетической
и средней потенциальной энергиями
частиц вещества может находиться
в одном из трех агрегатных состояний:
твердом, жидком или газообразном.
Это соотношение, в свою очередь,
определяется внешними условиями —
температурой и давлением. Следовательно,
фазовые превращения также определяются
изменениями температуры и давления.
Для
геометрического изображения фазовых
превращений используется диаграмма
состояния
(рис. 2), на которой в координатах
P,
Т задается зависимость между
температурой фазового перехода и
давлением в виде кривых испарения (КИ),
плавления (КП) и сублимации (КС),
разделяющих поле диаграммы на три
области, соответствующие условиям
существования твердой (ТТ), жидкой (Ж) и
газообразной (Г) фаз. Кривые на диаграмме
называются кривыми
фазового равновесия,
каждая точка на них соответствует
условиям равновесия двух сосуществующих
фаз: КП — твердого тела и жидкости,
КИ — жидкости и газа, КС -твердого
тела и газа.

Рис.2.
Точка,
в которой пересекаются эти кривые
и которая, следовательно, определяет
условия (температуру Ттр
и соответствующее
ей равновесное давление Pтр)
одновременного равновесного сосуществования
трех фаз вещества, называется
тройной
точкой.
Каждое вещество имеет
только одну тройную точку. Тройная
точка воды характеризуется температурой
0,01°С при давлении 4,58 мм. рт. ст.
Диаграмма
состояния, строящаяся на основе
экспериментальных данных, позволяет
судить, в каком состоянии находится
данное вещество при определенных P
и Т, а также какие фазовые переходы будут
происходить при том или ином процессе.
Например, при условиях, соответствующих
точке 1 (рис.
3), вещество находится
в твердом состоянии, точке 2 — в
газообразном, а точке 3
—
одновременно
в жидком и газообразном состояниях.
Допустим, что вещество в твердом
состоянии, соответствующем точке 4,
подвергается изобарному нагреванию,
изображенному
на диаграмме состояния горизонтальной
пунктирной прямой 4-5-6. Из
рисунка видно, что при температуре,
соответствующей точке 5, вещество
плавится, при более высокой температуре,
соответствующей
точке 6, — начинает превращаться
в газ. Если же вещество находится
в твердом состоянии, соответствующем
точке 7, то при изобарном нагревании
(пунктирная прямая 7-8)
кристалл
превращается в газ, минуя жидкую фазу.
Если вещество находится в состоянии,
соответствующем точке 9, то при
изотермическом сжатии (пунктирная
прямая
9-10)
оно
пройдет следующие три состояния:
газ — жидкость — кристаллическое
состояние.
На
диаграмме состояний (см. рис. 2 и
3) видно, что кривая испарения заканчивается
в критической точке К.
Благодаря
этому возможен непрерывный
переход
вещества из жидкого состояния в
газообразное
и обратно в обход критической
точки, без пересечения кривой испарения
(переход 11-12
на
рис. 3), т. е. такой
переход, который не сопровождается
фазовыми превращениями, так как оба
сосьояния являются изотропными. Переход
же кристаллического
состояния (характеризуется
анизотропией) в жидкое или газообразное
может быть только скачкообразным
(посредством фазового перехода), поэтому
кривые плавления и сублимации не могут
обрываться, как это имеет место для
кривой испарения в критической точке.
Кривая
плавления уходит в бесконечность, а
кривая сублимации идет в точку, где P
=
0 и Т
=
0.
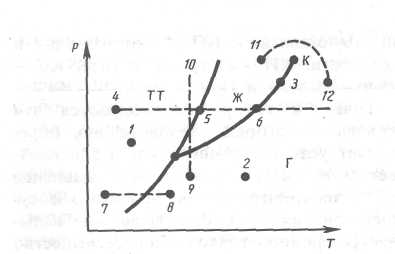
Рис.3.
Изменение
температуры
фазового перехода dT
при
изменении давления dP
описывается уравнением
Клапейрона
— Клаузиуса
![]()
где
— теплота фазового перехода (например,
теплота испарения, теплота плавления),
V2‘—V1‘
—
изменение удельного
объема вещества
(объема, приходящегося на
единицу массы)
при переходе его из первой фазы во
вторую, Т — температура перехода.
Поскольку
и Т
положительны, при dP>0
знак dT
определяется знаком V2‘—V1‘.
При
испарении жидкостей
и сублимации твердых
тел объем вещества всегда возрастает,
поэтому dT/dP>
0; следовательно, при этих процессах
повышение внешнего давления
приводит к увеличению температуры
и наоборот. При плавлении большинства
веществ объем, как правило, возрастает,
т.е. dT/dP>0,
следовательно, увеличение давления
приводит к повышению
температуры плавления (сплошная линия
КП
на рис. 2). Для некоторых же веществ
(Н2О,
чугун и др.) объем жидкой
фазы меньше объема твердой фазы,
т.е. dT/dP<0;
следовательно, увеличение
давления сопровождается понижением
температуры плавления (пунктирная линия
на рис. 2).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
