Если воспользоваться записью стехиометрического уравнения реакции в виде (11.2), то произведение реакции может быть записано в виде [c.176]
Из сказанного следует, что константа равновесия есть произведение реакции в условиях химического равновесия. Если же произведение не равно константе равновесия, то в системе начнется химическое превращение, направленное в сторону достижения химического [c.175]
Что касается гетерогенных реакций, то для них будет показано, что понятие произведения реакции и константы равновесия сохраняет смысл, если хотя бы один из компонентов реакции находится в фазе переменного состава. При этом для величин П и /С сохраняются выражения (11.26) и (11.25), но в них вводятся только концентрации компонентов реакции, находящихся в фазе переменного состава.-При этом принято для газов в качестве меры их концентрации использовать парциальные давления. С учетом сказанного для реакции Zn + 2Н = = Zn – – Н2 произведение реакции запишется в виде [c.177]
Если за время порядка времени релаксации в остальных стадиях относительные изменения концентрации всех компонентов — как участвующих, так и не участвующих в быстро устанавливающемся равновесии, незначительны, то произведение реакции для рассматриваемой обратимой стадии на протяжении основной части процесса будет практически равно константе равновесия. Это дает дополнительную (помимо условий материального баланса) алгебраическую связь между концентрациями компонентов, а тем самым и между скоростями по отдельным компонентам. Следовательно, уменьшается и число дифференциальных уравнений, необходимых для описания кинетики сложного процесса. В общем случае схема может содержать несколько обратимых стадий с быстро устанавливающимся равновесием, и число дифференциальных уравнений,описывающих кинетику процесса, уменьшается на число таких стадий. [c.280]
Из этого выражения следует, что процесс будет протекать в направлении образования продуктов реакции, т. е. с О, если произведение реакции меньше константы равновесия. Когда произведение реакции больше константы равновесия, то пойдет процесс с О, т. е. в сторону превращения продуктов в исходные вещества. [c.218]
Если реакция протекает в растворе, свойства которого заметно отклоняются от идеальных растворов, то в выражении для произведения реакции и константы равновесия следует заменить концентрации растворенных веществ и мольную долю растворителя на их активности. [c.218]
II — произведение реакции р — плотность жидкости Ф — экстенсивное свойство раствора [c.321]
Из сказанного следует, что константа равновесия есть произведение реакции в условиях химического равновесия. Если же произведение не равно константе равновесия, то в системе начнется химическое превращение, направленное в сторону достижения химического равновесия. Действительно, из (11,21) и (11,22) следует, что [c.201]
Заметим, что для реакции между компонентами идеального раствора, когда все Д можно заменить на концентрации, выражение для П полностью совпадает с выражением (11.26) для произведения реакции. В обшем случае концентрации компонентов раствора [в [c.250]
В соответствии с общими положениями теории химического равновесия, если произведение реакции (15.26) больше произведения растворимости, то происходит осаждение соли (или гидроксида), если же оно меньше произведения растворимости, то осадок соли или гидроксида растворяется до тех пор, пока произведение реакции (15.26) не станет равным К , при условии, что твердая фаза присутствует в достаточном для этого количестве. Учитывая, что [Ме +]=х1 и с помощью уравнения (15.27) нетрудно [c.287]
Если По(значение произведения реакции при = О, и, тем самым, при X = 0) меньше К, то с1х/с11 положительно и X монотонно растет, пока не достигнет значения х, при котором наступит равновесие и дальнейшее изменение х прекратится. При этом (1х/(И падает, т. е. с1 х/ё0 отрицательно. Поэтому кинетическая кривая для изменения по ходу реакции есть монотонно возрастающая кривая, обращенная выпуклостью вверх. [c.188]
Название ферментов производится прибавлением слога аза к названию произведенных реакций или их субстрата. Исключением являются исторические названия некоторых ферментов, как, например, эмульсин, зимаза, пенсии и т.д. [c.804]
Решение. В этой реакции на I мил1. азА50 выделяется 1 моль газообразного АвН ,. Газ оттесняет окружающую атмосферу и производит работу, равную рД1 . Рассматривая этот газ как идеальный и пренебрегая объемом исходных веществ, можно р / приравнять рУ, а рУ. = пЦТ Если прореагировал 1 моль Ыа АзОз, то работа, произведенная реакцией, =–nRT — моль-8,31 Дж/(моль-К)-298 К= – =2496,4 Дж = 2,5 кДж. Если реакцию проводят в плотно закрытой колбе, то 11 = О, так как объем не может увеличиваться. Работа производится только в том случае, когда изменяется объем системы. [c.21]
Величина рсо, представляет собой равновесное давление диоксида углерода над карбонатом кальция. Если давление СОа выше равное веского давления, то произведение реакции ниже константы равновесия и отсюда, совершенно так же, как это следовало для гомогенных реакций, процесс будет идти в сторону возрастания произведения, реакции, т. е. в сторону уменьшения парциального давления СОа-Это значит что СОа будет поглощаться оксидом кальция. Наоборот, если равновесное давление окажется выше, чем реальное давление СО а (в случае этой реакции равновесное давление растет с ростом температуры, т. е. такого положения можно достигнуть при достаточно высокой температуре), произведение реакции окажется меньше, чем константа равновесия, и процесс пойдет в направлении уменьшения произведения реакции, т. е. в сторону увеличения парциального давления СОа, т. е. начнется разложение. СаСОз ДО СаО и Oj. [c.177]
Заметим, что для реакции между компонентами идеального раствора, когда все йг можно заменить на концентрации, выражение для П полностью совпадает с уравнением (11.26) для произведения реакции. В общем случае концентрации компонентов раствЬра [в (14.14)1 заменены на активности, компоненты газовой смеси характеризуются их парциальными давлениями, а компоненты, образующие отдельные фазы (чистые вещества), в выражении для Пне представлены, так как их активности равны единице. В дальнейшем под произведением реакции будет пониматься величина, определяемая по (14.14). [c.217]
В соответствии с общими положен ями теории химического равновесия, если произведенйе реакции (15.26) будет больше произведения растворимости, то будет происходить осаждение соли (или гидроксида), если же оно меньше произведения растворимости, то осадок соли или гидроксида будет растворяться. [c.249]
Несмотря на многочисленность произведенных реакций, Пин-неру и его сотрудникам не удалось получить чистых препаратов. Большей частью достаточно растворимые только в содержащих гидроксил растворителях галоидгидраты иминоэфиров, как правило, разлагаются ими и потому с трудом подвергаются перекристаллизации. Соли формиминоэфиров, получаемые из простейшего нитрила — синильной кислоты, не были получены до последнего времени в чистом виде, почему Неф- з даже оспаривает их существование. [c.539]
Здесь П — так называемое произведение реакции, равное отношению произведения концентраций (активностей) всех продуктов реакции в степенях, равных стехиометрическим коэффициентам эти.х продуктов в уравнении процесса, к такому же произведению для исходных веществ. Например, для реакции гидролиза АТФ (ррр—Ado) до АДФ (РР-Ado) и ортофосфата в разбавленном водном растворе, принимая активность воды рав1юй единице, можно записать [c.339]
Если количество соответствующего иона значительно превышает открываемый минимум, продукт реакцнн (напри.мер, осадок) выделяется быстро. По мере у.ченьшения количества иона скорость образования продукта реакции постепенно уменьшается, и при количествах, близких к открываемому минимуму, реакция может давать как положительный, так и отрицательный результат. Мы попадаем в область ненадежной реакции . При дальнейшем уменьшении количества открываемого иона количество случаев, когда реакция дает отрицательный результат, все возрастает и, наконец, она вовсе перестает удаваться. Открываемым минимумом принято считать такое количество соответствующего иона, при котором половина из общего числа произведенных реакций сопровождается положительны.м результатом. [c.18]
Ответы Mail.ru
Наука, Техника, Языки
Гуманитарные науки
Естественные науки
Лингвистика
Техника
Вопросы – лидеры.
Французский язык упражнение помогите на тему le subjonctif dans le sobordonees circonstancielles
1 ставка
Какие вам известны прозвища,производные от слов"тапок/тапочек" ?
1 ставка
Посоветуйте идиш-русский русско-идиш онлайн-переводчик в советской орфографии идиша?
1 ставка
Учебник по испанскому
1 ставка
Какая страна была более развита в в 30-е годы СССР или США?
1 ставка
Лидеры категории
Лена-пена
Искусственный Интеллект
М.И.
Искусственный Интеллект
Y.Nine
Искусственный Интеллект
•••
По какой формуле можно найти произведение реакции (П) ?
_ _
Знаток
(383),
закрыт
10 лет назад
Лучший ответ
student_himik
Мыслитель
(8233)
10 лет назад
Чо? ) Может, произведение растворимости? Или порядок реакции
Остальные ответы
Похожие вопросы
Абсолютно
нерастворимых веществ нет. Твердые
вещества отличаются своей растворимостью.
Очевидно, что труднорастворимый
электролит легко образует насыщенный
раствор. Рассмотрим равновесия,
наблюдаемые в насыщенном растворе
какого-нибудь труднорастворимого
вещества, например, CaSO4.
В этой системе осадок находится в
равновесии с насыщенным раствором этого
вещества:
СaSO4Ca2+
+ SO42–
осадок раствор
Константа равновесия
для процесса растворения осадка имеет
следующий вид:
откуда
K∙[CaSO4]тв
= [Ca2+]∙[SO42-].
Концентрация
твердого вещества есть величина
постоянная:
[CaSO4]тв
= const.
Учитывая это,
K∙[CaSO4]тв
как произведение двух постоянных величин
также можно считать величиной постоянной,
некоторой константой, характерной для
данного вещества. Эту константу называют
произведением растворимости. Её
обозначают через ПР:
.
Для насыщенного
раствора сульфата кальция произведение
растворимости при 25оС
найдено равным 3,72∙10-5
г-ион2/л2.
Таким образом, ПР
– это произведение концентраций ионов
малорастворимого сильного электролита,
содержащихся в свободном виде в его
насыщенном растворе. Величина
ПР означает, что в
насыщенном растворе труднорастворимого
электролита произведение концентраций
его ионов есть величина постоянная (при
данной температуре).
Произведение
растворимости характеризует растворимость
электролитов. Растворимость численно
равна
(для бинарных электролитов).
В
общем случае для труднорастворимого
электролита состава AnBm
в растворе наблюдается равновесие:
AnBm
= nAa+
+ mBb–.
Тогда
ПР = [Aa+]n
[Вb–]m
Сравнивая значения
произведений растворимости труднорастворимых
солей, можно видеть, какая из них
растворяется лучше (приложение, табл.
3).
Из
величины ПР вытекает условие образования
и растворения осадка:
1.
Если [Aa+]n
[Вb–]m
= ПР, то осадок находится в равновесии
с раствором.
2.
Если [Aa+]n
[Вb–]m
> ПР, то осадок выпадает.
3. Если [Aa+]n
[Вb–]m
< ПР, то осадок растворяется.
Таким образом,
если при той или иной химической реакции
произведение концентраций участвующих
в ней ионов станет больше произведения
растворимости, то выпадает осадок
труднорастворимого вещества. И обратно,
если произведение концентраций ионов
данного электролита в насыщенном его
растворе в результате той или иной
реакции становится меньше произведения
растворимости для ионов этого электролита,
то осадок переходит в раствор.
8. Ионное произведение воды и водородный показатель
Измерение
электропроводности химически чистой
воды показало, что она обладает
незначительной электропроводностью,
т.е. в очень малой степени находится в
диссоциированном состоянии (слабый
электролит).
H2OH++OH
–
К её диссоциации
можно применять закон действующих масс
.
Константу диссоциации
можно вычислить по данным электропроводности.
При 22оС
она равна 1,8∙10-16,
а степень диссоциации 2,9∙10-9,
т.е. из 555000000 молекул воды диссоциирует
только одна. При такой ничтожно малой
диссоциации концентрацию недиссоциированных
молекул воды H2O
можно полагать равной концентрации
общего количества воды, считать величиной
постоянной и включить в константу
диссоциации
т.е. произведение
концентраций ионов водорода и гидроксильной
группы в любом водном растворе есть
величина постоянная (при данной
температуре) и называется ионным
произведением воды.
Можно вычислить
Концентрация как
недиссоциированных, так и исходных
молекул воды
моль/литр. Подставив эту величину в
выражение для ионного произведения
воды, получим
Как было
отмечено, степень диссоциации воды
повышается с повышением температуры.
Поэтому с повышением температуры
увеличивается концентрация [H+]
и [OH–]
ионов и величина ионного произведения;
так, при 100 оС
[H+][OH–]
= 59∙10-14
, при 0 оС
[H+][OH–]
= 0,139∙10-14.
В воде и в любом
водном растворе содержатся [H+]-
и [ОН–]-ионы,
их относительной концентрацией
определяется реакция среды – кислая,
щелочная или нейтральная.
В нейтральных
растворах и в чистой воде (при 22оС)
.
Эта величина
концентрации водородных ионов
соответствует нейтральной реакции
среды.
В кислых растворах
равновесие Н2ОH+
+ OH–
смещено влево, в сторону моляризации
избытка одноименных Н+-ионов,
но ионное произведение воды – величина
при данной температуре постоянная, в
любой среде (кислой, щелочной, нейтральной)
также сохраняется его значение
.
Но при этом [H+]>[OH–].
Величина концентрации Н+-ионов
обусловливает кислую реакцию среды
[H+]>10-7
г-ион/л.
В щелочных растворах
равновесие диссоциации воды также
смещено влево от избытка одноименных
ОН–-ионов;
величина ионного произведения воды
также сохраняется, причем [H+]<[OH–];
причиной щелочной реакции среды может
быть концентрация ОН–-ионов
(>10-7)
или также концентрация Н+-ионов
(<10-7)
согласно
.
Таким образом, концентрация Н+-ионов
может быть использована для характеристики
любой реакции среды. Характеристика
реакции среды обычно выражается очень
малыми величинами с отрицательными
показателями степени. Для большего
удобства принято пользоваться
отрицательным значением логарифма
величины [H+],
который назван водородным показателем,
обозначается рН:
рН = –lg
[H+]
[H+]
= 10–pH
Если реакция среды
нейтральная, то [H+]=10–7,
а рН=7.
Если реакция
кислая, то [H+]>10–7,
а рН<7.
Если среда щелочная,
то [H+]<10–7,
а рН>7.
Ввиду большого
практического значения величины рН
среды разработано много методов его
непосредственного определения. В
настоящее время применяют колориметрический
метод (по окрашиванию), основанный на
изменении окраски индикаторов, а также
электрометрические методы с помощью
специальных приборов рН-метров.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Тренажер предлагает учащимся почувствовать себя в роли одного из стажеров «Лаборатории искусственного интеллекта». Задания тренажера объединены общей идеей – обучение Робота основным функциям работы с музыкой. Функционал подобран таким образом, чтобы в результате прохождения урока учащийся получил представление об основных функциях работы музыкальных приложений (согласно своим возрастным особенностям и уровню знаний).
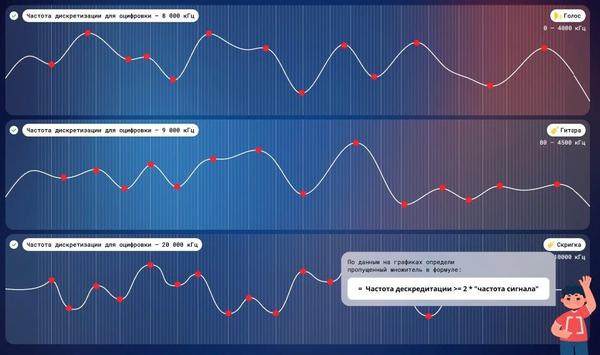
Задание 1. «Оцифровка звуковой волны»
Учащиеся знакомятся с основными принципами оцифровки звуковой волны с использованием общепринятой терминологии и теории, в достаточном для общего понимания темы объеме:
Версия задания для 5–11 классов.
Обратите внимание, что двоичный код является симуляцией и представляет из себя последовательность десятичных чисел графика, переведенных в двоичную систему счисления из условия, что каждое число кодируется одним байтом.
Учащимся 9–11 классов в процессе определения частоты дискретизации необходимо выявить ее зависимость от частоты звука:
Особенность задания 9–11 классов.
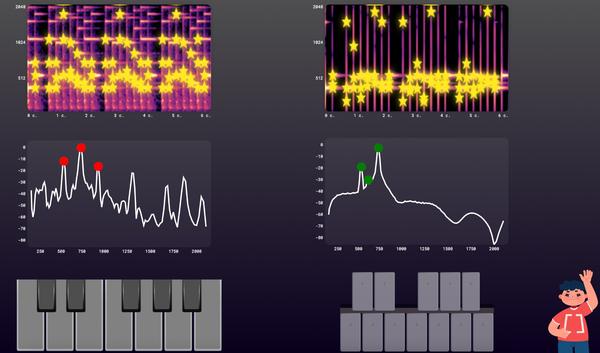
Задание 2. «Распознавание мелодии по спектрограмме»
В тренажере учащиеся знакомятся с понятием спектрограммы, как с графическим представлением музыкального произведения в памяти компьютера. Учащимся необходимо проиграть одну и ту же мелодию на двух музыкальных инструментах и убедиться в том, что спектрограммы выглядят по-разному.
Однако, после выделения самых ярких точек спектрограмм учащиеся убеждаются, что карты получившихся точек для одной и той же мелодии очень похожи.
Сравнив карту точек проигранной мелодии с картами точек музыкальных произведений базы данных, учащийся получает информацию о найденной мелодии.
Механики тренажеров для 1-4 и 5-11 классов повторяются. Разница в сложности тренажеров обусловлена сложностью мелодий и карт их точек.
Версия задания для 9-11 классов
Учащиеся 9-11 классов, кроме спектрограмм музыкальных произведений, познакомятся также с диаграммами частот каждой ноты, которая была проиграна в мелодии. Также, при желании, учащиеся могут ознакомиться с видео, в котором более подробно рассмотрен процесс составления спектрограмм.
Данное задание предполагает вариативность: учащимся класса задания выдаются случайным образом из некоторого набора однотипных заданий.
Задание 3. «Алгоритм рекомендаций»
Для настройки рекомендательной системы, учащимся представлены списки профилей некоторых пользователей с указанием в них музыкальных предпочтений. Задание выполняется в два этапа:
1) необходимо определить профили, схожие по музыкальным интересам;
2) проанализировать, кому можно рекомендовать предложенную мелодию.
Особенности заданий: учащиеся получают задание в комбинированном (таблично-графическом) виде. В таблице по вертикали представлены профили пользователей, а по горизонтали – исполнители. На пересечении – отношение пользователя к творчеству исполнителя согласно легенде.
Для выполнения задания требуется:
1) заменить графическое отображение реакции на числовое согласно легенде;
2) найти произведение реакции Толи и текущего профиля на каждого исполнителя;
3) найти сумму полученных чисел по каждому пользователю, чтобы узнать рейтинг соответствия профиля профилю Толи;
4) по наибольшему рейтингу определить наиболее схожий профиль с профилем Толи;
5) проанализировать по реакции владельца схожего профиля возможность рекомендации песни Толе («Да» или «Нет»).
Версия задания для 9-11 классов
Учащимся 5-11 классов будет предложено по два задания с незначительным повышением сложности. Вариативность выдачи заданий обеспечивается случайным выбором из некоторого банка заданий.
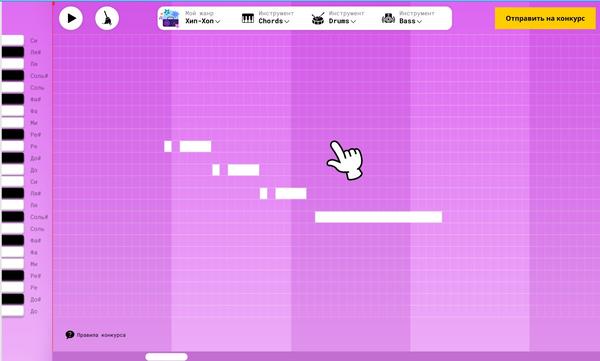
Конкурсное задание «Генерация музыки»
По своему желанию, учащиеся 5-11 классов могут принять участие в конкурсном задании, организованном компанией Яндекс. Это возможность получить ценные призы и приглашение на онлайн-встречу со «звездой».
Задание опирается на принцип генерации музыки через составление знаковых последовательностей, однако был трансформирован под максимально широкую публику ввиду низкой популярности музыкального образования среди школьников.
Задание сформировано в виде пианоролла:
Пианоролл – это таблица зависимости звучащих нот от времени:
- по вертикали – ноты, которыми можно использовать в произведении (каждая строка соответствует определенной ноте);
- по горизонтали – время, которое будут проигрываться отмеченные ноты. По сути, это измерение можно считать очередностью проигрывания.
Несмотря на то, что возможности пианоролла многократно ниже нотного стана, он позволяет не только максимально визуализировать закономерности в музыкальных произведениях, но и дать возможность испытать себя в области генерации музыки вне зависимости от наличия специальной музыкальной подготовки. Включение и выключение ноты производится кликом левой кнопки мыши по соответствующей ячейке таблицы.
Учащемуся предоставляется на выбор три музыкальных жанра. В результате выбора учащемуся открывается пианоролл, на котором нанесено начало мелодии в выбранном жанре. Ребенку необходимо:
1) выявить закономерности в данной мелодии (например, последовательности нот);
2) продолжить мелодию с учетом выявленных закономерностей в пределах доступных тактов;
3) наложить звуковые эффекты на получившеюся мелодию.
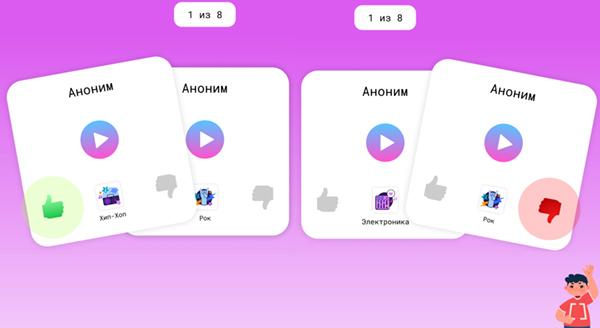
После отправки конкурсного задания учащемуся предлагается оценить 8 мелодий, сочиненных другими участниками конкурса. Подбор мелодий на голосование обеспечивает равные возможности для получения голосов за каждую конкурсную работу.
Возможно два типа оценки: «лайк» (нравится) = «1 балл», «дизлайк» (не нравится) = «-1 балл». Победитель определяется суммой всех набранных оценок за всё время проведения конкурса.
Результаты подводятся в общем зачёте, без учета возрастных особенностей учащихся.
После подведения итогов конкурса, на электронные адреса победителей (30 работ с максимальным суммарным оценочным баллом) будут высланы письма с дальнейшими указаниями.
В виду строгой необходимости наличия достаточного для творчества времени и возможности прослушивания мелодии в процессе сочинения, рекомендуется принять участие в конкурсе в домашних условиях, а также в указании актуальной электронной почты, так как она является единственным способом коммуникации с победителями конкурса.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
В насыщенных водных растворах малорастворимых соединений устанавливается равновесие:
PbCl2(кристалл.) ↔Pb2+(насыщ.р-р) + 2 Cl–(насыщ.р-р)
которое описывается константой равновесия, называемой произведением растворимости (ПР). Величина ПР равна:
ПР = [Pb2+] [Cl–]2
Понятие ПР используется только при описании гетерогенных равновесий в насыщенных растворах малорастворимых сильных электролитов и их твердых фаз. Растворимость вещества равна его концентрации в насыщенном растворе. Насыщенный раствор находится в равновесии с кристаллической фазой.
ПР связано с изменением энергии Гиббса процесса уравнением:
ΔGоT = – RT lnПР (1)
которое используется для расчетов ПР по термодинамическим данным.
Чем меньше величина ПР, тем в меньшей степени осуществляется переход вещества в раствор. Так, PbCl2 более растворим, чем PbI2 (при 25оС ПР(PbCl2) = 1,6·10–5, ПР(PbI2) = 8,2× 10–9), поэтому количественно осаждать ионы Pb2+ лучше в виде йодида, а не хлорида свинца.
Из определенной опытным путем растворимости соединения можно рассчитать ПР и, наоборот, зная ПР соединения, можно рассчитать его растворимость в воде.
Рассмотрим растворение малорастворимого электролита КnАm. В насыщенном растворе этого электролита имеет место равновесие:
КnАm (к) + aq ↔ n Кm+(насыщ.р-р) + m An-(насыщ.р-р)
Произведение растворимости КnАm запишется в виде:
ПР = [Кm+]n [An-]m (2)
Если обозначить растворимость электролита буквой Р, то концентрации катионов и анионов в насыщенном растворе составят:
[Кm+] = nP; [An-] = mP
В результате для величины ПР получаем
ПР = [nP]n [mP]m = nn mm Pn+m (3)
Растворимость симметричных электролитов (содержащих равнозарядные ионы, например, AgCl, BaSO4, AlPO4) рассчитывается как корень квадратный из ПР.
Добавление в раствор малорастворимого электролита, например, AgCl, веществ, содержащих одноименные ионы, в частности, BaCl2 или AgNO3, приводит к уменьшению растворимости этого электролита.
Примеры решения задач
Задача 1. Рассчитайте произведение растворимости карбоната бария, если известно, что при 298 К в 100 мл его насыщенного раствора содержится 1,38× 10-3 г BaCO3.
Решение. М(BaCO3) = 197 г/моль. Растворимость Р карбоната бария равна:
Р(BaCO3) = 7·10–5 моль/л.
В насыщенном растворе карбоната бария:
ВаСО3(к) + aq ↔ Ba2+(насыщ.р-р) + СO32–(насыщ.р-р)
концентрации ионов бария и карбонат-ионов равны. Следовательно,
[Ba2+] = [СO32-] = 7× 10–5 моль/л
Таким образом, растворимость Р карбоната бария равна 7·10–5 моль/л. Величина ПР составит:
ПР = [Ba2+][СO32–] = Р× Р = (7× 10–5)2 = 4,9× 10–9.
Задача 2. Вычислите растворимость PbCl2 в воде (моль/л и г/л), если произведение растворимости при 298 К для этой соли равно 1,6·10–5.
Решение.
PbCl2(к) + aq ↔ Pb2+(насыщ.р-р) + 2 Cl—(насыщ.р-р)
Пусть Р (моль/л) — растворимость PbCl2. Тогда концентрации ионов соли в растворе составят:
[Pb2+] = Р; [Cl–] = 2[Pb2+] = 2P.
ПР(PbCl2) = [Pb2+][ Cl—]2 = Р(2Р)2 = 1,6× 10-5.
Р(PbCl2) = 278× 1,6× 10–2 = 4,413 г/л, где 278 — М(PbCl2) (г/моль)
В этой задаче следует обратить внимание на то, что в квадрат возводится удвоенное значение растворимости: (2Р)2, т.е. растворимость умножается на стехиометрический коэффициент, и полученная величина возводится в степень, равную стехиометрическому коэффициенту.
Задача 3. Вычислите растворимость (моль/л) PbCl2 в 0,1 М растворе KCl, если ПР (PbCl2) = 1,6× 10–5 при 298 К.
Решение. Суммарная концентрация хлорид-ионов составляет
[Cl–] = (2Р + 0,1) моль/л
Хлорид-ионы образуются при диссоциации PbCl2. В его насыщенном растворе:
PbCl2(к) + aq ↔ Pb2+(насыщ.р-р) + 2 Cl—(насыщ.р-р)
а также за счет диссоциации неассоциированного электролита KCl в его 0,1М растворе:
KCl → K+ + Cl—
Запишем выражение для ПР(PbCl2): ПР = Р (2Р + 0,1)2. Слагаемым 2Р по сравнению со вторым слагаемым 0,1 можно пренебречь. Следовательно, ПР = Р(0,1)2. Растворимость PbCl2, равная концентрации ионов Pb2+, составляет Р = 1,6·10–3 моль/л.
В воде растворимость PbCl2 равна 1,6× 10–2 моль/л (см. предыдущую задачу), в растворе KCl растворимость PbCl2 уменьшилась и составила 1,6× 10–3 моль/л.
Задача 4. Смешали 100 мл 0,01 н раствора CuCl2 и 300 мл 0,1 н раствора Na2S. Выпадет ли осадок cульфида меди, если ПР(CuS) = 6,3× 10–36? Примите, что соли в растворе диссоциированы полностью и объем полученного раствора равен 400 мл.
Решение. Осадок выпадет, если [Сu2+][S2–] > ПР(СuS), т.е. если произведение концентраций ионов Сu2+ и S2– в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
Молярные концентрации растворов равны:
См (СuCl2) = 1/2× 0,01 = 0,005M
См (Na2S) = 1/2× 0,1 = 0,05M
До смешения растворов: [Сu2+] = 0,005 M, [S2–] = 0,05М.
После смешения растворов концентрации ионов изменятся и станут равными:
[Сu2+] = 0,005× 0,1:0,4 = 0,00125M
[S2–] = 0,05× 0,3:0,4 = 0,0375М
Следовательно, произведение концентраций ионов равно:
[Сu2+][S2–] = 0,00125× 0,0375 = 4,7× 10–5(моль/л)2
Поскольку [Сu2+][S2–] = 4,7·10–5 >> 6,3·10–36, то осадок выпадет.
Задача 5. При 298 К произведение растворимости BaSO4 равно 1× 10–10. Определите, в каком объеме воды растворяется 1 г сульфата бария.
Решение.
BaSO4(к) + aq ↔ Ba2+(насыщ.р-р) + SO42– (насыщ.р-р)
Примем растворимость BaSO4 за Р моль/л.
Растворимость BaSO4 равна концентрации ионов Ba2+ и SO42– в растворе: [Ba2+] = [SO42–].
ПР(BaSO4) = [Ba2+]·[SO42–] = Р·Р = 1× 10-10
Р = √ПР = 1× 10-5 моль/л или 233× 10–5 = 2,33× 10–3 г/л,
где 233 — М(BaSO4) (г/моль).
Следовательно, 1 г BaSO4 растворяются в 1/2,33× 10–3 = 429,2 л воды.
Задачи для самостоятельного решения
1. При некоторой температуре растворимость карбоната серебра равна 10-4 моль/л. Рассчитайте ПР этой соли.
2. При некоторой температуре в 20 л воды растворяется 4×10-3 моль фторида кальция. Рассчитайте ПР этой соли.
3. При некоторой температуре в 10 л воды растворяется 1,112 г хлорида свинца. Рассчитайте ПР этой соли.
4. При некоторой температуре рН насыщенного раствора гидроксида кальция составляет 13. Рассчитайте величину ПР этого основания.
5. ПР сульфата серебра при комнатной температуре составляет 5,02× 10-5. Рассчитайте растворимость этой сли в воде. Какой объем воды понадобится для растворения 1 г этой соли?
6. Вычислить растворимость Ag2SO4 в воде (моль/л и г/л), если произведение растворимости при 298 К для этой соли равно 1,2× 10–5.
7. Вычислить растворимость (моль/л) Ni(OH)2 в 0,15 М растворе Ni(NO3)2, если ПР(Ni(OH)2) = 1,2× 10–16 при 298 К.
8. Смешали 150 мл 0,1 н раствора FeCl2 и 350 мл 0,01 М раствора NaOH. Выпадет ли осадок Fe(OH)2, если ПР(Fe(OH)2) = 1,6× 10–15. Принять, что объем полученного раствора равен 500 мл (осаждение гидроксида проводят в инертной атмосфере).
|
Произведение концентраций ионов равно: |
9. При 298 К произведение растворимости Ag2CrO4 равно 4,7× 10–12. Определить, сколько г Ag2CrO4 можно растворить в 100 л воды при этой температуре.
10. При 298 К растворимость PbS в 0,015 М водном растворе K2S равна 4,1× 10–26 моль/л. Определить Go298 процесса растворения PbS.