Статьи
Основное общее образование
Линия УМК В. В. Лунина. Вводный курс (7)
Линия УМК В. В. Лунина. Химия (8-9)
Химия
Неметаллы. Физические и химические свойства
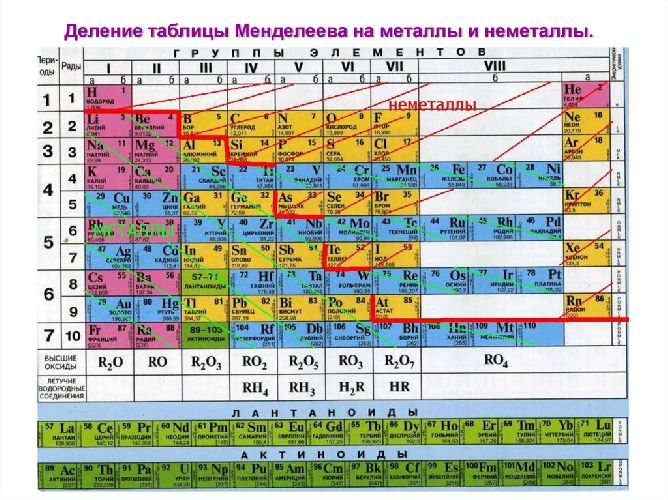
Неметаллы – вещества, обладающие неметаллическими свойствами и находящиеся в правом верхнем углу таблицы Менделеева. Открытие неметаллов произошло сравнительно недавно, в отличии от металлов, которые издавна известны человеку. В настоящее время открыто 22 неметаллических элемента.
11 апреля 2019
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.

Химия. Базовый уровень. 10 класс. Учебник.
Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Простота и доступность изложения курса органической химии , большое количество иллюстраций , а также разнообразные вопросы упражнения и задачи способствуют успешному усвоению учебного материала. Учебник соответствует Федеральному государственному образовательному стандарту среднего общего образования.
Купить
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
- Молекулярные:
- Летучие, газообразные, бесцветные кислород, водород.
- Газообразные, окрашенные хлор, азот, фтор.
- Единственный жидкий представитель — темно-красный бром.
- Твердые, но хрупкие вещества с невысокой температурой плавления — кристаллы йода, серы, белого фосфора.
- Немолекулярные:
- Твердые вещества с высокой температурой плавления — кремний, графит, алмаз и красный фосфор.
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
- Реакции с металлами.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Са + Сl2 = СаСl2
Са + O2 = СаO2
Na + Сl2 = Na+Сl2
- Реакции с водородом
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
Cl2 + H2 = 2HCl
С + 2Н2 = СН4
- Реакции с кислородом.
Неметаллы образуют кислотные или несолеобразующие оксиды.
S + O2 = SO2
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
Что ещё почитать?
ОГЭ по химии — 2019: расписание, критерии оценивания, типы заданий
Биография Д.И. Менделеева. Интересные факты из жизни великого химика
Карбоновые кислоты
Массовая доля вещества
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
- они проводят тепло и электрический ток;
- для них характерен металлический блеск;
- благодаря пластичности и ковкости им можно придать любую форму;
- для всех веществ характерна металлическая кристаллическая решетка.
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
Попытки открытия фтора стоили исследователям не только здоровья, но и жизни. Деви, братья Кнокс, Гей-Люссак — это неполный список жертв науки, что потеряли здоровье в попытках выделить фтор из плавикового шпата. Лишь в 1886 году Муассан решил сложную задачу способом электролиза. И получил первый галоген, а ещё – ядовитый хлор. Во времена Первой мировой войны его использовали как оружие массового поражения.
В настоящее время открыто 22 неметаллических элемента.
#ADVERTISING_INSERT#
Неметаллами называют химические элементы, которые образуют в свободном виде простые вещества, они не обладают физическими свойствами металлов. Из 109 химических элементов 87 можно отнести к металлам, 22 являются неметаллами.
При обычных условиях неметаллы могут находится в газообразном, жидком, а также твердом состоянии.
Газами являются гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe, радон Rn. Это все инертные газы. Каждая молекула инертного газа состоит из одного атома. На внешнем электронном уровне у атомов инертных газов (кроме гелия) расположены восемь электронов. У гелия лишь два. Из-за своей химической устойчивости инертные газы  можно сравнивать с благородными драгоценными металлами – золотом и платиной, у них также есть и другое название – благородные газы. Подобное название лучше подходит к инертным газам, так как они могут вступать в химические реакции и образовывать химические соединения. В 1962 году стало известно, что ксенон и фтор могут образовывать соединения. С того времени, известно более 150 химических соединений ксенона, криптона, радона с фтором, кислородом, хлором и азотом.
можно сравнивать с благородными драгоценными металлами – золотом и платиной, у них также есть и другое название – благородные газы. Подобное название лучше подходит к инертным газам, так как они могут вступать в химические реакции и образовывать химические соединения. В 1962 году стало известно, что ксенон и фтор могут образовывать соединения. С того времени, известно более 150 химических соединений ксенона, криптона, радона с фтором, кислородом, хлором и азотом.
Представление о химической исключительности благородных или инертных газов, оказалось не совсем верным, поэтому вместо ожидаемой нулевой группы инертные газы были отнесены к восьмой группе Периодической системы.
Такие газы как водород, кислород, азот, хлор и фтор образуют двухатомные молекулы, уже знакомые нам H2, O2, N2, CL2, F2.
Выразить состав вещества можно при помощи химических и математических знаков – химической формулой. Как мы уже знаем, по химической формуле можно вычислить относительную молекулярную массу вещества (Mr). Относительная молекулярная масса простого вещества равна произведению относительной атомной массы на число атомов в молекуле, к примеру, кислорода: O2
Mr (O2) = Ar (O) · 2 = 16 · 2 = 32
Тем не менее, кислород может образовывать еще одно газообразное простейшее вещество – озон, в состав молекулы озона входят уже три атома кислорода. Химическая формула O3.
 Способность атомов одного химического элемента создавать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными изменениями, их также называют модификациями.
Способность атомов одного химического элемента создавать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными изменениями, их также называют модификациями.
Свойства аллотропных модификаций химического элемента кислорода: простых веществ O2 и озона O3 существенно различаются.
Кислород не обладает характерным запахом в отличие от озона (отсюда пришло и название озона – в переводе с греческого языка озон обозначает «пахнущий»). Подобный аромат, можно ощутить во время грозы, газ образуется в воздухе за счет электрических разрядов.
Кислород не обладает цветом в отличие от озона, который можно отличить по бледно-фиолетовому оттенку. Озон обладает бактерицидными свойствами. Он также используется для обеззараживания питьевой воды. Озон может препятствовать прохождению ультрафиолетовых лучей солнечного спектра, они губительны для всех живых организмов на Земле. Озоновый экран (слой), который находится на высоте 20-35 км, защищает все живое от губительных солнечных лучей.
Из 22 простых веществ-неметаллов при обычных условиях в жидкообразном состоянии существует только бром, его молекулы двухатомны. Формула Брома: Br2.
Бром представляет из себя тяжелую бурую, с неприятным запахом жидкость (бромос с древнегреческого языка переводится как «зловонный»).
Такие твердые вещества-неметаллы как сера и углерод известны еще с древних времен (древесный уголь).
Твердые вещества-неметаллы также склонны к явлению аллотропии. Углерод может образовывать такие простые вещества, как алмаз, графит и т.п. Различие в строение алмаза и графита заключается в строении кристаллических решеток.
Остались вопросы? Не знаете, как сделать домашнее задание?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Остались вопросы?
Задайте свой вопрос и получите ответ от профессионального преподавателя.
Из
114 химических элементов 22 элемента являются неметаллами. Они располагаются
в правом верхнем углу от линии от бора к астату.
Неметаллы,
в отличие от металлов, могут быть газами, жидкостями и твёрдыми веществами.
Газами
являются элементы VIII
A группы.
Их ещё называют благородными, или инертными газами. Их молекулы
одноатомны. Благородные газы не вступают в реакции друг с другом и другими
соединениями. Однако сейчас известно более 150 соединений с инертными газами.
Благородные
газы широко используются человеком: гелий используется для заполнения
аэростатов и дирижаблей, потому что он легкий и негорючий; неон используют для
изготовления световой рекламы.
Газами
ещё являются такие вещества, как N2,
O2,
H2,
N2,
F2,
Cl2.
Единственная
жидкость среди неметаллов – это бром (Br2).
Это тяжелая бурая жидкость с неприятным запахом.
В
твёрдом состоянии находятся сера, углерод, йод, фосфор.
Многие
молекулы неметаллов состоят из двух атомов, поэтому в их
химической формуле пишется индекс два. К таким молекулам относятся: H2,
N2, O2,
F2, Cl2,
Br2,
I2. Их относительная
молекулярная масса равна произведению относительной атомной массы на число
атомов в молекуле. Например, для того, чтобы найти относительную
молекулярную массу брома, мы его относительную атомную массу умножаем на два и
получаем результат – 160.
Mr
(Br2)
= Ar (Br)
· 2 = 80 · 2 = 160
Кислород
существует не только в виде молекулы О2, но и в виде молекулы О3.
Посмотрите, атом один и тот же, а простые веществ различны. Т.е.
способность атомов данного химического соединения образовывать несколько
простых веществ называют аллотропией. А сами простые вещества – аллотропные
видоизменения или модификации.
Сравнение
свойств кислорода и озона
Из
таблицы видно, что у кислорода и озона различные относительные молекулярные
массы, т.к. число атомов различно, оба находятся в газообразном состоянии,
однако кислород не имеет цвета, а озон имеет сине-голубую окраску, кислород не
имеет запаха, а озон имеет резкий запах. Из этого, можно сделать вывод, что аллотропные
модификации отличаются по своим свойствам.
Аллотропные
модификации имеет и углерод. Сравним две его аллотропные модификации –
это графит и алмаз. Различие в их свойствах связано с кристаллической
решёткой этих соединений.
Фосфор
тоже имеет аллотропные модификации – красный и белый фосфор. В составе
белого фосфора 4 атома, поэтому его молекулярную формулу можно записать, как Р4.
Все
неметаллы, за исключением йода и графита не имеют металлического
блеска, однако деление элементов на металлы и неметаллы является
относительным. Сравним, например, аллотропию олова (Sn).
При комнатной температуре существует бета-олово (β-Sn).
Из этого белого олова – металла изготавливали оловянных солдатиков, изнутри
покрывали консервные банки, это олово входит в состав припоя и других сплавов.
Но при температуре ниже +13,2 0С более устойчиво альфа-олово
(α-Sn).
Оно напоминает неметалл, т.к. представляет собой серый мелкокристаллический
порошок. Белое олово может превратиться в серое при температуре – 33 0С,
это явление получило название «оловянная чума».
Неметаллы


4.1
Средняя оценка: 4.1
Всего получено оценок: 2382.
4.1
Средняя оценка: 4.1
Всего получено оценок: 2382.
Неметаллы – элементы, которые обладают неметаллическими свойствами и занимают положение в правом верхнем углу в таблице Менделеева. Каков же характер неметаллов, а также чем они отличаются от других соединений узнаем в этой статье.
Общая характеристика
К неметаллическим элементам относятся p-элементы, а также водород и гелий, которые в свою очередь относятся к s-элементам. Они расположены правее и выше диагонали бор-астат. Всего же известно 22 неметалла. У наиболее типичных неметаллов заполнение электронами внешнего уровня близко к максимальному, а радиусы атомов – минимальные среди элементов данного периода.
Атомы неметаллов имеют более высокие значения электроотрицательности, а соответственно высокие энергии ионизации и большое сродство к электрону. В связи с этим характер неметаллов таков, что, в отличии от металлов, могут проявлять окислительные свойства. В реакциях они могут восстанавливаться, присоединяя столько электронов, чтобы общее их количество на внешнем уровне достигло восьми (завершенный уровень, стабильное состояние атома).
Именно поэтому отрицательное значение степени окисления, которое могут иметь в соединениях неметаллы, в отличие от металлов, равно разности (8-N группы). Наиболее высокую электроотрицательность имеют неметаллы, положение которых приходится на правый верхний угол в Периодической системе, то есть галогены фтор и хлор, а также кислород. Именно эти элементы могут образовывать ионные связи. Самым активным неметаллом является фтор, который в соединениях может проявлять только одну валентность I и одну степень окисления -1.
Особенности строения неметаллов заключаются в том, что внешний электронный слой у большинства атомов неметаллов содержит от 4 до 8 электронов.
Другие неметаллы (кроме фтора) могут проявлять и положительные степени окисления, образуя ковалентные связи с другими элементами.
Физические свойства
Для большинства неметаллов простых веществ в твердом агрегатном состоянии характерна молекулярная кристаллическая решетка. То есть эти неметаллы являются кристаллическими веществами. Поэтому при обычных условиях они имеют вид газов, жидкостей или твердых веществ с низкими температурами плавления. Примерами таких веществ являются газы: водород H2 , неон Ne, жидкость – бром Br2 , твердые вещества йод I2, сера S8, фосфор P4 (белый фосфор). Существуют неметаллы (бор, углерод, кремний), которые имеют атомные кристаллические решетки.

Важнейшие элементы, которые содержаться в живых организмах – органогены. Они образуют воду, белки, витамины, жиры. К ним относятся 6 элементов: углерод, кислород, водород, азот, фосфор, сера.
Химические свойства и соединения
Водородные соединения неметаллов в основном являются летучими соединениями, в водных растворах имеющими кислотный характер. Они имеют молекулярные структуры, ковалентную полярную связь. Некоторые из них (вода, аммиак, фтороводород) образуют водородные связи. Соединения образуются при непосредственном взаимодействии неметаллов с водородом. Электронная формула серы с водородом выглядит следующим образом:
S+H2 =H2 S (до 350 градусов равновесие смещено вправо)
Все водородные соединения – восстановители (кроме HF), причем их восстановительная сила возрастает справа налево по периоду и сверху вниз по подгруппе.
Неметаллы взаимодействуют с металлами и другими неметаллами:
2Na+Cl2 =2NaCl
В результате получается натриевая соль соляной кислоты

S+O2 =SO2
соединения неметаллов с кислородом, как правило, являются кислотными оксидами, которым соответствуют кислородосодержащие кислоты. Структура оксидов типичных неметаллов молекулярная (SO3, P4 O10). Чем выше степень окисления неметалла, тем сильнее соответствующая оксокислота. Так, хлор непосредственно не взаимодействует с кислородом, однако образует ряд оксокислот, которым соответствуют оксиды, ангидриды этих кислот.
Неметаллы находят применение в разных отраслях промышленности. Вот список отраслей, где их использование является наиболее востребованным.
| Область применения | Примеры, перечень неметаллов, применяемых в той или иной промышленности |
| промышленность | Сера, азот и фосфор часто используют для получения кислот. Серу также используют на производстве резины. |
| транспорт | важным неметаллом в транспортной промышленности является водород. Его используют в качестве топлива. При сгорании такой вид топлива не загрязняет окружающую среду. |
| аграрная отрасль | сера используется для борьбы с вредными насекомыми и болезнями растений |
| медицина | Кислород используют для восстановления дыхания (кислородные подушки), уголь в форме активированного угля, который способен выводить из организма вредные вещества. |
| пищевая промышленность | азот используют для продления срока годности продуктов |

Что мы узнали?
В этой статье за 9 класс химии кратко излагается основная информация о неметаллах, их строении, и о том, с чем реагируют неметаллы. Неметаллами могут быть газы, жидкости и твердые вещества с кристаллической решеткой. Самым активным неметаллом является фтор, который имеет степень окисления-1.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Владомир Петрунько
10/10
-

Евгений Бурлуцкий
10/10
-

Анна Кучапова
10/10
-

Полина Богданова
10/10
-

Иван Сутягин
10/10
-

Саша Сиднев
9/10
-

Ислам Искаков
10/10
-

Kiřill Kóřóbóchki
10/10
-

Fozil Fhhbv
10/10
-

Александр Балабан
10/10
Оценка доклада
4.1
Средняя оценка: 4.1
Всего получено оценок: 2382.
А какая ваша оценка?

Выдержка из периодической таблицы, показывающая, как часто некоторые элементы классифицируются как неметаллы:
14 эффективно всегда[n 1]
3 часто[n 2]
6 иногда (металлоиды)[n 3]
Близлежащие металлы показаны серым шрифтом.[n 4]
Точного определения неметалла не существует; в разных источниках один и тот же элемент может быть отнесён к металлам, полуметаллам и неметаллам.
Водород обычно находится в группе 1 (согласно приведенной ниже полной таблице), но может быть и в группе 17 (согласно приведенному выше отрывку).[n 5]
Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы.
| Группа | I | III | IV | V | VI | VII | VIII |
|---|---|---|---|---|---|---|---|
| 1-й период | H | He | |||||
| 2-й период | C | N | O | F | Ne | ||
| 3-й период | P | S | Cl | Ar | |||
| 4-й период | Se | Br | Kr | ||||
| 5-й период | I | Xe | |||||
| 6-й период | Rn |
В отличие от металлов, неметаллов гораздо меньше, всего их насчитывается 22 – 23 элемента, в зависимости от классификации.
Характерной особенностью неметаллов является большее (по сравнению с металлами) число электронов на внешнем энергетическом уровне их атомов. Это определяет их большую способность к присоединению дополнительных электронов, и проявлению более высокой окислительной активности, чем у металлов.
Неметаллы имеют высокие значения сродства к электрону, большую электроотрицательность и высокий окислительно-восстановительный потенциал.
Благодаря высоким значениям энергии ионизации неметаллов, их атомы могут образовывать ковалентные химические связи с атомами других неметаллов и некоторых иных элементов. В отличие от преимущественно ионной природы строения соединений типичных металлов, простые неметаллические вещества, а также соединения неметаллов имеют чаще всего ковалентную природу строения.
В свободном виде при нормальных условиях пребывают в газообразном состоянии фтор, хлор, кислород, азот, водород, инертные газы, в твёрдом — иод, астат, сера, селен, теллур, фосфор, мышьяк, углерод, кремний, бор, при комнатной температуре в жидком состоянии существует лишь бром.
У некоторых неметаллов наблюдается проявление аллотропии. Так, для газообразного кислорода характерны две аллотропных модификации — кислород (O2) и озон (O3), у твёрдого углерода множество форм — алмаз, астралены, графен, графит, карбин, лонсдейлит, фуллерены, стеклоуглерод, диуглерод, углеродные наноструктуры (нанопена, наноконусы, нанотрубки, нановолокна) и аморфный углерод уже открыты, а ещё возможны и другие модификации, например, чаоит и металлический углерод.
В молекулярной форме в виде простых веществ в природе встречаются азот, кислород и сера. Чаще неметаллы находятся в химически связанном виде: это вода, минералы, горные породы, различные силикаты, фосфаты, бораты. По распространённости в земной коре неметаллы существенно различаются.
Определение и применимые элементы[править | править код]

График значений плотности и электроотрицательности первых 99 элементов. Неметаллические элементы занимают верхний левый угол, имеют относительно низкую плотность и значения электроотрицательности от умеренных до высоких. Металлоиды химически ведут себя как неметаллы, но иногда рассматриваются как промежуточный класс между металлами и неметаллами. На вставке вверху справа показаны соответствующие положения металлов в периодической таблице слева и металлоидов и неметаллов справа, за исключением водорода, который здесь показан в его обычном положении вверху слева
Неметалл — это химический элемент, обладающий, среди прочего, относительно низкой плотностью и электроотрицательностью от умеренной до высокой. В целом, у них нет типичных металлических свойств, таких как металический блеск, деформируемость, хорошая тепло- и электропроводность и низкая электроотрицательность. Поскольку не существует строгого определения неметалла, среди источников могут встречаться некоторые различия в отношении того, какие элементы классифицируются как неметаллы. Такие решения зависят от того, какое свойство или свойства считаются наиболее характерными для неметаллического или металлического характера.
Хотя Steudel в 2020 году признал двадцать три элемента неметаллами, любой такой список открыт для оспаривания. Четырнадцать элементов практически всегда признаются таковыми: водород, кислород, азот и сера; коррозионно-активные галогены фтор, хлор, бром и иод; и благородные газы гелий, неон, аргон, криптон, ксенон и радон; см., например, Larrañaga et al. Хотя те же авторы признали углерод, фосфор и селен неметаллами, Вернон ранее сообщал, что эти три элемента вместо этого иногда считались металлоидами. Элементы, обычно называемые металлоидами, а именно бор, кремний, германий, мышьяк, сурьма и теллур, иногда считаются промежуточным классом между металлами и неметаллами, когда критерии, используемые для различия между металлами и неметаллами, неубедительны; в других случаях они считаются неметаллами в свете их неметаллической химии.
Из 118 известных элементов 23 можно рассматривать как неметаллы; металлы превосходят их по численности в несколько раз. Астат, пятый галоген, часто игнорируется из-за его редкости и высокой радиоактивности; косвенные теоретические и экспериментальные данные убедительно свидетельствуют о том, что это металл. Неметаллами могут оказаться сверхтяжёлые элементы коперниций (Z = 112) и оганесон (118); их фактический статус ещё не подтверждён.
Общие свойства[править | править код]
Физические[править | править код]
Внешне около половины неметаллических элементов при нормальных условиях являются бесцветными или окрашенными газами, а бо́льшая часть остальных представляет собой блестящие твёрдые вещества. Бром, единственная жидкость, настолько летуч, что обычно покрыт слоем его паров; сера — единственный окрашенный твёрдый неметалл. Жидкие неметаллы имеют очень низкие плотности, температуры плавления и кипения и являются плохими проводниками тепла и электричества. Твёрдые неметаллические элементы имеют низкую плотность, являются хрупкими или рассыпчатыми с низкой механической и структурной прочностью, и проводниками от плохих до хороших.
Внутренняя структура и расположение связей неметаллов объясняют их различия в форме. Те неметаллы, что существуют в виде отдельных атомов (например, ксенон) или молекул (например, кислород, сера, бром), как правило, имеют низкие температуры плавления и кипения, поскольку они удерживаются вместе слабыми лондоновскими дисперсионными силами, действующими между их атомами или молекулами. Многие из них являются газами при комнатной температуре. Те, которые образуют гигантские структуры, такие как цепочки до 1000 атомов (например, селен), листы (углерод) или трёхмерные решетки (кремний), имеют более высокие температуры плавления и кипения, поскольку требуется больше энергии для преодоления их более сильной ковалентной связи, все они твёрдые. Те, кто находится ближе к левой части периодической таблицы или ниже по колонке, часто имеют некоторые слабые металлические взаимодействия между их молекулами, цепями или слоями в соответствии с их близостью к металлам; это происходит в боре, углероде, фосфоре, мышьяке, селене, сурьме, теллуре и иоде.
Проводимость неметаллов и хрупкость твёрдых тел также связаны с их внутренним устройством. Хорошая тепло- и электропроводность и пластичность (ковкость, пластичность) обычно связаны с наличием в металлах свободно движущихся и равномерно распределенных электронов; за некоторыми исключениями электроны в неметаллах обычно лишены такой подвижности. Среди неметаллических элементов:
- хорошая тепло- и электропроводность наблюдается только у углерода, мышьяка и сурьмы;
- сравнимые с металлами значения теплопроводности в остальном очевидны только для бора, кремния, фосфора и германия; такая проводимость передаётся через колебания кристаллических решёток этих элементов;
- умеренная электропроводность наблюдается у бора, кремния, фосфора, германия, селена, теллура и иода; и
- пластичность проявляется в ограниченных обстоятельствах только у углерода, фосфора, серы, селена и металлоидных неметаллов.
Физические различия между металлами и неметаллами возникают из-за внутренних и внешних атомных сил. Внутри атома положительный ядерный заряд удерживает его внешние электроны на месте. Внешне те же самые электроны подвержены силам притяжения от ядерных зарядов в соседних атомах. Когда внешние силы больше или равны внутренней силе, ожидается, что внешние электроны станут блуждающими (свободными перемещаться между атомами), и предсказываются металлические свойства. В противном случае ожидаются неметаллические свойства.
Химические[править | править код]
| Аспект | Металлы | Неметаллы |
|---|---|---|
| электроотрицательность | Ниже, чем у неметаллов,
за некоторыми исключениями |
От умеренного до высокого |
| Химическая
связь |
Редко образуют
ковалентные связи |
Часто образуют
ковалентные связи |
| Металлические связи (сплавы)
между металлами |
Ковалентные связи
между неметаллами |
|
| Ионные связи между неметаллами и металлами | ||
| Степени окисления | Положительный | Отрицательный или положительный |
| Оксиды | Основной в низших оксидах;
более кислая |
Кислотный; никогда не основные |
| В водном
растворе |
Существуют в виде катионов | Существуют в виде анионов
или оксианионов |
Неметаллы имеют значения электроотрицательности от умеренных до высоких и в химических реакциях склонны образовывать кислые соединения. Например, твёрдые неметаллы (в том числе металлоиды) реагируют с азотной кислотой с образованием либо кислоты, либо оксида, который является кислотным или имеет преобладающие кислотные свойства.
Они имеют тенденцию получать или делиться электронами, когда реагируют, в отличие от металлов, которые имеют тенденцию отдавать электроны. Более конкретно, и учитывая стабильность электронных конфигураций благородных газов (заполненные внешние оболочки), неметаллы обычно приобретают количество электронов, достаточное для придания им электронной конфигурации следующего благородного газа, тогда как металлы имеют тенденцию терять электроны, достаточные для того, чтобы их оставить. с электронной конфигурацией предшествующего благородного газа. Для неметаллических элементов эта тенденция инкапсулируется эмпирическими правилами дуэта и октета (а для металлов существует менее строгое правило 18-электронов).
Количественно неметаллы в основном имеют более высокие энергии ионизации, более высокое сродство к электрону, более высокие значения электроотрицательности и более высокие стандартные восстановительные потенциалы, чем металлы. В общем, чем выше эти значения, тем более неметаллическим является рассматриваемый элемент.
Химические различия между металлами и неметаллами в значительной степени возникают из-за силы притяжения между положительным ядерным зарядом отдельного атома и его отрицательно заряженными внешними электронами. Слева направо в каждом периоде таблицы Менделеева заряд ядра увеличивается по мере увеличения числа протонов в ядре. Существует связанное с этим уменьшение атомного радиуса по мере того, как увеличивающийся заряд ядра притягивает внешние электроны ближе к ядру. В металлах влияние заряда ядра обычно слабее, чем в неметаллических элементах. Таким образом, при химической связи металлы имеют тенденцию терять электроны и образовывать положительно заряженные или поляризованные атомы или ионы.тогда как неметаллы имеют тенденцию приобретать те же самые электроны из-за их более сильного ядерного заряда и образовывать отрицательно заряженные ионы или поляризованные атомы.
Количество соединений, образованных неметаллами, огромно. Первые десять мест в таблице «20 лучших» элементов, наиболее часто встречающихся в 895 501 834 соединениях, перечисленных в реестре Chemical Abstracts Service на 2 ноября 2021 г., заняли неметаллы. Водород, углерод, кислород и азот обнаружены в большинстве (80 %) соединений. Кремний, металлоид, оказался на 11-м месте. Металлом с самым высоким рейтингом с частотой встречаемости 0,14 % было железо, занявшее 12-е место. Примерами соединений неметаллов являются: борная кислота (H3BO3), используемый в керамических глазурях; селеноцистеин (C3H7NO2Se), 21-я аминокислота необходимая для; полуторный сульфид фосфора (P4S3), в месте удара совпадает; и тефлон ((C2F4)n).
Сложности[править | править код]
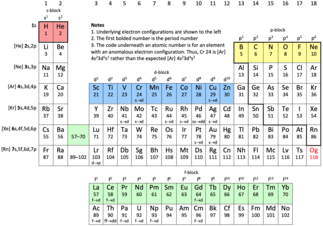
Периодическая таблица с выделением первой строки каждого блока. Гелий (He), как благородный газ, обычно отображается над неоном (Ne) вместе с остальными благородными газами. Элементы, охватываемые этой статьёй, заключены в толстую чёрную рамку. Статус оганесона (Og) пока неизвестен.
Химию неметаллов усложняют аномалии, наблюдаемые в первой строке каждого блока периодической таблицы. Эти аномалии заметны в водороде, боре (будь то в виде неметалла или металлоида), углероде, азоте, кислороде и фторе; и распространяться на вторичную периодичность или неравномерные периодические тренды, идущие вниз по большинству групп p-блоков; и необычные степени окисления в более тяжёлых неметаллах.
Аномалия первого ряда[править | править код]
Начиная с водорода, аномалия первого ряда в основном возникает из-за электронных конфигураций рассматриваемых элементов. Водород известен различными способами образования . Чаще всего образует ковалентные связи. Он может потерять свой единственный электрон в водном растворе, оставив после себя голый протон с огромной поляризующей силой. Это, следовательно, присоединяется к неподеленной электронной паре атома кислорода в молекуле воды, тем самым формируя основу кислотно-щелочной химии. Атом водорода в молекуле может образовывать вторую, более слабую связь с атомом или группой атомов в другой молекуле. Такая связь «помогает придать снежинкам их шестиугольную симметрию, связывает ДНКв двойную спираль; формирует трехмерные формы белков; и даже поднимает температуру кипения воды достаточно высоко, чтобы приготовить приличную чашку чая»
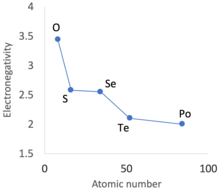
Значения электроотрицательности халькогеновых элементов группы 16, демонстрирующие W-образное чередование или вторичную периодичность, спускающуюся по группе
Для водорода и гелия, а также от бора до неона, поскольку подоболочки 1s и 2p не имеют внутренних аналогов (то есть нет нулевой оболочки и подоболочки 1p) и, следовательно, не испытывают эффектов отталкивания электронов, они имеют относительно малые радиусы, в отличие от подоболочек 1p. 3p, 4p и 5p подоболочки из более тяжёлых элементов. Энергии ионизации и электроотрицательности среди этих элементов, следовательно, выше, чем можно было бы ожидать в противном случае, принимая во внимание периодические тенденции. Небольшие атомные радиусы углерода, азота и кислорода облегчают образование двойных или тройных связей.
Хотя обычно ожидается, что водород и гелий, исходя из электронной конфигурации, будут располагаться поверх сильно металлических элементов s-блока, аномалия первого ряда в этих двух элементах достаточно сильна, чтобы гарантировать альтернативное размещение. Водород иногда располагается над фтором в группе 17, а не над литием в группе 1. Гелий обычно располагается над неоном в группе 18, а не над бериллием в группе 2.
Вторичная периодичность[править | править код]
Сразу после первого ряда переходных металлов 3d-электроны в 4-м ряду элементов, то есть в галлии (металле), германии, мышьяке, селене и броме, не столь эффективны для экранирования повышенного положительного заряда ядра. Аналогичный эффект сопровождает появление четырнадцати металлов f-блока между барием и лютецием, что в конечном итоге приводит к меньшим, чем ожидалось, атомным радиусам для элементов, начиная с гафния (Hf) и далее. Конечным результатом, особенно для групп 13-15 элементов, является чередование некоторых периодических тенденций, идущих вниз по группам с 13 по 17.
Необычные степени окисления[править | править код]
Большие атомные радиусы более тяжёлых неметаллов группы 15-18 обеспечивают более высокие объемные координационные числа и приводят к более низким значениям электроотрицательности, которые лучше переносят более высокие положительные заряды. Таким образом, участвующие элементы могут проявлять степени окисления, отличные от самых низких для своей группы (то есть 3, 2, 1 или 0), например, в пентахлориде фосфора (PCl5), гексафториде серы (SF6), гептафториде иода (IF7) и дифториде ксенона (XeF2)
Подклассы[править | править код]
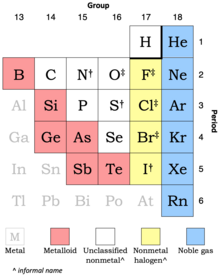
Выдержка из современной таблицы Менделеева, показывающая подклассы неметаллов.
† умеренно сильный окислитель
‡ сильный окислитель
Подходы к классификации неметаллов могут включать от двух до шести или семи подклассов. Например, в периодической таблице Британской энциклопедии есть благородные газы, галогены и другие неметаллы, а элементы, обычно считающиеся металлоидами, разделены на «другие металлы» и «другие неметаллы»; в то время как Периодическая таблица Королевского химического общества использует разные цвета для каждой из своих восьми основных групп, а неметаллы можно найти в семи из них.
Справа налево в терминах периодической таблицы более или менее обычно различают три или четыре вида неметаллов. Это:
- относительно инертные благородные газы;
- совокупность химически активных галогенных элементов — фтора, хлора, брома и иода — иногда называемых неметаллическими галогенами (используемый здесь термин) или стабильными галогенами;
- набор неклассифицированных неметаллов, включая такие элементы, как водород, углерод, азот и кислород, без общепризнанного собирательного названия; и
- химически слабоактивные неметаллические металлоиды иногда считаются неметаллами, а иногда нет.
Поскольку металлоиды занимают пограничную территорию, где металлы встречаются с неметаллами, их трактовка варьируется от автора к автору. Некоторые считают их отдельными как от металлов, так и от неметаллов; некоторые считают их неметаллами или подклассом неметаллов. Другие считают некоторые из них металлами, например мышьяк и сурьму, из-за их сходства с тяжёлыми металлами. Металлоиды рассматриваются здесь как неметаллы в свете их химического поведения и в сравнительных целях.
Помимо металлоидов, среди других подклассов неметаллов можно различить некоторую размытость границ и перекрытие (как обычно происходит со схемами классификации). Углерод, фосфор, селен, иод граничат с металлоидами и проявляют некоторый металлический характер, как и водород. Среди благородных газов радон является наиболее металлическим и начинает проявлять некоторое катионное поведение, что необычно для неметалла.
Благородные газы[править | править код]

Шесть неметаллов классифицируются как благородные газы: гелий, неон, аргон, криптон, ксенон и радиоактивный радон. В обычных периодических таблицах они занимают крайний правый столбец. Их называют благородными газами из-за характерной для них очень низкой химической активности.
Они имеют очень похожие свойства: все они бесцветны, не имеют запаха и не имеют свойство горения. Заполненные внешние электронные оболочки инертных газов обусловливают их слабые силы межатомного притяжения, что приводит к очень низким температурам плавления и кипения. Поэтому все они являются газами при стандартных условиях, даже те, у которых атомная масса больше, чем у многих обычно твёрдых элементов.
С химической точки зрения благородные газы имеют относительно высокие энергии ионизации, нулевое или отрицательное сродство к электрону и относительно высокую электроотрицательность. Соединения инертных газов исчисляются сотнями, хотя список продолжает расти, причём большинство из них происходит в результате соединения кислорода или фтора с криптоном, ксеноном или радоном.
В терминах периодической таблицы можно провести аналогию между благородными газами и благородными металлами, такими как платина и золото, причём последние также неохотно вступают в химическую комбинацию. В качестве ещё одного примера, ксенон в степени окисления +8 образует бледно-жёлтый взрывоопасный оксид, XeO4, а осмий, другой благородный металл, образует жёлтый сильно окисляющий оксид, OsO4. Параллели есть и в формулах оксифторидов: XeO2F4 и OsO2F4, а также XeO3F2 и OsO3F2.
В атмосфере Земли содержится около 1015 тонн инертных газов. Гелий также содержится в природном газе в количестве до 7 %. Радон диффундирует из горных пород, где он образуется в ходе естественного распада урана и тория. В 2014 году сообщалось, что ядро Земли может содержать ок. 1013 тонн ксенона, в виде стабильных интерметаллидов XeFe3 и XeNi3. Это может объяснить, почему «исследования атмосферы Земли показали, что более 90 % ожидаемого количества Xe истощено».
Галогены[править | править код]

Друза фиолетового флюорита CaF2, фторсодержащего минерала, между двумя кварцами
Хотя неметаллические галогены являются коррозионно-активными элементами, их можно найти в таких безвредных соединениях, как обычная поваренная соль (NaCl). Их высокую химическую активность как неметаллов можно противопоставить столь же высокой химической активности щелочных металлов, таких как натрий и калий.
Физически фтор и хлор представляют собой бледно-жёлтые и желтовато-зелёные газы; бром — красновато-коричневая жидкость (обычно покрытая слоем дыма); а иод в белом свете представляет собой металлическое твёрдое вещество. Электрически первые три являются изоляторами, а иод — полупроводником (проводимость выше вдоль кристаллических плоскостей).
Химически они имеют высокие энергии ионизации, сродство к электрону и значения электроотрицательности и в основном являются относительно сильными окислителями. Проявления этого статуса включают их внутреннюю коррозионную природу. Все четыре проявляют тенденцию к образованию преимущественно ионных соединений с металлами, тогда как остальные неметаллы, кроме кислорода, имеют тенденцию к образованию преимущественно ковалентных соединений с металлами. Реакционная и сильно электроотрицательная природа неметаллических галогенов представляет собой воплощение неметаллического характера.
В терминах периодической таблицы аналогами высоконеметаллических галогенов в группе 17 являются высокореакционноспособные металлы, такие как натрий и калий, в группе 1. Любопытно, что большинство щелочных металлов, как известно, образуют анионы −1 (что редко встречается среди неметаллов) как бы в подражание неметаллическим галогенам.
Галогены-неметаллы встречаются в солевых минералах. Фтор встречается во флюорите, который является широко распространенным минералом. В рассолах содержатся хлор, бром и йод. В виде исключения в исследовании 2012 г. сообщалось о наличии 0,04 % природного фтора (F2) по весу в антозоните, приписывая эти включения излучению от присутствия крошечных количеств урана.
Неклассифицированные неметаллы[править | править код]

Селен проводит электричество примерно в 1000 раз лучше, когда на него падает свет, это свойство используется с середины 1870-х годов в светочувствительных приложениях.
После того, как неметаллические элементы классифицируются как благородные газы, галогены или металлоиды (см. ниже), оставшиеся семь неметаллов — это водород, углерод, азот, кислород, фосфор, сера и селен. Три из них в наиболее стабильных аллотропах представляют собой бесцветные газы (H, N, O); три имеют вид металла (C, P, Se); и один жёлтый (S). Электрически графитовый углерод является полуметаллом вдоль своих плоскостей и полупроводником в направлении, перпендикулярном его плоскостям; фосфор и селен — полупроводники; а водород, азот, кислород и сера являются изоляторами.
Обычно считается, что они слишком разнообразны, чтобы заслуживать коллективного изучения, и их называют другими неметаллами [ или, проще говоря, неметаллами, расположенными между металлоидами и галогенами. Следовательно, их химия, как правило, преподается по-разному, в соответствии с их четырьмя соответствующими группами периодической таблицы, например: водород в группе 1; углеродные неметаллы группы 14 (углерод и, возможно, кремний и германий); неметаллы группы 15 пниктогенов (азот, фосфор и, возможно, мышьяк и сурьма); и халькоген-неметаллы группы 16 (кислород, сера, селен и, возможно, теллур). Возможны другие подразделения по индивидуальным предпочтениям авторов.
В частности, водород ведет себя в одних отношениях как металл, а в других — как неметалл. Подобно металлу, он может (сначала) потерять свой единственный электрон; он может заменять щелочные металлы в типичных структурах щелочных металлов; и способен образовывать сплавоподобные гидриды с металлической связью с некоторыми переходными металлами. С другой стороны, это изолирующий двухатомный газ, как типичный неметалл, и в более общих химических реакциях он имеет тенденцию достигать электронной конфигурации гелия. Он делает это путем образования ковалентной или ионной связи или, если он потерял свой электрон, присоединившись к неподеленной паре электронов.
Тем не менее некоторые или все эти неметаллы имеют несколько общих свойств. Большинство из них, будучи менее реакционноспособными, чем галогены, могут встречаться в природе в окружающей среде. Они играют видную биологическую и геохимическую роль. Хотя их физические и химические свойства являются «умеренно неметаллическими», в целом все они имеют коррозионные свойства. Водород может разъедать металлы. Углеродная коррозия может происходить в топливных элементах. Кислотные дожди вызываются растворенным азотом или серой. Кислород разъедает железо через ржавчину. Белый фосфор, наиболее нестабильная форма, воспламеняется на воздухе с образованием остатка фосфорной кислоты. Необработанный селен в почве может привести к образованию агрессивного газообразного селенида водорода. При соединении с металлами неклассифицированные неметаллы могут образовывать твердые (внедренные или тугоплавкие) соединения из-за их относительно малых атомных радиусов и достаточно низких значений энергии ионизации. Они проявляют тенденцию связываться друг с другом, особенно в твердотельных соединениях. Отношения диагональной таблицы Менделеева среди этих неметаллов повторяются аналогичные отношения среди металлоидов.
В терминах периодической таблицы просматривается географическая аналогия между неклассифицированными неметаллами и переходными металлами. Неклассифицированные неметаллы занимают территорию между сильно неметаллическими галогенами справа и слабо неметаллическими металлоидами слева. Переходные металлы занимают территорию «между ядовитыми и агрессивными металлами слева от периодической таблицы и спокойными и довольными металлами справа … [и] … образуют переходный мост между ними».
Неклассифицированные неметаллы обычно встречаются в элементарных формах (кислород, сера) или встречаются в ассоциации с любым из этих двух элементов:
- Водород встречается в Мировом океане в составе воды, а в природном газе — в составе метана и сероводорода.
- Углерод встречается в известняке, доломите и мраморе в виде карбонатов. Менее известен углерод в виде графита, который в основном встречается в метаморфических силикатных породах в результате сжатия и нагрева осадочных соединений углерода.
- Кислород содержится в атмосфере; в океанах как компонент воды; и в земной коре в виде оксидных минералов.
- Широко распространены минералы фосфора, обычно в виде фосфорно-кислородных фосфатов.
- Элементарную серу можно найти в горячих источниках и вулканических районах или вблизи них во многих частях мира. Широко распространены минералы серы, обычно в виде сульфидов или кислородно-серных сульфатов.
- Селен встречается в сульфидных рудах металлов, где он частично замещает серу; иногда встречается элементарный селен.
Металлоиды (полуметаллы)[править | править код]

Кристалл реальгара, также известного как «рубиновая сера» или «рубин мышьяка», минерал сульфида мышьяка As4S 4
Шесть элементов, которые чаще всего называют металлоидами, — это бор, кремний, германий, мышьяк, сурьма и теллур, каждый из которых имеет металлический вид. В стандартной периодической таблице они занимают диагональную область в p-блоке, простирающемся от бора в левом верхнем углу до теллура в правом нижнем углу вдоль разделительной линии между металлами и неметаллами, показанной в некоторых периодических таблицах.
Они хрупкие и плохо проводят тепло и электричество. Бор, кремний, германий и теллур являются полупроводниками. Мышьяк и сурьма имеют электронную структуру полуметаллов, хотя оба имеют менее стабильные полупроводниковые аллотропы.
Химически металлоиды обычно ведут себя как (слабые) неметаллы. Среди неметаллических элементов они, как правило, имеют самые низкие энергии ионизации, сродство к электрону и значения электроотрицательности; и являются относительно слабыми окислителями. Кроме того, они демонстрируют склонность к образованию сплавов с металлами.
В терминах периодической таблицы слева от слабо неметаллических металлоидов находится неопределенный набор слабо металлических металлов (таких как олово, свинец и висмут), иногда называемых постпереходными металлами. Дингл объясняет ситуацию следующим образом:
- … с «несомненными» металлами в крайнем левом углу таблицы и бесспорными неметаллами в крайнем правом … разрыв между двумя крайностями в первую очередь заполняется бедными (постпереходными) металлами., а затем металлоиды, которые, возможно, по тому же принципу можно было бы все вместе переименовать в «бедные неметаллы».
Металлоиды, как правило, встречаются в формах, связанных с кислородом или серой, или, в случае теллура, с золотом или серебром. Бор содержится в борно-кислородных боратных минералах, в том числе в водах вулканических источников. Кремний встречается в кремнекислородном минеральном кремнеземе (песок). Германий, мышьяк и сурьма в основном встречаются в составе сульфидных руд. Теллур встречается в теллуридных минералах золота или серебра. Сообщалось о природных формах мышьяка, сурьмы и теллура.
Аллотропы[править | править код]
Коричневатые кристаллы бакминстерфуллерена С60, полупроводникового аллотропа углерода.
Большинство неметаллических элементов существует в аллотропных формах. Углерод, например, встречается в виде графита и алмаза. Такие аллотропы могут проявлять физические свойства, которые являются более металлическими или менее неметаллическими.
Среди неметаллических галогенов и неклассифицированных неметаллов:
- Йод известен в полупроводниковой аморфной форме.
- Графит, стандартное состояние углерода, является довольно хорошим проводником электричества. Алмазный аллотроп углерода явно неметаллический, полупрозрачный и, как изолятор, очень плохой электрический проводник. Углерод также известен в нескольких других аллотропных формах, включая полупроводниковый бакминстерфуллерен, аморфный и паракристаллический (смешанные аморфные и кристаллические) разновидности.
- Азот может образовывать газообразный тетразот (N4), нестабильную многоатомную молекулу со временем жизни около одной микросекунды.
- Кислород в стандартном состоянии представляет собой двухатомную молекулу; он также существует в виде озона (O3), нестабильного неметаллического аллотропа с периодом полураспада «в помещении» около получаса по сравнению с примерно тремя днями в окружающем воздухе при 20 °C.
- Уникально, что фосфор существует в нескольких аллотропных формах, которые более стабильны, чем его стандартное состояние в виде белого фосфора (P4). Белая, красная и чёрная аллотропы, вероятно, наиболее известны; первый изолятор; последние два являются полупроводниками. Фосфор также существует в виде дифосфора (P2), нестабильного двухатомного аллотропа.
- У серы больше аллотропов, чем у любого другого элемента. Аморфная сера, метастабильная смесь таких аллотропов, известна своей эластичностью.
- У селена есть несколько неметаллических аллотропов, все из которых гораздо менее электропроводны, чем его стандартное состояние серого «металлического» селена.
Все элементы, наиболее часто считающиеся металлоидами, образуют аллотропы:
- Бор известен в нескольких кристаллических и аморфных формах.
- В последнее время кремний был известен только в кристаллической (алмазоподобной) и аморфной формах; о синтезе орторомбического аллотропа Si 24 сообщалось в 2014 г.
- При давлении ок. 10-11 ГПа германий переходит в металлическую фазу с той же тетрагональной структурой, что и олово. При декомпрессии и в зависимости от скорости сброса давления металлический германий образует ряд аллотропов, метастабильных в условиях окружающей среды.
- Мышьяк и сурьма образуют несколько хорошо известных аллотропов (желтый, серый и чёрный).
- Теллур известен в кристаллической и аморфной формах.
Известны и другие аллотропные формы неметаллических элементов либо под давлением, либо в виде монослоев. Было обнаружено, что при достаточно высоких давлениях по крайней мере половина неметаллических элементов, которые являются полупроводниками или изоляторами, , начиная с фосфора при 1,7 ГПа, образуют металлические аллотропы. Однослойные двумерные формы неметаллов включают борофен (бор), графен (углерод), силицен (кремний), фосфорен (фосфор), германен (германий), арсенен (мышьяк), антимонен (сурьма). и теллурен(теллур), вместе именуемые ксенами.
Распространенность и доступность[править | править код]
Изобилие[править | править код]
| Домен | Основные компоненты | Следующий по
количеству |
|---|---|---|
| Корка | 61 %, 20 % | Н 2,9 % |
| Атмосфера | Н 78 %, О 21 % | С 0,5 % |
| Гидросфера | О 66,2 %, Н 33,2 % | Кл 0,3 % |
| Биомасса | О 63 %, С 20 %, Н 10 % | Н 3,0 % |
По оценкам, водород и гелий составляют примерно 99 % всей обычной материи во Вселенной и более 99,9 % её атомов. Кислород считается следующим наиболее распространенным элементом, на ок. 0,1 %. Считается, что менее пяти процентов Вселенной состоит из обычной материи, представленной звездами, планетами и живыми существами. Баланс состоит из темной энергии и темной материи, которые в настоящее время плохо изучены.
Пять неметаллов, а именно водород, углерод, азот, кислород и кремний, составляют основную часть земной коры, атмосферы, гидросферы и биомассы в количествах, указанных в таблице.
Извлечение[править | править код]

Германий встречается в некоторых цинково-медно-свинцовых рудных телах в количествах, достаточных для оправдания добычи. Чистая форма стоит 360 долларов за 100 грамм по состоянию на февраль 2022 г.
Неметаллы и металлоиды извлекаются в сыром виде из:
- рассол — хлор, бром, йод;
- жидкий воздух — азот, кислород, неон, аргон, криптон, ксенон;
- полезные ископаемые — бор (боратные минералы); углерод (уголь; алмаз; графит); фтор (флюорит); кремний (силикагель); фосфор (фосфаты); сурьма (стибнит, тетраэдрит); йод (в виде йодата натрия и йодида натрия);
- природный газ — водород, гелий, сера; и
- руды, как побочные продукты переработки — германий (цинковые руды); мышьяк (медные и свинцовые руды); селен, теллур (медные руды); и радоновые (урансодержащие руды).
Стоимость[править | править код]
По состоянию на январь 2022 г., хотя нерадиоактивные неметаллы относительно недороги, существуют некоторые исключения. Бор, германий, мышьяк и бром могут стоить от 3 до 11 долларов США за грамм (ср. серебро по цене около 0,75 доллара за грамм). Цены могут резко упасть, если речь идет об оптовых партиях. Фосфор в его наиболее стабильной чёрной форме «может стоить до 1000 долларов за грамм» (примерно в 15 раз дороже золота), тогда как обычный белый фосфор доступен по цене 30 долларов за 100 граммов. Исследователи надеются, что смогут снизить стоимость чёрного фосфора до 1 доллара за грамм. До 2013 г. радон можно было приобрести в Национальном институте стандартов и технологий.по 1636 долларов за единицу выпуска объёмом 0,2 мл, что эквивалентно ок. 86 000 000 долларов за грамм без указания скидки на оптовые партии.
История, предыстория и таксономия[править | править код]
Открытие[править | править код]

Алхимик, открывающий фосфор картина (1771) Джозефа Райта. Алхимик —Хенниг Бранд; свечение исходит от сгорания фосфора внутри колбы.
Большинство неметаллов было открыто в XVIII—XIX веках. До этого в древности были известны углерод, сера и сурьма; мышьяк был открыт в средние века (Альбертом Великим); и Хенниг Бранд выделил фосфор из мочи в 1669 году. Гелий (1868) считается первым (и пока единственным) элементом, не открытым на Земле. Радон был последним открытым неметаллом, который был открыт только в конце XIX века.
Методы, основанные на химии или физике, использовавшиеся при попытках выделения, включали спектроскопию, фракционную перегонку, обнаружение радиации, электролиз, подкисление руды, сжигание, реакции замещения и нагревание: некоторые неметаллы встречались в природе в виде свободных элементов.
Из благородных газов гелий был обнаружен по его жёлтой линии в корональном спектре Солнца, а позднее по наблюдению пузырьков, вырывающихся из растворенного в кислоте уранита UO 2. Неон через ксенон получали фракционной перегонкой воздуха. Впервые радон был обнаружен в составе соединений тория через три года после открытия Анри Беккерелем излучения в 1896 г.
Галогены-неметаллы были получены из их галогенидов электролизом, добавлением кислоты или замещением. Некоторые химики погибли в результате своих экспериментов по выделению фтора.
Среди неклассифицированных неметаллов углерод был известен (или производился) как древесный уголь, сажа, графит и алмаз; азот наблюдался в воздухе, из которого был удален кислород; кислород получали нагреванием окиси ртути; фосфор высвобождается при нагревании гидрофосфата аммония-натрия (Na(NH 4)HPO 4), что обнаруживается в моче; сера встречалась в природе как свободный элемент; и селен был обнаружен в виде остатка в серной кислоте.
Большинство элементов, обычно считающихся металлоидами, были выделены путем нагревания их оксидов (бор, кремний, мышьяк, теллур) или сульфидов (германий). Сурьма была известна в своей естественной форме, а также в том, что её можно было выделить путем нагревания её сульфида.
Происхождение понятия[править | править код]
Различие между металлами и неметаллами возникло запутанным образом из грубого признания природных видов материи, а именно чистых веществ, смесей, соединений и элементов. Таким образом, материю можно было разделить на чистые вещества (такие как соль, бикарбонат натрия или сера) и смеси (например, царская водка, порох или бронза), а чистые вещества в конечном итоге можно было различить как соединения и элементы. «Металлические» элементы тогда, казалось, обладали широко различимыми свойствами, которых не было у других элементов, такими как их способность проводить тепло или их «земли» (оксиды).) с образованием основных растворов в воде, например, как это произошло с негашеной известью (CaO).
Использование термина[править | править код]
Термин «неметаллический» восходит к 1566 году. В опубликованном в том же году медицинском трактате Лойс де Л’Онэ (французский врач) упомянул свойства растительных веществ из металлических и «неметаллических» земель.
В ранней химии Вильгельм Хомберг (немецкий естествоиспытатель) упомянул «неметаллическую» серу в Des Essais de Chimie (1708). Он подверг сомнению пятичастное разделение всей материи на серу, ртуть, соль, воду и землю, как постулировал Этьен де Клав [ фр ] (1641) в «Новом философском свете истинных принципов и элементов природы». Подход Хомберга представляет собой «важный шаг к современной концепции элемента».
Лавуазье в своей «революционной» работе 1789 года Traité élémentaire de chimie опубликовал первый современный список химических элементов, в котором он различал газы, металлы, неметаллы и земли (термоустойчивые оксиды). За первые семнадцать лет работы Лавуазье было переиздано в двадцати трех изданиях на шести языках и «несло… [его] новую химию по всей Европе и Америке».
Предлагаемые критерии различения[править | править код]
В 1809 г. открытие Гемфри Дэви натрия и калия «уничтожило» демаркационную линию между металлами и неметаллами. Раньше металлы различали по их тяжелому весу или относительно высокой плотности. Натрий и калий, с другой стороны, плавали на поверхности воды и, тем не менее, явно были металлами на основании их химического поведения.
Ещё с 1811 года различные свойства — физические, химические и связанные с электронами — использовались в попытках уточнить различие между металлами и неметаллами. В прилагаемой таблице указано 22 таких свойства по типу и порядку дат.
Вероятно, наиболее известным свойством является то, что электропроводность металла увеличивается при понижении температуры, тогда как электропроводность неметалла повышается. Однако эта схема не работает для плутония, углерода, мышьяка и сурьмы. Плутоний, являющийся металлом, увеличивает свою электропроводность при нагревании в диапазоне температур от −175 до +125 °C. Углерод, несмотря на то, что он широко считается неметаллом, также увеличивает свою проводимость при нагревании. Мышьяк и сурьма иногда классифицируются как неметаллы, но действуют аналогично углероду.
Эмсли отметил, что «Ни одно свойство … нельзя использовать для классификации всех элементов как металлов или неметаллов». Kneen et al. предположил, что неметаллы можно различить после того, как был выбран [единственный] критерий металличности, добавив, что «возможно множество произвольных классификаций, большинство из которых, если их выбрать разумно, будут похожими, но не обязательно идентичными». Джонс, напротив, заметил, что «классы обычно определяются более чем двумя атрибутами».
Джонсон предположил, что физические свойства могут лучше всего указывать на металлические или неметаллические свойства элемента, при условии, что в неоднозначных случаях потребуются другие свойства. В частности, он заметил, что все газообразные или непроводящие элементы являются неметаллами; твердые неметаллы металлы бывают твердыми и хрупкими или мягкими и рассыпчатыми, тогда как металлы обычно податливы и пластичны; а оксиды неметаллов являются кислотными.
Как только основа для различения «двух больших классов элементов» установлена, неметаллы оказываются лишенными свойств металлов в большей или меньшей степени. Некоторые авторы дополнительно делят элементы на металлы, металлоиды и неметаллы, хотя все, что не является металлом, на основании классификации является неметаллом.
Разработка подклассов[править | править код]
Базовая систематика неметаллов была создана в 1844 году французским врачом, фармацевтом и химиком Альфонсом Дюпаскье. Чтобы облегчить изучение неметаллов, он писал:
- Они будут разделены на четыре группы или секции, как показано ниже:
- Органогены O, N, H, C
- Сульфуриды S, Se, P
- Хлориды F, Cl, Br, I
- Бороиды Б, Си.
Отголосок четырёхчастной классификации Дюпаскье можно увидеть в современных подклассах. Органогены и сульфуроиды представляют собой набор неклассифицированных неметаллов. Различные конфигурации этих семи неметаллов называются, например, основными неметаллами. биогены; центральные неметаллы; ЧНОПС; основные элементы; «неметаллы»; орфанные неметаллы; или окислительно-восстановительные неметаллы; Хлориды неметаллов стали независимо называть галогенами. Бороидные неметаллы расширились до металлоидов., начиная с 1864 г. Благородные газы, как отдельная группа, причислялись к неметаллам уже с 1900 г.
Сравнение[править | править код]
Некоторые свойства металлов и металлоидов, неклассифицированных неметаллов, неметаллических галогенов и инертных газов приведены в таблице. Физические свойства относятся к элементам в их наиболее стабильных формах в условиях окружающей среды и перечислены в произвольном порядке для удобства определения. Химические свойства перечислены от общих к описательным, а затем к конкретным. Пунктирная линия вокруг металлоидов означает, что, в зависимости от автора, вовлеченные элементы могут быть или не быть признаны отдельным классом или подклассом элементов. Металлы включены в качестве контрольной точки.
Большинство свойств показывают прогрессию слева направо от металлического к неметаллическому характеру или средним значениям. Таким образом, периодическую таблицу можно условно разделить на металлы и неметаллы, причем среди неметаллов наблюдается более или менее четкая градация.
| Некоторые межподклассовые свойства | |||||
| Физическое свойство | Металлы | Металлоиды | Неклассифицированные неметаллы | Неметаллические галогены | благородные газы |
|---|---|---|---|---|---|
| Щелочные, щелочноземельные, лантаноидные, актинидные, переходные и постпереходные металлы | Бор, кремний, германий, мышьяк, сурьма (Sb), теллур | Водород, углерод, азот, фосфор, кислород, сера, селен | Фтор, хлор, бром, йод | Гелий, неон, аргон, криптон, ксенон, радон | |
| Форма и вес |
|
|
|
|
|
| Появление | блестящий | блестящий |
|
|
бесцветный |
| Эластичность | в основном ковкий и пластичный (Hg жидкая) | хрупкий |
|
йод хрупок | непригодный |
| Электрическая проводимость | хорошо |
|
|
|
бедный |
| Электронная структура | металлический (Bi — полуметалл) | полуметалл (As, Sb) или полупроводник |
|
полупроводник (I) или изолятор | изолятор |
| Химическое свойство | Металлы | Металлоиды | Неклассифицированные неметаллы | Неметаллические галогены | благородные газы |
| Щелочные, щелочноземельные, лантаноидные, актинидные, переходные и постпереходные металлы | Бор, кремний, германий, мышьяк, сурьма (Sb), теллур | Водород, углерод, азот, фосфор, кислород, сера, селен | Фтор, хлор, бром, йод | Гелий, неон, аргон, криптон, ксенон, радон | |
| Общее химическое поведение |
|
слабо неметаллический | умеренно неметаллический | сильно неметаллический |
|
| Оксиды |
|
|
|
|
|
| Соединения с металлами | сплавы или интерметаллические соединения | склонны образовывать сплавы или интерметаллические соединения |
|
в основном ионный | простые соединения в условиях окружающей среды неизвестно |
| Энергия ионизации (кДж моль −1)†
(страница данных) |
|
|
|
|
|
| Электроотрицательность (шкала Полинга) †
(страница данных) |
|
|
|
|
|
| † Обозначения «низкий», «средний», «высокий» и «очень высокий» произвольно основаны на диапазонах значений, перечисленных в таблице.
‡ Водород также может образовывать сплавоподобные гидриды |
См. также[править | править код]
- Металлы
Примечания[править | править код]
Комментарии[править | править код]
- ↑ H; N; O, S; F, Cl, Br, I; He, Ne, Ar, Kr, Xe, Rn[1]
- ↑ C; P; Se.[2] On the other hand, these three elements were counted as metalloids in a survey of 194 lists of metalloids, 16, 10, and 46 times respectively.[3]
- ↑ B; Si, Ge; As, Sb; Te[4][5]
- ↑ Al, Ga, In, Tl; Sn, Pb; Bi; Po; At
- ↑ Hydrogen has historically been placed over one or more of lithium, boron,[6] carbon, or fluorine;[7] or over no group at all; or over all main groups simultaneously, and therefore may or may not be adjacent to other nonmetals.[8]
Источники[править | править код]
- ↑ Larrañaga, Lewis & Lewis 2016, p. 988
- ↑ Larrañaga, Lewis & Lewis 2016, p. 988
- ↑ Vernon R 2013, “Which elements are metalloids?”, Journal of Chemical Education, vol. 90, no. 12, 1703‒1707, doi:10.1021/ed3008457
- ↑ Hérold 2006, pp. 149–50
- ↑ Vernon 2020, p. 220
- ↑ Luchinskii & Trifonov 1981, pp. 200–220
- ↑ Jolly 1966, inside cover
- ↑ Rayner-Canham 2020, p. 212

