Общая структурная формула простых эфиров
Просты́е эфи́ры — органические вещества, имеющие формулу R-O-R’, где R и R’ — алкильные, арильные или другие заместители. Простые эфиры являются летучими жидкостями с приятным запахом. Благодаря своей химической инертности и особым сольватационным свойствам они широко используются как растворители в промышленности и лаборатории.
Номенклатура[править | править код]
Рекомендации ИЮПАК позволяют при присвоении названий простым эфирам вида R-O-R’ использовать разные типы номенклатуры:
- заместительную — когда группа R’-O- считается заместителем в родоначальном углеводороде RH;
- радикало-функциональную — называя функцию словом «эфир» (название «оксид» не рекомендуется) и перечисляя названия радикалов R и R’ в виде приставок;
- умножительную (если R и R’ циклические);
- заменительную;
- номенклатуру фанов[1].
Заместительная номенклатура является предпочтительной. В этом случае один из радикалов (R) выполняет роль родоначального углеводорода (RH) и получает название, соответствующее этому углеводороду. Группа R’O- считается заместителем, и её название образуется слиянием названия радикала R’ и приставки окси, например:
- CH3CH2CH2CH2CH2O- — пентилокси-.
В нескольких случаях за заместителем R’O- сохранено традиционное название:
- CH3O- — метокси-; CH3CH2O- — этокси-; CH3CH2CH2O- — пропокси-; CH3CH2CH2CH2O- — бутокси-; C6H5O- — фенокси-; (CH3)3CO- — трет-бутокси-; (CH3)2CHO- — изопропокси-[К 1][1].
В таком случае полные названия простых эфиров выглядят следующим образом:
- CH3OCH3 — метоксиметан;
- CH3CH2OCH3 — метоксиэтан;
- C6H5OCH3 — метоксибензол (также: анизол)[1].
В радикало-функциональной номенклатуре названия заместителей перед словом «эфир» перечисляются в алфавитном порядке:
- CH3OCH3 — диметиловый эфир;
- CH3CH2OCH3 — метилэтиловый эфир;
- PhOCH3 — метилфениловый эфир[1].
Заменительную номенклатуру удобно использовать в случае полиэфиров. В этом случае соединение называется как углеводород, а место, где углеродный атом формально заменён кислородом, называют в виде приставки «окса»-:
- CH3OCH2CH2OCH2CH2OCH2CH2OCH3 — 2,5,8,11-тетраоксадодекан;
- (по заместительной номенклатуре: 1-метокси-2-[2-(2-метоксиэтокси)этокси]этан)[1].
В редких случаях, когда оба заместителя в простом эфире являются циклическими, можно использовать умножительную номенклатуру:
- PhOPh — 1,1′-оксидибензол[1].
Физические свойства и строение[править | править код]
Диэтиловый эфир в бутылке
Физические свойства[править | править код]
Эфиры — бесцветные, подвижные, легкокипящие жидкости с характерным запахом. Эфиры малорастворимы в воде, но хорошо растворяются в органических растворителях и сами растворяют органические соединения[2].
Строение молекул[править | править код]
Валентный угол в молекулах простых эфиров
Строение молекул простых эфиров схоже со строением молекулы воды. Валентный угол С–O–C в диметиловом эфире составляет 112°. Атом кислорода имеет sp3-гибридизацию[3].
Спектральные свойства[править | править код]
Характеристической полосой простых эфиров в инфракрасном спектре является полоса при 1150–1080 см–1, соответствующая колебаниям группы C–O–C[2].
В спектрах 1Н ЯМР группа CH3O алкиловых эфиров имеет сигнал при 3,3-4,0 м. д., а та же группа метилариловых эфиров — при 3,7 м. д. Сигналы протонов двойной связи в виниловых эфирах (вида СН=СН–О) находятся при 5,7-7,5 м. д. (α-положение) и 3,5-5,0 м. д. (β-положение). Если сравнивать эти значения с положением сигналов в аналогичной углеводородной системе СН=СН–С, то сигнал α-углеродного атома оказывается смещённым на +1,2 м. д., а сигнал β-углеродного атома — на –1 м. д.[2][4]
В спектрах 13C ЯМР насыщенных простых эфиров атом углерода, находящийся в α-положении от атома кислорода, даёт сигнал в области 50-100 м. д., а более удалённые атомы углерода — в области 10-60 м. д. У виниловых эфиров углероды двойной связи (С=С–О) дают сигналы при 115-165 м. д. (α-положение) и 70-120 м. д. (β-положение). При этом, если сравнивать спектры с углеводородными системами типа С=С–С, то сигнал α-углеродного атома в виниловых эфирах оказывается смещённым на +15 м. д., а сигнал β-углеродного атома — на –30 м. д. У ароматических простых эфиров сигнал α-углеродного атома кольца наблюдается при 135-155 м. д. (смещение +25 м. д. по сравнению с ареном). Сигналы остальных ароматических атомов углерода при введении эфирной группы смещаются на –15 м. д. (орто-положение), +1 м. д. (мета-положение) и –8 м. д. (пара-положение)[4].
В масс-спектрах алифатических простых эфиров молекулярный ион проявляется в виде слабого сигнала, для ароматических простых эфиров — в виде интенсивного сигнала. Основное направление фрагментации молекулярного иона — разрыв связи между α- и β-углеродными атомами и гетеролитический разрыв связи C–O. В результате возникают ионы с массой (m/z), равной 31, 45, 59… М–46, М–33, М–18[4].
Для алкилариловых простых эфиров фрагментация протекает через потерю алкильной цепи. У диариловых эфиров молекулярный ион или ион М–Н теряет группу CO, а также происходит разрыв связи между атомом кислорода и арильным заместителем. Также в ходе масс-спектрометрии простые эфиры претерпевают перегруппировки с отщеплением молекулы спирта либо — в случае ариловых простых эфиров — с отщеплением алкена и образованием фенола[4].
Получение[править | править код]
Межмолекулярная дегидратация спиртов[править | править код]
При нагревании первичных спиртов с концентрированной серной кислотой при 130—140 °С образуются простые эфиры. С точки зрения механизма реакции, происходит алкилирование спирта под действием катиона алкоксония ROH+
2 или полуэфира серной кислоты ROSO3H[5].
Этот метод пригоден для получения некоторых простейших эфиров: диэтилового, дипропилового, дибутилового эфиров, тетрагидрофурана и диоксана. Недостатком этого метода является то, что вторичные и третичные спирты в этих условиях дегидратируются, превращаясь в алкены. Также он не позволяет получать несимметричные простые эфиры из двух разных спиртов, поскольку при этом получается смесь трёх продуктов[5].
Промышленным вариантом этой реакции является дегидратация спиртов в газовой фазе над оксидом алюминия, бокситом и другими катализаторами при нагревании до 180—250 °С. Выход эфиров в таких процессах составляет до 75 %[6].
Реакция алкенов со спиртами[править | править код]
Спирты присоединяются к алкенам в присутствии кислотных катализаторов (серной, фосфорной кислоты, хлороводорода, фторида бора и др.), образуя простые эфиры[2].
В промышленности таким способом получают простые эфиры из изобутилена либо изоамилена и метанола либо этанола, нагревая их над катионитом в кислой форме. При этом получают трет-бутилметиловый, трет-бутилэтиловый, трет-амилметиловый и трет-амилэтиловый эфиры[6].
В лабораторных условиях большее значение имеет реакция алкоксимеркурирования алкенов. Она аналогична реакции оксимеркурирования, при помощи которой алкены селективно превращают в спирты, однако в данном случае роль нуклеофильного реагента выполняет не вода, а спирт, который берут в качестве растворителя. Сам алкен вводят в реакцию с ацетатом ртути либо — для получения эфиров со вторичной или третичной алкильной группой — трифторацетатом ртути, а затем полученный продукт демеркурируют при помощи боргидрида натрия. Формально эта реакция представляет собой присоединения спирта по двойной связи согласно правилу Марковникова[7].
Реакция Вильямсона[править | править код]
Симметричные и несимметричные простые эфиры можно получить по реакции Вильямсона между алкоголятами и галогеналканами (либо сульфонатами). Эта реакция представляет собой нуклеофильное замещение по механизму SN2, и для неё верны соответствующие закономерности. Например, если в конечном продукте содержится вторичный или третичный заместитель, его следует вводить при помощи алкоголята, а не галогенида, поскольку в ином случае вместо замещения будет происходить реакция элиминирования. Наилучшими галогенидами в этой реакции являются первичные галогениды, а также аллил- и бензилгалогениды[8].
Симметричные простые эфиры можно получить из двух молекул галогеналкана в присутствии оксида серебра(I). Так, например, поступают в случае ди-трет-бутилового эфира, который трудно получить другими способами: трет-бутилхлорид вводят в реакцию с карбонатом серебра[6].
Интерес к реакции Вильямсона связан также с получением краун-эфиров. В этих процессах катион металла в алкоголяте выполняет роль матрицы при сборке макроцикла. Радиус ионов лития, натрия и калия соответствует размеру полости в 12-краун-4, 15-краун-5 и 18-краун-6, и наличие этих катионов сильно повышает выход соответствующих краун-эфиров[9].
Другие методы[править | править код]
Метиловые простые эфиры получают по реакции спиртов с диазометаном в присутствии кислот Льюиса (фторида бора, хлорида алюминия и др.)[2].
Химические свойства[править | править код]
Простые эфиры являются химически инертными веществами. Они устойчивы ко многим реагентам основной природы: не реагируют с гидридами, амидами щелочных металлов, комплексными гидридами, щелочными металлами. Также простые эфиры не гидролизуются щелочами[10].
Основные свойства[править | править код]
Химическая инертность простых эфиров позволяет применять их в качестве растворителей. В частности, они используются в реакциях восстановления алюмогидридом лития и магнийорганическом синтезе. Их сольватирующая способность объясняется тем, что они являются жёсткими основаниями Льюиса и образуют устойчивые комплексы с реактивами Гриньяра, литийорганическими соединениями, а также другими типичными кислотами Льюиса[10].
Также простые эфиры образуют комплексы с галогенами. Например, раствор иода в диэтиловом эфире имеет коричневую окраску, а не фиолетовую, как в алканах, что объясняется образованием комплекса и изменением спектра поглощения. С очень сильными алкилирующими реагентами простые эфиры образуют соли триалкилоксония[10].
Кислотное расщепление[править | править код]
Концентрированные бромоводородная и иодоводородная кислоты (48 %) при нагревании до 120—150 °С расщепляют простые эфиры с образованием спирта и галогеналкана. Легче всего расщепляются простые эфиры, имеющие третичную алкильную группу. Эту реакцию в 1861 году открыл А. М. Бутлеров[11].
Механизм кислотного расщепления основан на реакции SN1 или SN2, которая протекает в эфире, протонированном по атому кислорода. Если эфир содержит первичные или вторичные заместители, галогенид-ион атакует его протонированную форму по менее замещённому атому углерода. При одновременном присутствии первичной и вторичной алкильной группы галогенид селективно атакует первичную группу, в результате чего образуются первичный галогенид и вторичный спирт[11].
Простые эфиры с третичными заместителями реагируют по механизму SN1 в более мягких условиях. Их можно расщеплять трифторуксусной кислотой[11]. Аналогичное действие на простые эфиры оказывают хлорид бора и бромид бора, но в их случае расщепление происходит уже при −20 °С, что может быть полезно в том случае, когда в жёстких условиях протекают побочные реакции[11].
Метил- и этилалкиловые эфиры расщепляют иодоводородной кислотой, чтобы количественно определить наличие метокси- и этоксигрупп по методу Цейзеля[2]. Выделившиеся при такой обработке метилиодид и этилиодид пропускают через раствор нитрата серебра и определяют их количество по массе выпавшего иодида серебра либо окислением (по количеству образовавшегося иода)[2].
Радикальное галогенирование[править | править код]
По аналогии с алканами, простые эфиры вступают в реакции радикального галогенирования, однако в случае эфиров эта реакция протекает региоселективно по положению, соседнему с атомом кислорода (по α-положению). Эта селективность связана с тем, что галогенирование протекает через образование особо устойчивого радикала, где 2p-орбиталь с неспаренным электроном перекрывается с 2p-орбиталью, на которой находится неподелённая электронная пара атома кислорода[12].
Окисление[править | править код]
При доступе воздуха, особенно на свету, простые эфиры окисляются по радикальному механизму и образуют неустойчивые гидропероксиды и пероксиды, которые могут разлагаться со взрывом. Это известно из многочисленных случаев взрывов при перегонке эфиров, которые происходили из-за накопления в кубе менее летучих пероксидов и их резкого разложения при попытке отогнать растворитель досуха. Катализировать этот процесс могут любые источники радикалов[13].
трет-Бутилметиловый и трет-амилметиловый эфиры более устойчивы к радикальному окислению и образуют меньше пероксидов. Предотвратить этот процесс можно при помощи ловушек радикалов, например фенолов и аминов. Часто в диэтиловый эфир добавляют ионол (1-30 мг/кг) либо другие стабилизаторы[6].
Применение[править | править код]
Простые эфиры используются как растворители для жиров, смол, красителей и лаков. Также они используются в качестве растворителей в органических реакциях. Некоторые эфиры применяют как анестетики, топливные присадки для повышения октанового числа и смазочные масла. Некоторые простые эфиры являются инсектицидами и фумигантами, поскольку их пары токсичны для насекомых[2][14].
Ариловые простые эфиры находят применение в качестве антиоксидантов и консервантов. Некоторые ароматические простые эфиры имеют приятный запах, благодаря чему их используют в парфюмерной промышленности[2][14].
См. также[править | править код]
- Эпоксиды
- Краун-эфиры
Примечания[править | править код]
- Комментарии
- ↑ От приставки «изопропокси»-, в отличие от других сохранённых названий, не разрешается образовывать производные названия путём дальнейшего замещения.
- Источники
- ↑ 1 2 3 4 5 6 Favre H. A., Powell W. H. Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013. — The Royal Society of Chemistry, 2014. — P. 699–707. — doi:10.1039/9781849733069-FP001.
- ↑ 1 2 3 4 5 6 7 8 9 Химическая энциклопедия, 1998.
- ↑ Реутов, 2014, с. 294.
- ↑ 1 2 3 4 Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений : Таблицы спектральных данных / Пер. с англ. Б. Н. Тарасевича. — М. : БИНОМ. Лаборатория знаний, 2006. — С. 62–63. — ISBN 5-94774-572-0.
- ↑ 1 2 Реутов, 2014, с. 263, 294–295.
- ↑ 1 2 3 4 Ullmann, 2010, p. 436.
- ↑ Реутов, 2014, с. 295.
- ↑ Реутов, 2014, с. 264–265.
- ↑ Реутов, 2014, с. 296–298.
- ↑ 1 2 3 Реутов, 2014, с. 298–300.
- ↑ 1 2 3 4 Реутов, 2014, с. 300–301.
- ↑ Реутов, 2014, с. 301–302.
- ↑ Реутов, 2014, с. 302–303.
- ↑ 1 2 Kirk-Othmer, 2001, p. 427.
Литература[править | править код]
- Максимова Л. Н. Эфиры простые // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 508–509. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия : в 4 т.. — 5-е изд. — М. : БИНОМ. Лаборатория знаний, 2014. — Т. 2. — С. 293–310. — ISBN 978-5-9963-1536-9.
- Sakuth M., Mensing T., Schuler J., Heitmann W., Strehlke G., Mayer D. Ethers, Aliphatic (англ.) // Ullmann’s Encyclopedia of Industrial Chemistry. — Wiley, 2010. — doi:10.1002/14356007.a10_023.pub2.
- Kirk-Othmer Encyclopedia of Chemical Technology. — 4th ed. — Wiley, 2001. — Vol. 9. — P. 423–427.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
План урока:
Строение простых эфиров
Номенклатура простых и сложных эфиров
Изомерия простых и сложных эфиров
Классификация простых и сложных эфиров
Способы получения простых и сложных эфиров
Физические свойства простых и сложных эфиров
Химические свойства простых и сложных эфиров
Применение простых и сложных эфиров
Строение простых эфиров
Для атомов углерода насыщенных простых эфиров характерно состоянии sp3-гибридизации, а в ненасыщенных соединениях – sp2-гибридизации.
Строение молекулы диметилового эфира
Номенклатура эфиров
Если в простых эфирах R и R’ идентичны, то молекула симметрична, а если различны, то молекула несиметрична. Согласно международной номенклатуре названия простых эфиров формируются с помощью суффикса «-овый» и слова «эфир».
Например, симметричная молекула С2Н5-О-С2Н5 называется диэтиловым эфиром.
В несимметричной молекуле радикалы располагаются по алфавиту. Например, молекула СН3-О-С2Н5 называется метилэтиловым эфиром.
Согласно систематической номенклатуре в сложных эфирах в спиртовом радикале суффикс заменяется на «-оат». В названиях сложных эфиров присутствуют название кислотного аниона и спиртового радикала.
Строение сложных эфиров
Например, C2H5-C(O)O-CH3 – метилэтаноат. С2Н5-С(О)О-С2Н5 – этилэтаноат.
Название соединения в тривиальной номенклатуре формируется названием спиртового радикала, слова «эфир» и названием кислоты.
Например, C2H5-C(O)O-CH3 также можно назвать как метиловый эфир этановой кислоты, а С2Н5-С(О)О-С2Н5 – этиловый эфир этановой кислоты.
Изомерия эфиров
Изомерия простых эфиров
Изомерия сложных эфиров
Классификация эфиров
Виды простых эфиров
Простые эфиры классифицируются по строению углеводородного скелета.
Виды сложных эфиров
Сложные эфиры классифицируются на несколько видов.
- Сложные эфиры, образованные низшими карбоновыми кислотами и спиртами
С5Н11-С(О)О-СН3 – метиловый эфир пентановой кислоты
С2Н5-С(О)О-С3Н7 – пропиловый эфир этиловой кислоты
- Сложные эфиры, образованные высшими карбоновыми кислотами и спиртами
СН3-(СН2)14-С(О)О-(СН2)29-СН3 – мирициловый эфир пальмитиновой кислоты (один из компонентов пчелиного воска)
СН3-(СН2)14-С(О)О-(СН2)15-СН3 – цетиловый эфир пальмитиновой кислоты (основной компонент спермацета)
- Жиры
Жиры отличаются от других представителей класса тем, что они образованы от глицерина ОН-СН2-СН(ОН)-СН2-ОН.
Общая формула жиров
Способы получения простых и сложных эфиров
Получение простых эфиров
Простые эфиры не встречаются в природе, но есть множество химических способов получения эфиров.
- Дегидратация между молекулами спиртов
С помощью этого способа получают симметричные молекулы. Реакция дегидратации (отщепления молекулы воды) протекает в присутствии минеральной кислоты и при нагревании.
C5H11-OH + HO-C5H11 → C5H11-O-C5H11 + Н2О
- Реакция Вильямсона (взаимодействие галогенпроизводных с алкоголятами)
С помощью этого метода можно синтезировать несимметричные молекулы.
С2Н5ONa + C3H7Cl → C2H5-O-C3H7 + NaCl
- Окисление алкенов
Данным способом можно получать циклические соединения класса. Для проведения реакции необходимо нагревание и наличие катализатора.
Способ получения сложных эфиров
Реакция этерификации протекает в присутствии минеральной кислоты.
CH3-COOH + C2H5OH → CH3-C(O)O-C2H5 + H2O
Физические свойства простых и сложных эфиров
Физические свойства простых эфиров
Для простых эфиров не характерно твердое состояние. Диметиловый эфир и метилэтиловый эфир – газы, а все остальные представители класса находятся в жидком состоянии. Простые эфиры кипят при более низких температурах, по сравнению со спиртами. Также им характерен приятный и сладкий запах.
Диэтиловый эфир – бесцветная жидкость, кипящая при температуре 35,5˚С. Он малорастворим в воде, но хорошо растворим в этиловом спирте. Температура воспламенения – 9,4˚С. При взаимодействии с воздухом образуется взрывоопасная смесь. Используется как растворитель. Это ядовитое вещество, которое опасно тем, что вызывает привыкание.
Диэтиловый эфир
Диоксан – хороший растворитель, из-за чего его иногда называют «органической водой». Температура кипения – 101˚С. Диоксан токсичен и ядовит.
1,4-диоксан
Простые эфиры не растворимы в воде. Эта особенность связана с неспособностью образовывать водородные связи. Простые эфиры – отличные растворители.
Физические свойства сложных эфиров
Сложные эфиры, образованные от низших карбоновых кислот и спиртов, находятся в жидком состоянии. Они обладают приятными запахами и не растворяются в воде. Приятные цветочные и плодовые запахи обусловлены наличием сложных эфиров.
У сложных эфиров более низкие температуры плавления и кипения, чем у карбоновых кислот. Эта особенность связана с отсутствием межмолекулярных водородных связей.
Сложные эфиры, образованные от высших карбоновых кислот и спиртов – воски. У них отсутствуют запахи. Также они совсем не растворимы в воде, но растворимы в органических растворителях. Воски бывают растительными, животными, ископаемыми и синтетическими.
Соты из пчелиного воска
Растительные воски можно встретить на поверхностях листовых пластин, стеблей, плодов. Они защищают от проникания лишней воды, высыхания, попадания микроорганизмов. Наиболее популярный животный воск – пчелиный. Из него насекомые строят соты. Также животный воск находится на шерсти животных. Он предотвращает попадание избыточной влаги на кожу.
Ланолин (воск шерсти животных)
Представитель ископаемых восков – горный воск, который представляет собой минерал из группы нефтяных битумов. Синтетические воски получают на основе нефтяных и смоляных парафинов и их производных.
Химические реакции простых и сложных эфиров
Химические реакции простых эфиров
- Взаимодействие с йодоводородной (HI) или бромоводородной (HBr) кислотой
Под действием концентрированной кислоты происходит разложение простого эфира.
R-O-R’ + HI →R-OH + R’-I
- Взаимодействие с соляной кислотой (HCl)
В результате данной реакции образуются нестойкие соли оксония.
- Взаимодействие с кислородом (окисление)
При хранении простых эфиров на воздухе образуются перекиси.
CH3-O-CH3 + O2→ CH3-O-O-CH3
Из-за образованных перекисей в процессе перегонки эфира может произойти взрыв, поэтому особенно важно очищать эфиры перед началом работы.
Химические реакции сложных эфиров
Химические реакции сложных эфиров обусловлены нуклеофильной атакой по атому углерода, находящимся в карбонильной группе, и замещением алкоксигруппы.
- Взаимодействие с водой (гидролиз)
При кислотном гидролизе сложный эфир превращается в исходную карбоновую кислоту и спирт. Реакция проходит в присутствии минеральной кислоты.
CH3-C(O)O-C2H5 + H2O → CH3COOH + C2H5OH
При щелочном гидролизе образуются соль карбоновой кислоты и спирт. Данная реакция необратима.
CH3-C(O)O-C2H5 + NaOH→ CH3-C(O)ONa + C2H5OH
Следует обратить внимание на то, что кислотный гидролиз обратим.
- Взаимодействие с водородом (гидрирование, или восстановление)
В процессе гидрирования образуются две молекулы спирта. Реакция идет при наличии катализатора.
C2H5-C(O)O-C2H5 + 2H2→ 2C2H5OH
CH3-C(O)O-C2H5 + 2H2→ CH3OH + C2H5OH
- Взаимодействие с аммиаком
При взаимодействии сложных эфиров и аммиака образуются амиды кислот и спирты.
C2H5-C(O)O-C3H7 + NH3→ C2H5-C(O)NH2 + C3H7OH
- Взаимодействие с кислородом (горение)
2СН3-С(О)О-СН3 + 7О2→2СО2 + 6Н2О
Применение эфиров
Простым эфирам характерна химическая инертность, поэтому они могут играть роль растворителя. Эфиры с разветвленными радикалами применяются в качестве антидетонационных добавок в моторных топливах. Также благодаря приятным запахам их можно встретить в парфюмерной продукции.
Сложные эфиры используются в парфюмерной, косметической продукции, пищевой промышленности, производстве лаков, красок, клеев и лекарственных препаратов. Также они могут выступать в роли растворителей.
Применение сложных эфиров.
Из сложных эфиров низших карбоновых кислот и спиртов, производят различные эссенции, а от ароматических спиртов – парфюмерную продукцию. Воски входят в состав смазочных веществ, кремов и мазей.
В XIX-ХХ веках ученые получили и изучили сложные эфиры, которые легли в основу многих лекарств. В число препаратов из эфиров входят салол, валидол. Раньше в качестве обезволивающего средства использовался метилсалицилат, который на современном рынке вытеснен другими эффективными лекарственными препаратами.
Dmitry Pyatakov
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Общие методы получения простых эфиров
К общим методам получения простых эфиров относятся:
- реакция А. Вильямсона;
- межмолекулярная дегидратация спиртов;
- алкоксимеркурирование алкенов.
Синтез А. Вильямсона заключается в обработке алкогалятов калия или натрия галоидными соединениями, алкилсульфатами или алкилсульфонатами и имеет вид:
Рисунок 1.
Из двух радикалов один $R$ переходит в эфир из молекулы спирта, а второй $R’$ переходит из молекулы галогеналкана. Наилучший выход эфира можно получить, если $R’$ является первичным радикалом. В этом случае реакция идет по механизму бимолекулярного нуклеофильного замещения $S_N2$, например:
Рисунок 2.
Например, получение метилэтилового эфира из этилята натрия:
Рисунок 3.
Синтез А. Вильямсона пригоден только для первичных $RX$, так как трет-алкоголят-ионы очень объемистые.
Межмолекулярной дегидратацией первичных спиртов в присутствии кислых катализаторов можно получить симметричные простые эфиры, например, получение диметилового эфира из метанола:
Рисунок 4.
«Получение простых эфиров» 👇
Для других спиртов с дегидратацией конкурирует образование алкенов. Но при определенных условиях можно получить простой эфир:
Рисунок 5.
Межмолекулярная дегидратация спиртов не применяется для получения эфиров фенолов, так как гидроксил в этих соединениях прочно связан. Спирты с реакционноспособным гидроксилом, например, бензгидрол $(C_6H_5)_2CHOH$ или бензиловый спирт $C_6H_5CH_2OH$, очень легко этерифицируются.
В зависимости от строения спирта, дегидратация протекает по $S_N1$- или $S_N2$-механизму замещения. Реакция межмолекулярной дегидратации является хорошим методом получения смешанных спиртов, если группа $R$-первичная, а $R’$- третичная.
Специфическим катализатором при получении простых эфиров из аллиловых спиртов является платинохлористоводородная кислота.
Рисунок 6.
Межмолекулярная дегидратация имеет практическое значение для получения эфиров низших спиртов, особенно этилового эфира.
Реакцию этерификации можно осуществить в условиях гетерогенного катализа, пропуская пары спирта над $Al_2O_3$, $ThO_2$, $TiO_2$, $W_2O_5$ или над квасцами при температуре 135-140$^circ$С. В этой реакции применяют те же реактивы, что и для получения этилена. Однако будет иным соотношение исходных веществ и более низкая температура.
Алкоксимеркурирование алкенов начинается с атаки двойной связи олефина катионом $^+HgOCOCH_3$, в результате образуется интермедиат в виде меркуриониевого катиона, в последствии раскрывающегося в результате нуклеофильной атаки спирта по наиболее замещенному углеродному атому:
Рисунок 7.
При синтезе эфиров, имеющих вторичный или третичный алкил, применяют трифторацетат ртути (I), реакция протекает в спирте:
Рисунок 8.
Простые эфиры можно получить метилированием спиртов с помощью диазометана. Эта реакция дает особенно хорошие результаты в случае незатрудненных первичных и вторичных спиртов. Реакция протекает в присутствии кислого катализатора $HBF_4$ или $BF_3$ (кислоты с нуклеофильными анионами не применяют). Реакция протекает с образованием промежуточного иона метил-диазония ${CH_3N_3}^+$.
Рисунок 9.
Примеры использования метода А. Вильямсона
В основном синтез А. Вильямсона применяют для получения эфиров фенола.
Например: получение анизола (метилового эфира фенола) из фенолята натрия и йодистого метила:
Рисунок 10.
Подобным образом можно получить фенетол $C_6H_5OC_2H_5$ – этиловый эфир фенола.
Йодистые алкилы можно заменить соответствующими сульфатами, которые обладают подобной реакционной способностью.
Рисунок 11.
Методом А. Вильямсона можно получить ароматические эфиры, но реакция при этом будет протекать тяжелее в результате пониженной реакционной способности галоидного атома, связанного с ароматическим ядром.
Окись дифенила – дифениловый эфир можно получить при нагревании сухого фенолята натрия с бромбензолом до 210$^circ$С в присутствии катализатора порошка меди
Рисунок 12.
Получение замещенных эфиров
Например, необходимо получить дивиниловый эфир $CH_2=CH-O-CH=CH_2$.
Для образования дивинилового эфира нужно получить двойную углерод-углеродную и эфирную связь. Лучшим методом получения ненасыщенного эфира является дегидрогалогенирование галогенэфира.
Пути получения эфира с двумя хлорэтильными группами ($ClCH_2CH_2-$):
-
Хлорирование эфира. Однако хлорирование диэтилового эфира не дает нужного продукта, а полихлорирование эфира ведет к накоплению атомов хлора в одной этильной группе.
-
Превращение хлорсоединения в эфир. Хлорэтиловый эфир можно синтезировать дегидратацией хлорэтилового спирта
Рисунок 13.
Несимметричный эфир можно получить по реакции Вильямсона, например, получение фенил-n-нитробензилового эфира
Рисунок 14.
Эфир получают в результате взаимодействия фенолята натрия с n-нитробензилхлоридом. Фенолят натрия образуется при действии раствора гидроксида натрия на фенол. n-Нитробензилхлорид получают свободнорадикальным хлорированием n-нитротолуола, который образуется при нитровании толуола.
Рисунок 15.
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Простыми эфирами называют органические вещества, в которых два углеводородных радикала связаны атомом кислорода: R’–O–R”, где R’ и R” — различные или одинаковые радикалы.
Простые эфиры могут быть предельными, непредельными, циклическими, ароматическими.
предельные
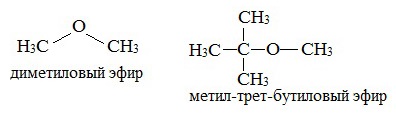
непредельные
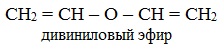
ароматические

циклические
Простые эфиры рассматриваются как производные спиртов. Названия этих соединений строятся из названий радикалов (в порядке возрастания молекулярной массы) и слова «эфир». Например, CH3-O-CH3 — диметиловый эфир; C2H5-O-CH3 — метилэтиловый эфир.
Физические свойства
Два первых простейших представителя – диметиловый и метилэтиловый эфиры – при обычных условиях газы, все остальные – жидкости.
Диэтиловый эфир (C2H5-O-C2H5)– бесцветная легкокипящая прозрачная жидкость (t кип. 35,5 °С), малорастворимая в воде. С этиловым спиртом смешивается в любых отношениях. Температура воспламенения – 9,4°С, образует с воздухом взрывоопасную смесь. Вызывает набухание резин. Широко применяется в качестве растворителя, в медицине (ингаляционный наркоз), вызывает привыкание человека, ядовит.
Диоксан (т. кип. 101°С) — хороший растворитель, смешивается как с водой, так и с углеводородами. За эти качества его назвали «органической водой». Достаточно токсичен. Значительно более опасны галогенсодержащие дибензопроизводные диоксана: диоксин (2,3,7,8-тетрахлордибензо-п-диоксин).
Простые эфиры имеют более низкие температуры кипения и плавления, чем изомерные им спирты. Эфиры практически не смешиваются с водой. Это объясняется тем, что простые эфиры не образуют водородных связей, т.к. в их молекулах отсутствуют полярные связи О-Н.
Простые эфиры хорошо растворяют многие органические вещества и поэтому часто используются как растворители.
Эфиры имеют приятный запах.
Химические свойства
Простые эфиры — малоактивные соединения, они значительно менее реакционноспособны, чем спирты.
1.Расщепление простых эфиров HJ и HBr
Простые эфиры разлагаются под действием концентрированных иодоводородной или бромоводородной кислот:
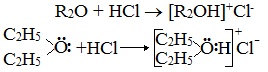
2. Образование комплексных соединений
Образование нестойких солей оксония (подобных солям аммония) в результате взаимодействия с сильными кислотами:
3. Окисление эфиров, образование перекисей
Несмотря на относительную химическую инертность, эфиры легко образуют при хранении на воздухе перекиси:
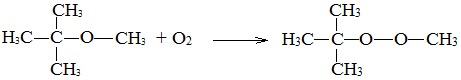
Перекиси являются причиной взрывов в конце перегонки эфиров, поэтому эфиры тщательно очищают от перекисей перед перегонкой и применением.
Получение
1. Межмолекулярная дегидратация спиртов
Симметричные простые эфиры R–O–R получают при межмолекулярной дегидратации спиртов:
При этом в одной молекуле спирта разрывается связь О-Н, а в другой — связь С-О. Реакцию можно рассматривать как нуклеофильное замещение группы HО– (в одной молекуле спирта) на группу RO– (от другой молекулы):
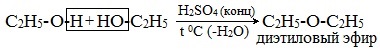
2. Взаимодействие галогенпроизводных с алкоголятами (реакция Вильямсона)
Эфиры несимметричного строения R–O–R’ образуются при взаимодействии алкоголята и галогенуглеводорода. Например, метилэтиловый эфир можно получить из этилата натрия и хлорметана:
В этой реакции происходит нуклеофильное замещение галогена (Cl–) на алкоксигруппу (CH3O–):
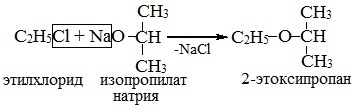
3. Дегидратация спиртов в присутствии ионов водорода как катализаторов
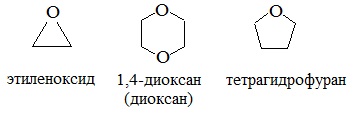
4. Получение гетероцикических кислородсодержащих соединений (циклические простые эфиры)
этиленоксид (эпоксид)

диоксан
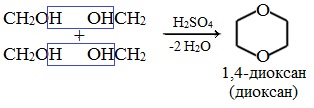
Применение
Вследствие относительной химической инертности, эфиры часто применяются в качестве органических растворителей (диэтиловый эфир, тетрагидрофуран, диоксан).
Эфиры с разветвленными алкильными радикалами (например, метил-трет-бутиловый эфир) используются в последнее время в качестве антидетонационных добавок в моторные топлива (бензины), заменяя чрезвычайно вредный тетраэтилсвинец (ТЭС) — Pb (CH3CH2)4.
Простые эфиры фенолов и нафтолов имеют своеобразные запахи и применяются в парфюмерии.
Химические свойства фенолов



![{displaystyle {mathsf {[R!!-!!CH_{2}!!-!!O!!-!!R']^{+cdot }rightarrow R^{cdot }+CH_{2}!!=!!O^{+}!!-!!R'}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/96fdcf2e8eb2a3987b184be2ced83be3c932c8fc)
![{displaystyle {mathsf {[R!!-!!O!!-!!R']^{+cdot }rightarrow R!!-!!O^{cdot }+R'^{+}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1a769aa926ab09e4045adf2052448760fc6daf3)
![{displaystyle {mathsf {[PhOCH_{2}CH_{2}R]^{+cdot }rightarrow [PhOH]^{+cdot }+CH_{2}!!=!!CH!!-!!R}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ed9a7f571413062fc01fc018e1799dc3e482c5d8)
![{displaystyle {mathsf {2~CH_{3}CH_{2}OH{xrightarrow[{}]{96;%~H_{2}SO_{4},~135~^{circ }C}}CH_{3}CH_{2}OCH_{2}CH_{3}+H_{2}O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f30a81a58275f461409a664e046d5466efa4ce47)
![{displaystyle {mathsf {(CH_{3})_{2}C!!=!!CH_{2}+CH_{3}OH{xrightarrow[{}]{BF_{3},~100~^{circ }C}}(CH_{3})_{2}C(OCH_{3})CH_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cae2b46d4175f2a7948e0a0f142f0dc223478152)
![{displaystyle {mathsf {RCH!!=!!CH_{2}{xrightarrow[{}]{Hg(OAc)_{2};~EtOH}}RCH(OEt)!!-!!CH_{2}!!-!!HgOAc{xrightarrow[{}]{NaBH_{4}}}RCH(OEt)!!-!!CH_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3cca4ef9cef59a53e19a2c9f3ddc13d498875655)



![{displaystyle {mathsf {ROH+CH_{2}N_{2}{xrightarrow[{}]{Al(OR')_{3}}}ROCH_{3}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3774930b54fff27eaa75674f75ddd332f4054634)

![{displaystyle {mathsf {R_{2}O+RF{xrightarrow[{}]{SbF_{5}}}R_{3}O^{+}SbF_{6}^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/352d0e8b9924f9578873f155afcb18a955edafd8)
![{displaystyle {mathsf {CH_{3}OCH(CH_{3})_{2}{xrightarrow[{}]{H^{+}}}CH_{3}OH^{+}CH(CH_{3})_{2}{xrightarrow[{}]{I^{-}}}CH_{3}I+HOCH(CH_{3})_{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9597978c183926bc4c2db779fcb053be62548237)
![{displaystyle {mathsf {CH_{3}CH_{2}OCH_{2}CH_{3}+Cl_{2}{xrightarrow[{}]{hv,~-20~^{circ }C}}CH_{3}CHClOCH_{2}CH_{3}+HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e3b299f22f3b07d83110508b0ab094466e7c0194)

































