Вспоминаем формулу: A = N + Z, где N – число протонов, A – массовое число, Z – заряд ядра атома (число протонов или порядковый номер элемента). Число электронов численно равно заряду ядра или порядковому номеру элемента.
Натрий (Na)
A = 23, Z = 11
N = 23 – 11 = 12
Ответ: 11 протонов, 11 электронов и 12 нейтронов.
Фосфор (P)
A = 31, Z = 15
N = 31 – 15 = 16
Ответ: 15 протонов, 15 электронов и 16 нейтронов.
Золото (Au)
A = 197, Z = 79
N = 197 – 79 = 118
Ответ: 79 протонов, 79 электронов, 118 нейтронов.
Если это не совсем понятно, рекомендую мануал как определить число протонов и нейтронов в атоме
Лабораторный опыт № 3
1. Какие научные эксперименты доказали, что атом – сложная частица, что он делим?
3. Пользуясь этимологическим словарём, объясните, почему планетарную модель строения атома, предложенную Э. Резерфордом, называют также нуклеарной. Почему протоны и нейтроны вместе называют нуклонами?
4. Порядковый номер элемента в таблице Д. И. Менделеева равен 35. Какой это элемент? Чему равен заряд ядра его атома? Сколько протонов, электронов и нейтронов в его атоме?
5. На уроках биологии вы рассматривали клетки растений, используя световой микроскоп. Каков принцип действия этого микроскопа?
6. Что выступает в роли аналога света в сканирующем микроскопе? Каков принцип действия этого микроскопа?
7. Что такое нанотехнологии? Почему эта отрасль науки и производства получила такое название?
помогите мне по химии. определите число протонов, электронов и нейтронов в атомах элементов: натрия,фосфора,золота.
Ученик
(79),
закрыт
9 лет назад
Дополнен 11 лет назад
ПОРЯДКОВЫЙ НОМЕР ЭЛЕМЕНТА В ТАБЛИЦЕ Д. И. МЕНДЕЛЕЕВА РАВЕН 35.КАКОЙ ЭТО ЭЛЕМЕНТ? ЧЕМУ РАВЕН ЗАРЯД ЯДРА ЕГО АТОМЕ? СКОЛЬКО ПРОТОНОВ, ЭЛЕКТРОНОВ И НЕЙТРОНОВ В ЕГО АТОМЕ?
NiNa Martushova
Искусственный Интеллект
(153334)
11 лет назад
Берешь таблицу Менделеева и смотришь на порядковый номер элемета, -это и есть заряд ядра или число протонов в ядре. У натрия он 11,значит в его ядре 11 протонов. Поскольку атом заряда не имеет, значит число протонов равно числу электронов. +11-11=0. Здесь же находим массу атома натрия, она равна 23. Вся масса атома соредоточена в ядре и равна сумме протонов и нейтронов в ядре, значит в ядре атома натрия содержится 23-11=12нейтронов. Сделай тоже самое с фосфором и золотом. Удачи!
Характеристика фосфора
Положение в ПСХЭ
Фосфор (P) располагается во 3 периоде, в V группе, главной подгруппе, имеет порядковый номер 15.
Атомные числа
A (массовое число) = 31
P (число протонов) = 15
N (число нейтронов) = A – Z = 31 – 15 = 16
ē (число электронов) = 15
Электронное строение атома
P
+15
2
8
5
15P 1s2 2s2 2p6 3s2 3p3
Валентные электроны
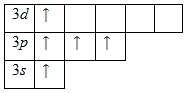
| 15P | ↑↓ | ↑ | ↑ | ↑ | ||||||||
| 3s | 3p | 3d |
| 15P* | ↑ | ↑ | ↑ | ↑ | ↑ | |||||||
| 3s | 3p | 3d |
Степени окисления
минимальная: -3
максимальная: +5
Свойства простого вещества
Фосфор – p-элемент, неметалл.
Высший оксид
P2O5 – оксид фосфора (V).
Проявляет кислотные свойства:
P2O5 + 6NaOH ⟶ 2Na3PO4 + 3H2O
Высший гидроксид
H3PO4 – ортофосфорная кислота.
Проявляет кислотные свойства:
H3PO4 + 3NaOH ⟶ Na3PO4 + 3H2O
Водородное соединение
PH3
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,660 -
гуманитарные
33,654 -
юридические
17,917 -
школьный раздел
611,971 -
разное
16,905
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Содержание
- Строение атома фосфора
- Общие сведения о строении атома фосфора
- Электронное строение атома фосфора
- Примеры решения задач
- Фосфор, свойства атома, химические и физические свойства
- Фосфор, свойства атома, химические и физические свойства.
- Атом и молекула фосфора. Формула фосфора. Строение атома фосфора:
- Изотопы и модификации фосфора:
- Свойства фосфора (таблица): температура, плотность, давление и пр.:
Строение атома фосфора
Общие сведения о строении атома фосфора
Относится к элементам p-семейства. Неметалл. Обозначение – P. Порядковый номер – 15. Относительная атомная масса – 30,974 а.е.м.
Электронное строение атома фосфора
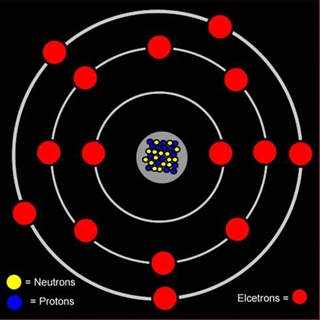
Атом фосфора состоит из положительно заряженного ядра (+15), внутри которого есть 15 протонов и 16 нейтронов, а вокруг, по трем орбитам движутся 15 электронов.
Рис.1. Схематическое строение атома фосфора.
Распределение электронов по орбиталям выглядит следующим образом:
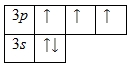
Внешний энергетический уровень атома фосфора содержит 5 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Каждый валентный электрон атома фосфора можно охарактеризовать набором из четырех квантовых чисел: n (главное квантовое), l (орбитальное), ml (магнитное) и s (спиновое):
Наличие трех неспаренных электронов свидетельствует о том, что степень окисления фосфора равна +3. Так как на третьем уровне есть вакантные орбитали 3d-подуровня, то для атома фосфора характерно наличие возбужденного состояния:
Именно поэтому для фосфора также характерна степень окисления +5.
Примеры решения задач
| Задание | Определите число нейтронов в ядре изотопа титана с массовым числом 48. |
| Решение | Массовое число А указывает суммарное число протонов Z и нейтронов в ядре атома любого элемента: |
Атом титана имеет порядковый номер 22, следовательно, количество протонов в ядре равно 22 (Z=22). Тогда число нейтронов в ядре атома титана определим по формуле:
n= A- Z =.48 -22 = 26.
Ответ n = 26
| Задание | Элемент состоит из двух изотопов в соотношении 2:3. Ядро первого изотопа содержит 10 протонов и 10 нейтронов. Определите атомную массу второго изотопа, если средняя относительная масса элемента равна 21,2. В ответе укажите на сколько нейтронов больше в ядре атома второго изотопа. |
| Решение | Относительная атомная масса первого изотопа равна: |
A1 = Z +n = 10 + 10 = 20 а.е.м.
Относительную атомную массу второго изотопа обозначим через A2.
Средняя относительная атомная масса элемента определяется суммой масс его изотопов с учетом их количества. Составим уравнение:
В ядре атома второго изотопа 10 протонов, следовательно, число, нейтронов будет равно n= A- Z =.22 — 10= 12. По условию задачи в ядре атома первого изотопа было 10 нейтронов. Значит, ядро атома второго изотопа содержит на два нейтрона больше, чем ядро первого изотопа.
Источник
Фосфор, свойства атома, химические и физические свойства
Фосфор, свойства атома, химические и физические свойства.
30,973762(2) 1s 2 2s 2 2p 6 3s 2 3p 3
Фосфор — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 15. Расположен в 15-й группе (по старой классификации — главной подгруппе пятой группы), третьем периоде периодической системы.
Атом и молекула фосфора. Формула фосфора. Строение атома фосфора:
Фосфор (лат. Phosphorus, от др.-греч. φῶς – “свет” и φέρω – “несу”; φωσφόρος – “светоносный”) – химический элемент периодической системы химических элементов Д. И. Менделеева с обозначением P и атомным номером 15. Расположен в 15-й группе (по старой классификации – главной подгруппе пятой группы), третьем периоде периодической системы.
Фосфор – неметалл. Относится к группе пниктогенов.
Фосфор обозначается символом P.
Как простое вещество фосфор при нормальных условиях представляет собой твёрдое вещество белого, красного, фиолетового, черного или синего цвета. Все модификации фосфора различаются по цвету, плотности и другим физическим и химическим характеристикам, особенно по химической активности. При переходе состояния вещества в более термодинамически устойчивую модификацию снижается химическая активность, например, при последовательном превращении белого фосфора в красный, потом красного в чёрный.
Химическая формула фосфора P.
Электронная конфигурация атома фосфора 1s 2 2s 2 2p 6 3s 2 3p 3 . Потенциал ионизации (первый электрон) атома фосфора равен 1011,81 кДж/моль (10,486 686 (15) эВ).
Строение атома фосфора. Атом фосфора состоит из положительно заряженного ядра (+15), вокруг которого по трем оболочкам движутся 15 электронов. При этом 10 электронов находятся на внутреннем уровне, а 5 электронов – на внешнем. Поскольку фосфор расположен в третьем периоде, оболочек всего три. Первая – внутренняя оболочка представлена s-орбиталью. Вторая – внутренняя оболочка представлена s- и р-орбиталями. Третья – внешняя оболочка представлена s- и р-орбиталями. На внешнем энергетическом уровне атома фосфора на 3s-орбитали находятся два спаренных электрона, на 3p-орбитали – три неспаренных электрона. В свою очередь ядро атома фосфора состоит из 15 протонов и 16 нейтронов. Фосфор относится к элементам p-семейства.
Радиус атома фосфора (вычисленный) составляет 114 пм.
Атомная масса атома фосфора составляет 30,973762(2) а. е. м.
Фосфор входит в состав важнейших биологических соединений — фосфолипидов. Фосфор содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Белый фосфор очень ядовит.
Изотопы и модификации фосфора:
Свойства фосфора (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Фосфор |
| 102 | Прежнее название | |
| 103 | Латинское название | Phosphorus |
| 104 | Английское название | Phosphorus |
| 105 | Символ | P |
| 106 | Атомный номер (номер в таблице) | 15 |
| 107 | Тип | Неметалл |
| 108 | Группа | Пниктоген |
| 109 | Открыт | Хенниг Бранд, Германия , 1669 г. |
| 110 | Год открытия | 1669 г. |
| 111 | Внешний вид и пр. | Твёрдое вещество белого, красного, фиолетового, черного или синего цвета |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
| 114 | Аллотропные модификации | Несколько аллотропных модификаций фосфора, в т.ч.:
– белый фосфор (α-фосфор (α-форма) с кубической объёмно-центрированной кристаллической решёткой и β-фосфор (β-форма) с гексагональной кристаллической решёткой), – синий фосфор |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | Фосфорен |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,099 % |
| 120 | Содержание в морях и океанах (по массе) | 7,0·10 -6 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 0,0007 % |
| 122 | Содержание в Солнце (по массе) | 0,0007 % |
| 123 | Содержание в метеоритах (по массе) | 0,11 % |
| 124 | Содержание в организме человека (по массе) | 1,1 % |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 30,973762(2) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 3 |
| 203 | Электронная оболочка | K2 L8 M5 N0 O0 P0 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 98 пм |
| 205 | Эмпирический радиус атома* | 100 пм |
| 206 | Ковалентный радиус* | 107 пм |
| 207 | Радиус иона (кристаллический) | P 3+
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | 180 пм |
| 209 | Электроны, Протоны, Нейтроны | 15 электронов, 15 протонов, 16 нейтронов |
| 210 | Семейство (блок) | элемент p-семейства |
| 211 | Период в периодической таблице | 3 |
| 212 | Группа в периодической таблице | 15-ая группа (по старой классификации – главная подгруппа 5-ой группы) |
| 213 | Эмиссионный спектр излучения |  |
| 300 | Химические свойства | |
| 301 | Степени окисления | -3 , -2, -1, 0, +1, +2, +3 , +4, +5 |
| 302 | Валентность | III, V |
| 303 | Электроотрицательность | 2,19 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 1011,81 кДж/моль (10,486 686 (15) эВ) |
| 305 | Электродный потенциал | 0 В |
| 306 | Энергия сродства атома к электрону | 72,037(1) кДж/моль (0,746609(11) эВ) |
| 400 | Физические свойства | |
| 401 | Плотность | 1,823 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – белый фосфор,
≈2,2-2,34г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – красный фосфор, 2,36 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – фиолетовый фосфор, 2,69 г/см 3 (при 20 °C и иных стандартных условиях , состояние вещества – твердое тело) – чёрный фосфор |
| 402 | Температура плавления | 44,15 °C (317,3 K, 111,5 °F) – белый фосфор,
≈590 °C (≈860 K, ≈1090 °F) – красный фосфор |
| 403 | Температура кипения | 280,5 °C (553,7 K , 536,9 °F) – белый фосфор |
| 404 | Температура сублимации | ≈416-590 °C (≈689,2-863 K, ≈780,8-1094 °F) – красный фосфор,
620 °C (893 K, 1148 °F) – фиолетовый фосфор |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 0,66 кДж/моль – белый фосфор |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 51,9 кДж/моль – белый фосфор |
| 409 | Удельная теплоемкость при постоянном давлении | |
| 410 | Молярная теплоёмкость | 23,824 Дж/(K·моль) – белый фосфор |
| 411 | Молярный объём | 16,99054 см³/моль |
| 412 | Теплопроводность | 0,236 Вт/(м·К) (при стандартных условиях ) – белый фосфор,
12,1 Вт/(м·К) (при стандартных условиях ) – красный фосфор, 0,236 Вт/(м·К) (при 300 K) – белый фосфор |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | Белый фосфор α-форма |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 18,800 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | |
| 516 | Название пространственной группы симметрии | P-1 |
| 517 | Номер пространственной группы симметрии | 2 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 12185-10-3 – белый фосфор,
7723-14-0 – красный фосфор |
205* Эмпирический радиус атома фосфора согласно [3] составляет 128 пм.
206* Ковалентный радиус фосфора согласно [1] и [3] составляет 107±3 пм и 106 пм соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) белого фосфора согласно [3] составляет 2,51 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) белого фосфора согласно [3] составляет 49,8 кДж/моль.
Источник