На этой странице вы узнаете
- В чем прелесть фазовых переходов?
- Что лучше выбрать: Mercedes или BMW?
Люди научились летать в космос, покорять недра Земли и погружаться в глубины океана. Эти и другие достижения возможны благодаря способности извлекать максимум пользы из имеющихся ресурсов,а именно получать тепловую энергию различными доступными способами. Сегодня мы разберем задачи, которые заставят тепловые процессы играть на нашей стороне.
Тепловые машины и их КПД
Рекомендация: перед тем как приступить к выполнению задач неплохо было бы повторить тему «Уравнение состояния идеального газа» . Но ключевую теорию, на которой основано решение задач, сейчас разберем вместе.
Вспомним, что фазовые переходы — это переход из одного агрегатного состояния в другое. При этом может выделяться большое количество теплоты.
Именно благодаря этому они и стали такими полезными для нас. Например, в ядерных реакторах воду используют в качестве рабочего тела, то есть она нагревается вследствие энергии, полученной из ядерных реакций, доходит до температуры кипения, а затем под большим давлением уже в качестве водяного пара воздействует на ротор генератора, который вращается и дает нам электроэнергию! На этом основан принцип работы атомных электростанций.
А самый простой пример фазового перехода — образование льда на лужах в морозные ноябрьские дни. Правда о выделении тепла здесь речи не идет.
Мы не почувствуем, как испарится капелька у нас на руке, потому что это не требует много тепла от нашего тела. Но мы можем наблюдать, как горят дрова в мангале, когда мы жарим шашлык, потому что выделяется огромное количество теплоты. А зачем мы вообще рассматриваем эти фазовые переходы? Все дело в том, что именно фазовые переходы являются ключевым звеном во всех процессах, где нас просят посчитать КПД, от них нашему рабочему телу и подводится теплота нагревателя.

Человечество придумало такие устройства, которые могут переработать тепловую энергию в механическую.
Тепловые двигатели, или тепловые машины, — устройства, способные преобразовывать внутреннюю энергию в механическую.
Их устройство довольно просто: они на входе получают какую-то энергию (в основном — энергию сгорания топлива), а затем часть этой теплоты расходуется на совершение работы механизмом. Например, в автомобилях часть энергии от сгоревшего бензина идет на движение. Схематично можно изобразить так:
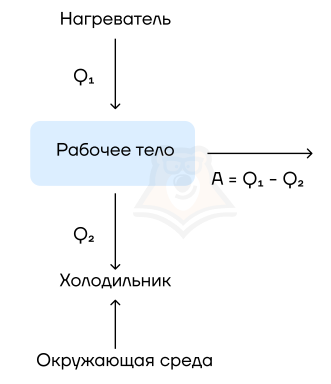
Рабочее тело — то, что совершает работу — принимает от нагревателя количество теплоты Q1, из которой A уходит на работу механизма. Остаток теплоты Q2 рабочее тело отдает холодильнику, по сути — это потеря энергии.
Физика не была бы такой загадочной, если б все в ней было идеально. Как и в любом процессе или преобразовании, здесь возможны потери, зачастую очень большие. Поэтому «индикатором качества» машины является КПД, с которым мы уже сталкивались в механике:
Коэффициент полезного действия (КПД) тепловой машины — это отношение полезной работы двигателя к энергии, полученной от нагревателя.
(eta) — КПД,
A — работа газа (Дж),
Q1 — количество теплоты, полученное от нагревателя (Дж).
Мы должны понимать, что КПД на практике никогда не получится больше 1, поскольку всегда будут тепловые потери.
Полезную работу можно расписать как Q1 — Q2 (по закону сохранения энергии). Тогда формула примет вид:
(eta = frac{Q_1 — Q_2}{Q_1} = 1 — frac{Q_2}{Q_1})
Давайте попрактикуемся в применении данной формулы на задаче номер 9 из ЕГЭ.
Задача. Тепловая машина, КПД которой равен 60%, за цикл отдает холодильнику 100 Дж. Какое количество теплоты за цикл машина получает от нагревателя? (Ответ дайте в джоулях).
Решение:
Давайте сначала вспомним нашу формулу для КПД:
(eta = frac{Q_1 — Q_2}{Q_1}),
где (Q_1) — это теплота, которую тело получает от нагревателя, (Q_2) — теплота, которая подводится к холодильнику.
Тогда отсюда можно вывести искомую теплоту нагревателя:
(eta Q_1 =Q_1-Q_2)
(eta Q_1 — Q_1= -Q_2)
(Q_1=frac{- Q_2}{eta-1}=frac{-100}{0,6-1}=250 Дж).
Ответ: 250 Дж
Цикл Карно
Мы знаем, что потери — это плохо, поэтому должны предотвращать их. Как это сделать? Нам ничего делать не нужно, за нас уже все сделал Сади Карно, французский физик, разработавший цикл, в котором машины достигают наивысшего КПД. Этот цикл носит его имя и состоит из двух изотерм и двух адиабат. Рассмотрим, как этот цикл выглядит в координатах p(V).
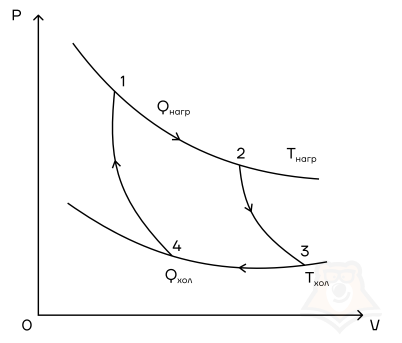
- Температура верхней изотермы 1-2 — температура нагревателя (так как теплота в данном процессе подводится).
- Температура нижней изотермы 3-4 — температура холодильника (так как теплота в данном процессе отводится).
- 2-3 и 4-1 — это адиабатические расширение и сжатие соответственно, в них газ не обменивается теплом с окружающей средой.
Цикл Карно — цикл идеальной тепловой машины, которая достигает наивысшего КПД.
Формула, по которой можно рассчитать ее КПД выражается через температуры:
T1 — температура нагревателя,
T2 — температура холодильника.
Не то круто, что красиво, а то, что по Карно работает! Поэтому присматривайте такой автомобиль, у которого высокий КПД.
Интересно, что максимальный уровень КПД двигателя внутреннего сгорания автомобилей на данный момент всего около 43%. По официальным заявлениям компания Nissan Motor с 2021 года испытывает прообраз двигателя нового поколения с планируемым КПД 50%.
Приступим к задачам
Задачи на данную тему достаточно часто встречаются в задании 27 из КИМа ЕГЭ. Давайте разберем некоторые примеры.
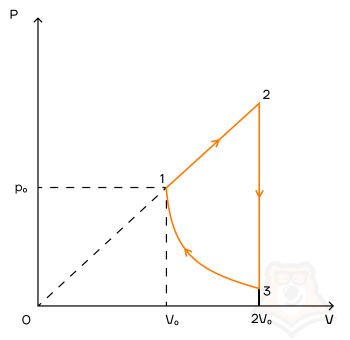
Задание 1. Одноатомный газ совершает циклический процесс, как показано на рисунке. На участке 1–2 газ совершает работу A12 = 1520 Дж. Участок 3–1 представляет собой адиабатный процесс. Количество теплоты, отданное газом за цикл холодильнику, равно |Qхол| = 4780 Дж. Найдите работу газа |A13| на адиабате, если количество вещества постоянно.
Решение:
Шаг 1. Первое, с чего лучше начинать задачи по термодинамике — исследование процессов.
Посмотрим на участок 1-2 графика: продолжение прямой проходит через начало координат, поэтому график функционально можно записать, как p = aV, где a — какое-то число, константа. Графиком является не изотерма, поскольку график изотермы в координатах p-V — гипербола. Из уравнения Менделеева-Клапейрона следует: (frac{pV}{T} = const). Отсюда можно сделать вывод, что возрастает температура, так как растут давление и объем. Температура и объем растут, значит, увеличивается и внутренняя энергия и объем соответственно.
Участок 2-3: процесс изохорный, поскольку объем постоянен, следовательно, работа газом не совершается. Рассмотрим закон Шарля: (frac{p}{T} = const). Давление в этом процессе растет, тогда растет и температура, поскольку дробь не должна менять свое значение. Делаем вывод, что внутренняя энергия тоже увеличивается.
Участок 3-1: адиабата по условию, то есть количество теплоты в этом переходе равна нулю из определения адиабатного процесса. Работа газа отрицательна, так как газ уменьшает объем.
Оформим все данные в таблицу.
Определим знаки Q, используя первый закон термодинамики: Q = ΔU + A.

Из этих данных сразу видно, что количество теплоты, отданное холодильнику — это количество теплоты в процессе 2-3.
Шаг 2. Первый закон термодинамики для процесса 1-2 запишется в виде:
Q12 = ΔU12 + A12.
Работа A12 — площадь фигуры под графиком процесса, то есть площадь трапеции:
(A_{12} = frac{p_0 + 2p_0}{2} * V0 =frac{3p_0V_0}{2}).
Запишем изменение внутренней энергии для этого процесса через давление и объем. Мы выводили эту формулу в статье «Первое начало термодинамики»:
(Delta U_{12} = frac{3}{2}(2p_0 * 2V_0 — p_0V_0) = frac{9p_0V_0}{2}).
Заметим, что это в 3 раза больше работы газа на этом участке:
(Delta U_{12} = 3A_{12} rightarrow Q_{12} = 4A_{12}).
Шаг 3. Работа цикла — площадь фигуры, которую замыкает график, тогда . A = A12 — |A31|. С другой стороны, работа цикла вычисляется как разность между энергиями нагревателя и холодильника: A = Q12 — |Q31|.
Сравним эти формулы:
Q12 -|Q31| = A12 — |A31|,
подставим выражения из предыдущего пункта:
4A12 — |Q31| = A12 — |A31| (rightarrow) |A31| = -3A12 + |Q31| = -31520 + 4780 = 220 Дж.
Ответ: 220 Дж
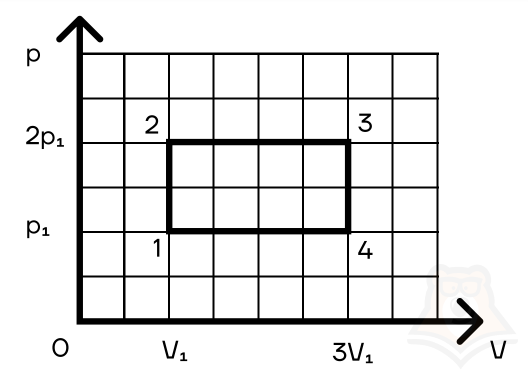
Задание 2. Найти КПД цикла для идеального одноатомного газа.
Решение:
Шаг 1. КПД цикла определим по формуле: (eta = frac{A}{Q}), где Q — количество теплоты от нагревателя, а А — работа газа за цикл. Найдем А как площадь замкнутой фигуры: A = (2p1 — p1)(3V1 — V1) = 2p1V1.
Шаг 2. Найдем процесс, который соответствует получению тепла от нагревателя. Воспользуемся теми же приемами, что и в прошлой задаче:
Посмотрим на участок 1-2 графика: давление растет, объем не меняется. По закону Шарля (frac{p}{T} = const) температура тоже растет. Работа газа равна 0 при изохорном процессе, а изменение внутренней энергии положительное.
2-3: давление не меняется, растет объем, а значит, работа газа положительна. По закону Гей-Люссака (frac{V}{T} = const) температура тоже растет, растет и внутренняя энергия.
3-4: давление уменьшается, следовательно, и температура уменьшается. При этом процесс изохорный и работа газа равна 0.
4-1: давление не меняется, объем и температура уменьшаются — работа газа отрицательна и внутренняя энергия уменьшается.
Оформим данные в таблицу:
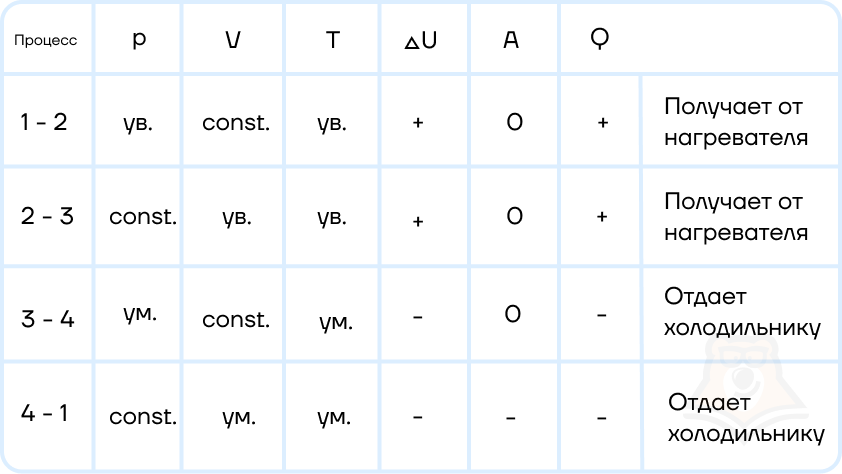
Отметим, что необходимое Q = Q12 + Q23.
Шаг 3. Запишем первый закон термодинамики для процессов 1-2 и 2-3:
(Q_{12} = U_{12} + A_{12} = Delta U_{12} = frac{3}{2}(2p_1V_1 -p_1V_1) = frac{3}{2}p_1V_1).
(Q_{23} = Delta U_{23} + A_{23}), работу газа найдем как площадь под графиком: A23 = 2p1(3V1 — V1) = 4p1V1.
(Delta U_{12} = frac{3}{2}(2p_1 * 3V_1 — 2p_1V_1) = 6p_1V_1).
(Q_{23} = Delta U_{23} + A_{23} = 10p_1V_1).
Шаг 4. Мы готовы считать КПД: (eta = frac{A}{Q} = frac{A}{Q_{12} + Q_{23}} = frac{2p_1V_1}{frac{3}{2}p_1V_1 + 10p_1V_1} = frac{4}{23} approx 0,17).
Ответ: 17%
Теперь вас не должно настораживать наличие графиков в условиях задач на расчет КПД тепловых машин. Продолжить обучение решению задач экзамена вы можете в статьях «Применение законов Ньютона» и «Движение точки по окружности».
Фактчек
- Тепловые двигатели — устройства, способные преобразовывать внутреннюю энергию в механическую.
- Тепловая машина принимает тепло от нагревателя, отдает холодильнику, а рабочим телом совершает работу.
- Коэффициент полезного действия (КПД) тепловой машины — это отношение полезной работы двигателя к энергии, полученной от нагревателя.
(eta = frac{A}{Q_1} = frac{Q_1 — Q_2}{Q_1} = 1 — frac{Q_2}{Q_1}) - Цикл Карно — цикл с максимально возможным КПД: (eta = frac{T_1 — T_2}{T_1} = 1 — frac{T_2}{T_1})
- Не забываем, что работа считается, как площадь фигуры под графиком.
Проверь себя
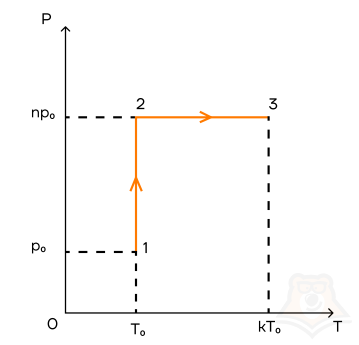
Задание 1.
1 моль идеального газа переходит из состояния 1 в состояние 2, а потом — в состояние 3 так, как это показано графике. Начальная температура газа равна T0 = 350 К. Определите работу газа при переходе из состояния 2 в состояние 3, если k = 3, а n = 2.
- 5672 Дж
- 4731 Дж
- 5817 Дж
- 6393 Дж
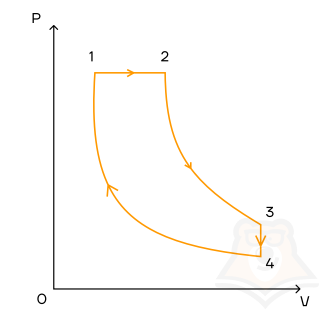
Задание 2.
1 моль идеального одноатомного газа совершает цикл, который изображен на pV-диаграмме и состоит из двух адиабат, изохоры, изобары. Модуль отношения изменения температуры газа при изобарном процессе ΔT12 к изменению его температуры ΔT34 при изохорном процессе равен 1,5. Определите КПД цикла.
- 0,6
- 0,5
- 0,8
- 1
Задание 3.
В топке паровой машины сгорело 50 кг каменного угля, удельная теплота сгорания которого равна 30 МДж/кг. При этом машиной была совершена полезная механическая работа 135 МДж. Чему равен КПД этой тепловой машины? Ответ дайте в процентах.
- 6%
- 100%
- 22%
- 9%
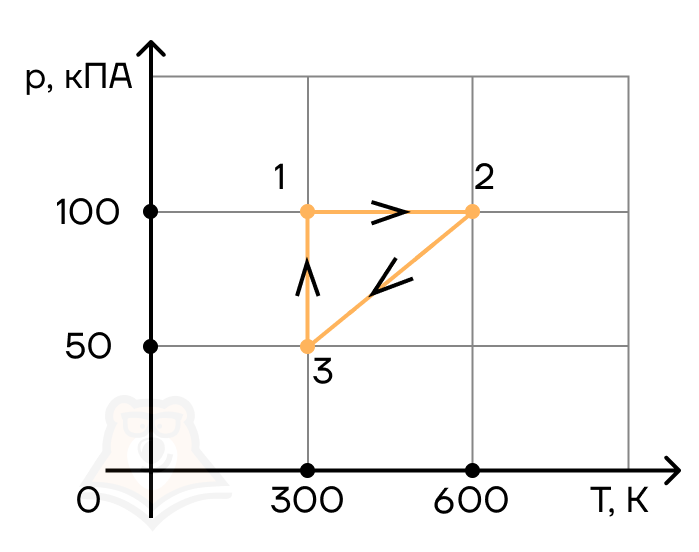
Задание 4.
С двумя молями одноатомного идеального газа совершают циклический процесс 1–2–3–1 (см. рис.). Чему равна работа, совершаемая газом на участке 1–2 в этом циклическом процессе?
- 4444 Дж
- 2891 Дж
- 4986 Дж
- 9355 Дж
Ответы:1 — 3; 2 — 1; 3 — 4; 4 — 3.
Ранее мы достаточно плотно познакомились с процессами и методами работы с ними. Среди часто используемых способов работы с процессами выделяются два: уравнение Менделеева-Клапейрона (для описания состояния идеального газа) и первое начало термодинамики. Из нескольких друг за другом идущих разных процессов можно составить общий циклический процесс.
Круговой процесс (цикл) – составной термодинамический процесс, в результате совершения которого рабочее тело (газ) возвращается в исходное состояние. Таким образом, начальное и конечное состояние газа (давление газа , объём газа
и температура газа
) одинаковы. Попробуем изобразить такой процесс в координатах
(рис. 1).

Рис. 1. Примеры циклических процессов
Например, наш циклический процесс 1.1 состоит из двух изохор, двух изотерм, а процесс 1.2 — из двух изобар и двух изохор. Таким образом, исходя из текстовых условий любой задачи и знания общего вида изопроцессов (именно из них чаще всего составляется цикл), можно нарисовать рисунок.
Для энергетического описания процесса (или цикла) через первое начало термодинамики необходимо обдумать два вопроса:
- как изменяется внутренняя энергия газа (
)
- чему равна работа газа (
)
- где
Для циклов есть небольшие фишки, которые удобно использовать для убыстрения задачи.
Так, изменение внутренней энергии газа зависит только от изменения температуры, а т.к. в цикле начальное и конечное состояние газа одинаково, то изменение внутренней энергии идеального газа за цикл равно 0 ().

Рис. 2. Графическая интерпретация работы газа
Поиск работы для газа также можно несколько упростить. Попробуем в координатах нарисовать график изобарического процесса и найти работу газа (рис. 2). Пусть газ находится в состоянии (давление
и объём
), далее газ изобарически перевели в состояние 2 (давление
и объём
). Тогда по определению работы газа:
(1)
Геометрически (рис. 2), произведение давления на разность объёмов численно равна площади прямоугольника, ограниченного сверху прямой (процессом), а снизу осью. В целом, эту логику можно расширить на любые процессы, тогда работа газа численно равна площади под кривой в координатах .
Также в рамках школьной физики присутствует условное деление циклов на прямые и обратные:
Прямой цикл – круговой, в котором рабочее тело совершает положительную работу за счёт сообщённой ему теплоты.
Обратный цикл — круговой, в котором рабочее тело совершает отрицательную работу.
Анализируя (1) вопрос о положительной и отрицательной работе, сводится к вопросу о соотношении между начальным и конечным объёмами, если:
— газ расширяется, работа положительна,
— газ сжимается, работа отрицательна.
Для графиков можно использовать следующую логику: в случае, если площадь под графиком расширения газа больше соответствующей площади для сжатия, значит цикл — прямой (рис. 3), если наоборот — обратный (рис. 4).

Рис. 3. Прямой циклический процесс

Рис. 4. Обратный циклический процесс
Таким образом, разница в прямом и обратном цикле может быть в очерёдности процессов. Так, прямой процесс, в нашем примере, — это 1-2-3-4-1, а обратный — 1-4-3-2-1.
Вывод: в задачах на циклические процессы нужно быть очень внимательным при прочтении, т.к. часть слов будет иметь глубокий физический смысл. Лучше всего процессы в таких задачах прорисовывать на графиках в координатах . Если график уже есть, то это к лучшему. Определяемся с конкретными изопроцессами, заданными в задаче, и используем это знание или через уравнение Менделеева-Клапейрона, или через первое начало термодинамики.
142
ЛЕКЦИЯ 13
ТЕПЛОВЫЕ МАШИНЫ
13.1. Обратимые и
необратимые процессы
Круговой процесс
– процесс, при котором система, пройдя
через ряд состояний, возвращается в
исходное состояние. На диаграмме
состояний цикл изображается замкнутой
кривой.

Прямой цикл
– это цикл, за который совершается
положительная работа:
![]() .
.
Цикл протекает по часовой стрелке.
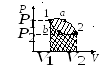
Цикл, совершаемый
идеальным газом можно разбить на процессы
расширения и сжатия. Работа расширения
(![]() )
)
определяется площадью фигуры
![]()
положительная (![]() ).
).
Работа сжатия (![]() )
)
определяется площадью фигуры
![]()
отрицательная (![]() ).
).
Работа, совершаемая
газом за цикл, определяется площадью,
охватываемой замкнутой кривой.
Обратный цикл
– цикл, за который совершается
отрицательная работа
![]() .
.
Цикл протекает против часовой стрелки.
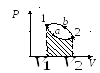
Работа расширения
1а2
положительная
![]() .
.
Работа сжатия 2b1
отрицательна
![]() .
.
Работа, совершаемая газом за цикл,
определяется площадью, охватываемой
замкнутой кривой.
Коэффициент
полезного действия (КПД) для кругового
процесса. В
результате кругового процесса система
возвращается в исходное состояние, т.е.
изменение внутренней энергии газа равно
нулю. Запишем первое начало термодинамики:
![]() .
.
Так как
![]() ,
,
следовательно
![]() ,
,
т.е. работа, совершаемая за цикл, равна
количеству полученной извне теплоты.
Но в результате кругового процесса
система может теплоту как получать, так
и отдавать, тогда
![]() ,
,
где
![]()
количество теплоты, полученное о
нагревателя, а
![]()
количество теплоты, отданное системой
охладителю.
КПД для кругового
процесса:
![]() .
.
Процесс называется
обратимым,
если он может происходить как в прямом,
так и в обратном направлении, и система
возвращается в исходное состояние, т.е.
в окружающей среде и в системе не
возникает никаких изменений. Всякий
иной процесс называется необратимым.
Все реальные
процессы сопровождаются диссипацией
энергии (из-за трения, теплопроводности).
Таким образом, обратные процессы – это
идеализированные реальные процессы.
Они более экономичные и имеют максимальный
КПД. Мы их рассматриваем по двум причинам:
1) многие процессы в природе и технике
практически обратимы; 2) можно увидеть
пути повышения КПД реальных двигателей.
Круговые процессы
лежат в основе работы тепловых двигателей
и холодильных машин.
13.2. Тепловые
двигатели и холодильные машины
Тепловой двигатель
‑ это периодически действующий
двигатель, совершающий работу за счет
полученной извне теплоты. В тепловых
двигателях используют прямой цикл.
Принцип действия
теплового двигателя.
От термостата с более высокой температурой
![]() ,
,
называемого нагревателем,
за цикл отнимается количество теплоты
![]() ,
,
а термостату с более низкой температурой
![]() ,
,
называемому холодильником, за цикл
передается количество теплоты
![]() ,
,
при этом совершается работа
![]()
(рис. 13.1).
Рис. 13.1 Тепловая
машина
КПД теплового
двигателя ‑ это отношение работы А,
совершаемой двигателем, к затраченной
энергии, т.е. к количеству теплоты, взятой
от нагревателя:
![]() .
.
Из этого выражения
видно, что даже у идеального теплового
двигателя КПД меньше 1, т.е. меньше 100 %.
Карно показал, что для работы теплового
двигателя необходимо не менее двух
источников теплоты с различными
температурами, т.к. в процессе сжатия
нужно охлаждать рабочее тело. В противном
случае никакой работы совершаться не
будет.
Теорема Карно.
Из всех периодических действующих
тепловых машин, имеющих одинаковые
температуры нагревателей (![]() )
)
и холодильников (![]() ),
),
наибольшим КПД обладают обратимые
машины. При этом, КПД обратимых машин,
работающих при одинаковых температурах
нагревателей (![]() )
)
и холодильников (![]() ),
),
равны друг другу и не зависят от природы
рабочего тела (тела, совершающего
круговой процесс и обменивающейся
энергией с другими телами), а определяется
только температурами нагревателя и
холодильника.
![]() .
.
Холодильные
машины ‑
периодически действующие установки, в
которых за счет работы внешних сил,
теплота переносится к телу с более
высокой температурой.
Принцип действия
холодильных машин.
Системой за цикл от термостата с более
низкой температурой
![]()
отнимается количество теплоты
![]()
и отдается термостату с более высокой
температурой
![]()
количество теплоты
![]()
(рис. 13.2).
Рис. 13.2. Холодильная
машина
Поскольку этот
процесс неестественен (теплота не может
самопроизвольно переходить от холодного
тела к горячему) приходится над системой
совершить работу.
![]() .
.
Таким образом,
количество теплоты Q1,
отданное системой термостату с более
высокой температурой Т1,
больше теплоты Q2,
полученной от термостата с более низкой
температурой Т2,
на величину работы А,
совершенной над системой.
КПД холодильной
машины (холодильный коэффициент):
![]() .
.
Вывод:
холодильный коэффициент характеризует
эффективность холодильной машины и
определяется как отношение отнятой от
термостата с более низкой температурой
количества теплоты
![]()
к работе А,
которая затрачивается на приведение
холодильной машины в действие. Без
совершения работы нельзя отбирать
теплоту от менее нагретого тела и
передавать ее более нагретому телу.
13.3 Цикл Карно и
работа за цикл
Цикл Карно наиболее
экономичный обратимый круговой цикл,
состоящий из двух изотерм и двух адиабат.
Рассмотрим прямой цикл Карно с идеальным
газом в качестве рабочего тела (рис.
13.3).

Рис. 13.3. Цикл Карно
в диаграмме P,
V
Процесс 1-2
изотермическое расширение; процесс 2-3
адиабатное расширение; процесс 3-4
изотермическое сжатие; процесс 4-1
адиабатное сжатие.
1-2
2-3 3-4
4-1
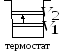

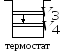
![]()
![]()
![]()
![]()
изотермическое
адиабатное изотермическое
адиабатное
расширение
расширение сжатие сжатие
Рассмотрим
термодинамические процессы и работу в
них.
![]()
изотермическое
расширение
![]() ,
,
![]() ,
,
![]() ;
;
![]()
адиабатное
расширение
![]() ,
,
![]() ,
,
![]() ;
;
![]()
изотермическое сжатие
![]() ,
,
![]() ,
,
![]() ;
;
![]()
адиабатное сжатие
![]() ,
,
![]() ,
,
![]() .
.
Работа за цикл:
![]() .
.
Вывод:
работа за цикл определяется площадью,
ограниченной изотермами и адиабатами
цикла Карно.
Термический КПД
цикла Карно:
![]() .
.
Используем рис.
13.3 и запишем уравнение адиабатического
процесса в виде
![]() :
:
![]() ;
;
![]() ;
;
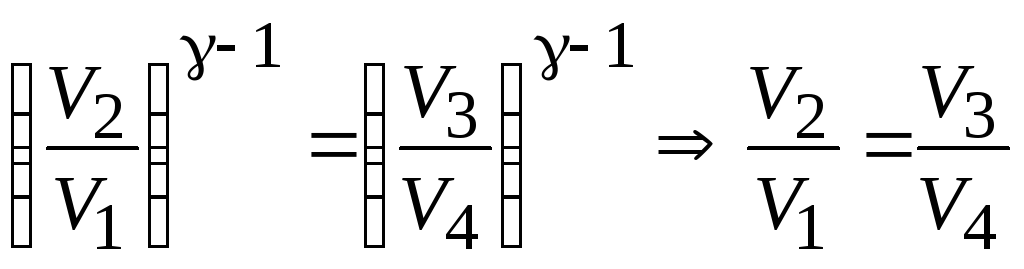 .
.
Подставим эти
выражения в формулу для термического
КПД кругового процесса:
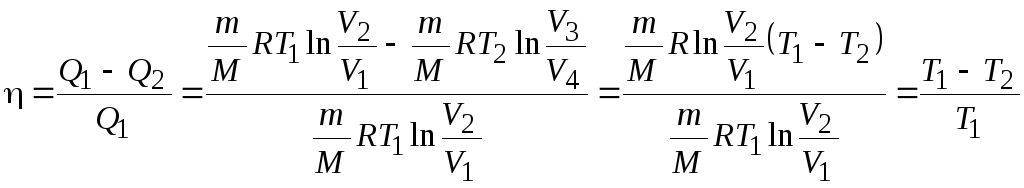 .
.
Вывод:
для цикла Карно КПД действительно
определяется только температурами
нагревателя и холодильника.
Контрольные
вопросы
-
Что такое круговой
процесс? -
Что такое прямой
и обратный цикл? Где они применяются? -
Что такое тепловые
двигатели и каков принцип их действия? -
Что такое холодильные
машины и каков принцип их действия? -
Что собой
представляет цикл Карно? Чему равна
работа за цикл? -
Получите выражение
для термического коэффициента полезного
действия цикла Карно.
Задачи
-
Идеальный тепловой
двигатель, работающий по циклу Карно,
совершает за цикл работу 2,94 кДж и отдает
охладителю количество теплоты 13,4 кДж.
Найдите КПД цикла. [≈ 18 %]. -
Идеальный тепловой
двигатель работает по циклу Карно. При
этом 80% количества теплоты, получаемого
от нагревателя, передается холодильнику.
Количество теплоты, полученное от
нагревателя, 6,28 кДж. Найдите КПД цикла
и работу, совершаемую за цикл. [0,2;
≈ 1,26 кДж]. -
Холодильник,
работающий по обратному циклу Карно,
совершает за цикл работу 37 кДж. При этом
он отбирает тепло от тела отела с
температурой ‑10 С
и передает тепло телу с температурой
17 С.
Найти холодильный коэффициент
холодильника и количество теплоты,
отнятое у холодного тела за цикл. [≈
9,74; 360 кДж].
ЛЕКЦИЯ 14
ЭНТРОПИЯ. ВТОРОЕ
НАЧАЛО ТЕРМОДИНАМИКИ
14.1. Энтропия и
ее изменение при некоторых термодинамических
процессах
Качественное
отличие теплового движения молекул от
других форм движения ‑ его
беспорядочность, хаотичность. Поэтому
для описания теплового движения молекул
вводят количественную меру степени
молекулярного беспорядка – энтропию.
Соседние файлы в папке 432_lecfiz
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
При изменении объема газа, газ совершает работу.
При изобарическом процессе работа определяется как A = p∆V, где
A ― работа газа [Дж],
p ― давление газа [Па],
∆V ― изменение объема [м3].
Отсюда видно, что если объём газа не меняется, то есть ∆V = 0, то работа не совершается.
При расширении газа его работа положительна.
При сжатии газа работа отрицательна.
Работа, совершаемая газом, равна площади под графиком на PV диаграмме. На рисунке работа равна площади трапеции:
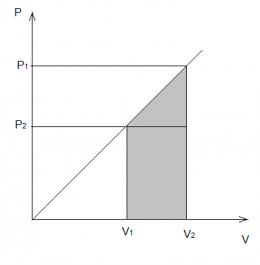
Внутренняя энергия идеального газа есть сумма кинетических энергий его частиц (энергией взаимодействия частиц пренебрегаем).
Внутренняя энергия идеального газа определяется формулой U = $frac{3}{2}; kT$ , где:
U ― внутренняя энергия [Дж],
T ― температура газа в Кельвинах [К],
k ― постоянная Больцмана, равная 1,38 10–23 [Дж/К].
Первое начало термодинамики представляет собой закон сохранения энергии, в применении к тепловым явлениям. Оно гласит, что тепло, полученное газом, идет на изменение внутренней энергии и совершение работы.
Q = ∆U + A, где
Q ― тепло, полученное газом [Дж],
∆U ― изменение внутренней энергии [Дж],
A ― работа газа [Дж].
Адиабатический процесс — термодинамический процесс, при котором система не обменивается теплотой с окружающим пространством.
В первом начале термодинамики при адиабатическом процессе необходимо положить Q = 0.
Коэффициент полезного действия (КПД) — отношение полезно использованной энергии газа, ко всей полученной энергии:
$eta = frac{Q_{H} – Q_{X}}{Q_H}$где
η ― коэффициент полезного действия, КПД,
QH ― количество теплоты, полученное от нагревателя [Дж],
QX ― количество теплоты, отданное холодильнику [Дж].
Цикл Карно — максимально возможный КПД любой тепловой машины.
КПД цикла Карно определяется температурами нагревателя и холодильника.
$eta = frac{T_H – T_X}{T_H}$ где
η ― коэффициент полезного действия , КПД,
ТН ― температура нагревателя [К],
ТХ ― температура холодильника [К].
