|
|
Макеты страниц

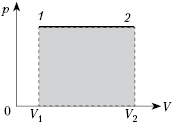
Рис. 4.3. Работа, произведенная газом, расширяющимся при постоянном давлении. На p—V – диаграмме работа изображается площадью (в данном случае заштрихованной) под горизонтальной линией, представляющей процесс (расширение при постоянном давлении). Работа определяется следующим выражением:

Теперь разобьем эту площадь на полоски, как показано на нижнем рисунке. Площадь первой полоски равна  второй
второй  и т. д., где
и т. д., где  — ширина каждой полоски. (Напомним, что каждое произведение
— ширина каждой полоски. (Напомним, что каждое произведение  представляет элементарную работу
представляет элементарную работу  ) Таким образом, полная работа равна полной площади, которая получается сложением площадей всех отдельных полосок:
) Таким образом, полная работа равна полной площади, которая получается сложением площадей всех отдельных полосок:

Здесь использовано стандартное математическое обозначение:  означает просто сумму всех членов от
означает просто сумму всех членов от  до
до  .
.
Теперь вернемся к случаю изменяющегося давления. На рис. 4.4 изображена изотерма — кривая, которая представляет связь между p и V в процессе их изменения при постоянной температуре. Для изотермического расширения, т. е. процесса, происходящего при постоянной температуре вдоль изображенной кривой, совершенная газом работа равна заштрихованной площади под кривой между начальным и конечным значениями объема. Задача заключается в ее вычислении. Начнем с того, что разобьем полное изменение объема на ряд малых изменений, точно так же, как мы сделали в случае постоянного давления. Далее предположим, что в течение каждого такого малого изменения объема давление остается постоянным. Результирующий график напоминает полку с книгами, высота которых постепенно уменьшается. Если сложить все площади  маленьких прямоугольников, мы получим неплохое приближение для площади между
маленьких прямоугольников, мы получим неплохое приближение для площади между  и
и  . Если сделать
. Если сделать  меньше и увеличить число прямоугольников, то приближение станет еще лучше.
меньше и увеличить число прямоугольников, то приближение станет еще лучше.

Рис. 4.4. Работа газа, расширяющегося при постоянной температуре. Величина работы по-прежнему определяется заштрихованной площадью под кривой (изотермой), изображающей ход процесса, но теперь она не равна произведению давления на изменение объема, поскольку давление также изменяется. Для вычисления работы необходимо прибегнуть к интегрированию, т. е. разбить площадь на большое число очень тонких полос. Работа определяется выражением

В пределе, когда величина  становится бесконечно малой, сумма площадей
становится бесконечно малой, сумма площадей  будет равна площади под кривой
будет равна площади под кривой  и
и  .
.
Но чтобы выполнить суммирование величины pdV, как показано на рис. 4.4, нужно знать величину p для каждого dV. Для этого обратимся к уравнению состояния. Для простоты расчета возьмем уравнение идеального газа. Согласно данному уравнению, в каждый момент времени pV — nRT; разрешая последнее уравнение относительно p, найдем, что p = nRT/V. Тогда получаем

Такое выражение справедливо для любого процесса расширения. В изотермическом случае, который мы рассматриваем, его можно упростить, заметив, что все  одни и те же. Тогда имеем
одни и те же. Тогда имеем

где мы снова использовали некоторые математические обозначения.
Символ  называется знаком интеграла. Он означает предел суммы когда величины
называется знаком интеграла. Он означает предел суммы когда величины  становятся бесконечно малыми, а их общее число — бесконечно большим. Символы
становятся бесконечно малыми, а их общее число — бесконечно большим. Символы  и
и  , стоящие сверху и снизу у интеграла, называются пределами интегрирования.
, стоящие сверху и снизу у интеграла, называются пределами интегрирования.
Они просто означают,что процесс суммирования(интегрирования) проводится по интервалу от начального объема  до конечного
до конечного  . Заметим, что знак
. Заметим, что знак  напоминает букву S, соответствующую греческой букве
напоминает букву S, соответствующую греческой букве  (сигма), которая используется для любой суммы независимо от величины
(сигма), которая используется для любой суммы независимо от величины  Символ
Символ  всегда связан с суммой бесконечно малых величин dV. Если подынтегральное выражение (то, что стоит под знаком интеграла) является дифференциалом некоторой величины, т. е. имеет вид d(…), то значение интеграла просто равно разности между значениями, которые получаются при подстановке верхнего и нижнего пределов интеграла в выражение, стоящее за символом d, например
всегда связан с суммой бесконечно малых величин dV. Если подынтегральное выражение (то, что стоит под знаком интеграла) является дифференциалом некоторой величины, т. е. имеет вид d(…), то значение интеграла просто равно разности между значениями, которые получаются при подстановке верхнего и нижнего пределов интеграла в выражение, стоящее за символом d, например  (По причинам, которые станут понятными позже, если подынтегральноевыражение записано с
(По причинам, которые станут понятными позже, если подынтегральноевыражение записано с  , а не с d, то нельзя написать
, а не с d, то нельзя написать 
Суммы или интегралы, подобные фигурирующим в выражении (7), так важны и так часто встречаются, что мы сделаем теперь небольшое отступление и покажем, как они вычисляются. Чтобы этот экскурс оказался действительно полезным, следует знать кое-что о логарифмах. Читателям, уже знакомым с логарифмами, полезно познакомиться с приведенным ниже обзором, заключенным в рамку. Тот, кто не сталкивался с таким представлением чисел, должен потратить некоторое время и ознакомиться с приложением II.
Оглавление
- ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
- ПРЕДИСЛОВИЕ
- ПРЕДИСЛОВИЕ АВТОРА
- БЛАГОДАРНОСТИ
- 1. ПЕРВЫЕ ШАГИ
- ГОРЯЧЕЕ И ХОЛОДНОЕ
- ПРЕОБРАЗОВАНИЕ РАБОТЫ В ТЕПЛОТУ
- ТЕПЛОТА И РАБОТА — НЕ ОДНО И ТО ЖЕ
- В ДЕЙСТВИЕ ВСТУПАЕТ ГРЕК ГЕРОН
- СНАЧАЛА ВОЗНИКЛО ОГНЕСТРЕЛЬНОЕ ОРУЖИЕ
- ВНОВЬ О ПАРЕ
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- 2. НАСКОЛЬКО ГОРЯЧО ГОРЯЧЕЕ?
- СТЕПЕНЬ НАГРЕТОСТИ, ОПРЕДЕЛЯЕМАЯ НА ОЩУПЬ
- ПЕРВЫЕ ТЕРМОМЕТРЫ
- ЧТО ЖЕ ТАКОЕ ТЕМПЕРАТУРА!
- ГАЗОВЫЕ ТЕРМОМЕТРЫ
- МЕЖДУНАРОДНАЯ ШКАЛА ТЕМПЕРАТУР
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- 3. СИСТЕМЫ, ПАРАМЕТРЫ СОСТОЯНИЯ И СОСТОЯНИЯ
- СПЕЦИАЛЬНЫЕ ЗНАЧЕНИЯ НЕКОТОРЫХ ОБЩИХ ТЕРМИНОВ
- ПОЧЕМУ ТЕМПЕРАТУРА ВХОДИТ В РАССМОТРЕНИЕ!
- СООТНОШЕНИЯ, В КОТОРЫЕ ВХОДИТ ТЕМПЕРАТУРА
- МОЛИ И МОЛЕКУЛЫ
- АТОМНАЯ ТЕОРИЯ: КРАТКИИ ОБЗОР
- ЗАКОН ИДЕАЛЬНОГО ГАЗА
- ДРУГИЕ УРАВНЕНИЯ СОСТОЯНИЯ
- УРАВНЕНИЯ СОСТОЯНИЯ В ВИРИАЛЬНОЙ ФОРМЕ
- НЕКОТОРЫЕ ТИПИЧНЫЕ ЗАДАЧИ
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- 4. ВНОВЬ О РАБОТЕ
- ОБЩЕЕ ОПРЕДЕЛЕНИЕ МЕХАНИЧЕСКОЙ РАБОТЫ
- РАБОТА ПРИ РАСШИРЕНИИ ГАЗА
- РАБОТА ПРИ ИЗМЕНЕНИИ ДАВЛЕНИЯ
- КРАТКО О ЛОГАРИФМАХ
- ВНОВЬ ОБ ИЗОТЕРМИЧЕСКОМ РАСШИРЕНИИ
- ПРИМЕР
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- 5. БОЛЕЕ ПОДРОБНО О ТЕПЛОТЕ
- ТЕПЛООБМЕН — ЭТО ПРОЦЕСС
- СКОЛЬКО ТЕПЛОТЫ ПЕРЕДАЕТСЯ?
- ЧТО ВЫЗЫВАЕТ ТЕПЛООБМЕН?
- КОНЦЕПЦИЯ ТЕПЛОРОДА И СВЕРЛИЛЬНЫЙ СТАНОК РУМФОРДА
- ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- 6 У ИСТОКОВ АНАЛИЗА ЦИКЛИЧЕСКИХ ПРОЦЕССОВ
- ЭТО НЕ ИГРУШКА, ЭТО МАШИНА
- ПОНЯТИЕ ЦИКЛА
- ЗНАМЕНИТЫЙ ЦИКЛ КАРНО
- СЛЕДСТВИЯ ВЗАИМОСВЯЗИ ПРОЦЕССОВ В ЦИКЛЕ КАРНО
- ТЕПЛОВЫЕ МАШИНЫ И ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- ПРИМЕР
- КРАТКИЕ ВЫВОДЫ
- 7. ЭКВИВАЛЕНТНОСТЬ ТЕПЛОТЫ И РАБОТЫ И ИХ СВЯЗЬ С ЭНЕРГИЕЙ
- СМЕНА ДЕКОРАЦИИ: ОБОРУДОВАНИЕ ДЛЯ ПИВОВАРЕНИЯ
- МЕХАНИКА И ПРОИСХОЖДЕНИЕ ПОНЯТИЯ ЭНЕРГИИ
- РАБОТА И КОНСЕРВАТИВНЫЕ СИСТЕМЫ
- ВЫХОД ЗА РАМКИ МЕХАНИКИ
- ТЕПЕРЬ ДОБАВИМ ТЕПЛОТУ
- ДРУГИЕ ВИДЫ ЭНЕРГИИ
- ПРИМЕРЫ
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- 8. РАЗРЕШЕНИЕ ОДНОЙ «ДИЛЕММЫ»
- ОДНОВРЕМЕННО В РАЗНЫХ СТРАНАХ
- НА НЕКОТОРЫЕ ДАВНО ИЗВЕСТНЫЕ ФАКТЫ
- НАГРЕВАНИЕ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- РАБОТА БЕЗ ТЕПЛООБМЕНА — АДИАБАТИЧЕСКОЕ РАСШИРЕНИЕ И СЖАТИЕ
- ЦИКЛ КАРНО С НОВОЙ ТОЧКИ ЗРЕНИЯ
- ПРИМЕР
- УПРАЖНЕНИЯ
- 9. ИТАК. ЧТО НАМ ИЗВЕСТНО?
- 10. ПТМ МОЖЕТ МНОГОЕ РАССКАЗАТЬ
- ПТМ НА ЭЛЕКТРОСТАНЦИИ
- ПТМ И НАУКА
- ПРИМЕРЫ
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- II. ПТМ И АВТОМОБИЛЬНЫЙ ДВИГАТЕЛЬ
- ЦИКЛ ОТТО, ИЛИ ДВИГАТЕЛЬ С ИСКРОВЫМ ВОСПЛАМЕНЕНИЕМ
- ИГРА С ОКТАНОВЫМ ЧИСЛОМ
- ПОСЛУШНЫЙ ДВИГАТЕЛЬ ДИЗЕЛЯ
- КПД И ОКРУЖАЮЩАЯ СРЕДА
- ПРИМЕР
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- 12. ПОЗНАКОМИМСЯ С ЭНТРОПИЕЙ
- ЕЩЕ О СВЯЗИ ПАРАМЕТРОВ И ВЗАИМОДЕЙСТВИЙ
- ВЫЧИСЛЕНИЕ ИЗМЕНЕНИЯ ЭНТРОПИИ В НЕКОТОРЫХ СЛУЧАЯХ
- К ВОПРОСУ О НЕЗАВИСИМОСТИ ОТ ПУТИ
- ДОПОЛНИТЕЛЬНОЕ УПРАЖНЕНИЕ
- КРАТКИЕ ВЫВОДЫ
- УПРАЖНЕНИЯ
- 13. ВСЕ КОНЧАЕТСЯ ЭНТРОПИЕЙ
- ИЗМЕНЕНИЯ ЭНТРОПИИ В ИЗОЛИРОВАННЫХ СИСТЕМАХ
- ЭНТРОПИЯ И ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- СВЯЗЬ МЕЖДУ РАЗЛИЧНЫМИ ФОРМУЛИРОВКАМИ ВТОРОГО НАЧАЛА ТЕРМОДИНАМИКИ
- СУЩНОСТЬ ЭНТРОПИИ
- ПОРЯДОК И ХАОС
- ПРИЛОЖЕНИЯ I. МЕХАНИЧЕСКИЕ ВЕЛИЧИНЫ-ЕДИНИЦЫ И ИЗМЕРЕНИЕ
- ВРЕМЯ
- ДЛИНА
- МАССА
- СИЛА
- ПРОИЗВОДНЫЕ ЕДИНИЦЫ
- II. ПУТЕВОДИТЕЛЬ ПО СТРАНЕ ЛОГАРИФМОВ
- III. ВСЕ ИМЕЕТ ЭНТРОПИЮ
В этой заметке рассмотрим как можно вычислить работу идеального газа при различных изо-процессах. Это будет полезно тем, кто только начинает изучать термодинамику и МКТ. Для простоты изображения всех процессов возьмем самые популярные P-V диаграммы.
Есть такое понятие как термодинамический процесс. Изменение любого параметра термодинамической системы (к параметрам можно отнести температуру T, давление p, объем V, энтропию S). Но так как все параметры термодинамической системы взаимосвязаны, то частенько, когда изменяется один параметр, то и изменяются другие параметры.
Если термодинамические процессы не протекают, то система находится в равновесном состоянии. То есть равновесное состояние — такое абстрактное состояние системы, при котором все термодинамические параметры системы остаются сколь угодно долго неизменными, если над системой не совершают никаких внешних воздействий. То есть система предоставлена сама себе. Почему же это состояние абстрактно? Потому что в реальной жизни очень тяжело изолировать систему от внешнего влияния окружающего мира. Таким образом, в каждый момент времени протекают какие-то термодинамические процессы.
Однако, процессы могут протекать настолько медленно, что система изменяется почти незаметно. Иногда это дает возможность рассматривать состояние системы из последовательных равновесных состояний. Такие процессы еще называются квазистатическими. Под квазистатичностью можно понимать что-то ооочень медленное, настолько медленной, что оно длится намного дольше, чем время релаксации (время, за которое амплитудное значение внешнего возмущения, которое начало менять систему, уменьшилось в e раз).
Еще система может постоянно возвращаться к исходному состоянию. Такой круговой процесс называется циклом (примерно по таким процессам работают тепловые машины и ДВС).
Что нужно чтобы изучить какую-либо термодинамическую систему?
1. Определить работу, совершаемую в данном процессе
2. Определить изменение внутренней энергии системы
3. Определить количество теплоты, которое вошло в систему или которое отдала система.
4. Установить связи между отдельными величинами, которые характеризуют состояние рабочего тела (газа)
Основные термодинамические процессы: изохорный, изобарный, изотермический, адиабатный и политропный.
И далее мы с вами выведем работы в этих основных процессах.
1. Изохорный процесс
Изохорным процесс — термодинамический процесс, который протекает при постоянном объеме. Такой процесс может совершаться при нагревании газа, помещенного в закрытый сосуд. Газ в результате подвода теплоты нагревается, и его давление возрастает.
2. Изотермический процесс
Изотермический процесс — термодинамический процесс, который протекает при постоянной температуре. На практике очень сложно осуществить этот процесс. Потому что при сжатии или расширении газа, нужны условия, при которых газ будет успевать обмениваться температурой с внешней средой, чтобы поддерживать свою температуру неизменной.
3. Изобарный процесс
Изобарный процесс — термодинамический процесс, который протекает при постоянном давлении. Помещение газа в плотный цилиндр с подвижным поршнем, на который действует постоянная сила ( например сила тяжести со стороны груза ) при отводе и подводе теплоты, может смоделировать такой процесс.
4. Адиабатный процесс
Адиабатный процесс — термодинамический процесс, который протекает без теплообмена (Q = 0) рабочего тела (газа) с окружающей средой. Также сложно осуществимый процесс. Примерная модель: газ помещают в цилиндр с подвижным поршнем. При этом цилиндр и поршень выполнены из высококачественного теплоизолирующего материала.
5. Политропный процесс (p∙Vⁿ = const )
Этот процесс является обобщением всех предыдущих. Все параметры в этом процессе могут меняться. А процессы выше являются его частными случаями. n – показатель политропы, некоторая постоянная, которая может принимать любые значения от -∞ до +∞.
n = 0 – изобарный процесс p = const
n = 0 – изотермический процесс T = const
n = γ – адиабатный процесс p∙Vⁿ = const
n = +∞ или n = -∞ – изохорный процесс V = const
Любые формулы для этого процесса аналогичны адиабатному процессу. При этом работа выводится точно также. Только коэффициент адиабаты (γ) в общем случае заменяется на коэффициент политропы (n).
Понравился разбор задачи ? Поставьте лайк, подпишитесь на канал! Вам не сложно, а мне очень приятно 🙂
Если Вам нужен репетитор по физике, математике или информатике/программированию, Вы можете написать мне или в мою группу Репетитор IT mentor в VK
Библиотека с книгами для физиков, математиков и программистов
Репетитор IT mentor в Instagram
Репетитор IT mentor в telegram
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?

Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.

Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
 |
| Изохорное охлаждение:
V=const A‘=0 |
 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
 |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.

Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505
 Идеальный одноатомный газ переходит из состояния 1 в состояние 2 (см. диаграмму). Масса газа не меняется. Как изменяются при этом следующие три величины: давление газа, его объём и внутренняя энергия?
Идеальный одноатомный газ переходит из состояния 1 в состояние 2 (см. диаграмму). Масса газа не меняется. Как изменяются при этом следующие три величины: давление газа, его объём и внутренняя энергия?
Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.

Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A

pазбирался: Алиса Никитина | обсудить разбор
Задание EF17966
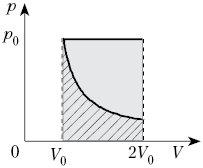
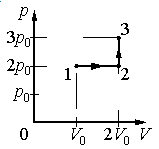 Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления газа от объёма. Работа, совершённая при этом газом, равна
Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления газа от объёма. Работа, совершённая при этом газом, равна
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 14.9k
При изучении физики в восьмом классе мы говорили о том, что
изменить состояние термодинамической системы, то есть её внутреннюю энергию, можно
двумя способами: используя теплопередачу или совершая механическую работу.
Поговорим о последней более подробно.
Итак, когда мы изучали механику, мы с вами говорили о том,
что работа силы (то есть механическая работа) связана с превращением одного
вида энергии в другой, например, механической энергии во внутреннюю. При этом работу
силы мы рассматривали как меру изменения энергии физической системы.
А вот как определить работу в термодинамике, ведь при
рассмотрении термодинамических процессов механическое перемещение макротел в
целом не рассматривается?
Забавно, но работа в термодинамике определяется так же, как и
в механике, но она равна изменению не механической энергии тела, а изменению
его внутренней энергии.
Итак, давайте рассмотрим газ, находящийся в цилиндрическом
сосуде с площадью основания S, и закрытый
подвижным поршнем. Взаимодействие газа с поршнем, а также со стенками сосуда
можно характеризовать давлением, которое газ оказывает на них.
Начнём медленно нагревать газ так, чтобы его давление не
изменялось. Очевидно, что в этом случае газ будет изобарически расширяться, а
поршень начнёт перемещаться за счёт работы силы давления газа над внешними
телами.
Предположим, что поршень переместился на расстояние ∆l.
Так как в процессе расширения давление газа не изменялось, то и сила давления
газа на поршень оставалась неизменной:
F
= pS.
Поэтому работу этой силы мы можем найти как произведение
модуля силы на модуль перемещения и на косинус угла между направлением вектора
силы и вектора перемещения (в нашем примере правда, этот угол равен нулю):
Подставим в записанное уравнение выражение для силы давления:
А теперь давайте подумаем, что определяет произведение площади
основания сосуда (она же площадь основания поршня) и модуля перемещения поршня?..
Да, оно определяет приращение объёма:
Тогда работа газа при его изобарном расширении будет
определяться произведением давления газа на изменение его объёма:
Из этой формулы следует, что сила давления газа совершает
работу только в процессе изменения объёма газа.
А так как давление газа всегда величина положительная, то из
формулы также следует, что при расширении газ совершает положительную работу. При
сжатии же газа сила давления будет совершать отрицательную работу.
Процесс медленного изобарного сжатия газа можно
характеризовать и работой внешних сил над газом, которая отличается от работы
самого газа только знаком:
А теперь давайте запишем уравнение Клайперона — Менделеева
для двух состояний газа в цилиндре:
И вычтем из второго уравнение первое:
В левой части полученного равенства у нас стоит произведение
давления газа на изменение его объёма. А это, как мы с вами нашли ранее, есть не
что иное, как работа газа при изобарном процессе:
Теперь предположим, что в сосуде под поршнем находится один
моль идеального газа и в результате изобарного расширения его температура
изменилась на один кельвин. Тогда получим, что «А равно Эр»:
Отсюда вытекает физический смысл универсальной газовой
постоянной: она численно равна работе, совершаемой одним молем идеального
газа при его изобарном нагревании на один кельвин.
Работе газа при его изобарном расширении или сжатии можно
дать простое геометрическое токование. Для этого давайте построим график
зависимости давления газа от занимаемого им объёма. Очевидно, что графиком
является прямая линия, параллельная оси абсцисс.
А площадь прямоугольника, ограниченного графиком процесса,
осью V и прямыми, соответствующими значениям объёмов в начальном и
конечном состояниях газа, — это есть ничто иное, как работа газа.
Если процесс перехода газа из начального состояния в конечное
не является изобарным, то кривую зависимости давления газа от занимаемого им
объёма можно представить как ломаную, состоящую из большого числа изохор и
изобар. Работа на изохорных участках равна нулю, а суммарная работа на всех
изобарных участках будет равна площади заштрихованной фигуры.
А теперь для закрепления материала решим с вами несколько
классических задач. В первой задаче нам необходимо будет определить работу, совершаемую
силой давления идеального газа определённой массы при его изобарном нагревании от
290 К до 355 К, если давление газа и его начальный объём соответственно 200 кПа
и 0,1 м3.
Задача 2. Идеальный газ в количестве 3 молей находится
при температуре 350 К. После изохорного охлаждения, в результате которого
давление уменьшилось в два раза, газ испытывает изобарное расширение, причём в
конечном состоянии температура равна первоначальной. Изобразите графически эти
процессы в осях p, V и вычислите совершённую газом работу.
Спецвыпуск
Г. А.
Белуха
Работа газа в термодинамике
··· Орловский выпуск ···
Г.А.БЕЛУХА,
школа № 4, г. Ливны, Орловская обл.
Работа газа в термодинамике
Методические рекомендации по
изучению темы, 10-й класс
При изучении работы газа в
термодинамике учащиеся неизбежно сталкиваются с
трудностями, обусловленными слабыми навыками
вычисления работы переменной силы. Поэтому к
восприятию этой темы необходимо готовиться,
начиная уже с изучения работы в механике и решая
с этой целью задачи на работу переменной силы
путём суммирования элементарных работ на всём
пути с помощью интегрирования.
Например, при вычислениях работы силы
Архимеда, силы упругости, силы всемирного
тяготения и т.п. надо учиться суммировать
элементарные величины с помощью простейших
дифференциальных соотношений типа dA = Fds.
Опыт показывает, что старшеклассники легко
справляются с этой задачей, – дугу траектории, на
которой сила увеличивается или уменьшается,
нужно разбить на такие промежутки ds, на
которых силу F можно считать постоянной
величиной, а затем, зная зависимость F = F(s),
подставить её под знак интеграла. Например, 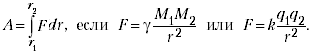
Работа этих сил вычисляется с помощью
простейшего табличного интеграла 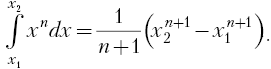
Такая методика облегчает адаптацию
будущих студентов к восприятию курса физики в
вузе и устраняет методические сложности,
связанные с умением находить работу переменной
силы в термодинамике и др.
После того как учащиеся усвоили, что
такое внутренняя энергия и как найти её
изменение, целесообразно дать обобщающую схему:
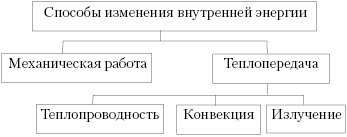
Усвоив, что работа – это один из
способов изменения внутренней энергии,
десятиклассники легко рассчитывают работу газа
в изобарном процессе. На данном этапе необходимо
подчеркнуть, что сила давления газа на всём пути
не меняется, и по третьему закону Ньютона |F2| = |F1|,
знак работы находим из формулы A = Fs cos![]() . Если
. Если ![]() = 0°, то A > 0,
= 0°, то A > 0,
если ![]() = 180°,
= 180°,
то A < 0. На графике зависимости р(V)
работа численно равна площади под графиком.
Пусть газ расширяется или сжимается
изотермически. Например, газ сжимается под
поршнем, давление изменяется, и в любой момент
времени 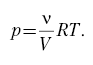
При бесконечно малом перемещении
поршня на dl мы получим бесконечно малое
изменение объёма dV, а давление р можно
считать постоянным. По аналогии с нахождением
механической работы переменной силы, составим
простейшее дифференциальное соотношение dA = pdV,
тогда 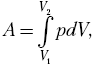 и, зная
и, зная
зависимость р (V), запишем 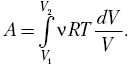 Это табличный интеграл
Это табличный интеграл
типа 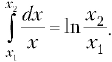 Работа
Работа
газа в этом случае отрицательна, т.к. ![]() = 180°:
= 180°:
![]()
т.к. V2 < V1.
Полученную формулу можно переписать,
используя соотношение 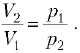
Для закрепления решим задачи.
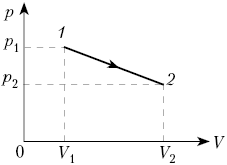
1. Газ переходит из состояния 1
(объём V1, давление р1) в
состояние 2 (объём V2, давление р2)
в процессе, при котором его давление зависит от
объёма линейно. Найдите работу газа.
Решение. Построим примерный
график зависимости p от V. Работа равна
площади под графиком, т.е. площади трапеции:
![]()
2. Один моль воздуха, находящийся при
нормальных условиях, расширяется от объёма V0
до 2V0 двумя способами – изотермически
и изобарно. Сравните работу, совершённую
воздухом в этих процессах.
Решение
При изобарном процессе Ap = р0![]() V, но р0 =
V, но р0 = ![]() RT0/V0,
RT0/V0,
![]() V = V0,
V = V0,
следовательно, Ap = ![]() RT0.
RT0.
При изотермическом процессе:
![]()
Сравним: ![]()
Изучив первый закон термодинамики и
его применение к изопроцессам и закрепив
решением задач тему о работе в термодинамике,
учащиеся подготовились к восприятию наиболее
сложной части термодинамики «Работа циклов и КПД
тепловых машин». Этот материал я излагаю в
следующей последовательности: работа циклов –
цикл Карно – КПД тепловых машин – круговые
процессы.
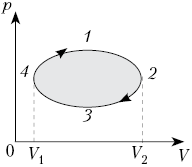 Круговым
Круговым
процессом (или циклом) называется
термодинамический процесс, в результате
которого тело, пройдя ряд состояний,
возвращается в исходное состояние. Если все
процессы в цикле равновесные, то цикл считается
равновесным. Его можно изобразить графически в
виде замкнутой кривой.
На рисунке показан график зависимости
давления p от объёма V (диаграмма p, V)
для некоторого цикла 1–2–3–4–1. На участках 1–2
и 4–1 газ расширяется и совершает
положительную работу А1, численно
равную площади фигуры V1412V2.
На участке 2–3–4 газ сжимается и совершает
работу А2, модуль которой равен
площади фигуры V2234V1. Полная
работа газ за цикл А = А1 + А2,
т.е. положительна и равна площади фигуры 12341.
Если равновесный цикл изображается
замкнутой кривой на р, V-диаграмме,
которая обходится по часовой стрелке, то работа
тела положительна, а цикл накзывается прямым.
Если замкнутая кривая на р, V-диаграмме
обходится против часовой стрелки, то газ
совершает отрицательную работу за цикл, а цикл
называется обратным. В любом случае модуль
работы газа за цикл равен площади фигуры,
ограниченной графиком цикла на р, V-диаграмме.
В круговом процессе рабочее тело
возвращается в исходное состояние, т.е. в
состояние с первоначальной внутренней энергией.
Это значит, что изменение внутренней энергии за
цикл равно нулю: ![]() U = 0.
U = 0.
Так как, по первому закону термодинамики, для
всего цикла Q = ![]() U + A, то Q = A.
U + A, то Q = A.
Итак, алгебраическая сумма всех количеств
теплоты, полученных за цикл, равна работе тела за
цикл: Aц = Qн + Qх = Qн
– |Qх|. 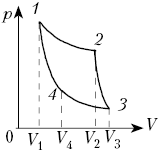
Рассмотрим один из круговых процессов
– цикл Карно. Он состоит из двух изотермических и
двух адиабатических процессов. Пусть рабочим
телом является идеальный газ. Тогда на участке 1–2
изотермического расширения, согласно первому
закону термодинамики, всё получаемое газом тепло
идёт на совершение положительной работы: Q12 = A12.
То есть нет никаких потерь тепла в окружающее
пространство и никакого изменения внутренней
энергии: ![]() U = 0,
U = 0,
т.к. T12 = const (потому что газ –
идеальный).
На участке 2–3 адиабатного
расширения газ совершает положительную работу
за счёт изменения внутренней энергии, т.к. Qад = 0
= ![]() U23 + Aг23
U23 + Aг23 ![]() Aг23 = –
Aг23 = –![]() U23.
U23.
Здесь также нет потерь тепла, по определению
адиабатного процесса.
На участке 3–4 над газом
совершается положительная работа внешней силой,
но он не нагревается (изотермический процесс).
Благодаря достаточно медленно протекающему
процессу и хорошему контакту с холодильником газ
успевает отдавать получаемую за счёт работы
энергию в виде тепла холодильнику. Сам же газ
совершает при этом отрицательную работу: Q34 = Aг34
< 0.
На участке 4–1 газ адиабатно (без
теплообмена) сжимается до исходного состояния.
При этом он совершает отрицательную работу, а
внешние силы – положительную: 0 = ![]() U41 + Aг41
U41 + Aг41
![]() Aг41 = –
Aг41 = –![]() U41.
U41.
Таким образом, за цикл газ получает
тепло только на участке 1–2, изотермически
расширяясь:
![]()
Холодильнику тепло отдаётся только
при изотермическом сжатии газа на участке 3–4:
![]()
Согласно первому закону термодинамики
Aц = Qн – |Qx|;
поэтому
![]()
КПД машины, работающей по циклу Карно,
найдём по формуле 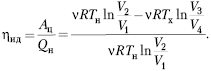
Согласно закону Бойля–Мариотта для
процессов 1–2 и 3–4, а также уравнению
Пуассона для процессов 2–3 и 4–1, легко
доказать, что ![]()
(Хорошо бы увидеть, как автор это
делает: ведь уравнение Пуассона для диабаты
идеального газа надо ещё получить. – Ред.)
После сокращений получим формулу КПД
тепловой машины, работающей по циклу Карно: ![]()
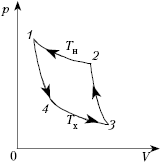 Работу тепловых машин, работающих по
Работу тепловых машин, работающих по
обратному циклу, методически правильно, как
показывает опыт, изучать на примере работы
обратного цикла Карно, т.к. он обратим и его можно
провести в обратном направлении: расширять газ
при понижении температуры от Tн до Tx
(процесс 1–4) и при низкой температуре Tx
(процесс 4–3), а затем сжимать (процессы 3–2
и 2–1). Теперь двигатель совершает работу,
чтобы привести в действие холодильную машину.
Рабочее тело отнимает количество теплоты Qx
у продуктов внутри при низкой температуре Tх,
а отдаёт количество теплоты Qн
окружающим телам, за пределами холодильника, при
более высокой температуре Tн. Таким
образом, машина, работающая по обратному циклу
Карно, уже не тепловая, а идеальная холодильная.
Роль нагревателя (отдающего тепло) выполняет
тело с более низкой температурой. Но, сохранив
названия элементов, как в тепловой машине,
работающей по прямому циклу, мы можем
представить блок-схему холодильника в следующем
виде:
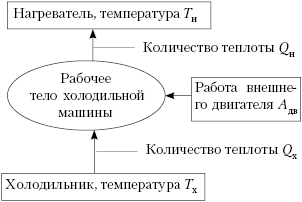
Обратим внимание, что тепло от
холодного тела переходит в холодильной машине к
телу с более высокой температурой не
самопроизвольно, а за счёт работы внешней силы.
Важнейшей характеристикой
холодильника является холодильный коэффициент ![]() , определяющий
, определяющий
эффективность работы холодильника и равный
отношению количества теплоты, отнятого от
холодильной камеры Qх к затраченной
энергии внешнего источника ![]()
За один обратный цикл рабочее тело
получает от холодильника количество теплоты Qх
и отдаёт в окружающее пространство количество
теплоты Qн, что больше Qх на
работу Aдв, совершаемую
электродвигателем над газом за цикл: |Qн| = |Qх| + Адв.
Энергия, затраченная двигателем
(электроэнергия в случае компрессорных
электрических холодильников), идёт на полезную
работу над газом, а также на потери при
нагревании обмоток двигателя электрическим
током QR и на трение в схеме Атр.
Если пренебречь потерями на трение и
джоулево тепло в обмотках двигателя, то
холодильный коэффициент
![]()
Учитывая, что в прямом цикле
![]()
после несложных преобразований
получим:
![]()
Последнее соотношение между
холодильным коэффициентом и КПД тепловой машины,
которая может работать и по обратному циклу,
показывает, что холодильный коэффициент может
быть больше единицы. В этом случае тепла
отнимается от холодильной камеры и возвращается
в комнату больше, чем для этого используется
энергии двигателем.
В случае идеальной тепловой машины,
работающей по обратному циклу Карно (идеального
холодильника), холодильный коэффициент имеет
максимальное значение:
![]()
В реальных холодильниках ![]() т.к. не вся получаемая
т.к. не вся получаемая
двигателем энергия идёт на работу над рабочим
телом, о чём написано выше.
Решим задачу:
• Оцените стоимость изготовления 1 кг
льда в домашнем холодильнике, если температура
испарения фреона –tх °С,
температура радиатора tн °С.
Стоимость одного киловатт-часа электроэнергии
равна Ц. Температура в комнате t.
Дано:
m, c, t, tн, tх,
![]() , Ц.
, Ц.
____________
Д – ?
Решение
Стоимость Д изготовления льда равна
произведению работы электродвигателя на тариф Ц:
Д = ЦА.
Для превращения воды в лёд с
температурой 0 °С необходимо отвести от неё
количество теплоты Q = m(ct + ![]() ). Считаем
). Считаем
приближённо, что над фреоном совершается
обратный цикл Карно с изотермами при
температурах Tн и Tх.
Используем формулы для холодильного
коэффициента: по определению, ![]() = Q/A и для
= Q/A и для
идеального холодильника ![]() ид = Tх/(Tн – Tх).
ид = Tх/(Tн – Tх).
Из условия следует, что ![]()
![]()
![]() ид.
ид.
Решаем совместно три последних
уравнения:
![]()
Разбирая с учащимися эту задачу,
необходимо обратить внимание на то, что основная
работа холодильного устройства идёт не на
охлаждение продуктов, а на поддержание
температуры внутри холодильного шкафа путём
периодической откачки тепла, проникающего
сквозь стенки холодильника.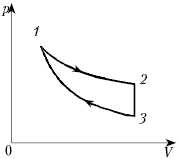
Для закрепления темы можно решить
задачу:
• КПД тепловой машины, работающей по
циклу, состоящему из изотермического процесса 1–2,
изохорического 2–3 и адиабатического 3–1,
равен ![]() , а
, а
разность максимальной и минимальной температур
газа в цикле равна ![]() T. Найдите работу, совершённую
T. Найдите работу, совершённую ![]() моль одноатомного
моль одноатомного
идеального газа в изотермическом процессе.
Решение
При решении задач, в которых
фигурирует КПД цикла, полезно предварительно
проанализировать все участки цикла, используя
первый закон термодинамики, и выявить участки,
где тело получает и отдаёт тепло. Проведём
мысленно ряд изотерм на р, V-диаграмме.
Тогда станет ясно, что максимальная температура
в цикле на изотерме, а минимальная – в т. 3.
Обозначим их через T1 и T3
соответственно.
На участке 1–2 изменение
внутренней энергии идеального газа U2 – U1 = 0.
По первому закону термодинамики, Q12 = (U2 – U1) + А12.
Так как на участке 1–2 газ расширялся, то
работа газа А12 > 0. Значит, и
подведённое к газу количество теплоты на этом
участке Q12 > 0, причём Q12 = А12.
На участке 2–3 работа газа равна
нулю. Поэтому Q23 = U3 – U2.
Воспользовавшись выражениями U2=
![]() cVT1
cVT1
и тем, что T1 – T3 = ![]() T, получим Q23 = –
T, получим Q23 = –![]() cV
cV ![]() T < 0.
T < 0.
Это означает, что на участке 2–3 газ получает
отрицательное количество теплоты, т.е. отдаёт
тепло.
На участке 3–1 теплообмена нет,
т.е. Q31 = 0 и, по первому закону
термодинамики, 0 = (U1 – U3) + A31.
Тогда работа газа
A31 = U3 – U1 = ![]() cV(T3 –T1) = –
cV(T3 –T1) = –![]() cV
cV ![]() T.
T.
Итак, за цикл газ совершил работу A12 + А31 = А12 – ![]() cV
cV ![]() T и получил
T и получил
тепло только на участке 1–2. КПД цикла
![]()
Так как ![]() то работа газа на изотерме равна
то работа газа на изотерме равна
![]()
Геннадий Антонович Белуха –
заслуженный учитель РФ, педагогический стаж 20
лет, ежегодно его ученики занимают призовые
места на различных этапах всероссийской
олимпиады по физике. Хобби – компьютерная
техника.

