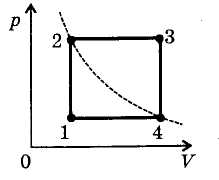
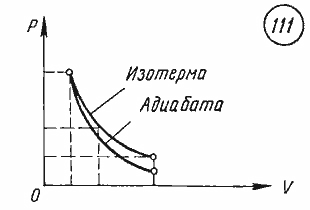
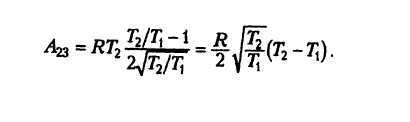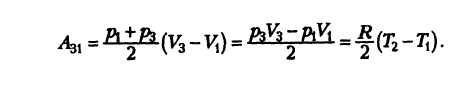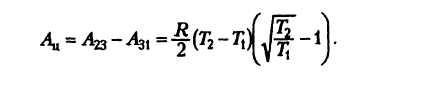В этой заметке рассмотрим как можно вычислить работу идеального газа при различных изо-процессах. Это будет полезно тем, кто только начинает изучать термодинамику и МКТ. Для простоты изображения всех процессов возьмем самые популярные P-V диаграммы.
Есть такое понятие как термодинамический процесс. Изменение любого параметра термодинамической системы (к параметрам можно отнести температуру T, давление p, объем V, энтропию S). Но так как все параметры термодинамической системы взаимосвязаны, то частенько, когда изменяется один параметр, то и изменяются другие параметры.
Если термодинамические процессы не протекают, то система находится в равновесном состоянии. То есть равновесное состояние — такое абстрактное состояние системы, при котором все термодинамические параметры системы остаются сколь угодно долго неизменными, если над системой не совершают никаких внешних воздействий. То есть система предоставлена сама себе. Почему же это состояние абстрактно? Потому что в реальной жизни очень тяжело изолировать систему от внешнего влияния окружающего мира. Таким образом, в каждый момент времени протекают какие-то термодинамические процессы.
Однако, процессы могут протекать настолько медленно, что система изменяется почти незаметно. Иногда это дает возможность рассматривать состояние системы из последовательных равновесных состояний. Такие процессы еще называются квазистатическими. Под квазистатичностью можно понимать что-то ооочень медленное, настолько медленной, что оно длится намного дольше, чем время релаксации (время, за которое амплитудное значение внешнего возмущения, которое начало менять систему, уменьшилось в e раз).
Еще система может постоянно возвращаться к исходному состоянию. Такой круговой процесс называется циклом (примерно по таким процессам работают тепловые машины и ДВС).
Что нужно чтобы изучить какую-либо термодинамическую систему?
1. Определить работу, совершаемую в данном процессе
2. Определить изменение внутренней энергии системы
3. Определить количество теплоты, которое вошло в систему или которое отдала система.
4. Установить связи между отдельными величинами, которые характеризуют состояние рабочего тела (газа)
Основные термодинамические процессы: изохорный, изобарный, изотермический, адиабатный и политропный.
И далее мы с вами выведем работы в этих основных процессах.
1. Изохорный процесс
Изохорным процесс — термодинамический процесс, который протекает при постоянном объеме. Такой процесс может совершаться при нагревании газа, помещенного в закрытый сосуд. Газ в результате подвода теплоты нагревается, и его давление возрастает.
2. Изотермический процесс
Изотермический процесс — термодинамический процесс, который протекает при постоянной температуре. На практике очень сложно осуществить этот процесс. Потому что при сжатии или расширении газа, нужны условия, при которых газ будет успевать обмениваться температурой с внешней средой, чтобы поддерживать свою температуру неизменной.
3. Изобарный процесс
Изобарный процесс — термодинамический процесс, который протекает при постоянном давлении. Помещение газа в плотный цилиндр с подвижным поршнем, на который действует постоянная сила ( например сила тяжести со стороны груза ) при отводе и подводе теплоты, может смоделировать такой процесс.
4. Адиабатный процесс
Адиабатный процесс — термодинамический процесс, который протекает без теплообмена (Q = 0) рабочего тела (газа) с окружающей средой. Также сложно осуществимый процесс. Примерная модель: газ помещают в цилиндр с подвижным поршнем. При этом цилиндр и поршень выполнены из высококачественного теплоизолирующего материала.
5. Политропный процесс (p∙Vⁿ = const )
Этот процесс является обобщением всех предыдущих. Все параметры в этом процессе могут меняться. А процессы выше являются его частными случаями. n – показатель политропы, некоторая постоянная, которая может принимать любые значения от -∞ до +∞.
n = 0 – изобарный процесс p = const
n = 0 – изотермический процесс T = const
n = γ – адиабатный процесс p∙Vⁿ = const
n = +∞ или n = -∞ – изохорный процесс V = const
Любые формулы для этого процесса аналогичны адиабатному процессу. При этом работа выводится точно также. Только коэффициент адиабаты (γ) в общем случае заменяется на коэффициент политропы (n).
Понравился разбор задачи ? Поставьте лайк, подпишитесь на канал! Вам не сложно, а мне очень приятно 🙂
Если Вам нужен репетитор по физике, математике или информатике/программированию, Вы можете написать мне или в мою группу Репетитор IT mentor в VK
Библиотека с книгами для физиков, математиков и программистов
Репетитор IT mentor в Instagram
Репетитор IT mentor в telegram
Внутренняя энергия газа может изменяться в результате совершения газом работы и сообщения ему теплоты. Поэтому принято говорить о двух формах передачи энергии от одних тел к другим: о теплоте и работе.
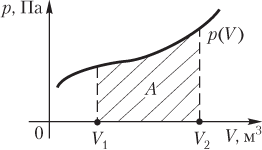
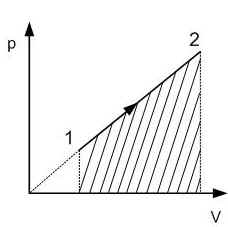
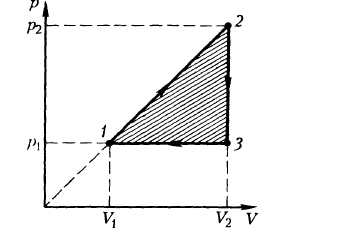
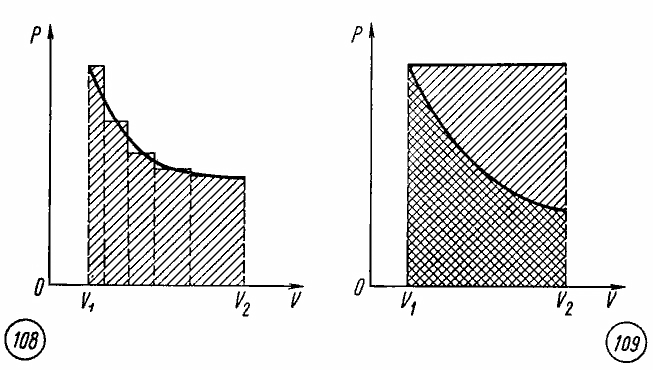
Работа газа при произвольном процессе рассчитывается как площадь криволинейной трапеции под графиком p(V). На рис. 6.1 показана произвольная зависимость давления газа p от его объема V (объем газа в начальном состоянии V 1; объем газа в конечном состоянии V 2). Площадь заштрихованной фигуры совпадает с работой, совершенной газом.
Если зависимость p(V) представляет собой прямую линию, то работа численно равна площади прямолинейной трапеции.
В Международной системе единиц работа, совершаемая газом, измеряется в джоулях (1 Дж).
Работа газа при изобарном процессе (p = const) может быть вычислена по одной из формул:
A = p∆V, или A = νR∆T,
где p — давление газа; ΔV — изменение объема газа при переходе из начального в конечное состояние, ΔV = V 2 − V 1; V 1 — объем газа в начальном состоянии; V 2 — объем газа в конечном состоянии; ν — количество вещества (газа); R — универсальная газовая постоянная, R ≈ 8,31 Дж/(моль ⋅ К); ΔT — соответствующее изменение температуры газа, ΔT = T 2 − T 1; T 1 — абсолютная температура начального состояния; T 2 — абсолютная температура конечного состояния.
Работа газа при изохорном процессе (V = const) не совершается:
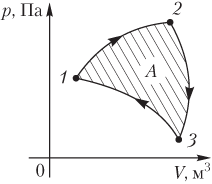
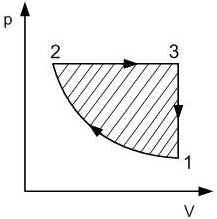
Работа газа при круговом (циклическом) процессе рассчитывается как площадь фигуры, ограниченной графиком функции p(V). На рис. 6.2 показан график произвольного кругового процесса; цифрами обозначены: 1 — исходное состояние идеального газа (оно совпадает с конечным); 2, 3 — промежуточные состояния газа.
Площадь заштрихованной фигуры совпадает с работой, совершенной газом при циклическом процессе.
Работа, совершаемая газом за цикл, может быть:
· положительной (прямой цикл);
· отрицательной (обратный цикл).
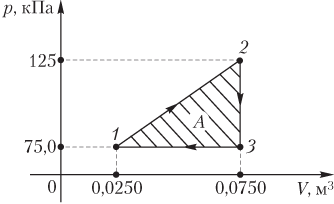
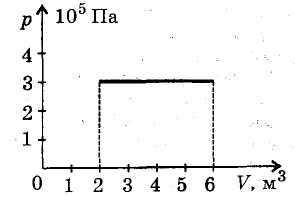
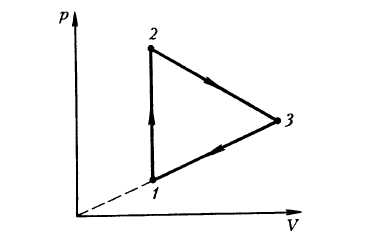
Пример 3. График циклического процесса, происходящего с некоторой массой идеального газа, в координатах p(V) имеет вид прямых, соединяющих точки (0,0250 м 3 ; 75,0 кПа), (0,0750 м 3 ; 125 кПа), (0,0750 м 3 ; 75,0 кПа). Определить абсолютную величину работы, совершаемой газом за цикл.
Решение. На рисунке изображен график циклического процесса в указанных термодинамических координатах p(V).
Величина искомой работы равна площади треугольника, ограниченного прямыми, соединяющими указанные точки:
A=12(125−75,0)⋅103⋅(0,0750−0,0250)=1,25⋅103 Дж=1,25 кДж.
Газ за цикл совершает работу 1,25 кДж.
Пример 4. Газ, состоящий из смеси 2,0 г водорода и 4,2 г гелия, при изобарном нагревании совершил работу 46 кДж. Во сколько раз увеличился объем газа, если его начальная температура была равна 300 К? Молярные массы водорода и гелия равны 2,0 и 4,0 г/моль соответственно.
Решение. Запишем формулу для расчета работы смеси газов при изобарном процессе:
где p — давление смеси газов (постоянная величина), p = const; V 1 — объем смеси газов в начальном состоянии; V 2 — объем смеси газов в конечном состоянии.
Давление смеси газов определяется законом Дальтона:
где p 1 — парциальное давление водорода; p 2 — парциальное давление гелия.
Давления указанных газов в смеси определяются следующими выражениями:
· парциальное давление водорода
где m 1 — масса водорода; M 1 — молярная масса водорода; T 1 — температура смеси газов в начальном состоянии; V 1 — объем смеси газов в начальном состоянии; R — универсальная газовая постоянная, R = 8,31 Дж/(моль ⋅ К);
· парциальное давление гелия
где m 2 — масса гелия; M 2 — молярная масса гелия.
Подстановка закона Дальтона и явного вида выражений для парциальных давлений водорода и гелия в формулу для работы, совершаемой смесью указанных газов, дает
Преобразование данного уравнения к виду
позволяет выразить искомое отношение объемов
Следовательно, при совершении указанной работы объем смеси увеличился в 10 раз.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: При сдаче лабораторной работы, студент делает вид, что все знает; преподаватель делает вид, что верит ему. 9364 – 

78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Условие задачи:
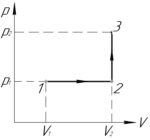
Задача №5.3.22 из «Сборника задач для подготовки к вступительным экзаменам по физике УГНТУ»
(V_1=2) л, (V_2=3) л, (p_1=400) кПа, (p_2=600) кПа, (A-?)
Решение задачи:
Процесс 1-2 — изобарный, поэтому работу газа (A_<1 — 2>) в этом процессе следует искать по такой формуле (численно работа равна площади фигуры под графиком процесса, на схеме к решению — заштриховано):
Процесс 2-3 — изохорный, работа газа (A_<2 — 3>) в этом процессе равна нулю, так как газ не изменяет своего объема (площадь фигуры под графиком этого процесса в координатах p-V также равна нулю).
В итоге формула (1) примет такой вид:
Переведём объемы газа (V_1) и (V_2) в систему СИ:
Ответ: 400 Дж.
Если Вы не поняли решение и у Вас есть какой-то вопрос или Вы нашли ошибку, то смело оставляйте ниже комментарий.
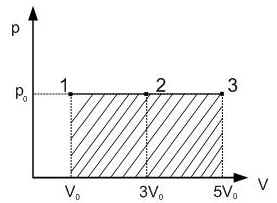
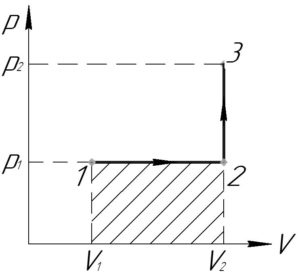
Какую работу совершает газ при переходе из состояния 1 в состояние 3? (Ответ дайте в кДж.)
На диаграмме p—V работе, совершаемой газом при переходе из начального состояния в конечное, соответствует площадь под линией, изображающей процесс перехода.
Для процесса 1—2—3 эта площадь показана на рисунке штриховкой. Таким образом, при переходе из состояния 1 в состояние 3 газ совершает работу
Какую работу совершает газ при переходе из состояния 1 в состояние 3? (Ответ дайте в кДж.)
На диаграмме p—V работе, совершаемой газом при переходе из начального состояния в конечное, соответствует площадь под линией, изображающей процесс перехода. Для процесса 1—2—3 эта площадь показана на рисунке штриховкой. Таким образом, при переходе из состояния 1 в состояние 3 газ совершает работу
Поясните,почему умножение идет 2х10^5 ,когда газ совершает работу от 1 до 2, вроде должно быть 1х10^5,а по ответу получается от 0 до 2.
На участке 1-2 вообще не совершается работа, так как объем газа на этом этапе не изменяется. Вся работа совершается на участке 2-3. Общее правило следующее, если процесс изображен на диаграмме , то работа равна площади под графиком со знаком плюс, если объем увеличивается, и со знаком минус, если уменьшается. Для тепловой машины, работающей по циклу, полезная работа равна площади ограниченной этим циклом, это укладывается в ранее озвученное правило. Когда мы идем по “верхней” части цикла, работа идет в +, потом возвращаемся по “нижней” в исходную точку, работа теперь идет в -, в результате остается только кусок внутри.
Алексей, вот Вы сказали, что “на участке 1-2 вообще не совершается работа, так как объем газа на этом этапе не изменяется.”
а на участке 2-3 ведь не меняется давление.Так почему работа там совершается? Разве не A=pV ?
Не, не так. Давайте разбираться.
Будем выводить формулу, по которой можно посчитать работу совершенную газом. Когда газ работает? Когда он что-то перемешает. Для этого должен как-то меняться его объем. Например, газ расширяется и толкает поршень вверх, а с ним и какой-то груз, вот Вам и работа. То есть без изменения объема нет работы.
Чтобы вывести формулу, рассмотрим модельную задачу. Рассмотрим цилиндрический сосуд с газом. Пусть сосуд закрыт подвижным поршнем площади . Давление газа равно
. Определим, какую работу совершит газ, когда поршень сдвинется на малое расстояние
. Так как это работа на малом перемещении, то назовем ее элементарной работой и обозначим через
. Работа газа равна произведению силы, с которой он давит на поршень, на перемещение поршня (газ давит нормально, поэтому косинуса не возникает):
. Но сила, с которой газ давит на поршень связана с давлением газа соотношением:
. Если перемещение поршня мало, то можно считать, что давление газа не изменяется сильно и что оно остается постоянным. Тогда:
. Но
— это как раз изменение объема газа
. Окончательно имеем:
.
Получив эту формулу, можно забыть о том, как она выводилась (про сосуд и поршень), она оказывается верной для любого малого изменения объема.
Теперь, чтобы найти работу на конечном изменении объема нужно просуммировать работы по малым изменения, в математике это делается при помощи интеграла: Если внимательно приглядеться, то тут можно как раз увидеть площадь под линией процесса на диаграмме
. Вот почему говорят, что для поиска работы надо искать площадь под графиком на этой диаграмме.
Для частных случаев формула приобретает вид:
1) при изобарном процессе давление выносится за знак интеграла и получаем:
2) при изохорном объем не изменяется, поэтому пределы интегрирования совпадают, интеграл равен нулю, работа равна нулю.
3) при изотермическом процессе, давление уже изменяется с объемом, поэтому надо добавить в рассмотрение уравнение Клапейрона-Менделеева: . Следовательно,
. А значит работа при изотермическом процессе равна:
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?
Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.
Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
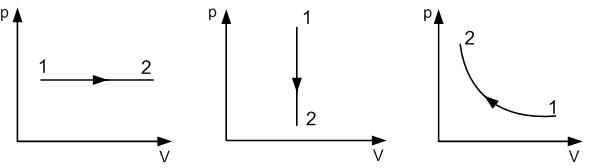
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
 |
| Изохорное охлаждение:
V=const A‘=0 |
 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
 |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.
Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505

Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A
pазбирался: Алиса Никитина | обсудить разбор
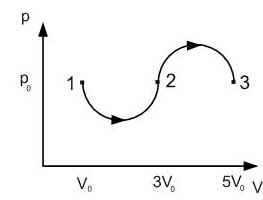
Задание EF17966
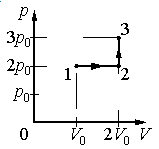
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 14.9k
ТЕМА: “РЕШЕНИЕ ЗАДАЧ НА РАССЧЕТ РАБОТЫ В
ТЕРМОДИНАМИКЕ МЕТОДОМ ДИАГРАММ СОСТОЯНИЙ”.
Тип урока: урок закрепления изучаемого
материала.
Задачи урока.
|
Для ученика |
Для учителя. |
|
Обучающие: |
Обучающие: |
| а) осмыслить понятие “работа”;
б) закрепить теоретические знания о в) научиться применять знания на |
а) организовать процесс б) активизировать |
|
Развивающие: |
Развивающие: |
|
а) развивать умение |
а) развивать умение б) развивать умение обобщать и в) развивать умение разрешать |
|
Воспитывающие |
Воспитывающие |
|
а) воспитывать б) воспитывать в себе “небоязнь” сложных |
а) воспитывать умение б) воспитывать умение слушать, спорить; б) воспитывать умение интенсивно |
Оборудование. Дидактический материал.
1. Графопроектор, слайды.
2. Раздаточный материал.
3. Задачник. Л. А. Кирик. Физика-10.
Разноуровневые самостоятельные и контрольные
работы. М.: “Илекса”, 2004. – 192.: ил.
Ход урока
Введение.
Сегодня второй урок по теме: “ Работа в
термодинамике”. Усвоили ли Вы на первом уроке
физическую сущность работы в термодинамических
процессах? Решение задач сегодня это покажет. Наш
урок пройдёт в форме аукциона. Аукцион (“auctio”
(лат.) – продажа с публичных торгов) – способ
продажи, при котором товар предварительно
выставляют для осмотра. Я выставляю типы задач на
аукцион, объявляю количество баллов за каждый
тип. Вы предлагаете ответы, получаете за них
баллы, которые будут суммироваться
индивидуально у каждого из Вас. В конце урока
суммированные баллы определят Ваши отметки. За
урок можно получить одну и более отметок. (1
минута)
Основная часть. Аукцион задач.
1. Начнём с “аукциончика”
графиков (проецирую на экран слайд с графиками
через графопроектор).
(2 минуты).
Задача №1. На аукцион выставлены три
очень известных графические зависимости в осях
(p,V). (Рис. 1).
Какую информацию Вы можете извлечь из
этих диаграмм?
Отвечайте, пожалуйста, по одному.
Правильный ответ – 0,5 балла.
Рис. 1
Ответы:
|
1. первый процесс – изобарное 2. второй процесс – изохорное 3. третий процесс – изотермическое 4. А1 = p (V2 –V1). |
5. А2 =0. 6. А3 = ? R T ln V2 /V1 7. А1 > 0. 8. А3 < 0. |
(Учащиеся отвечают устно с мест.)
Итоги “аукциончика”. (Объявляю баллы.)
2. От предварительного
“аукциончика” простейших графиков мы
продвигаемся к “аукциону простых задач”.
На аукцион выставлены на выбор задача
№ 5 (средний уровень) по цене 0,5 балла и задача
№ 1
(достаточный уровень) по цене 1 балл
на стр. 39 задачника.
Решения этих задачи потребуются в
дальнейшем при рассмотрении более сложных задач.
Время решения 2 минуты.
Задача №2.
Вариант А на 0,5 балла.
На рисунке 2 показана изобара газа в
координатах р, V. Определите работу,
совершенную газом в процессе расширения.
Рис. 2
Решение.
А = p (V2 –V1).
А = 1,2 МДж.
Вариант Б на 1 балл.
Азот массой 280 г был нагрет при постоянном
давлении на 100 °С. Определить работу расширения
газа.
Решение.
А = p ?V; p ?V = m/µ R?T; А = m/µ R?T.
А = 8,31 кДж.
(Учащиеся выполняют задачи в тетрадях и,
получив ответ, поднимают руку. Учитель подходит к
ним проверяет и выставляет баллы за правильный
ответ. Два ученика в это время решают задачи на
обратной стороне доски. Через 2 мин открываем
решения на доске, проверяем его. Ученики у доски
получают баллы в случае правильного решения).
Итоги “аукциона простых задач”.
(Объявляю баллы.)
3. Теперь перейдём к “аукциону
задач”.
Итак, нахождение работы с помощью
графика зависимости р(V). За задачу можно
заработать 3 балла. Эта задача № 3 на карточке
лежащей, на парте.
Задача №3. Газ расширился из
состояния с объемом V1 и давлением р1 в
состояние с объёмом V2 и давлением р2 в
процессе, при котором его давление зависит от
объёма линейно. Найти работу газа. Давление р1
меньше давления р2. . Время решения 2 мин.
Решение.
Построим график зависимости,
указанной в задаче, в координатах (р, V).
Рис. 3
Работа газа численно равна площади
трапеции.
А = ? (p1+ p2) (V2 – V1).
(Учащиеся выполняют задачу в тетрадях
и, получив ответ, поднимают руку. Учитель
подходит, проверяет и выставляет 2 балла за
правильный ответ. Через фиксированное время
проецируется помощь (через 1 мин) и решение задачи
(через 2 мин) с помощью графопроектора. Один
ученик решает задачу на пленке графопроектора,
лампа которого выключены. Через 2 мин
проецируется решение, ученик делает пояснение).
Итоги “аукциона задач”. (Объявляю
баллы.)
4. На аукцион выставляется хорошая
задача на нахождение работы с помощью диаграммы
состояния в осях (р, V). Итак, “аукцион хороших
задач”. Эта задача № 4 на карточке лежащей,
на парте. (Приложение). Правильное
решение задачи оценивается в 5 баллов. В процессе
решения я буду проецировать на экран подсказки.
Сделавший всю задачу до подсказки, получит за неё
4 балла, после первой подсказки – 3 балла, после
второй – 2 балла, а затем открывается всё решение
задачи.
(В подсказках поэтапно открываю: 1.
изотерму; 2. формулу работы).
Задача № 4.
Идеальный газ переводят изотермически
из состояния 1 в состояние 2 (V2< V1),
затем изобарно в состояние 3, возвращают изохорно
в состояние 1. Начертите данный процесс в осях
(р,V). Покажите штриховкой площадь, численно
равную работе за цикл. Положительную или
отрицательную работу совершает газ за цикл?
Поясните. Время решения 3 мин.
Решение:
Рис. 4
А = А12 + А23 + А31.
А12 < 0;
А23 > 0 Работа на участке 2 – 3
максимальна по модулю.
А31 =0.
Полная работа за цикл положительна.
(Учащиеся выполняют задачу в тетрадях
и, получив ответ, поднимают руку. Учитель
подходит, проверяет и выставляет 5 баллов за
правильное решение. Через отведенное время
проецируется решение задачи через
графопроектор. Решение на слайде пишет и
поясняет ученик, который сделал задачу первым).
Итоги “аукциона сложных задач”.
(Объявляю баллы).
5. На аукцион выставляется сложная
задача. Эта задача № 5 на карточке лежащей,
на парте. (Приложение). Ее правильное
решение оценивается в 5 баллов. Итак, “Аукцион
сложных задач”. Время выполнения задачи 5
минут.
Задача №5. С молем идеального одноатомного
газа совершен цикл, изображенный на рис. 5.
Температуры газа в различных состояниях равны Т1,
Т2, Т3, Т4. Найдите работу газа за
цикл.
Рис. 5
Подсказка-вопрос: А что Вы предполагаете
делать? (Ответ: Изобразить данный цикл в
координатах (p,V).)
Вопрос: Подумайте, а стоит ли?
Решение.
Из рис. 5 видно, что на участках 1 – 2 и 3 – 4
реализуется прямая пропорциональная
зависимость давления от температуры, т. е., как
следует из закона Менделеева — Клапейрона, объем
газа при этом не меняется, а значит, и работы газ
не совершает.
Необходимо найти работу газа лишь при
изобарических процессах 2 — 3 и 4 — 1.
На участке 2 — 3 совершенная работа будет равна
А23 = р2 (V3 – V2).
На участке 4 — 1 совершенная работа будет равна
А41 = р1 (V1 – V4).
Работа за цикл А = р2 (V3 – V2). + р1
(V1 – V4).
Уравнение Менделеева — Клапейрона
записывается в виде p V=? R T.
р1 V1 = v R T1 ; р1 V4
= v R T4 ; р2 V3 = v R T3 ;
р2 V2= v R T2.
Подставляя эти значения в выражение для работы,
получаем окончательно:
А = v R(T1 + T3 – T2 – T4).
(Решение проецируется через
графопроектор. Решение на слайде пишет и
поясняет ученик, сделавший задачу первым).
Итоги “аукциона сложных задач”.
(Объявляю баллы.)
6. Наконец, на аукцион выставляется
самая сложная на сегодняшний урок задача.
Начинаем “Аукцион конкурсных
задач”. Эта задача № 6 на карточке лежащей,
на парте. (Приложение). Правильное
решение задачи оценивается в 5 + 5 баллов. Время
решения 7 мин.
Тем, кого не устраивает эта задача,
предлагаю решить №1 (высокий уровень) стр. 40
задачника. Правильное решение – 5 баллов.
Задача № 6.
Вариант А на 5 баллов.
Один моль идеального газа совершает замкнутый
процесс, состоящий из двух изохор и двух изобар
(Рис. 6). Температура в точке1 равна T1, в точке
3 — T3. Определить работу, совершаемую газом
за цикл, если точки 2 и 4 лежат на одной изотерме.
Рис. 6
Решение.
На участках 1 —2 и 3 —4 работа равна
нулю.
Полная работа газа за цикл: А = А23
+ А41.
А23 = р2 (V3 – V2). Используя
уравнение Менделеева—Клапейрона, получим: р2
V3 = v R T3;
р2 V2= v R T2. Таким образом, А23
= v R T3 – v R T2.
Аналогично, А41 = v R T1 – v R T4.
Полная работа А = v R T3 – v R T2. +
v R T1 – v R T4. По условию T2
= T4.
А = v R T3. + v R T1 – 2v R T2.
Выразим T2. через T1 и T3.
Процесс 1—2 — изохорический, поэтому T1 / T2
= р1 / р2 .
В изобарическом процессе 2—3 T3 / T2 = V3
/ V2.
Умножив первое равенство на второе, получим:. T1
T3 / T 22 = р1 V3 / р2
V2 .
Учтем, что р1 = р4 и V3 = V4.
T1 T3 / T 22 = р4 V4 /
р2 V2; но р4 V4 = р2
V2; поэтому T1 T3 / T22 = 1.
T2 = v T1 T3 .
Работа за цикл А = v R (T3. + T1 – 2 v
T1 T3).
Окончательно получаем: А = v R (vT3. – v
T1)?.
Вариант Б на 5 + 5 баллов.
Над одним молем идеального газа совершается
цикл, показанный графически на рисунке 7. Какую
работу совершает газ во время этого процесса?
Данные взять с рисунка.
Рис. 7
Подсказка-вопрос: А что Вы предполагаете
делать? (Ответ: Изобразить данный цикл в
координатах (p,V)).
Правильно.
Решение.
Нарисуем график зависимости в координатах (p,V).)
для данного процесса (рис. 8).
Рис. 8
На участке 1 —2 давление меняется по закону р = V, где
— некоторая постоянная.
Выразим температуру газа через давление: Т = р2
/2 и
подставим в уравнение Менделеева—Клапейрона.
Получим р = 2
V/vR. Давление прямо пропорционально объему.
На этом участке газ совершает положительную
работу. Процесс 2—3 — изохорический, во время
этого процесса работа равна нулю. В
изобарическом процессе 3—1 работа совершалась
над газом, т. е. газ совершал отрицательную
работу. Полная работа газа равна площади
треугольника 1 2 3:
А = (р2 – р1) (V2–V1) /2.
Так как V2 = v R T2 / р2, V1 =
vRT1 / р1, окончательно получаем:
А = 0,5 v R (р2 – р1) (T2 / р2
– T1 / р1).
(Решение пишет на доске и поясняет
первый ученик, решивший задачу).
Итоги “Аукциона конкурсных
задач”. (Объявляю баллы.)
7. В заключение урока предлагаю “аукцион
олимпиадных задач”. Пятерка достанется только
одному ученику за идею и мгновенный ответ.
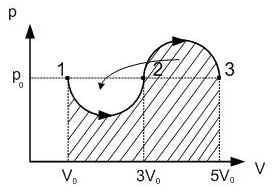
Задача №7.
Газ переводят из состояния 1 в состояние 3 в
процессе, изображенном на диаграмме в
координатах (p,V). (Проецирую на экран слайд через
графопроектор).
Линии 1 – 2 и 2 – 3 представляют собой
полуокружности равных диаметров. Найти работу
газа в данном процессе. Данные взять с диаграммы.
Рис. 9
Решение.
Преобразуем графическую зависимость к виду:
| Рис. 10
|
Рис. 11
|
Работа газа численно равна площади
прямоугольника:
А = р0 (5V0 – V0).
А = 4 р0V0.
(Решение проецируется через
графопроектор. Решение на слайде пишет и
поясняет первый ученик, решивший задачу).
Задание на дом. . Предлагается решить
достаточно сложную задачу №8. Её цена 5 + 5
баллов. Задача №8 помещена на стенде
кабинета.
Тем, кого не устраивает эта задача, предлагаю
решить № 31. 1 и 31. 4 на стр. 160 учебника под ред. А. А.
Пинского.
Задача №8. Найдите работу, совершенную молем
идеального газа в цикле, состоящем из двух
участков линейной зависимости давления от
объема и изохоры (рис. 12). Точки 2 и 3 лежат на
изотерме, прямая 3— 1 проходит через начало
координат. Заданы температуры Т1, и Т2,
Т3. .
Рис. 12
Решение:
Работа на изохоре 1 – 2 равна нулю. Работа на
участке 2 – 3 равна площади трапеции. Учтя, что
р 2V 2 = р 3V 3 = ?RT 2,
имеем:
Поскольку прямая 3 – 1 проходит через начало
координат и, следовательно, р1/V1 = р3/V3
получаем:
Т 1/V1 2 = Т 2/V2 2
= Т 3/V3 2 . Поэтому работу А 23
можно окончательно записать в виде:
Работа на участке 3—1 тоже равна площади
трапеции:
Искомая работа в цикле равна:
Для участка прямой 2—3, соединяющего точки
изотермы, так же как и для самой изотермы, работа
газа определяется лишь отношением объемов.
Работа же газа вдоль участка произвольной
прямой, проходящей через начало координат на
диаграмме р V, определяется лишь разностью
температур конечного и начального состояний.
Заключение.
Сегодня было выставлено на интеллектуальный
аукцион немало задач, и вы с ними справились.
“Много задач вместе иногда решить легче, чем
одну из них, если то большее число задач хорошо
согласовано, а одна задача сама по себе
изолирована” (Д. Пойа). Не правда ли?
Окончательные итоги. Максимальное количество
решенных задач за урок –
Максимальная оценка за урок –
(Объявляю оценки. Некоторые учащиеся могут
получить за урок несколько оценок за интенсивную
умственную работу).
Надеюсь, все получили удовольствие от
интеллектуальной деятельности.
Литература.
1. Физика: Учеб. для 10 кл. шк. и кл. с углубл.
изучением физики / О. Ф. Кабардин, В. В. Орлов, Э. Е.
Эвенчик. ; под ред. А. А. Пинского. – 7-е изд. –М.:
Просещение, 2002. – 415 с.: ил.
2. Л. А. Кирик. Физика-10. Разноуровневые
самостоятельные и контрольные работы. М.:
“Илекса”, 2004. – 192 с.: ил.
3. Практикум абитуриента. Молекулярная
физика, оптика, квантовая физика. Под ред. В. В
Можаева и А. И. Черноацана. Приложение к журналу
“Квант” №2, 1995. – М.: – Бюро “Квантум”.
4. Ю. А. Конаржевский. Анализ урока. М.: – Центр
“педагогический поиск”, 2003. – 336с.
Работа расширения или сжатия газа
Одним
из основных термодинамических процессов,
совершающихся в большинстве тепловых
машин, является процесс расширения газа
с совершением работы. Легко определить
работу, совершаемую при изобарном
расширении газа.
Если
при изобарном расширении газа от объема
V1
до объема V2
происходит перемещение поршня в цилиндре
на расстояние l
(рис. 7.3), то работа A’,
совершенная газом, равна
,
(7.27)
где
p
— давление газа,
—
изменение его объема.
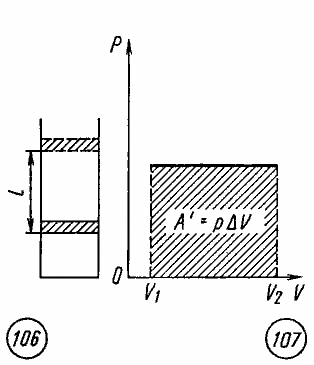
Рис
7.3 Рис 7.4
Как
видно из рисунка 7.4, при изображении
изобарного процесса расширения газа в
координатных осях p
, V
площадь фигуры, ограниченной графиком
процесса, координатами V1
и V2,
осью абсцисс, пропорциональна работе
газа A’.
Работа
при произвольном процессе расширения
газа.
Произвольный процесс расширения газа
от объема V1
до объема V2
можно представить как совокупность
чередующихся изобарных и изохорных
процессов.
При
изохорных процессах работа равна нулю,
так как поршень в цилиндре не перемещается.
Работа при изобарных процессах
пропорциональна площади фигуры на
диаграмме p,
V
под соответствующим участком изобары
(рис. 7.5).
Рис.
7.5
Рис. 7.6
Следовательно,
работа при произвольном процессе
расширения газа прямо пропорциональна
площади фигуры под соответствующим
участком графика процесса на диаграмме
p,
V.
Работа
при изотермическом расширении газа.
Сравнивая площади фигур под участками
изотермы и изобары (рис. 7.6), можно сделать
вывод, что расширение газа от объема V1
до объема V2
при одинаковом начальном значении
давления газа сопровождается в случае
изобарного расширения совершением
большей работы.
Работа
при сжатии газа.
При расширении газа направление вектора
силы давления газа совпадает с направлением
вектора перемещения, поэтому работа
A’,
совершенная газом, положительна (A’
> 0), а работа А
внешних сил отрицательна: A
= –A’
< 0.
При
сжатии газа направление вектора внешней
силы совпадает с направлением перемещения,
поэтому работа А
внешних сил положительна (A
> 0), а работа A’,
совершенная газом, отрицательна (A’
< 0).
Адиабатный
процесс.
Кроме изобарного, изохорного и
изотермического процессов, в термодинамике
часто рассматриваются адиабатные
процессы.
Адиабатным
процессом
называется процесс, происходящий в
термодинамической системе при отсутствии
теплообмена с окружающими телами, т. е.
при условии Q
= 0.
Отсутствие
теплообмена с окружающей средой может
быть обеспечено хорошей теплоизоляцией
газа. Быстрые процессы расширения или
сжатия газа могут быть близкими к
адиабатному и при отсутствии теплоизоляции,
если время, за которое происходит
изменение объема газа, значительно
меньше времени, необходимого для
установления теплового равновесия газа
с окружающими телами.
Примерами
адиабатных процессов могут служить
процессы сжатия воздуха в цилиндре
воздушного огнива, в цилиндре двигателя
внутреннего сгорания. В соответствии
с первым законом термодинамики, при
адиабатном сжатии изменение внутренней
энергии газа
равно
работе внешних сил А:
(7.28)
Так
как работа внешних сил при сжатии
положительна, внутренняя энергия газа
при адиабатном сжатии увеличивается,
его температура повышается.
При
адиабатном расширении газ совершает
работу A’
за счет уменьшения своей внутренней
энергии:
,
(7.29)
поэтому
температура газа при адиабатном
расширении понижается. Это можно
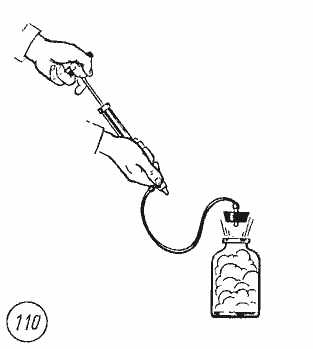
обнаружить в следующем опыте. Если в
бутылку, содержащую насыщенный водяной
пар, накачивать с помощью насоса воздух,
то пробка вылетает (рис. 7.7).
Рис.
7.7
Работа
A’
по выталкиванию пробки совершается
воздухом за счет уменьшения его внутренней
энергии, так как расширение воздуха
происходит за очень короткое время и
теплообмен с окружающей средой не
успевает произойти. Образование капель
тумана доказывает, что при адиабатном
расширении воздуха его температура
понизилась и опустилась ниже точки
росы.
График
адиабатного процесса.
Поскольку при адиабатном сжатии
температура газа повышается, то давление
газа с уменьшением объема растет быстрее,
чем при изотермическом процессе.
Понижение температуры газа при адиабатном
расширении приводит к тому, что давление
газа убывает быстрее, чем при изотермическом
расширении.
График
адиабатного процесса в координатных
осях p,
V
представлен на рисунке 1.8. На том же
рисунке для сравнения приведен график
изотермического процесса.
Рис.
7.8
Вну́тренняя
эне́ргия
тела (обозначается как E
или U) —
полная энергия этого тела за вычетом
кинетической
энергии
тела как целого и потенциальной
энергии
тела во внешнем поле сил. Следовательно,
внутренняя энергия складывается из
кинетической энергии хаотического
движения молекул,
потенциальной энергии взаимодействия
между ними и внутримолекулярной энергии.
Внутренняя
энергия является однозначной функцией
состояния системы. Это означает, что
всякий раз, когда система оказывается
в данном состоянии, её внутренняя энергия
принимает присущее этому состоянию
значение, независимо от предыстории
системы. Следовательно, изменение
внутренней энергии при переходе из
одного состояния в другое будет всегда
равно разности между ее значениями в
конечном и начальном состояниях,
независимо от пути, по которому совершался
переход.
Внутреннюю
энергию тела нельзя измерить напрямую.
Можно определить только изменение
внутренней энергии:
где
—подведённая
к телу теплота,
измеренная в джоулях
—работа,
совершаемая телом против внешних сил,
измеренная в джоулях
Эта
формула является математическим
выражением первого
начала термодинамики
Для
квазистатических
процессов
выполняется следующее соотношение:
где
—температура,
измеренная в кельвинах
—энтропия,
измеренная в джоулях/кельвин
—давление,
измеренное в паскалях
—химический
потенциал
—количество
частиц в системе
Идеальные
газы
Согласно
закону Джоуля, выведенному эмпирически,
внутренняя энергия идеального
газа
не зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости
при постоянном объёме,
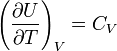
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то

(7.30)
Эта
же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при постоянном
объёме (изохорных
процессах);
в общем случае CV
(T,V)
является функцией и температуры, и
объёма.
Если
пренебречь изменением молярной
теплоёмкости при изменении температуры,
получим:
ΔU
= νCVΔT,
(7.31)
где
ν — количеств о вещества, ΔT —
изменение температуры.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #