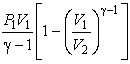Адиабатический процесс и уравнения адиабаты для идеального газа. Пример задачи
Адиабатический переход между двумя состояниями в газах не относится к числу изопроцессов, тем не менее, он играет важную роль не только в различных технологических процессах, но и в природе. В данной статье рассмотрим, что представляет собой этот процесс, а также приведем уравнения адиабаты идеального газа.
Кратко об идеальном газе
Идеальным называется такой газ, в котором нет взаимодействий между его частицами, и их размеры равны нулю. В природе, конечно же, не существует идеальных на сто процентов газов, поскольку все они состоят из имеющих размеры молекул и атомов, которые взаимодействуют друг с другом всегда как минимум с помощью ван-дер-ваальсовых сил. Тем не менее, описанная модель часто выполняется с достаточной для решения практических задач точностью для многих реальных газов.
 Вам будет интересно: Атеизм и антиклерикализм – это. В чем отличие понятий
Вам будет интересно: Атеизм и антиклерикализм – это. В чем отличие понятий
Главным уравнением идеального газа является закон Клапейрона-Менделеева. Он записывается в следующей форме:
Это уравнение устанавливает прямую пропорциональность между произведением давления P на объем V и количества вещества n на абсолютную температуру T. Величина R – газовая константа, которая играет роль коэффициента пропорциональности.
Что это адиабатический процесс?
Адиабатический процесс – это такой переход между состояниями газовой системы, при котором обмена энергией с внешней средой не происходит. При этом изменяются все три термодинамических характеристики системы (P, V, T), а количество вещества n остается постоянным.
Различают адиабатическое расширение и сжатие. Оба процесса происходят только за счет внутренней энергии системы. Так, в результате расширения давление и особенно температура системы сильно падают. Наоборот, адиабатическое сжатие приводит к положительному скачку температуры и давления.
Чтобы не происходил обмен теплом между окружающей средой и системой, последняя должна обладать теплоизолированными стенками. Кроме того, сокращение длительности протекания процесса значительно уменьшает тепловой поток от и к системе.
Уравнения Пуассона для адиабатического процесса

Первый закон термодинамики записывается в таком виде:
Иными словами, сообщенная системе теплота Q идет на выполнение системой работы A и на повышение ее энергии внутренней ΔU. Чтобы написать уравнение адиабаты, следует положить Q=0, что соответствует определению изучаемого процесса. Получаем:
При изохорном процессе в идеальном газе все тепло идет на повышение внутренней энергии. Этот факт позволяет записать равенство:
Где CV – изохорная теплоемкость. Работа A, в свою очередь, вычисляется так:
Где dV – малое изменение объема.
Помимо уравнения Клапейрона-Менделеева, для идеального газа справедливо следующее равенство:
Где CP – изобарная теплоемкость, которая всегда больше изохорной, так как она учитывает потери газа на расширение.
Анализируя записанные выше равенства и проводя интегрирование по температуре и объему, приходим к следующему уравнению адиабаты:
Здесь γ – это показатель адиабаты. Он равен отношению изобарной теплоемкости к изохорной. Это равенство называется уравнением Пуассона для процесса адиабатического. Применяя закон Клапейрона-Менделеева, можно записать еще два аналогичных выражения, только уже через параметры P-T и P-V:
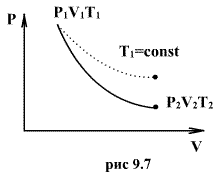
График адиабаты можно привести в различных осях. Ниже он показан в осях P-V.
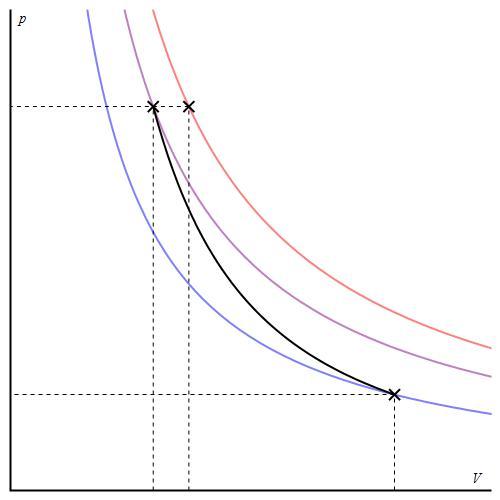
Цветные линии на графике соответствуют изотермам, черная кривая – это адиабата. Как видно, адиабата ведет себя более резко, чем любая из изотерм. Этот факт просто объяснить: для изотермы давление меняется обратно пропорционально объему, для изобаты же давление изменяется быстрее, поскольку показатель γ>1 для любой газовой системы.
Пример задачи
В природе в горной местности, когда воздушная масса движется вверх по склону, то ее давление падает, она увеличивается в объеме и охлаждается. Этот адиабатический процесс приводит к снижению точки росы и к образованию жидких и твердых осадков.

Предлагается решить следующую задачу: в процессе подъема воздушной массы по склону горы давление упало на 30 % по сравнению с давлением у подножия. Чему стала равна ее температура, если у подножия она составляла 25 oC?
Для решения задачи следует использовать следующее уравнение адиабаты:
Его лучше записать в таком виде:
Если P1 принять за 1 атмосферу, то P2 будет равно 0,7 атмосферы. Для воздуха показатель адиабаты равен 1,4, поскольку его можно считать двухатомным идеальным газом. Значение температуры T1 равно 298,15 К. Подставляя все эти числа в выражение выше, получаем T2 = 269,26 К, что соответствует -3,9 oC.
2.4. Адиабатный процесс
Адиабатный процесс — это процесс, при котором не происходит теплообмена с внешней средой.
Физически это означает, что процесс протекает достаточно быстро и система не успевает обменяться теплотой с внешними телами. Однако коль скоро мы имеем дело с равновесными процессами, скорость адиабатного процесса не должна быть слишком уж велика. Примером таких процессов может служить распространение звуковых колебаний в упругой среде.
Выведем уравнение, описывающее адиабатный процесс. Ранее мы имели дело с самыми простыми уравнениями процессов

— для изотермического процесса;

— для изобарного процесса;

— для изохорного процесса.
Поскольку в адиабатном процессе dQ = 0, из первого начала термодинамики следует, что

C другой стороны,

Приравнивая эти выражения, находим

Умножая уравнение (2.28) на V g –1 , получаем в левой части полный дифференциал

В результате интегрирования (2.29) приходим к уравнению адиабатного процесса

Графически адиабатный процесс описывается на (р,V) — диаграмме кривыми, похожими на изотермы (рис. 2.12), но идущими круче, так как g > 1, поскольку Сp > СV.

Рис. 2.12. Адиабатный процесс в идеальном газе: 1 — адиабата, 2 — изотерма
Это и понятно, так как при адиабатном расширении газ совершает работу за счет внутренней энергии, и его температура падает, что еще больше уменьшает давление по сравнению с изотермическим расширением.
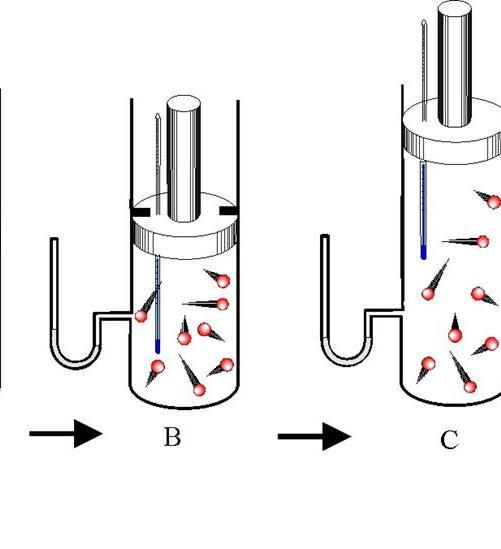
Экспериментальное исследование адиабатного процесса в идеальном газе можно выполнить с помощью установки, представленной на рис. 2.13.

Рис. 2.13. Экспериментальное изучение адиабатного процесса в идеальном газе
Учитывая, что из уравнения состояния идеального газа следует пропорциональность

уравнение адиабатного процесса можно также представить в виде

Первый закон термодинамики в применении к адиабатному процессу позволяет вычислить работу газа при адиабатном расширении:

Выражения для работы при адиабатном процессе с учетом уравнения Клапейрона — Менделеева можно выразить также через температуры в начале и конце процесса

Для бесконечно малых изменений параметров уравнения (2.32), (2.33) переходят в соотношения

Пример. Горючая смесь в двигателе Дизеля (см. рисунок выше) воспламеняется при температуре Т2 = 1 100 К. Начальная температура смеси Т1 = 350 К. Определим, во сколько раз нужно уменьшить объем смеси при сжатии, чтобы она воспламенилась. Сжатие будем считать адиабатным. Показатель адиабаты для смеси g = 1,4.
Для решения удобнее воспользоваться уравнением адиабатного процесса в форме (2.31):

Отсюда сразу следует выражение для степени сжатия горючей смеси:
Адиабатический процесс
Вы будете перенаправлены на Автор24
Что такое адиабатический процесс
Адиабатическим или адиабатным процессом называют процесс, при котором отсутствует теплообмен с окружающей средой ($delta Q=0$).
В таком случае первое начало термодинамики можно записать в виде:
[0=frac<2>nu RdT+pdV left(1right).]
Из уравнения (1) следует, что при увеличении объема в адиабатном процессе уменьшается температура системы. Или говорят, что в адиабатном процессе работа совершается за счет уменьшения внутренней энергии системы. И обратное справедливо: работа, совершенная над системой, увеличивает внутреннюю энергию системы и, как следствие, температуру. Уравнение, которое характеризует адиабатный процесс в термодинамических параметрах (уравнение адиабаты) носит имя Пуассона. Получим это уравнение для идеального газа. Из уравнения состояния идеального газа:
Из соотношения Майера:
[C_p-C_V=nu R left(3right).]
Подставим (3) в (2), получим:
Разделим уравнение (1) $C_VT ( C_V=frac<2>нR)$, получим:
где $gamma =frac$ — показатель адиабаты. Проинтегрируем уравнение (5):
где $lnA$- некоторая постоянная.
Потенцируем уравнение (6), получаем:
Уравнение (7) есть уравнение адиабаты в параметрах T,V. Для того, чтобы перейти к уравнению адиабаты, в параметрах p,V используют уравнение Менделеева — Клайперона. И получают уравнение адиабаты в виде:
Или в параметрах p,T уравнение (7,8) имеет вид:
Зная, что теплоемкости можно представить как:
показатель адиабаты исходя из ($gamma =frac$) и уравнений (10)
Легко получить формулу работы для адиабатного процесса. По определению работа газа A равна:
где $p_1V_1=nu RT_1.$ Используя уравнение адиабаты, записанное для двух состояний в параметрах $V,T$, получаем:
Что такое адиабата
Линия, изображающая на термодинамической диаграмме адиабатный процесс, называется адиабатой (рис.1).
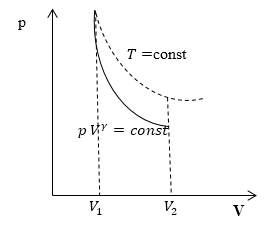
Для сравнения на рис. 1 представлена также изотерма (пунктиром). На рис. 1 видно, что адиабата идет круче, чем изотерма. Работа в адиабатическом процессе по расширению от объема $V_1 $до $V_2$ меньше, чем в изотермическом процессе с таким же изменением объема. Это объясняется тем, что при адиабатном процессе происходит охлаждение газа. В изотермическом процессе при расширении давление уменьшается только за счет уменьшения плотности, тогда как в адиабатном за счет плотности и средней кинетической энергии молекул (соответственно температуры).
Задание: Одноатомный газ совершает адиабатное расширение от объема $V_1=$1$м^3 $при температуре $Т_1=400 К$, при этом давление газа изменяется от $p_1=5cdot <10>^6Па $до $p_2=2cdot <10>^6 Па$. Найдите объем газа в конечном состоянии.
При адиабатном расширении имеем:
где $gamma =frac , $так как газ одноатомный, то i=3, следовательно, $gamma =frac<3+2><3>=frac<5><3>$. Значит можно выразить интересующий нас объем:
Ответ: Объем газа в конечном состоянии 4,6 $м^3.$
Задание: Некоторую массу газа сжали так, что $frac=5$, в первом случае процесс проводился адиабатический, второй изотермический. Начальные состояния газов одинаковы в том и другом случае. Найти отношение работ $frac=?$
Работа в адиабатном процессе задана формулой над газом:
Формула для работы в изотермическом процессе имеет вид:
Тогда найдем искомое отношение:
Для коэффициента адиабаты мы знаем формулу вычисления через число степеней свободы$(i)$, а для одноатомного газа $i=3$:
Подставим данные из условий задачи, получим:
Ответ: Отношение работ, которые совершают над газом в процессах сжатия в адиабатном процессе и изотермическом равно 1,89. Работа над газом в адиабатном процессе больше.
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 26 11 2021
[spoiler title=”источники:”]
http://online.mephi.ru/courses/physics/molecular_physics/data/course/2/2.4.1.html
http://spravochnick.ru/fizika/termodinamika/adiabaticheskiy_process/
[/spoiler]
Пользуясь только что полученным уравнением адиабаты, мы теперь можем вычислить работу, совершаемую газом при его адиабатном расширении (или работу, производимую внешними силами при сжатии газа).
Вычислим работу расширения газа (I моля) от некоторого начального значения объема  до
до  По-прежнему элементарная работа при изменении объема на
По-прежнему элементарная работа при изменении объема на  равна
равна

Связь между давлением газа  и его объемом V определяется уравнением адиабаты (чтобы быть равновесным, процесс расширения должен вестись вдоль адиабаты):
и его объемом V определяется уравнением адиабаты (чтобы быть равновесным, процесс расширения должен вестись вдоль адиабаты):

которое мы можем написать и в таком виде:

где  начальное давление газа,
начальное давление газа,  начальный объем его. Отсюда
начальный объем его. Отсюда

Подставив это значение  в формулу для работы, получим:
в формулу для работы, получим:

Чтобы получить работу расширения от до  надо проинтегрировать выражение для
надо проинтегрировать выражение для  в этих пределах:
в этих пределах:

После интегрирования получаем для интеграла в правой части равенства выражение:

Поэтому выражение для работы А принимает вид:

Из уравнения состояния следует, что  откуда получаем окончательное выражение:
откуда получаем окончательное выражение:

Если масса газа равна  формула эта принимает вид:
формула эта принимает вид:

Так как  Поэтому формулу для работы при адиабатном изменении объема можно представить в виде:
Поэтому формулу для работы при адиабатном изменении объема можно представить в виде:

так как 
Сравнение выражений (31.1) и (29.2) показывает, что при адиабатном расширении совершается меньшая работа, чем при изотермическом (при одном и том же изменении объема). Это, очевидно, связано с большей крутизной адиабаты по сравнению с изотермой, так как из-за этого при одинаковых начальных условиях в любой стадии процесса расширения давление при адиабатном процессе будет меньше, чем при изотермическом.
Работа при адиабатном расширении газа существенно зависит от значения показателя адиабаты  Легко видеть, что если
Легко видеть, что если  работа адиабатного расширения стремится к значению работы при изотермическом процессе. В этом можно убедиться, найдя предельное значение правой части уравнения (31.1) при
работа адиабатного расширения стремится к значению работы при изотермическом процессе. В этом можно убедиться, найдя предельное значение правой части уравнения (31.1) при  (применив теорему Лопиталя).
(применив теорему Лопиталя).
У многоатомных газов, для которых значение у ближе всего к единице, разница в значениях работ изотермического и адиабатного процессов наименьшая.
Сравнение двух рассмотренных процессов удобнее всего провести, если прибегнуть к графическому изображению процесса изменения объема газа. На графике зависимости давления газа от его объема (рис. 39) элементарная работа  изменения объема газа на
изменения объема газа на  изобразится площадью, ограниченной частью кривой АВ и отрезком на оси абсцисс
изобразится площадью, ограниченной частью кривой АВ и отрезком на оси абсцисс  (штриховка «в клеточку»).
(штриховка «в клеточку»).

Рис. 39.

Рис. 40.
Работа же изменения объема газа от значения  до значения
до значения  равная
равная  изобразится всей заштрихованной площадью, ограниченной соответствующим участком кривой А В и отрезком оси абсцисс.
изобразится всей заштрихованной площадью, ограниченной соответствующим участком кривой А В и отрезком оси абсцисс.
На рис. 40 приведены для сравнения кривые  и 2, представляющие собой изотерму и адиабату для одного и того же газа и для одинаковых начальных условий. Работа изотермического изменения объема газа от
и 2, представляющие собой изотерму и адиабату для одного и того же газа и для одинаковых начальных условий. Работа изотермического изменения объема газа от  до
до  равна площади АВ
равна площади АВ  а соответствующая работа адиабатного расширения равна площади
а соответствующая работа адиабатного расширения равна площади  которая, очевидно, меньше (см. рис. 40).
которая, очевидно, меньше (см. рис. 40).
Чем меньше постоянная адиабаты у, тем адиабата ближе к изотерме и тем меньше разница в площадях под обеими кривыми. В пределе, когда  адиабата переходит в изотерму.
адиабата переходит в изотерму.
Адиабатический
процесс – это такое изменение состояний
газа, при котором он не отдает и не
поглощает извне теплоты. Следовательно,
адиабатический процесс характеризуется
отсутствием теплообмена газа с окружающей
средой. Адиабатическими можно считать
быстро протекающие процессы. Так как
передачи теплоты при адиабатическом
процессе не происходит, то ![]() и
и
уравнение I начала термодинамики
принимает вид
|
|
(9.20) |
или
![]()
т.е.
внешняя работа газа может производиться
вследствие изменения его внутренней
энергии. Адиабатное расширение газа
(dV>0) сопровождается положительной
внешней работой, но при этом внутренняя
энергия уменьшается и газ охлаждается
(dT<0).
Сжатие
газа (dV0, т.е. адиабатное сжатие газа
сопровождается его нагреванием.
Найдем
связь между параметрами состояния
идеального газа (например, Р и V) в
адиабатическом процессе. Для этого
перепишем (9.20) в форме
![]()
а
величину ![]() найдем
найдем
из уравнения Менделеева – Клапейрона
![]()
Таким
образом,
![]()
или,
учитывая, что для идеального
газа ![]()
![]()
Разделим
обе части этого уравнения на ![]()
![]()
где ![]() безразмерная
безразмерная
величина, называемая постоянной адиабаты.
Пренебрегая зависимостью![]() от
от
температуры, можно считать, что для
данного газа ![]() .
.
Интегрируя последнее уравнение
![]()
получим
![]()
т.е.
|
|
(9.21) |
Это
выражение называют уравнением Пуассона.
Соотношение между давлением и температурой,
а также между объемом и температурой
идеального газа в адиабатическом
процессе имеют вид
![]()
Эти
соотношения легко получить из (9.21),
пользуясь уравнением Менделеева –
Клапейрона. Линию, изображающую
адиабатический процесс в диаграмме
состояния, называют адиабатой. На рис.
9.7 сплошной линией показан вид адиабаты
в (P-V) диаграмме. Для сравнения в том же
рисунке пунктирной линией изображена
изотерма, соответствующая температуре
газа в начальном состоянии 1. Так как
для любого идеального газа показатель
адиабаты ![]() ,
,
то в (P-V) диаграмме адиабата всегда идет
круче, чем изотерма. Объясняется это
тем, что при адиабатическом сжатии
увеличение давления обусловлено не
только уменьшением объема газа, как при
изотермическом сжатии, то также еще и
увеличения температуры. При адиабатическом
расширении температура газа уменьшается,
поэтому давление газа падает быстрее,
чем при изотермическом расширении.
Работу,
совершаемую газом в адиабатическом
процессе, найдем интегрируя выражение
![]()
Полная
работа
![]()
Из
уравнения Майера (9.18) и выражения ![]() для
для
показателя адиабаты γ следует, что
![]()
Поэтому
|
|
(9.22) |
В
соответствии с соотношением ![]()
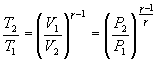
Следовательно,
выражение (9.22) для работы можно представить
в виде
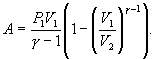
или
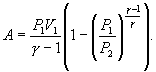
.6.
Политропический процесс
В параграфе
2.4 отмечалось,
что важным классом термодинамических
процессов являются процессы, происходящие
при постоянной теплоемкости, то
есть политропические
процессы.
К таким процессам, в частности, относятся
адиабатический, изотермический,
изобарический и изохорический процессы.
Для
идеального газа нетрудно получить
уравнение политропического процесса
тем же способом, которым ранее было
выведено уравнение Пуассона. Пусть
молярная теплоёмкость идеального газа
в политропическом процессе равна ![]() .
.
Тогда в соответствии с первым началом
термодинамики (1.5) имеем
выражение:
|
|
(2.99) |
из
которого следует:
|
|
(2.100) |
Подставляя
это выражение в формулу (2.76) получим
|
|
(2.101) |
или
с учетом соотношения Майера (2.70)
|
|
(2.102) |
Сравнение
формул (2.100) и (2.102) при
условии, что ![]() ,
,
позволяет записать уравнение
|
|
(2.103) |
аналогичное
уравнению (2.79).
Здесь введен параметр
|
|
(2.104) |
который
называется показателем
политропы.
Из
этой формулы можно также получить
зависимость молярной теплоемкости ![]() от
от
показателя политропы ![]() :
:
|
|
(2.105) |
Преобразование
формулы (2.103) к
виду:
|
|
(2.106) |
и
интегрирование полученного уравнения
дает
|
|
(2.107) |
Уравнение (2.107) называется уравнением
политропического процесса или политропы –
кривой, описываемой таким уравнением
в переменных ![]() и
и ![]() .
.
Аналогично
уравнениям адиабаты (2.86) и (2.87) уравнение
политропы может быть переписано в других
термодинамических координатах:
|
|
(2.108) |
|
|
(2.109) |
При
адиабатическом процессе ![]() ,
,
что соответствует нулевой теплоемкости.
Подставив ![]() в
в
формулу (2.104) и
сравнив получившееся выражение с (2.80),
имеем ![]() ,
,
и уравнение политропы (2.107) становится
уравнением адиабаты: ![]() .
.
Если
процесс изотермический, то ![]() ,
,
так как при этом ![]() .
.
В этом случае показатель политропы ![]() в
в
пределе равен единице, и уравнение
политропы (2.107) преобразуется
в уравнение Бойля-Мариотта (2.11): ![]() .
.
Обратим внимание на то, что поскольку
при выводе уравнения политропы мы
исключали величину ![]() ,
,
то этот вывод не может считаться полностью
корректным для изотермического процесса.
Для
изобарического процесса при ![]() показатель
показатель
политропы ![]() ,
,
и уравнение (2.107) принимает
форму: ![]() .
.
При
изохорическом процессе ![]() должно
должно
стать равным ![]() ,
,
что соответствует случаю, когда
показатель ![]() .
.
Очевидно, переход в формуле (2.107) к
указанному пределу некорректен. Это
связано с тем, что при выводе уравнения
политропы предполагалось, что ![]() (см.
(см.
переход к формуле (2.103)).
Если
умножить уравнение (2.100) на
величину ![]() и
и
сложить его с уравнением (2.102),
предварительно умноженным на величину ![]() ,
,
то получим уравнение политропы в
дифференциальном виде
|
|
(2.110) |
При ![]() это
это
уравнение приобретает форме:
|
|
(2.111) |
Отсюда
имеем ![]() или
или ![]() .
.
Из уравнения (2.110) также
следует, что в процессе, при котором ![]() ,
,
давление постоянно: ![]() .
.
Для
политропических процессов значение
теплоёмкости и, соответственно, показателя
политропы могут принимать любые величины.
Отрицательные значения теплоёмкости,
когда показатель политропы ![]() принимает
принимает
значения от единицы до величины g (см.
формулу (2.105)),
соответствуют таким условиям, при
которых внутренняя энергия термодинамической
системы убывает при передаче ей
положительного количества теплоты. Это
может быть осуществлено при принудительном
расширении газа.
В
соответствии с
формулой (2.100) при ![]() величины
величины ![]() и
и ![]() имеют
имеют
различные знаки, и с ростом объёма газа
его температура, а, следовательно, и
внутренняя энергия, уменьшаются. С этим,
в частности, связано понижение температуры
идеального газа при его адиабатическом
расширении, так как в этом процессе ![]() .
.
Наоборот, при ![]() с
с
ростом объёма газа его температура
растёт. В соответствии с первым началом
термодинамики этот рост должен быть
обеспечен подводом к системе дополнительного
количества теплоты.
Рассуждая
аналогичным образом, можно на основании
формулы (2.102) установить
связь между приращениями давления и
температуры. При![]() с
с
ростом давления температура газа будет
возрастать, а при ![]() –
–
уменьшаться.
Работа
газа в политропическом процессе может
быть определена с помощью интеграла (1.13) при
подстановке в него уравнения
политропы(2.107),
аналогично тому, как это сделано в
формуле (2.97):
|
|
(2.112) |
Интегрирование
в выражении (2.112) дает
формулу для определения работы в
политропическом процессе
|
|
(2.113) |
где: ![]() и
и ![]() –
–
начальные давление и объём газа, ![]() –
–
его конечный объём.
Из
этой формулы, в частности, следует, что
работа при расширении газа всегда
остаётся положительной, независимо от
того, какое значение принимает показатель
политропы, больше или меньше единицы.
Нетрудно
видеть, что для адиабатического процесса
при ![]() выражение (2.113) переходит
выражение (2.113) переходит
в формулу (2.95).
Для изобарического процесса, при ![]() ,
,
выражение (2.113) дает
|
|
(2.114) |
где
учтено, что при этом процессе ![]() .
.
Формула (2.113) неприменима
для описания изохорического процесса,
так как при выводе уравнения
политропы (2.103) исключался
случай ![]() .
.
Но из формулы (2.100) очевидно,
что работа газа в изохорическом процессе
равна нулю.
Другим
процессом, не описывающимся
соотношением (2.113),
является изотермический процесс. Как
было сказано выше, он является предельным
случаем политропического процесса
при ![]() .
.
Работу в изотермическом процессе можно
найти, если в формулу (2.112) в
соответствии с законом Бойля-Мариотта
подставить ![]() ,
,
а затем выполнить интегрирование. Тогда
имеем
|
|
(2.115) |
или
|
|
(2.116) |
где
учтено постоянство температуры в этом
процессе: ![]() .
.
Поскольку
внутренняя энергия идеального газа не
изменяется в изотермическом процессе,
количество теплоты, полученное газом,
также может быть рассчитано по этой
формуле, то есть в этом процессе ![]() .
.
При изотермическом расширении идеального
газа работа совершается только за счёт
теплоты, подведённой из окружающей
среды.
В
заключение параграфа запишем все
полученные формулы в единую таблицу
2.1.
|
Термодинамический |
Показательполитропы |
Теплоемкость |
Работа |
|
Изотермический |
1 |
|
|
|
Изобарический |
0 |
|
|
|
Изохорический |
|
|
0 |
|
Адиабатический |
|
0 |
|
Задача
2.4. Какова молярная теплоёмкость ![]() одноатомного
одноатомного
газа и показатель политропы ![]() для
для
процесса, в котором работа, совершаемая
газом, в два раза превосходит количество
теплоты, передаваемое ему?
Решение:
Так как по условию задачи ![]() ,
,
то в соответствии с первым началом
термодинамики имеем:
![]()
или
![]() .
.
Тогда,
с учетом одноатомности газа (число
степеней свободы ![]() ),
),
молярную теплоемкость можно определить
по формуле:
![]() ,
,
а
показатель политропы соответственно
будет равен:
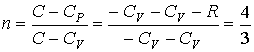
Задача
2.5. Какая работа совершается одним молем
идеального газа в политропическом
процессе с показателем политропы ![]() при
при
изменении температуры газа на ![]() ?
?
Решение:
Используя уравнение политропы (2.108): ![]() и
и
уравнение Клапейрона-Менделеева для
одного моля ![]() ,
,
перепишем (2.113) в
виде:
 .
.
Отсюда
имеем:
![]() .
.
Следовательно,
работа, совершаемая одном молем идеального
газа в процессе с постоянной теплоёмкостью,
определяется только разностью температур
конечного и начального состояний газа.
Таким
образом, для идеального газа работа, а,
следовательно, и количество теплоты, в
политропических процессах определяются
только конечным и начальным состояниями
системы, так как путь перехода из одного
состояния в другое определён теплоёмкостью
газа (показателем политропы). Однако
даже при рассмотрении только политропических
процессов, работу и количество теплоты
нельзя считать функцией состояния
системы, так как переход из одного
состояния в другое может быть осуществлен
последовательностью различных
политропических процессов.
Задача
2.6. Какое количество теплоты передано
одноатомному газу в процессе, описанному
в условии задачи 2.5?
Решение:
В соответствии с формулой (2.105) имеем:
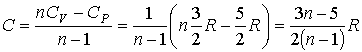 .
.
Тогда
количество теплоты будет равно:
 .
.
Отсюда,
в частности, следует, что при равенстве
показателя политропы показателю адиабаты
для одноатомного газа: ![]() ,
,
количество теплоты ![]() .
.
Работа
идеального газа в изопроцессах.
Первый
закон термодинамики (закон сохранения
энергии для тепловых процессов) определяет
количественное соотношение между
изменением внутренней энергии системы
дельта U, количеством теплоты Q, подведенным
к ней, и суммарной работой внешних сил
A, действующих на систему.
Первый
закон термодинамики – Изменение внутренней
энергии системы при ее переходе из
одного состояния в другое равно сумме
количества теплоты, подведенного к
системе извне, и работы внешних сил,
действующих на нее:
![]()
Первый
закон термодинамики – количество теплоты,
подведенное к системе, идет на изменение
ее внутренней энергии и на совершение
системой работы над внешними телами:
![]()
Частные
случаи первого закона термодинамики
для изопроцессов
При
изохорном процессе объем газа остается
постоянным, поэтому газ не совершает
работу. Изменение внутренней энергии
газа происходит благодаря теплообмену
с окружающими телами:
![]()
При
изотермическом процессе количество
теплоты, переданное газу от нагревателя,
полностью расходуется на совершение
работы:
Q=A’
При
изобарном расширении газа подведенное
к нему количество теплоты расходуется
как на увеличение его внутренней энергии
и на совершение работы газом:
![]()
Адиабатный
процесс – термодинамический процесс в
теплоизолированной системе.
![]()
Адиабатический
процесс.
Адиабатический
процесс — термодинамический процесс
в макроскопической системе, при котором
система не получает и не отдаёт тепловой
энергии.
Для
адиабатического процесса первое начало
термодинамики в силу отсутствия
теплообмена системы со средой имеет
вид: ![]() ,
, ![]() –
–
изменение внутренней энергии тела, A –
работа, совершаемая системой
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
В этой заметке рассмотрим как можно вычислить работу идеального газа при различных изо-процессах. Это будет полезно тем, кто только начинает изучать термодинамику и МКТ. Для простоты изображения всех процессов возьмем самые популярные P-V диаграммы.
Есть такое понятие как термодинамический процесс. Изменение любого параметра термодинамической системы (к параметрам можно отнести температуру T, давление p, объем V, энтропию S). Но так как все параметры термодинамической системы взаимосвязаны, то частенько, когда изменяется один параметр, то и изменяются другие параметры.
Если термодинамические процессы не протекают, то система находится в равновесном состоянии. То есть равновесное состояние — такое абстрактное состояние системы, при котором все термодинамические параметры системы остаются сколь угодно долго неизменными, если над системой не совершают никаких внешних воздействий. То есть система предоставлена сама себе. Почему же это состояние абстрактно? Потому что в реальной жизни очень тяжело изолировать систему от внешнего влияния окружающего мира. Таким образом, в каждый момент времени протекают какие-то термодинамические процессы.
Однако, процессы могут протекать настолько медленно, что система изменяется почти незаметно. Иногда это дает возможность рассматривать состояние системы из последовательных равновесных состояний. Такие процессы еще называются квазистатическими. Под квазистатичностью можно понимать что-то ооочень медленное, настолько медленной, что оно длится намного дольше, чем время релаксации (время, за которое амплитудное значение внешнего возмущения, которое начало менять систему, уменьшилось в e раз).
Еще система может постоянно возвращаться к исходному состоянию. Такой круговой процесс называется циклом (примерно по таким процессам работают тепловые машины и ДВС).
Что нужно чтобы изучить какую-либо термодинамическую систему?
1. Определить работу, совершаемую в данном процессе
2. Определить изменение внутренней энергии системы
3. Определить количество теплоты, которое вошло в систему или которое отдала система.
4. Установить связи между отдельными величинами, которые характеризуют состояние рабочего тела (газа)
Основные термодинамические процессы: изохорный, изобарный, изотермический, адиабатный и политропный.
И далее мы с вами выведем работы в этих основных процессах.
1. Изохорный процесс
Изохорным процесс — термодинамический процесс, который протекает при постоянном объеме. Такой процесс может совершаться при нагревании газа, помещенного в закрытый сосуд. Газ в результате подвода теплоты нагревается, и его давление возрастает.
2. Изотермический процесс
Изотермический процесс — термодинамический процесс, который протекает при постоянной температуре. На практике очень сложно осуществить этот процесс. Потому что при сжатии или расширении газа, нужны условия, при которых газ будет успевать обмениваться температурой с внешней средой, чтобы поддерживать свою температуру неизменной.
3. Изобарный процесс
Изобарный процесс — термодинамический процесс, который протекает при постоянном давлении. Помещение газа в плотный цилиндр с подвижным поршнем, на который действует постоянная сила ( например сила тяжести со стороны груза ) при отводе и подводе теплоты, может смоделировать такой процесс.
4. Адиабатный процесс
Адиабатный процесс — термодинамический процесс, который протекает без теплообмена (Q = 0) рабочего тела (газа) с окружающей средой. Также сложно осуществимый процесс. Примерная модель: газ помещают в цилиндр с подвижным поршнем. При этом цилиндр и поршень выполнены из высококачественного теплоизолирующего материала.
5. Политропный процесс (p∙Vⁿ = const )
Этот процесс является обобщением всех предыдущих. Все параметры в этом процессе могут меняться. А процессы выше являются его частными случаями. n – показатель политропы, некоторая постоянная, которая может принимать любые значения от -∞ до +∞.
n = 0 – изобарный процесс p = const
n = 0 – изотермический процесс T = const
n = γ – адиабатный процесс p∙Vⁿ = const
n = +∞ или n = -∞ – изохорный процесс V = const
Любые формулы для этого процесса аналогичны адиабатному процессу. При этом работа выводится точно также. Только коэффициент адиабаты (γ) в общем случае заменяется на коэффициент политропы (n).
Понравился разбор задачи ? Поставьте лайк, подпишитесь на канал! Вам не сложно, а мне очень приятно 🙂
Если Вам нужен репетитор по физике, математике или информатике/программированию, Вы можете написать мне или в мою группу Репетитор IT mentor в VK
Библиотека с книгами для физиков, математиков и программистов
Репетитор IT mentor в Instagram
Репетитор IT mentor в telegram
Адиабатным называют такой процесс в термодинамике, при котором не происходит теплообмена с окружающей средой.
Уравнение
Первое начало гласит, что общее количество теплоты есть сумма изменения внутренней энергии∆U системы и работы внешних сил А.
Q = ∆U + A.
При отсутствии обмена теплотой выражение будет иметь вид:
∆U + A = 0 или А = − ∆U
Иными словами, в адиабатном термодинамическом процессе работа газа равна убыли его внутренней энергии.
Продолжим преобразования.
Если работа А равна произведению давления p на бесконечно малое изменение объема, то
dU = − pdV
Используя уравнение Менделеева-Клапейрона (МК), запишем для идеального газа:
pdV = − CvdT.
Откуда следует, что dU = ν CvdT.
Дифференцирование все части, полная запись преображается следующим образом:
pdV + Vdp = ν RdT,
где R – универсальная газовая постоянная.
Выражаем dT как dU/ν Cv, а dU как – pdV и получаем:
pdV + Vdp = – pdV
Группируем подобные слагаемые:
Vdp = − pdV (1+R/Cv).
Примем сумму (1+R/Cv) за коэффициент γ:
γ = −
После интегрирования получим запись:
γln V = – ln p + const
Применяя свойства логарифмов, окончательно имеем:
pVγ = const
Равенство, к которому мы пришли есть уравнение адиабатного процесса. Другое название выражения – уравнение Пуассона. Следует напомнить, что рассматриваемая система – идеальный газ.
В этом уравнении коэффициент γ – показатель адиабаты (коэффициент Пуассона). Его физический смысл – отношение теплоемкостей системы при p = const и V = const, соответственно.
Графическое описание процесса
В координатах «давление – объём» адиабатические явления описываются графиком адиабатой. Кривая напоминает изотерму, но имеет более крутой вид. Это следует из пропорциональности произведения pV температуре T, согласно уравнению МК.
На рисунке кривая 1 является адиабатой, кривая 2 – изотермой для одной и той же идеальной системы.
Исходя из того, что:

pV T, адиабатный закон можно описать и так: TVγ−1 = const.
Соотношение между температурой и давлением в адиабатическом процессе:
pT(γ/1-γ) = const
Как найти работу газа
Чтобы выразить работу А, которую совершает система при Q = 0, снова используем уравнение МК:
dA = − νCvdT, что после дифференцирования преобразуется так:
А = − νCv(T1 – T2).
Уравнение Мейера для идеальных газов показывает связь между теплоёмкостями при изобарном и изохорном процессах. Согласно этому равенству, разность Cp и Сv есть универсальная газовая постоянная R. Тогда учитывая, что показатель адиабаты – это отношение этих теплоемкостей, выразим Сv в формуле для полной работы:
![]()
Подставляем теплоемкость изохорного процесса:

Связь температур, объёмов и давлений в термодинамике идеальных систем выглядит так:

Таким образом, работу можно представить через соотношение давлений или объемов:

Примеры задач
- Температура воспламенения T2 горючей смеси с показателем адиабаты 1,4 в двигателе Дизеля 1100 К (см. рисунок). Исходная температура Т1 равна 350 К. Найти, во сколько раз необходимо уменьшить объем смеси сжатием, чтобы произошло воспламенение.

Решение. Воспользуемся соотношением температур и объемов для адиабатного процесса идеального газа. Тогда:
T1V1γ−1 = T2V2γ−1. Выражаем отношение объемов и получаем ответ:
V1/V2 = (T2/T1)(1/(γ−1)) = (1100/3500)2,5 ≈ 17,5 раз.
- Начальные параметры воздуха Р1 0,1 МПа и Т1 = 300 К. После адиабатного сжатия в компрессоре двигателя давление Р2 стало 0,28 МПа. После этого при постоянном давлении произошло охлаждение воздушной смеси до 37 °С. Найти работу сжатия и количество отводимой теплоты при охлаждении.
Решение.

Для адиабатического процесса соотношение давлений и температуры:
(Р2/Р1)(γ−1)/γ = Т2/Т1, откуда находим температуру по завершении сжатия:
Т2 = Т1((Р2/Р1)(γ−1)/γ = 300 (0,28/0,1)1/0,4 = 402 К.
Показатель адиабаты равен 1,4 для воздуха в данных условиях.
Количество теплоты, которое отводится при изобарном охлаждении равно с учетом перевода градусов Цельсия в Кельвины:
Q = Cp(Т2 – Т3) = 1000(402-310) = 92 кДж/кг.
Тогда работа сжатия компрессора равна:
А = R (T2 – T1)/γ-1 ≈ 73,2 кДж/кг.
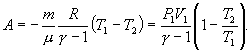
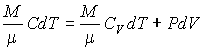 ,
, .
.
 .
. ,
,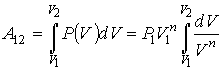 .
.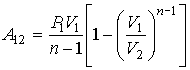 ,
,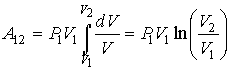
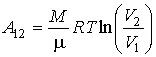 ,
,