Работа расширения или сжатия газа
Одним
из основных термодинамических процессов,
совершающихся в большинстве тепловых
машин, является процесс расширения газа
с совершением работы. Легко определить
работу, совершаемую при изобарном
расширении газа.
Если
при изобарном расширении газа от объема
V1
до объема V2
происходит перемещение поршня в цилиндре
на расстояние l
(рис. 7.3), то работа A’,
совершенная газом, равна
![]() ,
,
(7.27)
где
p
— давление газа,
![]() —
—
изменение его объема.
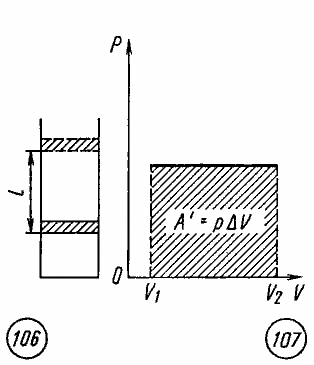 3
3
Рис
7.3 Рис 7.4
Как
видно из рисунка 7.4, при изображении
изобарного процесса расширения газа в
координатных осях p
, V
площадь фигуры, ограниченной графиком
процесса, координатами V1
и V2,
осью абсцисс, пропорциональна работе
газа A’.
Работа
при произвольном процессе расширения
газа.
Произвольный процесс расширения газа
от объема V1
до объема V2
можно представить как совокупность
чередующихся изобарных и изохорных
процессов.
При
изохорных процессах работа равна нулю,
так как поршень в цилиндре не перемещается.
Работа при изобарных процессах
пропорциональна площади фигуры на
диаграмме p,
V
под соответствующим участком изобары
(рис. 7.5).
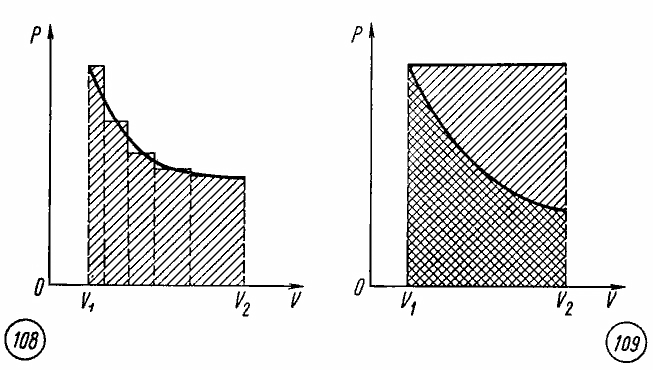
Рис.
7.5
Рис. 7.6
Следовательно,
работа при произвольном процессе
расширения газа прямо пропорциональна
площади фигуры под соответствующим
участком графика процесса на диаграмме
p,
V.
Работа
при изотермическом расширении газа.
Сравнивая площади фигур под участками
изотермы и изобары (рис. 7.6), можно сделать
вывод, что расширение газа от объема V1
до объема V2
при одинаковом начальном значении
давления газа сопровождается в случае
изобарного расширения совершением
большей работы.
Работа
при сжатии газа.
При расширении газа направление вектора
силы давления газа совпадает с направлением
вектора перемещения, поэтому работа
A’,
совершенная газом, положительна (A’
> 0), а работа А
внешних сил отрицательна: A
= –A’
< 0.
При
сжатии газа направление вектора внешней
силы совпадает с направлением перемещения,
поэтому работа А
внешних сил положительна (A
> 0), а работа A’,
совершенная газом, отрицательна (A’
< 0).
Адиабатный
процесс.
Кроме изобарного, изохорного и
изотермического процессов, в термодинамике
часто рассматриваются адиабатные
процессы.
Адиабатным
процессом
называется процесс, происходящий в
термодинамической системе при отсутствии
теплообмена с окружающими телами, т. е.
при условии Q
= 0.
Отсутствие
теплообмена с окружающей средой может
быть обеспечено хорошей теплоизоляцией
газа. Быстрые процессы расширения или
сжатия газа могут быть близкими к
адиабатному и при отсутствии теплоизоляции,
если время, за которое происходит
изменение объема газа, значительно
меньше времени, необходимого для
установления теплового равновесия газа
с окружающими телами.
Примерами
адиабатных процессов могут служить
процессы сжатия воздуха в цилиндре
воздушного огнива, в цилиндре двигателя
внутреннего сгорания. В соответствии
с первым законом термодинамики, при
адиабатном сжатии изменение внутренней
энергии газа
![]() равно
равно
работе внешних сил А:
![]() (7.28)
(7.28)
Так
как работа внешних сил при сжатии
положительна, внутренняя энергия газа
при адиабатном сжатии увеличивается,
его температура повышается.
При
адиабатном расширении газ совершает
работу A’
за счет уменьшения своей внутренней
энергии:
![]() ,
,
(7.29)
поэтому
температура газа при адиабатном
расширении понижается. Это можно
обнаружить в следующем опыте. Если в
бутылку, содержащую насыщенный водяной
пар, накачивать с помощью насоса воздух,
то пробка вылетает (рис. 7.7).
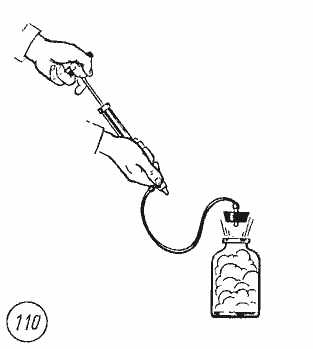
Рис.
7.7
Работа
A’
по выталкиванию пробки совершается
воздухом за счет уменьшения его внутренней
энергии, так как расширение воздуха
происходит за очень короткое время и
теплообмен с окружающей средой не
успевает произойти. Образование капель
тумана доказывает, что при адиабатном
расширении воздуха его температура
понизилась и опустилась ниже точки
росы.
График
адиабатного процесса.
Поскольку при адиабатном сжатии
температура газа повышается, то давление
газа с уменьшением объема растет быстрее,
чем при изотермическом процессе.
Понижение температуры газа при адиабатном
расширении приводит к тому, что давление
газа убывает быстрее, чем при изотермическом
расширении.
График
адиабатного процесса в координатных
осях p,
V
представлен на рисунке 1.8. На том же
рисунке для сравнения приведен график
изотермического процесса.
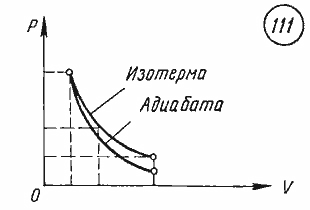
Рис.
7.8
Вну́тренняя
эне́ргия
тела (обозначается как E
или U) —
полная энергия этого тела за вычетом
кинетической
энергии
тела как целого и потенциальной
энергии
тела во внешнем поле сил. Следовательно,
внутренняя энергия складывается из
кинетической энергии хаотического
движения молекул,
потенциальной энергии взаимодействия
между ними и внутримолекулярной энергии.
Внутренняя
энергия является однозначной функцией
состояния системы. Это означает, что
всякий раз, когда система оказывается
в данном состоянии, её внутренняя энергия
принимает присущее этому состоянию
значение, независимо от предыстории
системы. Следовательно, изменение
внутренней энергии при переходе из
одного состояния в другое будет всегда
равно разности между ее значениями в
конечном и начальном состояниях,
независимо от пути, по которому совершался
переход.
Внутреннюю
энергию тела нельзя измерить напрямую.
Можно определить только изменение
внутренней энергии:
![]()
где
![]() —подведённая
—подведённая
к телу теплота,
измеренная в джоулях
![]() —работа,
—работа,
совершаемая телом против внешних сил,
измеренная в джоулях
Эта
формула является математическим
выражением первого
начала термодинамики
Для
квазистатических
процессов
выполняется следующее соотношение:
![]()
где
![]() —температура,
—температура,
измеренная в кельвинах
![]() —энтропия,
—энтропия,
измеренная в джоулях/кельвин
![]() —давление,
—давление,
измеренное в паскалях
![]() —химический
—химический
потенциал
![]() —количество
—количество
частиц в системе
Идеальные
газы
Согласно
закону Джоуля, выведенному эмпирически,
внутренняя энергия идеального
газа
не зависит от давления или объёма. Исходя
из этого факта, можно получить выражение
для изменения внутренней энергии
идеального газа. По определению молярной
теплоёмкости
при постоянном объёме,
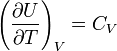 .
.
Так как внутренняя энергия идеального
газа является функцией только от
температуры, то
 .
.
(7.30)
Эта
же формула верна и для вычисления
изменения внутренней энергии любого
тела, но только в процессах при постоянном
объёме (изохорных
процессах);
в общем случае CV
(T,V)
является функцией и температуры, и
объёма.
Если
пренебречь изменением молярной
теплоёмкости при изменении температуры,
получим:
ΔU
= νCVΔT,
(7.31)
где
ν — количеств о вещества, ΔT —
изменение температуры.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Числом степеней свободы механической системы называют количество независимых величин, с помощью которых может быть задано положение системы.
Внутренняя энергия идеального газа представляет собой сумму только кинетической энергии всех молекул, а потенциальной энергией взаимодействия можно пренебречь:
U=∑Ek0=NEk0=mNAM·ikT2=i2·mMRT=i2νRT=i2pV
i — степень свободы. i = 3 для одноатомного (или идеального) газа, i = 5 для двухатомного газа, i = 6 для трехатомного газа и больше.
Изменение внутренней энергии идеального газа в изопроцессах
| Основная формула |
ΔU=32·mMRT=32νRT=32νR(T2−T1) |
| Изотермический процесс |
ΔU=0 Температура при изотермическом процессе — величина постоянная. Так как внутренняя энергия идеального газа постоянной массы в замкнутой системе зависит только от изменения температуры, то она тоже остается постоянной. |
| Изобарное расширение |
ΔU=32νR(T2−T1)=32(pV2−pV1)=32pΔV |
| Изохорное увеличение давления |
ΔU=32νR(T2−T1)=32(p2V−p1V)=32VΔp |
| Произвольный процесс |
ΔU=32νR(T2−T1)=32(p2V2−p1V1) |
Пример №1. На рисунке показан график циклического процесса, проведенного с идеальным газом. На каком из участков внутренняя энергия газа уменьшалась?

Внутренняя энергия газа меняется только при изменении температуры. Так как она прямо пропорциональная температуре, то уменьшается она тогда, когда уменьшается и температура. Температура падает на участке 3.
Работа идеального газа
Если газ, находящийся под поршнем, нагреть, то, расширяясь, он поднимет поршень, т.е. совершит механическую работу.

Механическая работа вычисляется по формуле:
A=Fscosα
Перемещение равно разности высот поршня в конечном и начальном положении:
s=h2−h1
Также известно, что сила равна произведению давления на площадь, на которое это давление оказывается. Учтем, что направление силы и перемещения совпадают. Поэтому косинус будет равен единице. Отсюда работа идеального газа равна произведению давления на площадь поршня:
Работа идеального газа
F=pS
p — давление газа, S — площадь поршня
Работа, необходимая для поднятия поршня — полезная работа. Она всегда меньше затраченной работы, которая определяется изменением внутренней энергии идеального газа при изобарном расширении:
A‘=p(V2−V1)=pΔV>0
Внимание! Знак работы определяется только знаком косинуса угла между направлением силы, действующей на поршень, и перемещением этого поршня.
Работа идеального газа при изобарном сжатии:
A‘=p(V2−V1)=pΔV<0
Работа идеального газа при нагревании газа:
A‘=νRΔT=νR(T2−T1)=mMνRΔT
Внимание! В изохорном процессе работа, совершаемая газом, равна нулю, так как работа газа определяется изменением его объема. Если изменения нет, работы тоже нет.
Геометрический смысл работы в термодинамике
В термодинамике для нахождения работы можно вычислить площадь фигуры под графиком в осях (p, V).
Примеры графических задач
| Изобарное расширение:
A‘=p(V2−V1) A‘>0 |
 |
| Изобарное сжатие:
A‘=p(V2−V1) A‘<0 |
 |
| Изохорное охлаждение:
V=const A‘=0 |
 |
|
Изохорное охлаждение и изобарное сжатие: 1–2: A‘=0 2–3: A‘=pΔV<0 |
 |
| Замкнутый цикл:
1–2: A‘>0 2–3: A‘=0 3–4: A‘<0 4–1: A‘=0 A‘=(p1−p3)(V2−V1) |
 |
| Произвольный процесс:
A‘=p1+p22(V2−V1) |
 |
Пример №2. На pV-диаграмме показаны два процесса, проведенные с одним и тем же количеством газообразного неона. Определите отношение работ A2 к A1 в этих процессах.

Неон — идеальный газ. Поэтому мы можем применять формулы, применяемые для нахождения работы идеального газа. Работа равна площади фигуры под графиком. С учетом того, что в обоих случаях изобарное расширение, получим:
A2=p(V2−V1)=4p(5V−3V)=4p2V=8pV
A1=p(V2−V1)=p(5V−V)=4pV
Видно, что работа, совершенная во втором процессе, вдвое больше работы, совершенной газом в первом процессе.
Задание EF17505
 Идеальный одноатомный газ переходит из состояния 1 в состояние 2 (см. диаграмму). Масса газа не меняется. Как изменяются при этом следующие три величины: давление газа, его объём и внутренняя энергия?
Идеальный одноатомный газ переходит из состояния 1 в состояние 2 (см. диаграмму). Масса газа не меняется. Как изменяются при этом следующие три величины: давление газа, его объём и внутренняя энергия?
Для каждой величины подберите соответствующий характер изменения:
1) увеличивается
2) уменьшается
3) не изменяется
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.

Алгоритм решения
- Определить по графику, как меняется давление.
- Определить, как меняется объем.
- Определить, отчего зависит внутренняя энергия газа, и как она меняется в данном процессе.
Решение
На графике идеальный одноатомный газ изотермически сжимают, так как температура остается неизменной, а давление увеличивается. При этом объем должен уменьшаться. Но внутренняя энергия идеального газа определяется его температурой. Так как температура постоянна, внутренняя энергия не изменяется.
Ответ: 123
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17758
Один моль аргона, находящийся в цилиндре при температуре T1=600 K и давлении p1=4⋅105 Па, расширяется и одновременно охлаждается так, что его температура при расширении обратно пропорциональна объёму. Конечное давление газа p2=105 Па. Какое количество теплоты газ отдал при расширении, если при этом он совершил работу A=2493 Дж?
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение состояния идеального газа.
3.Записать формулу для расчета внутренней энергии газа.
4.Используя первое начало термодинамики, выполнить общее решение задачи.
5.Подставив известные данные, вычислить неизвестную величину.
Решение
Запишем исходные данные:
• Начальная температура газа: T1 = 600 К.
• Начальное давление: p1 = 4∙105 Па.
• Конечное давление: p2 = 105 Па.
• Работа, совершенная газом: A = 2493 Дж.
Аргон является одноатомным газом. Поэтому для него можно использовать уравнение состояния идеального газа:
pV=νRT
Внутренняя энергия одноатомного идеального газа пропорциональна температуре:
U=32νRT
Внутренняя энергия аргона до расширения и после него:
U1=32νRT1
U2=32νRT2
Согласно условию задачи, температура при расширении обратно пропорциональна объёму. Следовательно:
T=constV
T1V1=T2V2
Выразим конечную температуру:
T2=T1V1V2
Составим уравнение состояния газа для состояний аргона 1 и 2:
p1V1=νRT1
p2V2=νRT2
Отсюда:
νR=p1V1T1=p2V2T2
Отсюда отношение объема аргона в состоянии 1 к объему газа в состоянии 2 равно:
V1V2=p2T1p1T2
Подставим это отношение в формулу для конечной температуры:
T2=T1V1V2=p2T12p1T2
Отсюда:
T2=T1√p2p1
Отсюда внутренняя энергия газа в состоянии 2 равна:
U2=32νRT1√p2p1
Уменьшение внутренней энергии аргона составило (изначально она была выше):
ΔU=U1−U2=32νRT1−32νRT1√p2p1=32νRT1(1−√p2p1)
В соответствии с первым началом термодинамики уменьшение внутренней энергии равно сумме совершённой работы и количества теплоты, отданного газом:
ΔU=Q+A
Следовательно, газ отдал следующее количество теплоты:
Q=ΔU−A=32νRT1(1−√p2p1)−A

pазбирался: Алиса Никитина | обсудить разбор
Задание EF17966
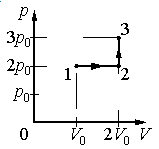 Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления газа от объёма. Работа, совершённая при этом газом, равна
Идеальный газ переводят из состояния 1 в состояние 3 так, как показано на графике зависимости давления газа от объёма. Работа, совершённая при этом газом, равна
Ответ:
а) р0V0
б) 2р0V0
в) 4р0V0
г) 6р0V0
Алгоритм решения
1.Определить, на каком участке графика совершается работа.
2.Записать геометрический смысл работы.
3.Извлекая данные из графика, вычислить работу, совершенную газом.
Решение
Работа совершается только тогда, когда газ меняет объем. Поэтому работа совершается только на участке 1–2.
Работа идеального газа равна площади фигуры, заключенной под графиком термодинамического процесса в координатах (p, V).
Давление газа при этом равно 2p0, а объем равен разности 2V0 и V0. Следовательно, работа, совершенная газом, будет равна произведению:
A=2p0(2V0−V0)=2p0V0
Ответ: б
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 14.9k
В этой заметке рассмотрим как можно вычислить работу идеального газа при различных изо-процессах. Это будет полезно тем, кто только начинает изучать термодинамику и МКТ. Для простоты изображения всех процессов возьмем самые популярные P-V диаграммы.
Есть такое понятие как термодинамический процесс. Изменение любого параметра термодинамической системы (к параметрам можно отнести температуру T, давление p, объем V, энтропию S). Но так как все параметры термодинамической системы взаимосвязаны, то частенько, когда изменяется один параметр, то и изменяются другие параметры.
Если термодинамические процессы не протекают, то система находится в равновесном состоянии. То есть равновесное состояние — такое абстрактное состояние системы, при котором все термодинамические параметры системы остаются сколь угодно долго неизменными, если над системой не совершают никаких внешних воздействий. То есть система предоставлена сама себе. Почему же это состояние абстрактно? Потому что в реальной жизни очень тяжело изолировать систему от внешнего влияния окружающего мира. Таким образом, в каждый момент времени протекают какие-то термодинамические процессы.
Однако, процессы могут протекать настолько медленно, что система изменяется почти незаметно. Иногда это дает возможность рассматривать состояние системы из последовательных равновесных состояний. Такие процессы еще называются квазистатическими. Под квазистатичностью можно понимать что-то ооочень медленное, настолько медленной, что оно длится намного дольше, чем время релаксации (время, за которое амплитудное значение внешнего возмущения, которое начало менять систему, уменьшилось в e раз).
Еще система может постоянно возвращаться к исходному состоянию. Такой круговой процесс называется циклом (примерно по таким процессам работают тепловые машины и ДВС).
Что нужно чтобы изучить какую-либо термодинамическую систему?
1. Определить работу, совершаемую в данном процессе
2. Определить изменение внутренней энергии системы
3. Определить количество теплоты, которое вошло в систему или которое отдала система.
4. Установить связи между отдельными величинами, которые характеризуют состояние рабочего тела (газа)
Основные термодинамические процессы: изохорный, изобарный, изотермический, адиабатный и политропный.
И далее мы с вами выведем работы в этих основных процессах.
1. Изохорный процесс
Изохорным процесс — термодинамический процесс, который протекает при постоянном объеме. Такой процесс может совершаться при нагревании газа, помещенного в закрытый сосуд. Газ в результате подвода теплоты нагревается, и его давление возрастает.
2. Изотермический процесс
Изотермический процесс — термодинамический процесс, который протекает при постоянной температуре. На практике очень сложно осуществить этот процесс. Потому что при сжатии или расширении газа, нужны условия, при которых газ будет успевать обмениваться температурой с внешней средой, чтобы поддерживать свою температуру неизменной.
3. Изобарный процесс
Изобарный процесс — термодинамический процесс, который протекает при постоянном давлении. Помещение газа в плотный цилиндр с подвижным поршнем, на который действует постоянная сила ( например сила тяжести со стороны груза ) при отводе и подводе теплоты, может смоделировать такой процесс.
4. Адиабатный процесс
Адиабатный процесс — термодинамический процесс, который протекает без теплообмена (Q = 0) рабочего тела (газа) с окружающей средой. Также сложно осуществимый процесс. Примерная модель: газ помещают в цилиндр с подвижным поршнем. При этом цилиндр и поршень выполнены из высококачественного теплоизолирующего материала.
5. Политропный процесс (p∙Vⁿ = const )
Этот процесс является обобщением всех предыдущих. Все параметры в этом процессе могут меняться. А процессы выше являются его частными случаями. n – показатель политропы, некоторая постоянная, которая может принимать любые значения от -∞ до +∞.
n = 0 – изобарный процесс p = const
n = 0 – изотермический процесс T = const
n = γ – адиабатный процесс p∙Vⁿ = const
n = +∞ или n = -∞ – изохорный процесс V = const
Любые формулы для этого процесса аналогичны адиабатному процессу. При этом работа выводится точно также. Только коэффициент адиабаты (γ) в общем случае заменяется на коэффициент политропы (n).
Понравился разбор задачи ? Поставьте лайк, подпишитесь на канал! Вам не сложно, а мне очень приятно 🙂
Если Вам нужен репетитор по физике, математике или информатике/программированию, Вы можете написать мне или в мою группу Репетитор IT mentor в VK
Библиотека с книгами для физиков, математиков и программистов
Репетитор IT mentor в Instagram
Репетитор IT mentor в telegram
При изменении объема газа, газ совершает работу.
При изобарическом процессе работа определяется как A = p∆V, где
A ― работа газа [Дж],
p ― давление газа [Па],
∆V ― изменение объема [м3].
Отсюда видно, что если объём газа не меняется, то есть ∆V = 0, то работа не совершается.
При расширении газа его работа положительна.
При сжатии газа работа отрицательна.
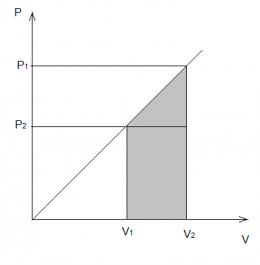
Работа, совершаемая газом, равна площади под графиком на PV диаграмме. На рисунке работа равна площади трапеции:
Внутренняя энергия идеального газа есть сумма кинетических энергий его частиц (энергией взаимодействия частиц пренебрегаем).
Внутренняя энергия идеального газа определяется формулой U = $frac{3}{2}; kT$ , где:
U ― внутренняя энергия [Дж],
T ― температура газа в Кельвинах [К],
k ― постоянная Больцмана, равная 1,38 10–23 [Дж/К].
Первое начало термодинамики представляет собой закон сохранения энергии, в применении к тепловым явлениям. Оно гласит, что тепло, полученное газом, идет на изменение внутренней энергии и совершение работы.
Q = ∆U + A, где
Q ― тепло, полученное газом [Дж],
∆U ― изменение внутренней энергии [Дж],
A ― работа газа [Дж].
Адиабатический процесс — термодинамический процесс, при котором система не обменивается теплотой с окружающим пространством.
В первом начале термодинамики при адиабатическом процессе необходимо положить Q = 0.
Коэффициент полезного действия (КПД) — отношение полезно использованной энергии газа, ко всей полученной энергии:
$eta = frac{Q_{H} – Q_{X}}{Q_H}$где
η ― коэффициент полезного действия, КПД,
QH ― количество теплоты, полученное от нагревателя [Дж],
QX ― количество теплоты, отданное холодильнику [Дж].
Цикл Карно — максимально возможный КПД любой тепловой машины.
КПД цикла Карно определяется температурами нагревателя и холодильника.
$eta = frac{T_H – T_X}{T_H}$ где
η ― коэффициент полезного действия , КПД,
ТН ― температура нагревателя [К],
ТХ ― температура холодильника [К].
