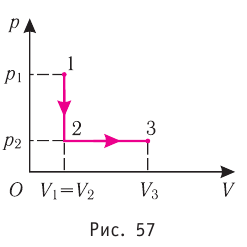
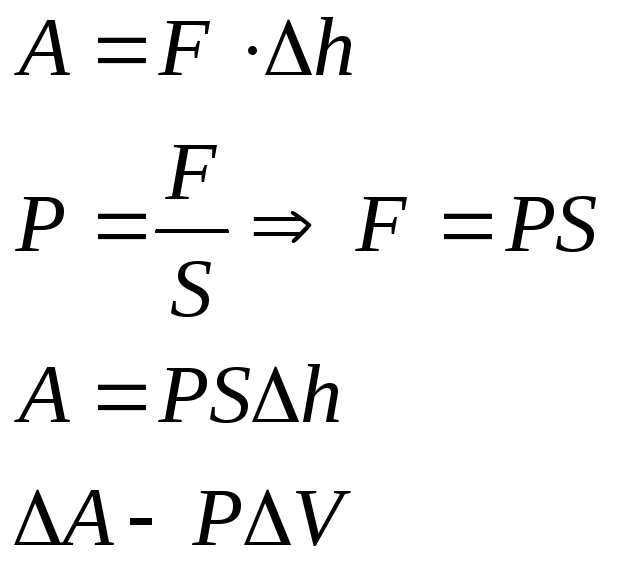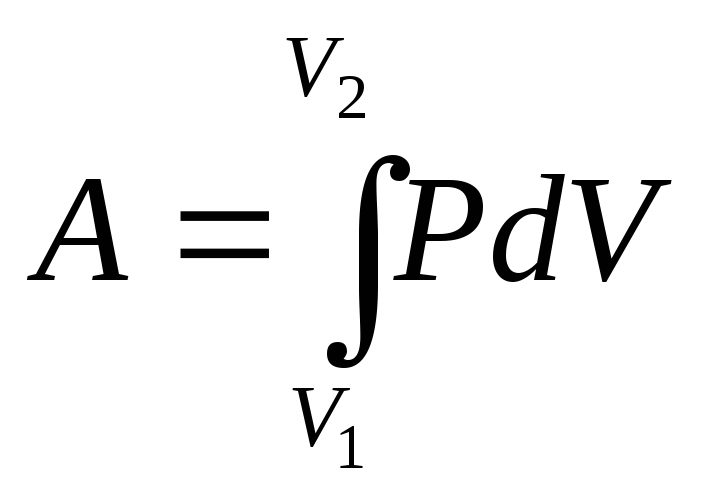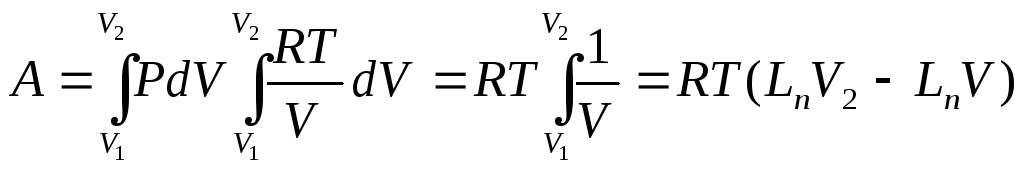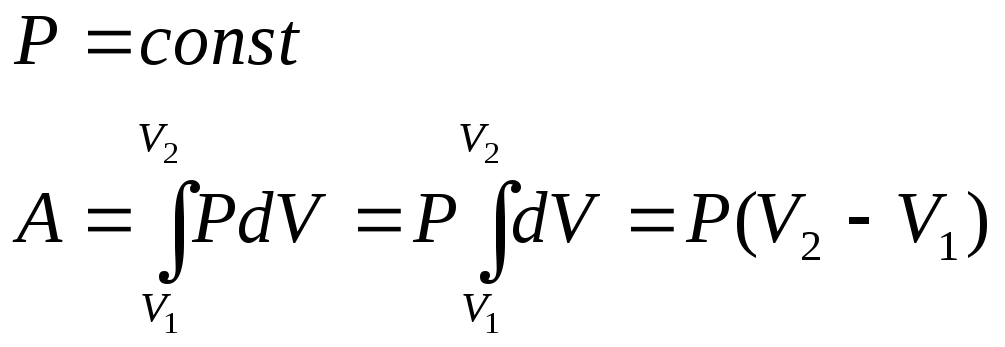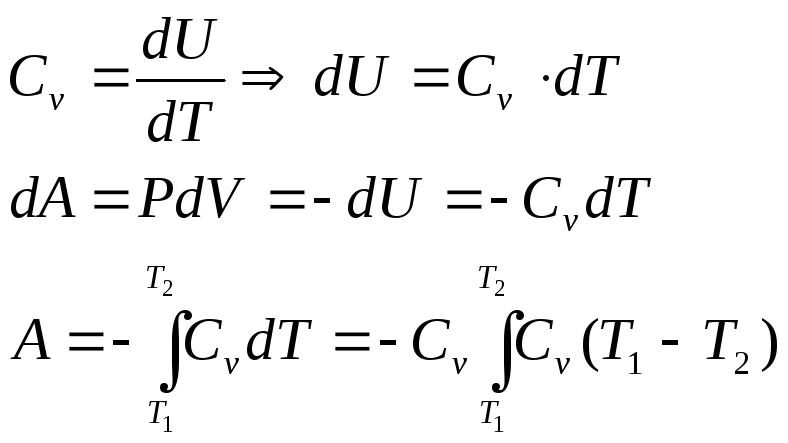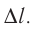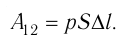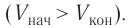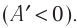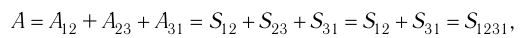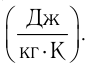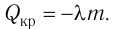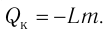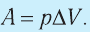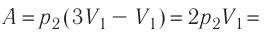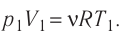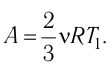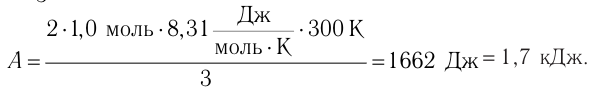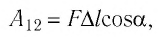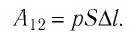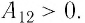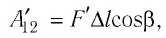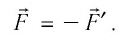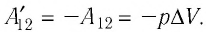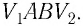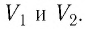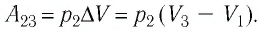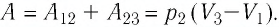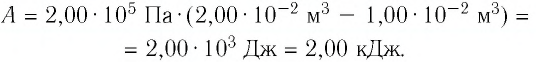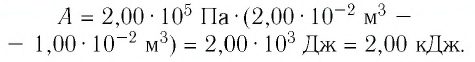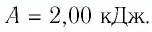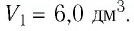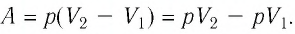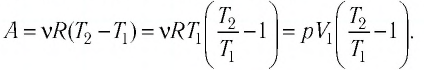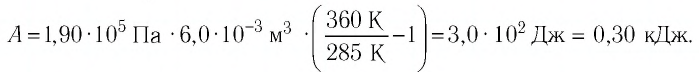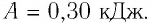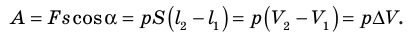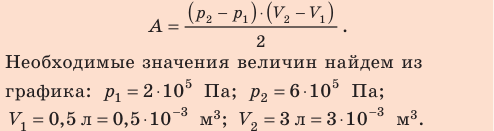В этой заметке рассмотрим как можно вычислить работу идеального газа при различных изо-процессах. Это будет полезно тем, кто только начинает изучать термодинамику и МКТ. Для простоты изображения всех процессов возьмем самые популярные P-V диаграммы.
Есть такое понятие как термодинамический процесс. Изменение любого параметра термодинамической системы (к параметрам можно отнести температуру T, давление p, объем V, энтропию S). Но так как все параметры термодинамической системы взаимосвязаны, то частенько, когда изменяется один параметр, то и изменяются другие параметры.
Если термодинамические процессы не протекают, то система находится в равновесном состоянии. То есть равновесное состояние — такое абстрактное состояние системы, при котором все термодинамические параметры системы остаются сколь угодно долго неизменными, если над системой не совершают никаких внешних воздействий. То есть система предоставлена сама себе. Почему же это состояние абстрактно? Потому что в реальной жизни очень тяжело изолировать систему от внешнего влияния окружающего мира. Таким образом, в каждый момент времени протекают какие-то термодинамические процессы.
Однако, процессы могут протекать настолько медленно, что система изменяется почти незаметно. Иногда это дает возможность рассматривать состояние системы из последовательных равновесных состояний. Такие процессы еще называются квазистатическими. Под квазистатичностью можно понимать что-то ооочень медленное, настолько медленной, что оно длится намного дольше, чем время релаксации (время, за которое амплитудное значение внешнего возмущения, которое начало менять систему, уменьшилось в e раз).
Еще система может постоянно возвращаться к исходному состоянию. Такой круговой процесс называется циклом (примерно по таким процессам работают тепловые машины и ДВС).
Что нужно чтобы изучить какую-либо термодинамическую систему?
1. Определить работу, совершаемую в данном процессе
2. Определить изменение внутренней энергии системы
3. Определить количество теплоты, которое вошло в систему или которое отдала система.
4. Установить связи между отдельными величинами, которые характеризуют состояние рабочего тела (газа)
Основные термодинамические процессы: изохорный, изобарный, изотермический, адиабатный и политропный.
И далее мы с вами выведем работы в этих основных процессах.
1. Изохорный процесс
Изохорным процесс — термодинамический процесс, который протекает при постоянном объеме. Такой процесс может совершаться при нагревании газа, помещенного в закрытый сосуд. Газ в результате подвода теплоты нагревается, и его давление возрастает.
2. Изотермический процесс
Изотермический процесс — термодинамический процесс, который протекает при постоянной температуре. На практике очень сложно осуществить этот процесс. Потому что при сжатии или расширении газа, нужны условия, при которых газ будет успевать обмениваться температурой с внешней средой, чтобы поддерживать свою температуру неизменной.
3. Изобарный процесс
Изобарный процесс — термодинамический процесс, который протекает при постоянном давлении. Помещение газа в плотный цилиндр с подвижным поршнем, на который действует постоянная сила ( например сила тяжести со стороны груза ) при отводе и подводе теплоты, может смоделировать такой процесс.
4. Адиабатный процесс
Адиабатный процесс — термодинамический процесс, который протекает без теплообмена (Q = 0) рабочего тела (газа) с окружающей средой. Также сложно осуществимый процесс. Примерная модель: газ помещают в цилиндр с подвижным поршнем. При этом цилиндр и поршень выполнены из высококачественного теплоизолирующего материала.
5. Политропный процесс (p∙Vⁿ = const )
Этот процесс является обобщением всех предыдущих. Все параметры в этом процессе могут меняться. А процессы выше являются его частными случаями. n – показатель политропы, некоторая постоянная, которая может принимать любые значения от -∞ до +∞.
n = 0 – изобарный процесс p = const
n = 0 – изотермический процесс T = const
n = γ – адиабатный процесс p∙Vⁿ = const
n = +∞ или n = -∞ – изохорный процесс V = const
Любые формулы для этого процесса аналогичны адиабатному процессу. При этом работа выводится точно также. Только коэффициент адиабаты (γ) в общем случае заменяется на коэффициент политропы (n).
Понравился разбор задачи ? Поставьте лайк, подпишитесь на канал! Вам не сложно, а мне очень приятно 🙂
Если Вам нужен репетитор по физике, математике или информатике/программированию, Вы можете написать мне или в мою группу Репетитор IT mentor в VK
Библиотека с книгами для физиков, математиков и программистов
Репетитор IT mentor в Instagram
Репетитор IT mentor в telegram
При термодинамических
процессах совершается работа. Получим
выражение для этой работы.
Рассмотрим переход
системы из первого состояния во второе.
На бесконечно малом участке совершается
работа, равная:
Рисунок 32.
– полная работа,
совершаемая при переходе системы из
первого состояния во второе.
Полная
работа, совершаемая при переходе системы
из первого состояния во второе, графически
равна площади, ограниченной кривой 1,2,
ординатами
и
и осью (рис.32).
Работа,
совершаемая при термодинамических
процессах зависит от характера процесса.
Рассмотрим
работу при изотермическом, изобарическом,
адиабатическом процессе.
Работа при изотермическом процессе.
Из
уравнения Менделеева- Клапейрона имеем:
– работа при
изотермическом процессе.
Работа при изобарическом процессе.
–
работа при изобарическом процессе
Работа при адиабатическом процессе.
– изменение
внутренней энергии
Работа
при адиабатическом процессе происходит
за счет изменения внутренней энергии
системы.
Т.к.,
при адиабатическом процессе не происходит
теплообмена между системой и окружающей
средой
,
значит работа при адиабатическом
процессе совершается за счет изменения
внутренней энергии системы:.
Таким
образом работа при адиабатическом
процессе равна:
Для
описания адиабатического процесса
используется уравнение Пуассона:
– показатель
адиабаты
При
адиабатическом расширении температура
газа уменьшается, при адиабатическом
сжатии температура увеличивается.
1.5.Тепловая машина. Цикл Карно.
Машиной
называется
периодический действующий механизм,
который, пройдя ряд термодинамических
состояний, возвращается в исходное
состояние и этот процесс повторяется.
Рассмотрим
устройство и работу тепловой машины,
изобретенной французским физиком Карно.
С
помощью своей тепловой машины Карно
провел важнейший опыт, который лег в
основу второго начала термодинамики.
Для проведения своего опыта Карно
использовал цилиндрический сосуд с
нетеплопроводными стенками и с
теплопроводным дном, заключив в этот
сосуд один моль газа. Внутри стенок
сосуда перемещался поршень, который
давал газу возможность изменять свой
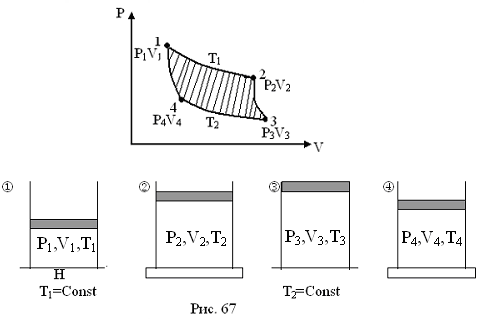
объем . В процессе проведения опыта в
системе, изобретенной Карно, протекало
4 процесса: изотермическое расширение,
адиабатическое расширение, изотермическое
сжатие, адиабатическое сжатие. Графики
этих процессов представлены на рисунке
33.
Рассмотрим
работу идеальной тепловой машины, в
качестве рабочего тела в которой
используется один моль идеального газа
(рис.33)
Рисунок
33.
-
Газ
в сжатом состоянии. Поршень в положении
.
Обеспечивается изотермическое
расширение. Дно соприкасается с
нагревателем. -
Газ
расширяется до состояния (P2V2T1),
а затем, адиабатически, до состояния(P3V3T2).
Совершая работу газ охладится, поэтому
Т2<Т1
3 .Для завершения
цикла газ возвращается в исходное
состояние за счет внешних сил –
изотермически до состояния .
4.
Далее газ адиабатически возвращается
в состояние j.
В результате цикла,
газ, получив количество теплоты Q1от нагревателя, и, передав часть теплаQ2холодильнику,
совершил внешнюю работу.
Возникает вопрос
– возможен ли переход системы в
первоначальное состояние без участия
холодильника. Очевидно, что нет.
Проведенный Карно опыт лег в основу
второго начала термодинамики.
Второе начало
термодинамики –невозможен такой
периодически действующий механизм,
который бы все переданное ему тепло
переводил бы в работу. Часть тепла должна
быть отдана холодильнику.
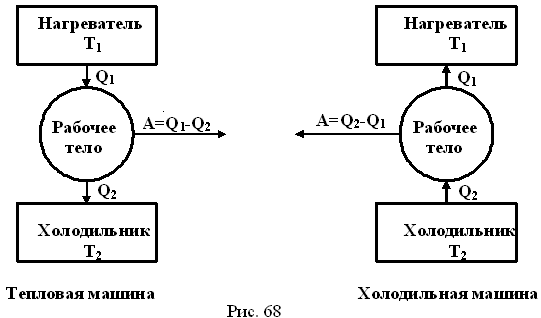
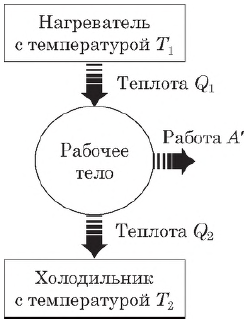
Тепловая машинасостоит из нагревателя, холодильника
и рабочего тела (рис.34)
Нагреватель
передаёт рабочему телу количество
теплоты. Рабочее тело совершает работу,
равную разности количества теплоты,
переданного от нагревателя рабочему
телу, и количества теплоты, полученного
холодильником от рабочего тела. По
такому же принципу, но с обратным циклом
Карно, работает холодильная машина.
Рисунок
34.
КПД
тепловой машины.
Тепловые машины
благодаря трению и неизбежным тепловым
потерям имеют небольшой коэффициент
полезного действия (например КПД
двигателя внутреннего сгорания составляет
45%).
Энтропия –
математическая абстракция вводимая,
как мера беспорядка в системе и для
описания термодинамических процессов.
Энтропия
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Работа в термодинамике
В термодинамике, в отличие от механики, рассматривается не движение тела как целого, а лишь относительное изменение частей термодинамической системы, в результате которого меняется ее объем.
Рассмотрим работу газа при изобарическом расширении.
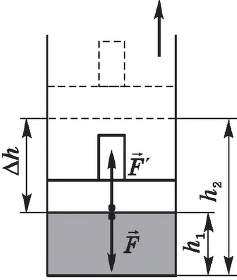
Вычислим работу, совершаемую газом при его действии на поршень с силой ${F’}↖{→}$, равной по величине и противоположной по направлению силе ${F’}↖{→}$, действующей на газ со стороны поршня: ${F’}↖{→}=-{F’}↖{→}$ (согласно третьему закону Ньютона), $F’=pS$, где $p$ — давление газа, а $S$ — площадь поверхности поршня. Если перемещение поршня $∆h$ в результате расширения мало, то давление газа можно считать постоянным и работа газа равна:
$A’=F’∆h=pS∆h=p∆V$
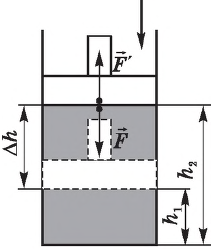
Если газ расширяется, он совершает положительную работу, та к как перемещение поршня совпадает по направлению с силой ${F’}↖{→}$. Если газ сжимается, то работа газа отрицательна, поскольку перемещение поршня противоположно силе ${F’}↖{→}$. В формуле $A’=F’∆h=pS∆h=p∆V$ появится знак «минус»: $∆V < 0$, поскольку $∆h < 0$.
Работа внешних сил $А$, наоборот, положительна при сжатии газа и отрицательна при расширении:
$A=-A’=-p∆V$
Совершая над газом положительную работу, внешние тела передают ему часть своей энергии. При расширении газа внешние тела отбирают у газа часть его энергии — работа внешних сил отрицательна.
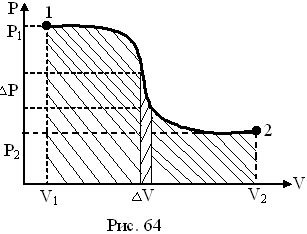
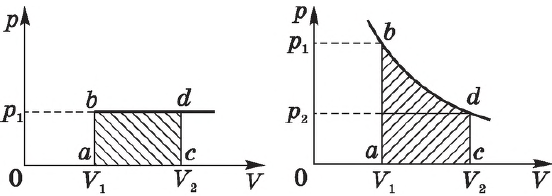
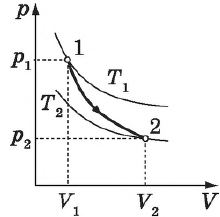
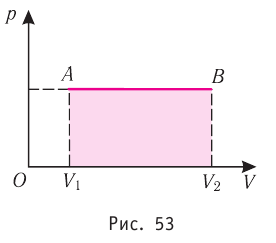
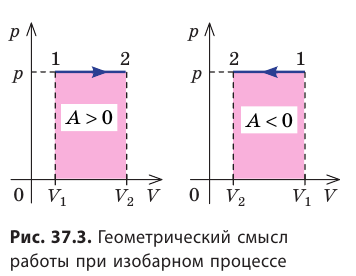
На графике зависимости давления от объема $р(V)$ работа определяется как площадь, ограниченная кривой $р(V)$, осью $V$ и отрезками $ab$ и $cd$, равными давлениям $р_1$ в начальном ($V_1$) и $р_2$ в конечном ($V_2$) состояниях, как для изобарного, так и для изотермического процессов.
Первый закон термодинамики
Первое начало (первый закон) термодинамики — это закон сохранения и превращения энергии для термодинамической системы.
Согласно первому началу термодинамики, работа может совершаться только за счет теплоты или какой-либо другой формы энергии. Следовательно, работу и количество теплоты измеряют в одних единицах — джоулях (как и энергию).
Первое начало термодинамики было сформулировано немецким ученым Ю. Л. Майером в 1842 г. и подтверждено экспериментально английским ученым Дж. Джоулем в 1843 г.
Первый закон термодинамики формулируется так:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
$∆U=A+Q$
где $∆U$ — изменение внутренней энергии, $А$ — работа внешних сил, $Q$ — количество теплоты, переданной системе.
Из $∆U=A+Q$ следует закон сохранения внутренней энергии. Если систему изолировать от внешних воздействий, $A=0$ и $Q=0$,а следовательно, $∆U=0$.
При любых процессах, происходящих в изолированной системе, ее внутренняя энергия остается постоянной.
Если работу совершает система, а не внешние силы, то уравнение ($∆U=A+Q$) записывается в виде:
$Q=∆U+A’$
где $А’$ — работа, совершаемая системой ($А’=-А$).
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Первое начало термодинамики может быть сформулировано как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника, т. е. только за счет внутренней энергии.
Действительно, если к телу не поступает теплота ($Q=0$), то работа $А’$, согласно уравнению $Q=∆U+A’$, совершается только за счет убыли внутренней энергии $A’=-∆U$. После того, как запас энергии окажется исчерпанным, двигатель перестает работать.
Следует помнить, что как работа, так и количество теплоты являются характеристиками процесса изменения внутренней энергии, поэтому нельзя говорить, что в системе содержится определенное количество теплоты или работы. Система в любом состоянии обладает лишь определенной внутренней энергией.
Применение первого закона термодинамики к различным процессам
Рассмотрим применение первого закона термодинамики к различным термодинамическим процессам.
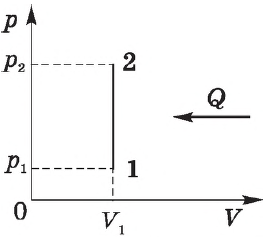
Изохорный процесс. Зависимость $р(Т)$ на термодинамической диаграмме изображается изохорой.
Изохорный (изохорический) процесс — термодинмический процесс, происходящий в системе при постоянном объеме.
Изохорный процесс можно осуществить в газах и жидкостях, заключенных в сосуд с постоянным объемом.
При изохорном процессе объем газа не меняется ($∆V=0$), и, согласно первому началу термодинамики $Q=∆U+A’$,
$∆U=Q$
т. е. изменение внутренней энергии равно количеству переданного тепла, т. к. работа ($A=p∆V=0$) газом не совершается.
Если газ нагревается, то $Q > 0$ и $∆U > 0$, его внутренняя энергия увеличивается. При охлаждении газа $Q < 0$ и $∆U < 0$, внутренняя энергия уменьшается.
Изотермический процесс графически изображается изотермой.
Изотермический процесс — это термодинамический процесс, происходящий в системе при постоянной температуре.
Поскольку при изотермическом процессе внутренняя энергия газа не меняется ($T=const$), то все переданное газу количество теплоты идет на совершение работы:
$Q=A’$
При получении газом теплоты ($Q > 0$) он совершает положительную работу ($А’ > 0$). Если газ отдает тепло окружающей среде, $Q < 0$ и $А’ < 0$. В этом случае над газом совершается работа внешними силами. Для внешних сил работа положительна. Геометрически работа при изотермическом процессе определяется площадью под кривой $р(V)$.
Изобарный процесс на термодинамической диаграмме изображается изобарой.
Изобарный (изобарический) процесс — термодинамический процесс, происходящий в системе с постоянным давлением $p$.
Примером изобарного процесса является расширение газа в цилиндре со свободно ходящим нагруженным поршнем.
При изобарном процессе согласно формуле $Q=∆U+A’$ передаваемое газу количество теплоты идет на изменение его внутренней энергии $∆U$ и на совершение им работы $A’$ при постоянном давлении:
$Q=∆U+A’$
Работа идеального газа определяется по графику зависимости $p(V)$ для изобарного процесса ($A’=p∆V$).
Для идеального газа при изобарном процессе объем пропорционален температуре, в реальных газах часть теплоты расходуется на изменение средней энергии взаимодействия частиц.
Адиабатический процесс
Адиабатический процесс (адиабатный процесс) — это термодинамический процесс, происходящий в системе без теплообмена с окружающей средой ($Q=0$).
Адиабатическая изоляция системы приближенно достигается в сосудах Дьюара, в так называемых адиабатных оболочках. На адиабатически изолированную систему не оказывает влияния изменение температуры окружающих тел. Ее внутренняя энергия и может меняться только за счет работы, совершаемой внешними телами над системой, или самой системой.
Согласно первому началу термодинамики ($∆U=A+Q$), в адиабатной системе
$∆U=A$
где $А$ — работа внешних сил.
При адиабатном расширении газа $А < 0$.
Следовательно,
$∆U={i}/{2}·{m}/{M}R∆T < 0,$
что означает уменьшение температуры при адиабатном расширении. Оно приводит к тому, что давление газа уменьшается более резко, чем при изотермическом процессе.
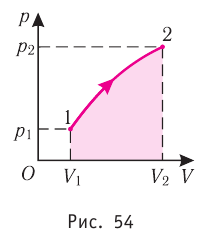
На рисунке адиабата $1—2$, проходящая между двумя изотермами, наглядно иллюстрирует сказанное. Площадь под адиабатой численно равна работе, совершаемой газом при его адиабатическом расширении от объема $V_1$ до $V_2$.
Адиабатное сжатие приводит к повышению температуры газа, т. к. в результате упругих соударений молекул газа с поршнем их средняя кинетическая энергия возрастает, в отличие от расширения, когда она уменьшается (в первом случае скорости молекул газа увеличиваются, во втором — уменьшаются).
Резкое нагревание воздуха при адиабатическом сжатии используется в двигателях Дизеля.
Принцип действия тепловых двигателей
Тепловой двигатель — это устройство, преобразующее внутреннюю энергию топлива в механическую энергию.
Согласно второму началу термодинамики, тепловой двигатель может непрерывно совершать периодически повторяющуюся механическую работу за счет охлаждения окружающих тел, если он не только получает теплоту от более горячего тела (нагревателя), но при этом отдает теплоту менее нагретому телу (холодильнику). Следовательно, на совершение работы идет не все количество теплоты, полученное от нагревателя, а только часть ее.
Таким образом, основными элементами любого теплового двигателя являются:
- рабочее тело (газ или пар), совершающее работу;
- нагреватель, сообщающий энергию рабочему телу;
- холодильник, поглощающий часть энергии от рабочего тела.
Коэффициент полезного действия теплового двигателя
Согласно закону сохранения энергии, работа, совершаемая двигателем, равна:
$A’=|Q_1|-|Q_2|$
где $Q_1$ — количество теплоты, полученное от нагревателя, $Q_2$ — количество теплоты, отданное холодильнику.
Коэффициентом полезного действия (КПД) теплового двигателя называется отношение работы $А’$, совершаемой двигателем, к количеству теплоты, полученному от нагревателя:
$η={A’}/{|Q_1|}={|Q_1|-|Q_2|}/{|Q_1|}=1-{|Q_2|}/{|Q_1|}$
Так как у всех двигателей некоторое количество теплоты передается холодильнику, то $η < 1$.
КПД теплового двигателя пропорционален разности температур нагревателя и холодильника. При $T_1 – T_2=0$ двигатель не может работать.
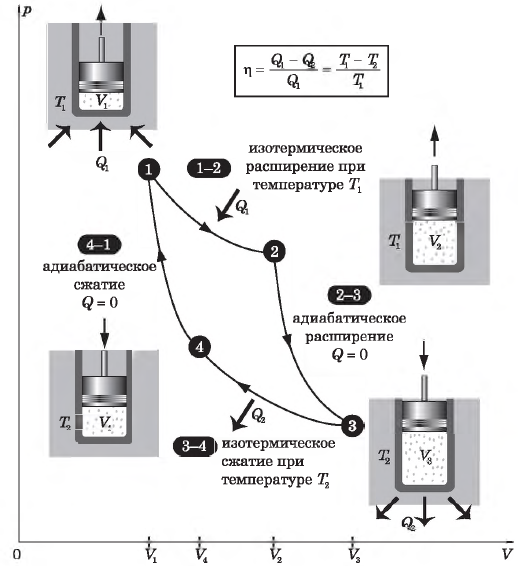
Цикл Карно
Цикл Карно — это круговой обратимый процесс, состоящий из двух изотермических и двух адиабатических процессов.
Впервые этот процесс был рассмотрен французским инженером и ученым Н. Л. С. Карно в 1824 г. в книге «Размышления о движущей силе огня и о машинах, способных развивать эту силу».
Целью исследований Карно было выяснение причин несовершенства тепловых машин того времени (они имели КПД $< 5%$)и поиски путей их усовершенствования.
Выбор двух изотермических и двух адиабатических процессов был обусловлен тем, что работа газа при изотермическом расширении совершается за счет внутренней энергии нагревателя, а при адиабатном процессе — за счет внутренней энергии расширяющегося газа. В этом цикле исключен контакт тел с разной температурой, следовательно, исключена теплопередача без совершения работы.
Цикл Карно — самый эффективный из всех возможных. Его КПД максимален.
На рисунке изображены термодинамические процессы цикла. В процессе изотермического расширения ($1-2$) при температуре $Т_1$ работа совершается за счет изменения внутренней энергии нагревателя, т. е. за счет подведения к газу количества теплоты $Q_1$:
$A_{12}=Q_1.$ Охлаждение газа перед сжатием ($3-4$) происходит при адиабатном расширении ($2-3$). Изменение внутренней энергии $∆U_{23}$ при адиабатном процессе ($Q=0$) полностью преобразуется в механическую работу:
$A_{23}=-∆U_{23}$
Температура газа в результате адиабатического расширения ($2-3$) понижается до температуры холодильника $Т_2 < Т_1$. В процессе ($3-4$) газ изотермически сжимается, передавая холодильнику количество теплоты $Q_2$:
$A_{34}=Q_2,$
Цикл завершается процессом адиабатического сжатия ($4—1$), при котором газ нагревается до температуры $Т_1$.
Максимальное значение КПД тепловых двигателей, работающих на идеальном газе, по циклу Карно:
$η={T_1-T_2}/{T_1}=1-{T_2}/{T_1}$
Суть формулы $η={T_1-T_2}/{T_1}=1-{T_2}/{T_1}$ выражена в доказанной С. Карно теореме о том, что КПД любого теплового двигателя не может превышать КПД цикла Карно, осуществляемого при той же температуре нагревателя и холодильника.
Содержание:
Работа в термодинамике:
В 9 классе вы узнали, что работа силы (механическая работа) связана с превращением одного вида энергии в другой, например, механической энергии во внутреннюю. Работу силы рассматривают как меру изменения энергии физической системы. А как определить работу в термодинамике? Как может быть выражена эта работа через макроскопические параметры — давление и об1
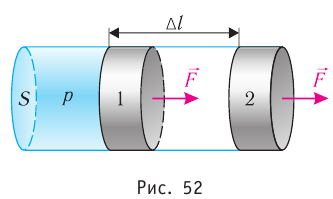
Рассмотрим газ, находящийся в цилиндрическом сосуде с площадью основания S, закрытом подвижным поршнем (рис. 52).
Взаимодействие газа с поршнем, а также со стенками сосуда можно характеризовать давлением р, которое газ оказывает на них. Допустим, что в результате изобарного расширения газа поршень переместился из положения 1 в положение 2 на расстояние
Модуль силы давления газа, действующей на поршень, F = pS. Эта сила совершает работу по перемещению поршня
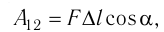
где а — угол между направлениями силы и перемещения. В рассматриваемом примере а = 0, тогда
Произведение 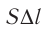
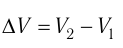
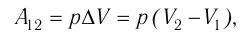
где 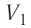
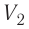
Так как давление р газа всегда величина положительная, из формулы (10.2) следует, что, если газ расширяется 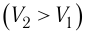
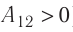
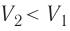
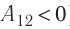
Процесс медленного изобарного сжатия газа из состояния 2 с начальным объёмом 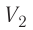
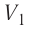
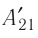
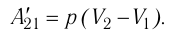
Из сравнения равенств (10.2) и (10.3) вытекает соотношение между работой 
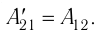
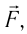
направление, противоположное силе давления 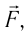
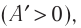
Если газ расширяется 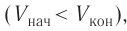
Геометрическое толкование работы
Построим график зависимости давления газа от его объёма при р = const. Как видно из рисунка 53, при изобарном расширении газа работа, совершённая силой давления газа, численно равна площади прямоугольника
Если процесс перехода газа из начального состояния в конечное не является изобарным, то работа, совершённая силой давления газа при изменении его объёма от 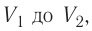
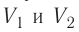
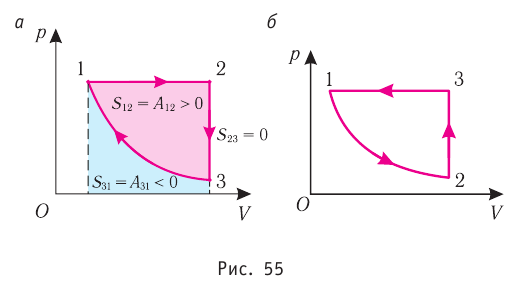
Процесс, при котором термодинамическая система, прошедшая некоторую последовательность состояний, снова возвращается в исходное состояние, называют циклическим процессом или циклом (рис. 55). Работа, совершаемая системой при циклическом процессе, или работа цикла, равна площади фигуры, ограниченной линиями, которые изображают цикл:
где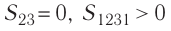
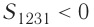
Если «кривая расширения» (изобара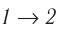
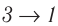
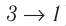
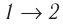
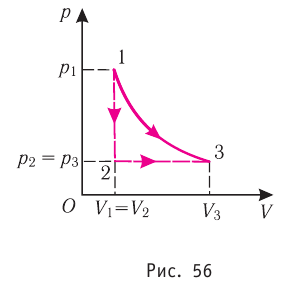
Из рисунка 56 видно, что численное значение работы цикла определяется не только начальным и конечным состояниями системы, но и видом процесса. Например, газ из состояния 1 можно перевести в состояние 3 либо в результате изотермического расширения, либо сначала изохорно понизив его давление до значения 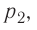
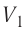
Как видно из рисунка 56, в первом случае работа, совершённая силами давления газа, больше, чем во втором. Следовательно, работа, совершаемая при переходе термодинамической системы из одного состояния в другое, зависит не только от начального и конечного состояний системы, но и от вида процесса.
Количество теплоты и удельная теплоёмкость
Итак, существуют два способа передачи энергии от одного тела к другому. Первый характеризуется передачей энергии в процессе механического взаимодействия тел — механическая энергия одного тела переходит в энергию хаотического движения частиц вещества другого тела или, наоборот, убыль энергии хаотического движения частиц вещества одного тела сказывается на увеличении механической энергии другого тела. Такую форму передачи энергии в термодинамике (как и в механике) называют работой. Так, например, в рассмотренной нами ранее термодинамической системе (газ в цилиндрическом сосуде под поршнем) расширение газа приводит к перемещению поршня. При этом убыль внутренней энергии газа равна работе, совершённой силой давления газа, под действием которой поршень переместился.
Второй способ передачи энергии осуществляется при непосредственном обмене энергией между хаотически движущимися частицами взаимодействующих тел. За счёт переданной при этом энергии увеличивается внутренняя энергия одного тела и уменьшается внутренняя энергия другого. Если, например, привести в соприкосновение два тела с разными температурами, то частицы более нагретого тела будут передавать часть своей энергии частицам более холодного тела. В результате внутренняя энергия первого тела уменьшается, а второго тела увеличивается. Процесс передачи энергии от одного тела к другому без совершения работы называют теплопередачей. Как вы уже знаете, существуют три вида теплопередачи: теплопроводность, конвекция и излучение.
Количественной мерой энергии, переданной телу в процессе теплопередачи, является количество теплоты Q. В СИ единицей количества теплоты является джоуль (Дж). Иногда для измерения количества теплоты используют внесистемную единицу — калорию (1 кал = 4,19Дж).
Если процесс теплопередачи не сопровождается изменением агрегатного состояния вещества, то
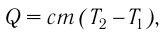
где m — масса тела, 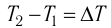
теплоемкость измеряют в джоулях, деленных на килограмм, кельвин
Физическая величина, равная произведению массы тела на удельную теплоёмкость вещества, носит название теплоёмкости тела. Обозначают теплоёмкость тела С и измеряют в джоулях на кельвин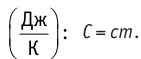
Удельная теплота плавления
Физическую величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг, взятого при температуре плавления, в жидкость той же температуры, называют удельной теплотой плавления 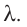
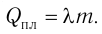
Удельная теплота парообразования
Физическую величину, численно равную количеству теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, для превращения её при постоянной температуре в пар, называют удельной теплотой парообразования L. Количество теплоты, необходимое для превращения жидкости массой m, предварительно нагретой до температуры кипения, в пар, определяют по формуле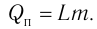
Удельная теплота сгорания топлива
Физическую величину, численно равную количеству теплоты, выделяющемуся при полном сгорании топлива массой 1 кг, называют удельной теплотой сгорания топлива q. Количество теплоты, выделившееся при полном сгорании некоторой массы m топлива, определяют по формуле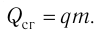
Отметим, что в результате теплопередачи могут изменяться как обе составляющие внутренней энергии тела, так и одна из них. При нагревании (охлаждении) изменяются кинетическая энергия хаотического движения частиц, которые составляют тело, и потенциальная энергия их взаимодействия. При плавлении (кристаллизации), кипении (конденсации) изменяется только потенциальная энергия взаимодействия частиц вещества.
При совершении работы также может изменяться как кинетическая, так и потенциальная энергия частиц вещества. Следовательно, как при теплопередаче, так и при совершении работы происходит изменение кинетической и потенциальной энергий частиц вещества, что приводит к изменению внутренней энергии тела.
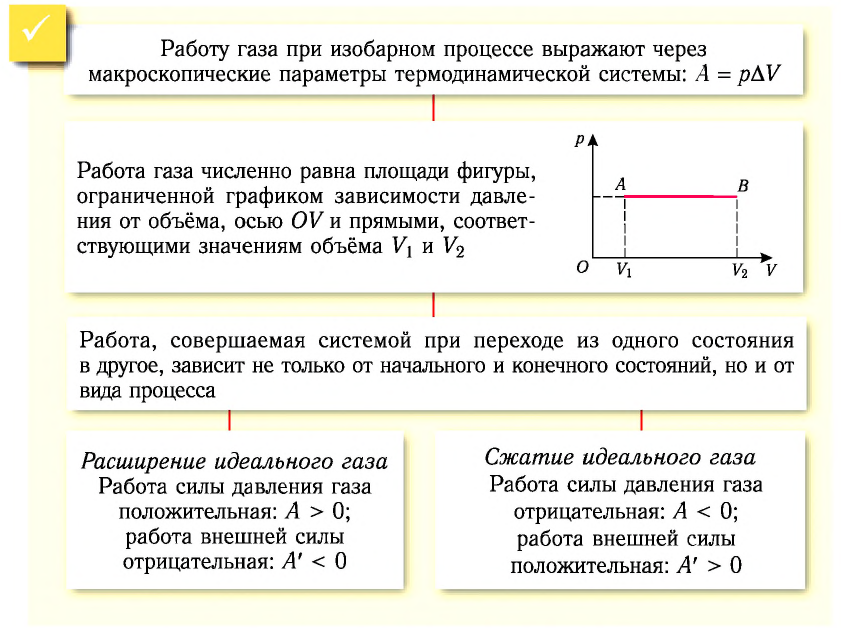
1. Работу газа при изобарном процессе выражают через макроскопические параметры термодинамической системы:
2. Работа газа численно равна площади фигуры, ограниченной графиком зависимости давления от объёма, осью OV и прямыми, соответствующими значениям объёмов
3. Работа, совершаемая при переходе системы из одного состояния в другое, зависит не только от начального и конечного состояний, но и от вида процесса.
4. Процесс передачи энергии от одного тела к другому без совершения работы называют теплопередачей.
Пример №1
Определите работу, совершаемую силой давления идеального газа определённой массы при изобарном повышении его температуры от 
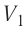
Дано:
Пример №2
Состояние идеального газа, взятого в количестве v=l,0 моль при температуре 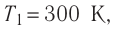
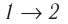
Дано:
v = 1,0 моль
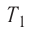
А — ?
Решение. Работа Л газа в ходе всего процесса равна сумме работ на участках 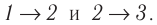
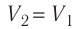
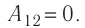
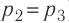
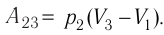
Так как по условию 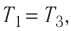
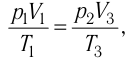
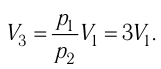
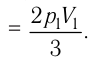
Тогда
Ответ: А = 1,7 кДж.
Работа в термодинамике
В 9-м классе вы узнали, что передача энергии путём совершения работы происходит в процессе силового взаимодействия тел. То есть работа, совершённая над рассматриваемым телом, есть не что иное, как работа сил, приложенных к этому телу со стороны всех остальных (внешних) тел, с которыми оно взаимодействует. Работа, совершённая над телом, может непосредственно изменить любой вид энергии этого тела, например внутреннюю энергию, поэтому работу силы рассматривают как меру изменения энергии физической системы.
Одним из способов изменения внутренней энергии термодинамической системы является совершение работы. Этот способ характеризуется передачей энергии в процессе механического взаимодействия тел. При этом механическая энергия одного тела переходит во внутреннюю энергию другого тела или, наоборот, убыль внутренней энергии одного тела сказывается на увеличении механической энергии другого тела.
Таким образом, при совершении работы происходит превращение энергии из одной формы в другую.
Поскольку для описания термодинамических систем используют макропараметры (давление, объём, температура), то работу в термодинамике необходимо выражать, применяя эти параметры.
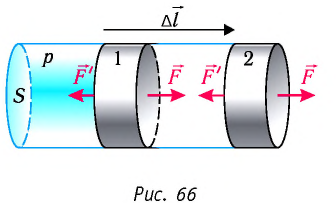
Рассмотрим газ в цилиндре, закрытом поршнем, площадь которого S (рис. 66). Давление газа в цилиндре 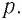
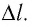
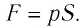
где 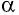
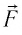
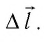
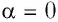
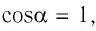
Произведение 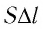
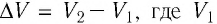
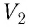
Таким образом, работа силы давления газа при его изобарном расширении:
Так как давление р газа — величина положительная, то из формулы (12.1) следует, что
При изобарном расширении газа из состояния 1 в состояние 2 работа силы 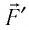
где 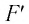
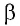
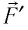
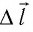
Перемещение 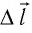
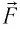
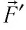
Следовательно, работы 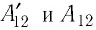
Таким образом, можно сделать следующие выводы.
Геометрическое толкование работы:
Работу газа можно определить графически. Изобразим график зависимости давления газа от его объёма при 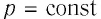
Если процесс перехода газа из начального состояния в конечное не является изобарным (рис. 69), то работа силы давления газа при изменении объёма от 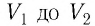
Работу газа определяют не только начальное и конечное состояния системы, но и вид процесса. Например, газ из состояния 1 можно перевести в состояние 3 либо в результате изотермического расширения (рис. 70), либо сначала изохорно понизив его давление до значения 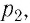
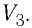
Следовательно, работа, совершаемая термодинамическом системой при переходе из одного состояния в другое, зависит не только от начального и конечного состояний системы, но и от вида процесса.
Пример №3
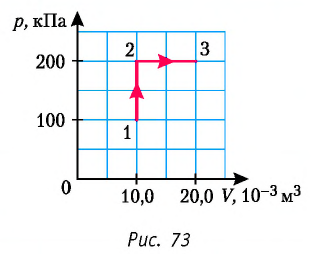
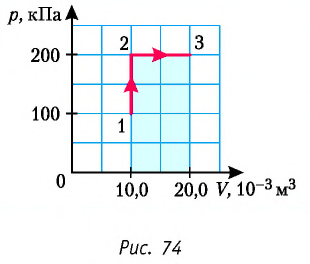
Определите работу, совершаемую силой давления идеального газа определённой 200 массы при переходе из состояния 1 в состояние 3 (рис. 73).
Решение. 1 способ. Работа А газа в ходе всего процесса равна сумме работ на участках 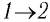
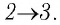
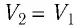
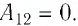
Тогда при переходе из состояния 1 в состояние 3 работа
2 способ. Работа газа численно равна площади заштрихованной фигуры, ограниченной графиком зависимости давления от объёма, осью OV и прямыми, соответствующими значениям объёма 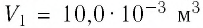
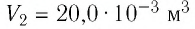
Ответ:
Пример №4
Определите работу, совершаемую силой давления идеального газа определённой массы при изобарном повышении его температуры от 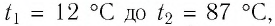
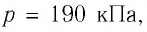
Решение. Сила давления газа совершает положительную работу, поскольку при изобарном нагревании увеличивается его объём. Поэтому
Согласно уравнению Клапейрона—Менделеева,
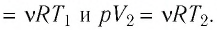
Ответ:
Как определить работу в термодинамике
В конце XVIII в. английский физик Бенджамин Томпсон (граф Румфорд) исследовал тепло, выделяющееся при сверлении бронзовых пушек. Румфорд успевал вскипятить поставленные на пушки котлы с водой за счет тепла, которое выделялось, пока лошади приводили в движение очень тупое сверло. В данном случае энергия механического движения сверла превращалась в энергию хаотического движения молекул бронзы и воды. А можно ли сделать наоборот?
Почему при изменении объема газа изменяется его внутренняя энергия
Внутренняя энергия газа может изменяться, если действующие на него внешние силы совершают работу (положительную или отрицательную). Например, если газ сжимают (газ совершает отрицательную работу) (рис. 37.1) и он при этом не отдает энергию окружающей среде, то скорость движения молекул газа, а соответственно, и внутренняя энергия, и температура газа увеличиваются. И наоборот: если газ расширяется (то есть совершает положительную работу), то скорость движения молекул, температура и внутренняя энергия газа уменьшаются.
Рис. 37.1. При сжатии газа скорость его молекул после столкновения с поршнем увеличивается (v > 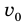
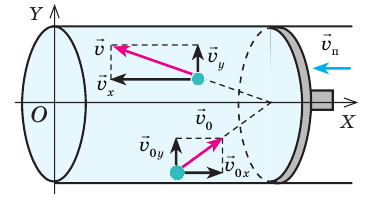
Как вычислить работу газа
Вычислим работу, которую совершает сила давления газа при изменении его объема от 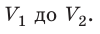
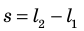
Таким образом, работа газа при его изобарном расширении равна:
Работе газа при изобарном расширении (или сжатии) можно дать простое геометрическое толкование: работа газа численно равна площади прямоугольника под графиком зависимости p(V) (рис. 37.3).
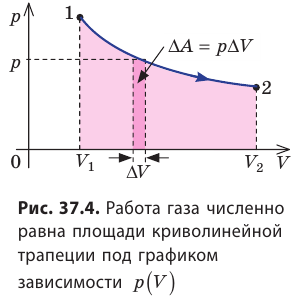
Пусть некоторый газ переходит из состояния 1 в состояние 2 (рис. 37.4). Если изменение объема газа (∆V) достаточно мало, то давление газа можно считать неизменным. Тогда работа газа численно равна площади выделенной на рисунке полосы. Полная работа при изменении объема от 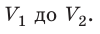
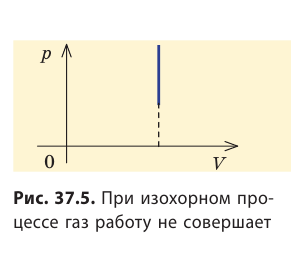
Очевидно, что при изохорном процессе (V = const) площадь фигуры под графиком зависимости p (V) равна нулю (рис. 37.5), — газ работу не совершает (A = 0) . Работа газа зависит от того, каким образом происходил переход газа из начального состояния в конечное (рис. 37.6).
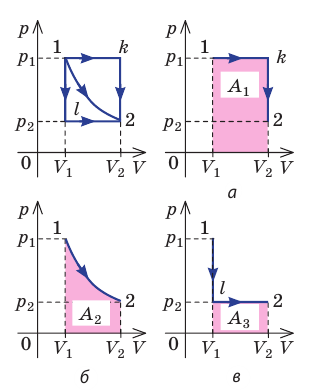
Рис. 37.6. три пути перехода газа из состояния 1 в состояние 2: а — газ изобарно расширяется (участок 1k), затем изохорно охла ждается (участок k2); б — газ изотермически расширяется; в — газ изохорно охлаждается (участок 1l), затем изобарно расширяется (участок l2). сравнив площади фигур под графиками, видим, что:
Пример №5
На рисунке графически изображен циклический процесс, совершаемый идеальным газом. Определите работу газа за цикл.
Решение:
Полная работа за цикл равна сумме работ, совершенных газом в ходе каждого процесса цикла. Работа газа в ходе процесса 1–2 численно равна площади трапеции, основания которой равны 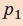
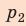
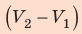
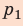
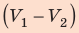
Выводы:
- При отсутствии теплообмена с окружающей средой, если над газом совершают работу, внутренняя энергия газа увеличивается; если газ сам совершает работу, его внутренняя энергия уменьшается.
- Если объем газа увеличивается, то газ совершает положительную работу. Если объем газа уменьшается, то работа газа отрицательна.
- Работа газа численно равна площади фигуры под графиком зависимости p (V). При изобарном процессе работу газа можно определить по формуле A=p∆V, при изохорном процессе работа газа равна нулю: A = 0.
- Первый закон термодинамики
- Второй закон термодинамики
- Тепловые двигатели и их КПД
- Тепловое состояние тел
- Термодинамика – основные понятия, формулы и определения
- Необратимость тепловых процессов
- Адиабатический процесс
- Молекулярно-кинетическая теория
Thermodynamic work is one of the principal processes by which a thermodynamic system can interact with its surroundings and exchange energy. This exchange results in externally measurable macroscopic forces on the system’s surroundings, which can cause mechanical work, to lift a weight, for example,[1] or cause changes in electromagnetic,[2][3][4] or gravitational[5] variables. The surroundings also can perform work on a thermodynamic system, which is measured by an opposite sign convention.
For thermodynamic work, appropriately chosen externally measured quantities are exactly matched by values of or contributions to changes in macroscopic internal state variables of the system, which always occur in conjugate pairs, for example pressure and volume[1] or magnetic flux density and magnetization.[3]
In the International System of Units (SI), work is measured in joules (symbol J). The rate at which work is performed is power, measured in joules per second, and denoted with the unit watt (W).
History[edit]
1824[edit]
Work, i.e. “weight lifted through a height”, was originally defined in 1824 by Sadi Carnot in his famous paper Reflections on the Motive Power of Fire, where he used the term motive power for work. Specifically, according to Carnot:
We use here motive power to express the useful effect that a motor is capable of producing. This effect can always be likened to the elevation of a weight to a certain height. It has, as we know, as a measure, the product of the weight multiplied by the height to which it is raised.
1845[edit]
In 1845, the English physicist James Joule wrote a paper On the mechanical equivalent of heat for the British Association meeting in Cambridge.[6] In this paper, he reported his best-known experiment, in which the mechanical power released through the action of a “weight falling through a height” was used to turn a paddle-wheel in an insulated barrel of water.
In this experiment, the motion of the paddle wheel, through agitation and friction, heated the body of water, so as to increase its temperature. Both the temperature change ∆T of the water and the height of the fall ∆h of the weight mg were recorded. Using these values, Joule was able to determine the mechanical equivalent of heat. Joule estimated a mechanical equivalent of heat to be 819 ft•lbf/Btu (4.41 J/cal). The modern day definitions of heat, work, temperature, and energy all have connection to this experiment. In this arrangement of apparatus, it never happens that the process runs in reverse, with the water driving the paddles so as to raise the weight, not even slightly. Mechanical work was done by the apparatus of falling weight, pulley, and paddles, which lay in the surroundings of the water. Their motion scarcely affected the volume of the water. Work that does not change the volume of the water is said to be isochoric; it is irreversible. The energy supplied by the fall of the weight passed into the water as heat.
Overview[edit]
Conservation of energy[edit]
A pre-supposed guiding principle of thermodynamics is the conservation of energy. The total energy of a system is the sum of its internal energy, of its potential energy as a whole system in an external force field, such as gravity, and of its kinetic energy as a whole system in motion. Thermodynamics has special concern with transfers of energy, from a body of matter, such as, for example a cylinder of steam, to the surroundings of the body, by mechanisms through which the body exerts macroscopic forces on its surroundings so as to lift a weight there; such mechanisms are the ones that are said to mediate thermodynamic work.
Besides transfer of energy as work, thermodynamics admits transfer of energy as heat. For a process in a closed (no transfer of matter) thermodynamic system, the first law of thermodynamics relates changes in the internal energy (or other cardinal energy function, depending on the conditions of the transfer) of the system to those two modes of energy transfer, as work, and as heat. Adiabatic work is done without matter transfer and without heat transfer. In principle, in thermodynamics, for a process in a closed system, the quantity of heat transferred is defined by the amount of adiabatic work that would be needed to effect the change in the system that is occasioned by the heat transfer. In experimental practice, heat transfer is often estimated calorimetrically, through change of temperature of a known quantity of calorimetric material substance.
Energy can also be transferred to or from a system through transfer of matter. The possibility of such transfer defines the system as an open system, as opposed to a closed system. By definition, such transfer is neither as work nor as heat.
Changes in the potential energy of a body as a whole with respect to forces in its surroundings, and in the kinetic energy of the body moving as a whole with respect to its surroundings, are by definition excluded from the body’s cardinal energy (examples are internal energy and enthalpy).
Nearly reversible transfer of energy by work in the surroundings[edit]
In the surroundings of a thermodynamic system, external to it, all the various mechanical and non-mechanical macroscopic forms of work can be converted into each other with no limitation in principle due to the laws of thermodynamics, so that the energy conversion efficiency can approach 100% in some cases; such conversion is required to be frictionless, and consequently adiabatic.[7] In particular, in principle, all macroscopic forms of work can be converted into the mechanical work of lifting a weight, which was the original form of thermodynamic work considered by Carnot and Joule (see History section above). Some authors have considered this equivalence to the lifting of a weight as a defining characteristic of work.[8][9][10][11] For example, with the apparatus of Joule’s experiment in which, through pulleys, a weight descending in the surroundings drives the stirring of a thermodynamic system, the descent of the weight can be diverted by a re-arrangement of pulleys, so that it lifts another weight in the surroundings, instead of stirring the thermodynamic system.
Such conversion may be idealized as nearly frictionless, though it occurs relatively quickly. It usually comes about through devices that are not simple thermodynamic systems (a simple thermodynamic system is a homogeneous body of material substances). For example, the descent of the weight in Joule’s stirring experiment reduces the weight’s total energy. It is described as loss of gravitational potential energy by the weight, due to change of its macroscopic position in the gravity field, in contrast to, for example, loss of the weight’s internal energy due to changes in its entropy, volume, and chemical composition. Though it occurs relatively rapidly, because the energy remains nearly fully available as work in one way or another, such diversion of work in the surroundings may be idealized as nearly reversible, or nearly perfectly efficient.
In contrast, the conversion of heat into work in a heat engine can never exceed the Carnot efficiency, as a consequence of the second law of thermodynamics. Such energy conversion, through work done relatively rapidly, in a practical heat engine, by a thermodynamic system on its surroundings, cannot be idealized, not even nearly, as reversible.
Thermodynamic work done by a thermodynamic system on its surroundings is defined so as to comply with this principle. Historically, thermodynamics was about how a thermodynamic system could do work on its surroundings.
Work done by and on a simple thermodynamic system[edit]
Work done on, and work done by, a thermodynamic system need to be distinguished, through consideration of their precise mechanisms. Work done on a thermodynamic system, by devices or systems in the surroundings, is performed by actions such as compression, and includes shaft work, stirring, and rubbing. Such work done by compression is thermodynamic work as here defined. But shaft work, stirring, and rubbing are not thermodynamic work as here defined, in that they do not change the volume of the system against its resisting pressure. Work without change of volume is known as isochoric work, for example when an agency, in the surroundings of the system, drives a frictional action on the surface or in the interior of the system.
In a process of transfer of energy from or to a thermodynamic system, the change of internal energy of the system is defined in theory by the amount of adiabatic work that would have been necessary to reach the final from the initial state, such adiabatic work being measurable only through the externally measurable mechanical or deformation variables of the system, that provide full information about the forces exerted by the surroundings on the system during the process. In the case of some of Joule’s measurements, the process was so arranged that some heating that occurred outside the system (in the substance of the paddles) by the frictional process also led to heat transfer from the paddles into the system during the process, so that the quantity of work done by the surrounds on the system could be calculated as shaft work, an external mechanical variable.[12][13]
The amount of energy transferred as work is measured through quantities defined externally to the system of interest, and thus belonging to its surroundings. In an important sign convention, preferred in chemistry, work that adds to the internal energy of the system is counted as positive. On the other hand, for historical reasons, an oft-encountered sign convention, preferred in physics, is to consider work done by the system on its surroundings as positive.
Processes not described by macroscopic work[edit]
One kind of heat transfer, through direct contact between a closed system and its surroundings, is by the microscopic thermal motions of particles and their associated inter-molecular potential energies.[14] Microscopic accounts of such processes are the province of statistical mechanics, not of macroscopic thermodynamics. Another kind of heat transfer is by radiation.[15][16] Radiative transfer of energy is irreversible in the sense that it occurs only from a hotter to a colder system, never the other way. There are several forms of dissipative transduction of energy that can occur internally within a system at a microscopic level, such as friction including bulk and shear viscosity[17] chemical reaction,[2] unconstrained expansion as in Joule expansion and in diffusion, and phase change.[2]
Thermodynamic work does not account for any energy transferred between systems as heat or through transfer of matter.
Open systems[edit]
For an open system, the first law of thermodynamics admits three forms of energy transfer, as work, as heat, and as energy associated with matter that is transferred. The latter cannot be split uniquely into heat and work components.
One-way convection of internal energy is a form a transport of energy but is not, as sometimes mistakenly supposed (a relic of the caloric theory of heat), transfer of energy as heat, because one-way convection is transfer of matter; nor is it transfer of energy as work. Nevertheless, if the wall between the system and its surroundings is thick and contains fluid, in the presence of a gravitational field, convective circulation within the wall can be considered as indirectly mediating transfer of energy as heat between the system and its surroundings, though the source and destination of the transferred energy are not in direct contact.
Fictively imagined reversible thermodynamic “processes”[edit]
For purposes of theoretical calculations about a thermodynamic system, one can imagine fictive idealized thermodynamic “processes” that occur so slowly that they do not incur friction within or on the surface of system; they can then be regarded as virtually reversible. These fictive processes proceed along paths on geometrical surfaces that are described exactly by a characteristic equation of the thermodynamic system. Those geometrical surfaces are the loci of possible states of thermodynamic equilibrium for the system. Really possible thermodynamic processes, occurring at practical rates, even when they occur only by work assessed in the surroundings as adiabatic, without heat transfer, always incur friction within the system, and so are always irreversible. The paths of such really possible processes always depart from those geometrical characteristic surfaces. Even when they occur only by work assessed in the surroundings as adiabatic, without heat transfer, such departures always entail entropy production.
Joule heating and rubbing[edit]
The definition of thermodynamic work is in terms of the changes of the system’s extensive deformation[18] (and chemical constitutive and certain other) state variables, such as volume, molar chemical constitution, or electric polarisation. Examples of state variables that are not extensive deformation or other such variables are temperature T and entropy S, as for example in the expression U = U(S, V, {Nj}). Changes of such variables are not actually physically measureable by use of a single simple adiabatic thermodynamic process; they are processes that occur neither by thermodynamic work nor by transfer of matter, and therefore are said occur by heat transfer. The quantity of thermodynamic work is defined as work done by the system on its surroundings. According to the second law of thermodynamics, such work is irreversible. To get an actual and precise physical measurement of a quantity of thermodynamic work, it is necessary to take account of the irreversibility by restoring the system to its initial condition by running a cycle, for example a Carnot cycle, that includes the target work as a step. The work done by the system on its surroundings is calculated from the quantities that constitute the whole cycle.[19] A different cycle would be needed to actually measure the work done by the surroundings on the system. This is a reminder that rubbing the surface of a system appears to the rubbing agent in the surroundings as mechanical, though not thermodynamic, work done on the system, not as heat, but appears to the system as heat transferred to the system, not as thermodynamic work. The production of heat by rubbing is irreversible;[20] historically, it was a piece of evidence for the rejection of the caloric theory of heat as a conserved substance.[21] The irreversible process known as Joule heating also occurs through a change of a non-deformation extensive state variable.
Accordingly, in the opinion of Lavenda, work is not as primitive concept as is heat, which can be measured by calorimetry.[22] This opinion does not negate the now customary thermodynamic definition of heat in terms of adiabatic work.
Known as a thermodynamic operation, the initiating factor of a thermodynamic process is, in many cases, a change in the permeability of a wall between the system and the surroundings. Rubbing is not a change in wall permeability. Kelvin’s statement of the second law of thermodynamics uses the notion of an “inanimate material agency”; this notion is sometimes regarded as puzzling.[23] The triggering of a process of rubbing can occur only in the surroundings, not in a thermodynamic system in its own state of internal thermodynamic equilibrium. Such triggering may be described as a thermodynamic operation.
Formal definition[edit]
In thermodynamics, the quantity of work done by a closed system on its surroundings is defined by factors strictly confined to the interface of the surroundings with the system and to the surroundings of the system, for example, an extended gravitational field in which the system sits, that is to say, to things external to the system.
A main concern of thermodynamics is the properties of materials. Thermodynamic work is defined for the purposes of thermodynamic calculations about bodies of material, known as thermodynamic systems. Consequently, thermodynamic work is defined in terms of quantities that describe the states of materials, which appear as the usual thermodynamic state variables, such as volume, pressure, temperature, chemical composition, and electric polarization. For example, to measure the pressure inside a system from outside it, the observer needs the system to have a wall that can move by a measurable amount in response to pressure differences between the interior of the system and the surroundings. In this sense, part of the definition of a thermodynamic system is the nature of the walls that confine it.
Several kinds of thermodynamic work are especially important. One simple example is pressure–volume work. The pressure of concern is that exerted by the surroundings on the surface of the system, and the volume of interest is the negative of the increment of volume gained by the system from the surroundings. It is usually arranged that the pressure exerted by the surroundings on the surface of the system is well defined and equal to the pressure exerted by the system on the surroundings. This arrangement for transfer of energy as work can be varied in a particular way that depends on the strictly mechanical nature of pressure–volume work. The variation consists in letting the coupling between the system and surroundings be through a rigid rod that links pistons of different areas for the system and surroundings. Then for a given amount of work transferred, the exchange of volumes involves different pressures, inversely with the piston areas, for mechanical equilibrium. This cannot be done for the transfer of energy as heat because of its non-mechanical nature.[24]
Another important kind of work is isochoric work, i.e., work that involves no eventual overall change of volume of the system between the initial and the final states of the process. Examples are friction on the surface of the system as in Rumford’s experiment; shaft work such as in Joule’s experiments; stirring of the system by a magnetic paddle inside it, driven by a moving magnetic field from the surroundings; and vibrational action on the system that leaves its eventual volume unchanged, but involves friction within the system. Isochoric mechanical work for a body in its own state of internal thermodynamic equilibrium is done only by the surroundings on the body, not by the body on the surroundings, so that the sign of isochoric mechanical work with the physics sign convention is always negative.
When work, for example pressure–volume work, is done on its surroundings by a closed system that cannot pass heat in or out because it is confined by an adiabatic wall, the work is said to be adiabatic for the system as well as for the surroundings. When mechanical work is done on such an adiabatically enclosed system by the surroundings, it can happen that friction in the surroundings is negligible, for example in the Joule experiment with the falling weight driving paddles that stir the system. Such work is adiabatic for the surroundings, even though it is associated with friction within the system. Such work may or may not be isochoric for the system, depending on the system and its confining walls. If it happens to be isochoric for the system (and does not eventually change other system state variables such as magnetization), it appears as a heat transfer to the system, and does not appear to be adiabatic for the system.
Sign convention[edit]
In the early history of thermodynamics, a positive amount of work done by the system on the surroundings leads to energy being lost from the system. This historical sign convention has been used in many physics textbooks and is used in the present article.[25]
According to the first law of thermodynamics for a closed system, any net change in the internal energy U must be fully accounted for, in terms of heat Q entering the system and work W done by the system:[14]
[26]
An alternate sign convention is to consider the work performed on the system by its surroundings as positive. This leads to a change in sign of the work, so that 
This equation reflects the fact that the heat transferred and the work done are not properties of the state of the system. Given only the initial state and the final state of the system, one can only say what the total change in internal energy was, not how much of the energy went out as heat, and how much as work. This can be summarized by saying that heat and work are not state functions of the system.[14] This is in contrast to classical mechanics, where net work exerted by a particle is a state function.
Pressure–volume work[edit]
Pressure–volume work (or PV or P–V work) occurs when the volume V of a system changes. PV work is often measured in units of litre-atmospheres where 1L·atm = 101.325J. However, the litre-atmosphere is not a recognized unit in the SI system of units, which measures P in pascals (Pa), V in m3, and PV in joules (J), where 1 J = 1 Pa·m3. PV work is an important topic in chemical thermodynamics.
For a process in a closed system, occurring slowly enough for accurate definition of the pressure on the inside of the system’s wall that moves and transmits force to the surroundings, described as quasi-static,[30][31] work is represented by the following equation between differentials:
where
Moreover,
where 
The first law of thermodynamics can then be expressed as[14]
(In the alternative sign convention where W = work done on the system, 

Path dependence[edit]
PV work is path-dependent and is, therefore, a thermodynamic process function. In general, the term 
The first law of thermodynamics states that 
For a quasi-static adiabatic process, 
Also 
It follows that 
Internal energy is a state function so its change depends only on the initial and final states of a process. For a quasi-static adiabatic process, the change in internal energy is equal to minus the integral amount of work done by the system, so the work also depends only on the initial and final states of the process and is one and the same for every intermediate path. As a result, the work done by the system also depends on the initial and final states.
If the process path is other than quasi-static and adiabatic, there are indefinitely many different paths, with significantly different work amounts, between the initial and final states. (Again the internal energy change depends only on the initial and final states as it is a state function).
In the current mathematical notation, the differential 
In another notation, δW is written đW (with a horizontal line through the d). This notation indicates that đW is not an exact one-form. The line-through is merely a flag to warn us there is actually no function (0-form) W which is the potential of đW. If there were, indeed, this function W, we should be able to just use Stokes Theorem to evaluate this putative function, the potential of đW, at the boundary of the path, that is, the initial and final points, and therefore the work would be a state function. This impossibility is consistent with the fact that it does not make sense to refer to the work on a point in the PV diagram; work presupposes a path.
Other mechanical types of work[edit]
There are several ways of doing mechanical work, each in some way related to a force acting through a distance.[34] In basic mechanics, the work done by a constant force F on a body displaced a distance s in the direction of the force is given by
If the force is not constant, the work done is obtained by integrating the differential amount of work,
Rotational work[edit]
Energy transmission with a rotating shaft is very common in engineering practice. Often the torque T applied to the shaft is constant which means that the force F applied is constant. For a specified constant torque, the work done during n revolutions is determined as follows: A force F acting through a moment arm r generates a torque T
This force acts through a distance s, which is related to the radius r by
The shaft work is then determined from:
The power transmitted through the shaft is the shaft work done per unit time, which is expressed as
Spring work[edit]
When a force is applied on a spring, and the length of the spring changes by a differential amount dx, the work done is
For linear elastic springs, the displacement x is proportional to the force applied
where K is the spring constant and has the unit of N/m. The displacement x is measured from the undisturbed position of the spring (that is, X = 0 when F = 0). Substituting the two equations
,
where x1 and x2 are the initial and the final displacement of the spring respectively, measured from the undisturbed position of the spring.
Work done on elastic solid bars[edit]
Solids are often modeled as linear springs because under the action of a force they contract or elongate, and when the force is lifted, they return to their original lengths, like a spring. This is true as long as the force is in the elastic range, that is, not large enough to cause permanent or plastic deformation. Therefore, the equations given for a linear spring can also be used for elastic solid bars. Alternately, we can determine the work associated with the expansion or contraction of an elastic solid bar by replacing the pressure P by its counterpart in solids, normal stress σ = F/A in the work expansion
where A is the cross sectional area of the bar.
Work associated with the stretching of liquid film[edit]
Consider a liquid film such as a soap film suspended on a wire frame. Some force is required to stretch this film by the movable portion of the wire frame. This force is used to overcome the microscopic forces between molecules at the liquid-air interface. These microscopic forces are perpendicular to any line in the surface and the force generated by these forces per unit length is called the surface tension σ whose unit is N/m. Therefore, the work associated with the stretching of a film is called surface tension work, and is determined from
where dA=2b dx is the change in the surface area of the film. The factor 2 is due to the fact that the film has two surfaces in contact with air. The force acting on the moveable wire as a result of surface tension effects is F = 2b σ, where σ is the surface tension force per unit length.
Free energy and exergy[edit]
The amount of useful work which may be extracted from a thermodynamic system is determined by the second law of thermodynamics. Under many practical situations this can be represented by the thermodynamic availability, or Exergy, function. Two important cases are: in thermodynamic systems where the temperature and volume are held constant, the measure of useful work attainable is the Helmholtz free energy function; and in systems where the temperature and pressure are held constant, the measure of useful work attainable is the Gibbs free energy.
Non-mechanical forms of work[edit]
Non-mechanical work in thermodynamics is work caused by external force fields that a system is exposed to. The action of such forces can be initiated by events in the surroundings of the system, or by thermodynamic operations on the shielding walls of the system.
The non-mechanical work of force fields can have either positive or negative sign, work being done by the system on the surroundings, or vice versa. Work done by force fields can be done indefinitely slowly, so as to approach the fictive reversible quasi-static ideal, in which entropy is not created in the system by the process.
In thermodynamics, non-mechanical work is to be contrasted with mechanical work that is done by forces in immediate contact between the system and its surroundings. If the putative ‘work’ of a process cannot be defined as either long-range work or else as contact work, then sometimes it cannot be described by the thermodynamic formalism as work at all. Nevertheless, the thermodynamic formalism allows that energy can be transferred between an open system and its surroundings by processes for which work is not defined. An example is when the wall between the system and its surrounds is not considered as idealized and vanishingly thin, so that processes can occur within the wall, such as friction affecting the transfer of matter across the wall; in this case, the forces of transfer are neither strictly long-range nor strictly due to contact between the system and its surrounds; the transfer of energy can then be considered as by convection, and assessed in sum just as transfer of internal energy. This is conceptually different from transfer of energy as heat through a thick fluid-filled wall in the presence of a gravitational field, between a closed system and its surroundings; in this case there may convective circulation within the wall but the process may still be considered as transfer of energy as heat between the system and its surroundings; if the whole wall is moved by the application of force from the surroundings, without change of volume of the wall, so as to change the volume of the system, then it is also at the same time transferring energy as work. A chemical reaction within a system can lead to electrical long-range forces and to electric current flow, which transfer energy as work between system and surroundings, though the system’s chemical reactions themselves (except for the special limiting case in which in they are driven through devices in the surroundings so as to occur along a line of thermodynamic equilibrium) are always irreversible and do not directly interact with the surroundings of the system.[35]
Non-mechanical work contrasts with pressure–volume work. Pressure–volume work is one of the two mainly considered kinds of mechanical contact work. A force acts on the interfacing wall between system and surroundings. The force is that due to the pressure exerted on the interfacing wall by the material inside the system; that pressure is an internal state variable of the system, but is properly measured by external devices at the wall. The work is due to change of system volume by expansion or contraction of the system. If the system expands, in the present article it is said to do positive work on the surroundings. If the system contracts, in the present article it is said to do negative work on the surroundings. Pressure–volume work is a kind of contact work, because it occurs through direct material contact with the surrounding wall or matter at the boundary of the system. It is accurately described by changes in state variables of the system, such as the time courses of changes in the pressure and volume of the system. The volume of the system is classified as a “deformation variable”, and is properly measured externally to the system, in the surroundings. Pressure–volume work can have either positive or negative sign. Pressure–volume work, performed slowly enough, can be made to approach the fictive reversible quasi-static ideal.
Non-mechanical work also contrasts with shaft work. Shaft work is the other of the two mainly considered kinds of mechanical contact work. It transfers energy by rotation, but it does not eventually change the shape or volume of the system. Because it does not change the volume of the system it is not measured as pressure–volume work, and it is called isochoric work. Considered solely in terms of the eventual difference between initial and final shapes and volumes of the system, shaft work does not make a change. During the process of shaft work, for example the rotation of a paddle, the shape of the system changes cyclically, but this does not make an eventual change in the shape or volume of the system. Shaft work is a kind of contact work, because it occurs through direct material contact with the surrounding matter at the boundary of the system. A system that is initially in a state of thermodynamic equilibrium cannot initiate any change in its internal energy. In particular, it cannot initiate shaft work. This explains the curious use of the phrase “inanimate material agency” by Kelvin in one of his statements of the second law of thermodynamics. Thermodynamic operations or changes in the surroundings are considered to be able to create elaborate changes such as indefinitely prolonged, varied, or ceased rotation of a driving shaft, while a system that starts in a state of thermodynamic equilibrium is inanimate and cannot spontaneously do that.[36] Thus the sign of shaft work is always negative, work being done on the system by the surroundings. Shaft work can hardly be done indefinitely slowly; consequently it always produces entropy within the system, because it relies on friction or viscosity within the system for its transfer.[37] The foregoing comments about shaft work apply only when one ignores that the system can store angular momentum and its related energy.
Examples of non-mechanical work modes include
- Electric field work – where the force is defined by the surroundings’ voltage (the electrical potential) and the generalized displacement is change of spatial distribution of electrical charge
- Electrical polarization work – where the force is defined by the surroundings’ electric field strength and the generalized displacement is change of the polarization of the medium (the sum of the electric dipole moments of the molecules)
- Magnetic work – where the force is defined by the surroundings’ magnetic field strength and the generalized displacement is change of total magnetic dipole moment
Gravitational work[edit]
Gravitational work is defined by the force on a body measured in a gravitational field. It may cause a generalized displacement in the form of change of the spatial distribution of the matter within the system. The system gains internal energy (or other relevant cardinal quantity of energy, such as enthalpy) through internal friction. As seen by the surroundings, such frictional work appears as mechanical work done on the system, but as seen by the system, it appears as transfer of energy as heat. When the system is in its own state of internal thermodynamic equilibrium, its temperature is uniform throughout. If the volume and other extensive state variables, apart from entropy, are held constant over the process, then the transferred heat must appear as increased temperature and entropy; in a uniform gravitational field, the pressure of the system will be greater at the bottom than at the top.
By definition, the relevant cardinal energy function is distinct from the gravitational potential energy of the system as a whole; the latter may also change as a result of gravitational work done by the surroundings on the system. The gravitational potential energy of the system is a component of its total energy, alongside its other components, namely its cardinal thermodynamic (e.g. internal) energy and its kinetic energy as a whole system in motion.
See also[edit]
- Electrochemical hydrogen compressor
- Chemical reactions
- Microstate (statistical mechanics) – includes Microscopic definition of work
References[edit]
- ^ a b Kittel, C. Kroemer, H. (1980). Thermal Physics, second edition, W.H. Freeman, San Francisco, ISBN 0716710889
- ^ a b c Guggenheim, E.A. (1985). Thermodynamics. An Advanced Treatment for Chemists and Physicists, seventh edition, North Holland, Amsterdam, ISBN 0444869514.
- ^ a b Jackson, J.D. (1975). Classical Electrodynamics, second edition, John Wiley and Sons, New York, ISBN 978-0-471-43132-9.
- ^ Konopinski, E.J. (1981). Electromagnetic Fields and Relativistic Particles, McGraw-Hill, New York, ISBN 007035264X.
- ^ North, G.R., Erukhimova, T.L. (2009). Atmospheric Thermodynamics. Elementary Physics and Chemistry, Cambridge University Press, Cambridge (UK), ISBN 9780521899635.
- ^ Joule, J.P. (1845) “On the Mechanical Equivalent of Heat”, Brit. Assoc. Rep., trans. Chemical Sect, p.31, which was read before the British Association at Cambridge, June
- ^ F.C.Andrews Thermodynamics: Principles and Applications (Wiley-Interscience 1971), ISBN 0-471-03183-6, p.17-18.
- ^ Silbey, R.J., Alberty, R.A., Bawendi, M.G. (2005). Physical Chemistry, 4th edition, Wiley, Hoboken NJ., ISBN 978-0-471-65802-3, p.31
- ^ K.Denbigh The Principles of Chemical Equilibrium (Cambridge University Press 1st ed. 1955, reprinted 1964), p.14.
- ^ J.Kestin A Course in Thermodynamics (Blaisdell Publishing 1966), p.121.
- ^ M.A.Saad Thermodynamics for Engineers (Prentice-Hall 1966) p.45-46.
- ^ Buchdahl, H.A. (1966). The Concepts of Classical Thermodynamics, Cambridge University Press, London, p. 40.
- ^ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, ISBN 0-88318-797-3, pp. 35–36.
- ^ a b c d e G.J. Van Wylen and R.E. Sonntag, Fundamentals of Classical Thermodynamics, Chapter 4 – Work and heat, (3rd edition)
- ^ Prevost, P. (1791). Mémoire sur l’equilibre du feu. Journal de Physique (Paris), vol 38 pp. 314-322.
- ^ Planck, M. (1914). The Theory of Heat Radiation, second edition translated by M. Masius, P. Blakiston’s Son and Co., Philadelphia, 1914.
- ^ Rayleigh, John William Strutt (1894–1896). The theory of sound. University of California Libraries. London : Macmillan.
- ^ Buchdahl, H.A. (1966). The Concepts of Classical Thermodynamics, Cambridge University Press, Cambridge UK, page 6.
- ^ Lavenda, B.H. (2010). A New Perspective on Thermodynamics, Springer, New York, ISBN 978-1-4419-1429-3, pp. 117–118.
- ^ Planck, M. (1926). Über die Begründung des zweiten Hauptsatzes der Thermodynamik, Sitzungsberichte der Preussischen Akademie der Wissenschaften: Physikalisch-mathematische Klasse: 453–463.
- ^ Lavenda, B.H. (2010). A New Perspective on Thermodynamics, Springer, New York, ISBN 978-1-4419-1429-3, page 20.
- ^ Lavenda, B.H. (2010). A New Perspective on Thermodynamics, Springer, New York, ISBN 978-1-4419-1429-3, page 120.
- ^ Lavenda, B.H. (2010). A New Perspective on Thermodynamics, Springer, New York, ISBN 978-1-4419-1429-3, page 141.
- ^ Tisza, L. (1966). Generalized Thermodynamics, M.I.T. Press, Cambridge MA, p. 37.
- ^ a b Schroeder, D. V. An Introduction to Thermal Physics, 2000, Addison Wesley Longman, San Francisco, CA, ISBN 0-201-38027-7, p. 18
- ^ Freedman, Roger A., and Young, Hugh D. (2008). 12th Edition. Chapter 19: First Law of Thermodynamics, page 656. Pearson Addison-Wesley, San Francisco.
- ^ Quantities, Units and Symbols in Physical Chemistry (IUPAC Green Book) See Sec. 2.11 Chemical Thermodynamics, p. 56.
- ^ Planck, Max; Ogg, Alexander (1903). Treatise on thermodynamics. University of California Libraries. London : Longmans, Green.
- ^ a b Adkins, C.J. (1968/1983). Equilibrium Thermodynamics, (1st edition 1968), third edition 1983, Cambridge University Press, Cambridge UK, ISBN 0-521-25445-0, pp. 35–36.
- ^ Callen, H. B. (1960/1985), Thermodynamics and an Introduction to Thermostatistics, (first edition 1960), second edition 1985, John Wiley & Sons, New York, ISBN 0-471-86256-8, p. 19.
- ^ Münster, A. (1970), Classical Thermodynamics, translated by E. S. Halberstadt, Wiley–Interscience, London, ISBN 0-471-62430-6, p. 24.
- ^ Borgnakke, C., Sontag, R. E. (2009). Fundamentals of Thermodynamics, seventh edition, Wiley, ISBN 978-0-470-04192-5, p. 94.
- ^ Haase, R. (1971). Survey of Fundamental Laws, chapter 1 of Thermodynamics, pages 1–97 of volume 1, ed. W. Jost, of Physical Chemistry. An Advanced Treatise, ed. H. Eyring, D. Henderson, W. Jost, Academic Press, New York, lcn 73–117081, p. 21.
- ^ Yunus A. Cengel and Michael A. Boles,Thermodynamics: An Engineering Approach 7th Edition, , McGraw-Hill, 2010,ISBN 007-352932-X
- ^ Prigogine, I., Defay, R. (1954). Chemical Thermodynamics, translation by D.H. Everett of the 1950 edition of Thermodynamique Chimique, Longmans, Green & Co., London, p. 43.
- ^ Thomson, W. (March 1851). “On the Dynamical Theory of Heat, with numerical results deduced from Mr Joule’s equivalent of a Thermal Unit, and M. Regnault’s Observations on Steam”. Transactions of the Royal Society of Edinburgh. XX (part II): 261–268, 289–298. Also published in Thomson, W. (December 1852). “On the Dynamical Theory of Heat, with numerical results deduced from Mr Joule’s equivalent of a Thermal Unit, and M. Regnault’s Observations on Steam”. Phil. Mag. 4. IV (22): 8–21. Retrieved 25 June 2012.
- ^ Münster, A. (1970), Classical Thermodynamics, translated by E.S. Halberstadt, Wiley–Interscience, London, ISBN 0-471-62430-6, p. 45.