
Изображение атома гелия, где плотность вероятности нахождения электрона представлена серым цветом, более тёмные области соответствуют большей плотности.

Ра́диус а́тома — расстояние между атомным ядром и самой дальней из стабильных орбит электронов в электронной оболочке этого атома. Поскольку, согласно квантовой механике, атомы не имеют четких границ, а вероятность найти электрон, связанный с ядром данного атома, на определённом расстоянии от этого ядра быстро убывает с увеличением расстояния, атому приписывают некоторый определённый радиус, полагая, что в шаре этого радиуса заключена подавляющая часть электронной плотности (порядка 90 процентов). Существуют различные определения радиуса атома[⇨], три наиболее широко используемых: радиус Ван-дер-Ваальса, ионный радиус и ковалентный радиус.
В зависимости от определения термин «радиус атома» может применяться либо только к изолированным атомам, либо также к атомам в конденсированной среде, ковалентно связанным в молекулах или в ионизированном и возбужденном состояниях; его значение может быть получено путем экспериментальных измерений или вычислено из теоретических моделей. Значение радиуса может зависеть от состояния атома и окружающей среды[1].
Электроны не имеют четко определённых орбит или границ. Скорее, их положения могут быть описаны как распределения вероятностей, которые постепенно сужаются по мере удаления от ядра без резкого сокращения. Кроме того, в конденсированном веществе и молекулах электронные облака атомов обычно в некоторой степени перекрываются, и некоторые из электронов могут перемещаться в области, охватывающей два или более атомов («принадлежать» нескольким атомам одновременно).
Согласно большинству определений, радиусы изолированных нейтральных атомов колеблются в диапазоне от 30 до 300 пм (или от 0,3 до 3 ангстрем), в то время как радиусы атомных ядер находятся пределах от 0,83 до 10 фм[2]. Следовательно, радиус типичного атома примерно в 30 тысяч раз больше радиуса его ядра.
Во многих случаях форма атома может быть аппроксимирована сферой. Это лишь грубое приближение, но оно может дать количественные представления и выступить в качестве базовой модели для описания для многих явлений, таких как плотность жидкостей и твердых веществ, диффузия жидкостей через молекулярные сита, расположение атомов и ионов в кристаллах, а также размер и форма молекул.
Радиусы атомов изменяются, подчиняясь определённым закономерностям периодической таблицы химических элементов. Например, радиусы атомов обычно уменьшаются при перемещении слева направо вдоль каждого периода (строки) таблицы, от щелочных металлов до благородных газов, и возрастают по мере продвижения сверху вниз в каждой группе (столбце). Радиусы атомов резко возрастают при переходе между благородным газом в конце каждого периода и щелочным металлом в начале следующего периода. Эти тенденции изменения радиусов атомов (наряду с другими химическими и физическими свойствами элементов) могут быть объяснены с точки зрения теории электронной оболочки атома, а также представляют доказательства подтверждения квантовой теории. Радиусы атомов уменьшаются в периодической таблице, потому что с увеличением атомного номера увеличивается число протонов в атоме, а дополнительные электроны добавляются в одну и ту же квантовую оболочку. Следовательно, эффективный заряд атомного ядра по отношению к внешним электронам увеличивается, притягивая внешние электроны. В результате электронное облако сжимается и атомный радиус уменьшается.
История[править | править код]
В 1920 году, вскоре после того, как стало возможным определять размеры атомов с помощью рентгеноструктурного анализа, было высказано предположение, что все атомы одного и того же элемента имеют одинаковые радиусы[3]. Однако в 1923 году, когда было получено больше данных о кристаллах, было обнаружено, что аппроксимация атома сферой не всегда корректна при сравнении атомов одного и того же элемента в разных кристаллических структурах[4].
Определения[править | править код]
Широко используемые определения радиуса атома включают:
- Радиус Ван-дер-Ваальса, Вандерваальсовы радиусы[5] — эта величина соответствует половине межъядерного расстояния между ближайшими одноимёнными атомами, не связанными между собой химической связью и принадлежащими разным молекулам (например, в молекулярных кристаллах).[6].
- Ионный радиус: номинальный радиус ионов элемента в определённом состоянии ионизации, выведенный из расстояния между атомными ядрами в кристаллических солях, которые включают эти ионы. В принципе, расстояние между двумя соседними противоположно заряженными ионами (длина ионной связи между ними) должно равняться сумме их ионных радиусов[6].
- Ковалентный радиус: номинальный радиус атомов элемента, когда они ковалентно связаны с другими атомами, выводится из расстояния между атомными ядрами в молекулах. В принципе, расстояние между двумя атомами, которые связаны друг с другом в молекуле (длина этой ковалентной связи), должно равняться сумме их ковалентных радиусов[6].
- Металлический радиус: номинальный радиус атомов элемента, когда они соединены с другими атомами металлическими связями.
- Боровский радиус: радиус орбиты электрона с наименьшей энергией, предсказанный Боровской моделью атома (1913)[7][8]. Он применим только к атомам и ионам с одним электроном, таким как водород, однократно ионизованный гелий и позитроний. Хотя сама модель в настоящее время устарела, радиус Бора для атома водорода считается одной из фундаментальных физических постоянных.
Измерение радиуса атома опытным путём[править | править код]
В таблице приведены измеренные опытным путём ковалентные радиусы для элементов, опубликованные американским химиком Д.Слейтером в 1964 году[9]. Значения приведены в пикометрах (пм или 1 × 10-12 м) с точностью около 5 пм. Оттенки цвета ячеек варьируются от красного до жёлтого по мере увеличения радиуса; серый цвет — отсутствие данных.
| Группы (столбцы) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Периоды (строки) |
||||||||||||||||||
| 1 | H 25 |
He 31 |
||||||||||||||||
| 2 | Li 145 |
Be 105 |
B 85 |
C 70 |
N 65 |
O 60 |
F 50 |
Ne 38 |
||||||||||
| 3 | Na 180 |
Mg 150 |
Al 125 |
Si 110 |
P 100 |
S 100 |
Cl 100 |
Ar 71 |
||||||||||
| 4 | K 220 |
Ca 180 |
Sc 160 |
Ti 140 |
V 135 |
Cr 140 |
Mn 140 |
Fe 140 |
Co 135 |
Ni 135 |
Cu 135 |
Zn 135 |
Ga 130 |
Ge 125 |
As 115 |
Se 115 |
Br 115 |
Kr |
| 5 | Rb 235 |
Sr 200 |
Y 180 |
Zr 155 |
Nb 145 |
Mo 145 |
Tc 135 |
Ru 130 |
Rh 135 |
Pd 140 |
Ag 160 |
Cd 155 |
In 155 |
Sn 145 |
Sb 145 |
Te 140 |
I 140 |
Xe |
| 6 | Cs 260 |
Ba 215 |
* |
Hf 155 |
Ta 145 |
W 135 |
Re 135 |
Os 130 |
Ir 135 |
Pt 135 |
Au 135 |
Hg 150 |
Tl 190 |
Pb 180 |
Bi 160 |
Po 190 |
At |
Rn |
| 7 | Fr |
Ra 215 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| Лантаноиды | * |
La 195 |
Ce 185 |
Pr 185 |
Nd 185 |
Pm 185 |
Sm 185 |
Eu 185 |
Gd 180 |
Tb 175 |
Dy 175 |
Ho 175 |
Er 175 |
Tm 175 |
Yb 175 |
Lu 175 |
||
| Актиноиды | ** |
Ac 195 |
Th 180 |
Pa 180 |
U 175 |
Np 175 |
Pu 175 |
Am 175 |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
||
Объяснение общих тенденций[править | править код]

Изменение радиуса атома с увеличением зарядового числа можно объяснить расположением электронов в оболочках с постоянной ёмкостью. Оболочки обычно заполнены в порядке увеличения радиуса, поскольку отрицательно заряженные электроны притягиваются положительно заряженными протонами атомного ядра. Поскольку зарядовое число увеличивается вдоль каждой строки периодической таблицы, дополнительные электроны входят в ту же самую внешнюю оболочку, а её радиус постепенно сжимается из-за увеличения заряда ядра. В атомах инертных газов внешняя оболочка полностью заполнена; следовательно, дополнительный электрон следующего элемента — щелочного металла — перейдет в следующую внешнюю оболочку, что объясняет внезапное увеличение атомного радиуса.
Увеличивающийся заряд ядра частично уравновешивается ростом числа электронов, это явление известно как экранирование[en]; он объясняет, почему размер атомов обычно увеличивается в каждом столбце периодической таблицы. Из этой закономерности есть важное исключение, известное как лантаноидное сжатие: меньшие, по сравнению с ожидаемыми, величины ионных радиусов химических элементов, входящих в группу лантаноидов (атомный номер 58—71), которое происходит из-за недостаточного экранирования заряда ядра электронами 4f-орбитали.
По существу, атомный радиус уменьшается на протяжении периодов из-за увеличения количества протонов в ядре. Соответственно, большее количество протонов создает более сильный заряд и сильнее притягивает электроны, уменьшая размер радиуса атома. При движении сверху вниз по столбцам (группам) периодической таблицы атомный радиус увеличивается, поскольку есть больше энергетических уровней и, следовательно, больше расстояние между протонами и электронами. Кроме того, электронное экранирование ослабляет притяжение протонов, поэтому оставшиеся электроны могут удаляться от положительно заряженного ядра. Таким образом, размер (радиус атома) увеличивается.
В следующей таблице приведены основные факторы, влияющие радиус атома:
| Фактор | Закон | Возрастает с… | как правило | Влияние на радиус атома |
|---|---|---|---|---|
| Электронные оболочки | Квантовая механика | Главным и азимутальным квантовым числом | Увеличивает радиус атома | Возрастает сверху вниз в каждой колонке |
| Атомный заряд | Притяжение электронов протонами ядра атома | Зарядовым числом | Сокращает радиус атома | Сокращается в течение всего периода |
| Экранирование | Отталкивание внешних электронов внутренними электронами | Количеством электронов во внутренних оболочках | Увеличивает радиус атома | Снижает эффект второго фактора |
Лантаноидное сжатие[править | править код]
У химических элементов группы лантаноидов электроны в 4f-подоболочке, которая постепенно заполняется от церия (Z = 58) до лютеция (Z = 71), не особенно эффективны для экранирования увеличивающегося заряда ядра. Элементы, следующие непосредственно за лантаноидами, имеют радиусы атомов, которые меньше, чем можно было бы ожидать, и которые почти идентичны атомным радиусам элементов, находящихся непосредственно над ними[10]. Следовательно, гафний имеет практически тот же атомный радиус (и химические свойства), что и цирконий, а тантал имеет радиус атома, как у ниобия, и так далее. Эффект лантаноидного сжатия заметен вплоть до платины (Z = 78), после чего он нивелируется релятивистским эффектом, известным как эффект инертной пары[en].
Лантаноидное сжатие даёт 5 следующих эффектов:
- Размер ионов Ln3 + регулярно уменьшается с атомным номером. Согласно правилам Фаянса[en], уменьшение размера ионов Ln3+ увеличивает ковалентную связь и уменьшает основную связь между ионами Ln3+ и OH− в Ln(OH)3 до такой степени, что Yb(OH)3 и Lu(OH)3 с трудом растворяются в горячем концентрированном NaOH. Отсюда порядок размера ионов Ln3+:
La3+ > Ce3+ > …, … > Lu3+. - Наблюдается регулярное уменьшение ионных радиусов.
- Наблюдается регулярное снижение способности ионов действовать в качестве восстановителя с увеличением атомного номера.
- Второй и третий ряды переходных элементов d-блока довольно близки по свойствам.
- Эти элементы встречаются вместе в природных минералах и их трудно разделить.
d-сжатие[править | править код]
d-сжатие[en] менее выражено, чем лантаноидное сжатие, но возникает по той же причине. В этом случае плохая экранирующая способность 3d-электронов влияет на атомные радиусы и химические свойства элементов, следующих непосредственно за первым рядом переходных металлов, от галлия (Z = 30) до брома (Z = 35)[10].
Вычисленные радиусы атомов[править | править код]
В таблице приведены значения радиусов атомов, рассчитанные по теоретическим моделям, опубликованные итальянским химиком Энрико Клементи[en] и другими в 1967 году[11]. Значения даны в пикометрах (пм).
| Группы (столбцы) |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Периоды (строки) |
||||||||||||||||||
| 1 | H 53 |
He 31 |
||||||||||||||||
| 2 | Li 167 |
Be 122 |
B 87 |
C 67 |
N 56 |
O 48 |
F 42 |
Ne 38 |
||||||||||
| 3 | Na 190 |
Mg 145 |
Al 118 |
Si 111 |
P 98 |
S 88 |
Cl 79 |
Ar 71 |
||||||||||
| 4 | K 243 |
Ca 194 |
Sc 184 |
Ti 176 |
V 171 |
Cr 166 |
Mn 161 |
Fe 156 |
Co 152 |
Ni 149 |
Cu 145 |
Zn 142 |
Ga 136 |
Ge 125 |
As 114 |
Se 103 |
Br 94 |
Kr 98 |
| 5 | Rb 265 |
Sr 219 |
Y 212 |
Zr 206 |
Nb 198 |
Mo 190 |
Tc 183 |
Ru 178 |
Rh 173 |
Pd 169 |
Ag 165 |
Cd 161 |
In 156 |
Sn 145 |
Sb 133 |
Te 123 |
I 115 |
Xe 108 |
| 6 | Cs 298 |
Ba 253 |
* | Hf 208 |
Ta 200 |
W 193 |
Re 188 |
Os 185 |
Ir 180 |
Pt 177 |
Au 174 |
Hg 171 |
Tl 156 |
Pb 154 |
Bi 143 |
Po 135 |
At 127 |
Rn 120 |
| 7 | Fr |
Ra |
** | Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og |
| Лантаноиды | * | La 226 |
Ce 210 |
Pr 247 |
Nd 206 |
Pm 205 |
Sm 238 |
Eu 231 |
Gd 233 |
Tb 225 |
Dy 228 |
Ho 226 |
Er 226 |
Tm 222 |
Yb 222 |
Lu 217 |
||
| Актиноиды | ** | Ac |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
||
См. также[править | править код]
- Боровский радиус
- Ковалентный радиус
- Радиус Ван-дер-Ваальса
- Ионный радиус
- Химическая связь
Примечания[править | править код]
- ↑
Cotton, F. A.; Wilkinson, G. Advanced Inorganic Chemistry (неопр.). — 5th. — Wiley, 1988. — С. 1385. — ISBN 978-0-471-84997-1. - ↑
Basdevant, J.-L.; Rich, J.; Spiro, M. Fundamentals in Nuclear Physics (неопр.). — Springer, 2005. — С. 13, fig 1.1. — ISBN 978-0-387-01672-6. - ↑
Bragg, W. L. The arrangement of atoms in crystals (англ.) // Philosophical Magazine : journal. — 1920. — Vol. 6, no. 236. — P. 169—189. — doi:10.1080/14786440808636111. - ↑
Wyckoff, R. W. G. On the Hypothesis of Constant Atomic Radii (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1923. — Vol. 9, no. 2. — P. 33—38. — doi:10.1073/pnas.9.2.33. — Bibcode: 1923PNAS….9…33W. — PMID 16576657. — PMC 1085234. - ↑ Такое написание даёт «Русский орфографический словарь: около 200 000 слов / Российская академия наук. Институт русскоrо языка им. В. В. Виноградова / Под ред. В. В. Лопатина, О. Е. Ивановой. — Изд. 4-е, испр. и доп. — М.: АСТ-ПРЕСС КНИГА, 2013. — 896 с. — (Фундаментальные словари русскою языка). — с. 68. — ISBN 978-5-462-01272-3».
- ↑ 1 2 3
L.; Pauling. The Nature of the Chemical Bond (неопр.). — 2nd. — Cornell University Press, 1945. - ↑
Bohr, N. On the Constitution of Atoms and Molecules, Part I. – Binding of Electrons by Positive Nuclei (англ.) // Philosophical Magazine : journal. — 1913. — Vol. 26, no. 151. — P. 1—24. — doi:10.1080/14786441308634955. - ↑
Bohr, N. On the Constitution of Atoms and Molecules, Part II. – Systems containing only a Single Nucleus (англ.) // Philosophical Magazine : journal. — 1913. — Vol. 26, no. 153. — P. 476—502. — doi:10.1080/14786441308634993. - ↑
Slater, J. C. Atomic Radii in Crystals (англ.) // Journal of Chemical Physics : journal. — 1964. — Vol. 41, no. 10. — P. 3199—3205. — doi:10.1063/1.1725697. — Bibcode: 1964JChPh..41.3199S. - ↑ 1 2
W. L.; Jolly. Modern Inorganic Chemistry (неопр.). — 2nd. — McGraw-Hill Education, 1991. — С. 22. — ISBN 978-0-07-112651-9. - ↑
Clementi, E.; Raimond, D. L.; Reinhardt, W. P. Atomic Screening Constants from SCF Functions. II. Atoms with 37 to 86 Electrons (англ.) // Journal of Chemical Physics : journal. — 1967. — Vol. 47, no. 4. — P. 1300—1307. — doi:10.1063/1.1712084. — Bibcode: 1967JChPh..47.1300C.
Литература[править | править код]
- Рабинович В. А., Хавин З.Я. Краткий химический справочник. Изд. 2-е, испр. и доп. — Л.: Химия, 1978. — 392 с.
Вот казалось бы, радиус атома – штука хорошо известная и кажется уже чем-то очевидным. Значение это приведено даже в таблице Менделеева. Правда ни в каждой, но есть такие “прокаченные” варианты, где отражены основные параметры каждого приведенного элемента. Ну и исходя из таких данных, мы вполне можем выбрать самый большой атом и самый маленький.
В чём сложность?
Однако, тут нужно помнить, что размер атома – величина весьма условная. Одной из главных проблем тут является нестабильность самого атома. Под термином нестабильность тут мы будем понимать не его склонность к постоянному распаду, а ряд сопутствующих проблем.
Например, вроде бы очевидно, что измерять размер следует исходя из радиуса, который является отрезком прямой, соединяющий центр ядра атома и наиболее стабильную электронную орбиталь, где вероятность появления электрона наибольшая. Но это очень красиво, пока мы рисуем планетарную модель. На самом же деле, орбиты электронов, движущихся вокруг атома выглядят примерно так 🙂
Соответственно, уже “с порога” встаёт вопрос точности измерения. При этом нужно понимать, что переход атома в возбужденное состояние при таком раскладе сможет изменить его размер.
Но даже если исходить из усреднения измерений, есть и ещё одна важная проблема. На данный момент не существует объективной методики, которая позволяет измерять размер атома, как мы измеряем гайку штангенциркулем. Все измерения размера атомов косвенные.
Какие методики измерения существуют?
В энциклопедии довольно мудрёно объясняется, что нормальных в нашем понимании измерений пока нет. Существующие методики строятся на логическом предположении, которое позволяет утверждать, что мы измеряем размер атома.
Например, существует методика измерения размера атома, исходя из плотности потока отражения бомбардируемых частиц. По атому стреляют частичкам и там где есть атом, эти частички отлетают в обратном направлении. Пятно, появившееся на сенсоре, фиксирующем такие отраженные частицы, считается соответствующим размеру измеряемого атома.
Есть теоретическая методика, которая исходит из измерения размера атома посредством определения межатомных расстояний. Исходя из принципа плотнейшей упаковки, расстояние между атомами для каждого элемента фиксировано и прямо соотносится с размером самого атома. Это даёт возможность предположить, что реальный размер атома такой-то. Ну а измерить расстояние между самими атомами технически проще, чем измерять радиус атома. Тут достаточно точечных рефлексов.
Наиболее точной методикой измерения размеров атома сегодня считается методика спектроскопии. Спектроскопические методы основаны на взаимодействии электромагнитной волны с веществом. При некоторых условиях, вещество выступает как дифракционная решетка, а параметры решетки могут быть высчитаны. При этом, размер самой решетки прямо соотносится с размерами межатомных пространств. Ну а исходя из знаний о строении вещества, можно прикинуть и размер самого атома.
Есть и ещё одна интересная методика. Она расчётная. Исходя из атомной массы высчитывается размер атома. Плотность можно измерить, массу высчитать. Дальше простая арифметика позволяет рассчитать и радиус атома. Правда тут приближений ещё больше, чем во всех описанных ранее методиках.
Ну и из серии совсем экстравагантных измерений – на одном из конкурсов научной фотографии победила фотография “Одинокий атом стронция в ионной ловушке”. Там на простой фотоаппарат был сфотографирован атом и выглядит он как светящаяся точка. Сопоставляя размеры этой точки и любого объекта, вполне можно прикинуть реальный размер.
Важно отметить, что в основном все методики дают сопоставимые результаты. Казалось бы, это означает, что размер атома определен верно и однозначно. Но, возвращаемся к началу статьи и вспоминаем, что сама по себе однозначная форма атома – это научное приближение и абстракция. В реальных условиях может меняться как реальная форма, так характерный размер.
Так, если измерять атом внутри кристаллической решетки, то мы получим один размер, а если измерять атом того же вещества, свободно путешествующий в пространстве – другой. Логично предположить, что размер свободного атома больше размера связанного атома. Он ведет себя подобно резиновому мячику. Пока мячик сжимается внешними силами, он имеет меньший радиус, нежели мячик, который находится в свободном положении.
Так есть ли точная информация?
В итоге можно сказать, что однозначно определенных значений атомных радиусов не существует. Ведь помимо того, что все методики измерений дают хоть и коррелирующий, но не одинаковый результат, есть ещё и конфигурация самого атома. Отсюда следует очень простой и, отчасти печальный, вывод.
Размер атома, известный нам – это всего лишь научная абстракция, используемая для удобной работы с моделью строения вещества. Радиус атома, приведенный в справочнике подразумевает измерение в одинаковых условиях одинаковым методом. Нельзя сказать, что это полная ахинея, ведь размеры соизмеримы с реальностью, но и нельзя утверждать о высокой точности.
Обязательно подпишитесь на проект, оцените статью лайком и напишите комментарий! Это поможет развитию канала, а вы не пропустите новые интересные статьи
Советую также прочитать на нашем канале:
—–
Смотрите нас на YouTube и присоединяйтесь к телеге!
From Wikipedia, the free encyclopedia

(Top) Diamond crystal structure, depicting an atomic spacing of 0.154 nm. (Bottom) Graphite crystal structure, depicting an atomic spacing of 0.142 nm.
Atomic spacing refers to the distance between the nuclei of atoms in a material. This space is extremely large compared to the size of the atomic nucleus, and is related to the chemical bonds which bind atoms together.[1] In solid materials, the atomic spacing is described by the bond lengths of its atoms. In ordered solids, the atomic spacing between two bonded atoms is generally around a few ångströms (Å), which is on the order of 10−10 meters. However, in very low density gases (for example, in outer space) the average distance between atoms can be as large as a meter. In this case, the atomic spacing isn’t referring to bond length.
The atomic spacing of crystalline structures is usually determined by passing an electromagnetic wave of known frequency through the material, and using the laws of diffraction to determine its atomic spacing. The atomic spacing of amorphous materials (such as glass) varies substantially between different pairs of atoms, therefore diffraction cannot be used to accurately determine atomic spacing. In this case, the average bond length is a common way of expressing the distance between its atoms.
Example[edit]
Bond length can be determined between different elements in molecules by using the atomic radii of the atoms. Carbon bonds with itself to form two covalent network solids.[2] Diamond’s C-C bond has a distance of Sqrt[3]a/4 ≈ 0.154 nm away from each carbon since adiamond ≈ 0.357 nm, while graphite’s C-C bond has a distance of a/Sqrt[3] ≈ 0.142 nm away from each carbon since agraphite ≈ 0.246 nm. Although both bonds are between the same pair of elements they can have different bond lengths.[3]
References[edit]
- ^ Kittel, Charles (2004-11-11). Introduction to Solid State Physics (8th ed.). Wiley. ISBN 047141526X.
- ^ Rossi, Miriam. “How can graphite and diamond be so different if they are both composed of pure carbon?”. Scientific American. Scientific American. Retrieved October 9, 2007.
- ^ Brown; Lemay; Bursten (1997). Chemistry the Central Science. Upper Saddle River, NJ: Simon and Schuster. pp. 412–413.
Расстояние между соседними плоскостями
с индексами (hkl) можно
вычислить в единицах длины ребра куба
с помощью уравнения:
![]()
Расстояние между плоскостями с большими
индексами малы по сравнению с расстояниями
между плоскостями, имеющими малые
индексы. У плоскостей с малыми индексами
более высокая плотность расположения
атомов (количество атомов на единицу
площади), чем у плоскостей с большими
индексами.
Расстояние между ионами (или между
атомами) в решетках можно вычислить по
плотности вещества по формуле:
![]()
Пример: Плотность поваренной соли ρ
= 2,173 г/см3,масса 1 моль NaCl
равна 58,455 г. В нем находится 2 · 6·1023
ионов, откуда
![]()
нм
Расстояние между ионами можно определить,
исходя из ионных радиусов.
Например:
![]() =0,98Å=0,098
=0,98Å=0,098
нм
![]() =1,81Å=0,181
=1,81Å=0,181
нм
Затем полученные данные сложим.
d= 0,098+0,181=0,279 нм
Этот метод менее точен. Таблица ионных
радиусов приведена в приложении.
2. Контрольные задания
2.1. Задание №1.
Определить длину ребра куба и атомный
радиус по указанным в таблице данным.
В таблице приняты следующие обозначения
решеток: простая кубическая решетка
NaCl, объемноцентрированная
– CsCl или ОЦК; гранецентрированная
решетка – ГЦК; гексагональная плотной
упаковки – ГПУ; решетки типа алмаза –
«алмаз» или ZnS (сфалерит);
решетка флюорита – CaF2.
|
№ задачи |
Металл |
Тип решетки |
Плотность, |
|
|
Pb |
ГЦК |
11,34 |
|
|
Pt |
ГЦК |
21,45 |
|
|
Cu |
ГЦК |
8,9 |
|
|
Ta |
ОЦК |
16,60 |
|
|
α |
ОЦК |
7,80 |
|
|
Na |
ОЦК |
0,97 |
|
|
Zi |
ОЦК |
0,53 |
|
|
W |
ОЦК |
19,10 |
|
|
Cr |
ОЦК |
7,00 |
|
|
V |
ОЦК |
6,10 |
|
|
γ |
ГЦК |
8,14 |
|
|
Rb |
ОЦК |
1,50 |
|
|
Au |
ГЦК |
19,32 |
|
|
Sr |
ГЦК |
2,60 |
|
|
Nb |
ОЦК |
8,58 |
|
|
Mo |
ОЦК |
10,20 |
|
|
Cs |
ОЦК |
1,90 |
|
|
Ba |
ОЦК |
3,75 |
|
|
Ag |
ГЦК |
10,50 |
|
|
Al |
ГЦК |
2,7 |
|
|
α |
ГЦК |
1,55 |
|
|
Mg |
ГПУ |
1,74 |
|
|
β |
ОЦК |
4,515 |
|
|
α |
ГПУ |
6,505 |
|
|
Tc |
ГПУ |
11,5 |
|
|
β |
ОЦК |
7,86 |
|
|
α |
ГПУ |
8,33 |
|
|
Ni |
ГЦК |
8,9 |
|
|
β |
ГЦК |
8,33 |
|
|
α |
ГПУ |
11,87 |
|
|
β |
ГЦК |
11,87 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Чтобы разобраться в вопросе, что в современной науке называется радиусом атома, вспомним, что из себя представляет сам атом. По классическим представлениям в центре атома находится ядро, состоящее из протонов и нейтронов, а вокруг ядра каждый на своей орбите вращаются электроны.
Содержание:
- Радиус атома в физике
- Атомный радиус в химии и кристаллографии
- Какие бывают виды
- Как зависит от типа химической связи
- Видео
Радиус атома в физике
Поскольку в данной модели строения атома электроны являются пространственно ограниченными частицами, т. е. корпускулами, логично считать атомным радиусом (а. р.) расстояние от его ядра до самой дальней, или внешней, орбиты, по которой вращаются так называемые валентные электроны.
Однако по современным, квантовомеханическим представлениям, определить данный параметр нельзя так однозначно, как это делается в классической модели. Здесь электроны уже не представляются в виде частиц-корпускул, а получают свойства волн, т. е. пространственно-неограниченных объектов. В такой модели точно определить положение электрона просто невозможно. Здесь эта частица уже представляется в виде электронной орбитали, плотность которой меняется, в зависимости от расстояния до ядра атома.
Итак, в современной модели строения атома его радиус нельзя определить однозначно. Поэтому в квантовой физике, общей химии, физике твердого тела и других смежных науках эту величину сегодня определяют как радиус сферы, в центре которой находится ядро, внутри которой сосредоточено 90-98% плотности электронного облака. Фактически это расстояние и определяет границы атома.
Если рассмотреть Периодическую таблицу химических элементов (таблицу Менделеева), в которой приведены атомные радиусы, можно увидеть определенные закономерности, которые выражаются в том, что в пределах периода эти числа уменьшаются слева направо, а в пределах группы они увеличиваются сверху вниз. Такие закономерности объясняются тем, что внутри периода при движении слева направо заряд атома возрастает, что увеличивает силу притяжения им электронов, а при движении внутри группы сверху вниз все больше заполняется электронных оболочек.
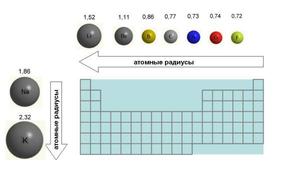
Атомный радиус в химии и кристаллографии
Какие бывают виды
Данная характеристика сильно варьируется, в зависимости от того, в какой химической связи состоит атом. Поскольку все вещества в природе в подавляющем своем большинстве состоят из молекул, понятие а. р. используют для определения межатомных расстояний в молекуле. А данная характеристика зависит от свойств входящих в молекулу атомов, т. е. их положения в Периодической системе химических элементов. Обладая разными физическими и химическими свойствами, молекулы образуют все огромное разнообразие веществ.
По сути, эта величина очерчивает сферу действия силы электрического притяжения ядра атома и его внешних электронных оболочек. За пределами этой сферы в действие вступает сила электрического притяжения соседнего атома. Существует несколько типов химической связи атомов в молекуле:
- ковалентная;
- ионная;
- металлическая;
- ван-дер-ваальсова.
Соответственно этим связям таким же будет и атомный радиус.
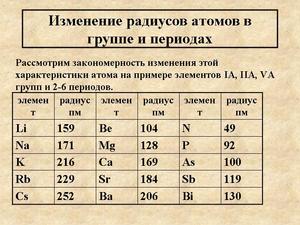
Как зависит от типа химической связи
При ковалентной связи АР определяется как половина расстояния между соседними атомами в одинарной химической связи Х—Х, причем Х — это неметалл, ибо данная связь свойственна неметаллам. Например, для галогенов ковалентный радиус будет равен половине межъядерного расстояния Х—Х в молекуле Х2, для молекул селена Se и серы S — половине расстояния Х—Х в молекуле Х8, для углерода С он будет равен половине кратчайшего расстояния С—С в кристалле алмаза.
Данная химическая связь обладает свойством аддитивности, т. е. суммирования, что позволяет определять межъядерные расстояния в многоатомных молекулах. Если связь в молекуле двойная или тройная, то ковалентный АР уменьшается, т. к. длины кратных связей меньше одинарных.
При ионной связи, образующейся в ионных кристаллах, используют значения ионного АР для определения расстояния между ближайшими анионом и катионом, находящимися в узлах кристаллической решетки. Такое расстояние определяется как сумма радиусов этих ионов.
Существует несколько способов определения ионных радиусов, при которых отличаются значения у индивидуальных ионов. Но в результате эти способы дают примерно одинаковые значения межъядерных расстояний. Эти способы или системы были названы в честь ученых, проводивших в этой области соответствующие исследования:
- Гольдшмидта;
- Полинга;
- Белова и Бокия;
- других ученых.
При металлической связи, возникающей в кристаллах металлов, АР принимаются равными половине кратчайшего расстояния между ними. Металлический радиус зависит от координационного числа К. При К=12 его значение условно принимается за единицу. Для координационных чисел 4, 6 и 8 металлические радиусы одного и того же элемента соответственно будут равны 0.88, 0.96 и 0.98.
Если взять два разных металла и сравнить металлические радиусы их элементов, то близость этих значений друг к другу будет означать необходимое, но недостаточное условие взаимной растворимости этих металлов по типу замещения. Например, жидкие калий К и литий Li в обычных условиях не смешиваются и образуют два жидких слоя, потому что их металлические радиусы сильно различаются (0.236 нм и 0.155 нм соответственно), а калий К с цезием Cs образуют твердый раствор благодаря близости их радиусов (0.236 нм и 0.268 нм).

Ван-дер-ваальсовы АР используют для определения эффективных размеров атомов благородных газов, а также расстояний между ближайшими одноименными атомами, принадлежащими разным молекулам и не связанными химической связью (пример — молекулярные кристаллы). Если такие атомы сблизятся на расстояние, меньшее суммы их ван-дер-ваальсовых радиусов, между ними возникнет сильное межатомное отталкивание. Эти радиусы определяют минимально допустимые границы контакта двух атомов, принадлежащих соседним молекулам.
Кроме того, данные АР используют для определения формы молекул, их конформаций и упаковки в молекулярных кристаллах. Известен принцип “плотной упаковки”, когда молекулы, образующие кристалл, входят друг в друга своими “выступами” и “впадинами”. На основе этого принципа интерпретируются данные кристаллографии и предсказываются структуры молекулярных кристаллов.
Видео
Это полезное видео поможет вам понять, что такое радиус атома.
