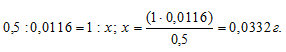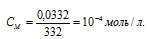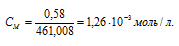Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Теоретическое введение
Примеры решения задач
Задачи для самостоятельного решения
Теоретическое введение
В насыщенных водных растворах малорастворимых соединений устанавливается равновесие:
PbCl2(кристалл.) ↔Pb2+(насыщ.р-р) + 2 Cl–(насыщ.р-р)
которое описывается константой равновесия, называемой произведением растворимости (ПР). Величина ПР равна:
ПР = [Pb2+] [Cl–]2
Понятие ПР используется только при описании гетерогенных равновесий в насыщенных растворах малорастворимых сильных электролитов и их твердых фаз. Растворимость вещества равна его концентрации в насыщенном растворе. Насыщенный раствор находится в равновесии с кристаллической фазой.
ПР связано с изменением энергии Гиббса процесса уравнением:
ΔGоT = – RT lnПР (1)
которое используется для расчетов ПР по термодинамическим данным.
Чем меньше величина ПР, тем в меньшей степени осуществляется переход вещества в раствор. Так, PbCl2 более растворим, чем PbI2 (при 25оС ПР(PbCl2) = 1,6·10–5, ПР(PbI2) = 8,2× 10–9), поэтому количественно осаждать ионы Pb2+ лучше в виде йодида, а не хлорида свинца.
Из определенной опытным путем растворимости соединения можно рассчитать ПР и, наоборот, зная ПР соединения, можно рассчитать его растворимость в воде.
Рассмотрим растворение малорастворимого электролита КnАm. В насыщенном растворе этого электролита имеет место равновесие:
КnАm (к) + aq ↔ n Кm+(насыщ.р-р) + m An-(насыщ.р-р)
Произведение растворимости КnАm запишется в виде:
ПР = [Кm+]n [An-]m (2)
Если обозначить растворимость электролита буквой Р, то концентрации катионов и анионов в насыщенном растворе составят:
[Кm+] = nP; [An-] = mP
В результате для величины ПР получаем
ПР = [nP]n [mP]m = nn mm Pn+m (3)
Растворимость симметричных электролитов (содержащих равнозарядные ионы, например, AgCl, BaSO4, AlPO4) рассчитывается как корень квадратный из ПР.
Добавление в раствор малорастворимого электролита, например, AgCl, веществ, содержащих одноименные ионы, в частности, BaCl2 или AgNO3, приводит к уменьшению растворимости этого электролита.
Примеры решения задач
Задача 1. Рассчитайте произведение растворимости карбоната бария, если известно, что при 298 К в 100 мл его насыщенного раствора содержится 1,38× 10-3 г BaCO3.
Решение. М(BaCO3) = 197 г/моль. Растворимость Р карбоната бария равна:
Р(BaCO3) = 7·10–5 моль/л.
В насыщенном растворе карбоната бария:
ВаСО3(к) + aq ↔ Ba2+(насыщ.р-р) + СO32–(насыщ.р-р)
концентрации ионов бария и карбонат-ионов равны. Следовательно,
[Ba2+] = [СO32-] = 7× 10–5 моль/л
Таким образом, растворимость Р карбоната бария равна 7·10–5 моль/л. Величина ПР составит:
ПР = [Ba2+][СO32–] = Р× Р = (7× 10–5)2 = 4,9× 10–9.
Задача 2. Вычислите растворимость PbCl2 в воде (моль/л и г/л), если произведение растворимости при 298 К для этой соли равно 1,6·10–5.
Решение.
PbCl2(к) + aq ↔ Pb2+(насыщ.р-р) + 2 Cl—(насыщ.р-р)
Пусть Р (моль/л) — растворимость PbCl2. Тогда концентрации ионов соли в растворе составят:
[Pb2+] = Р; [Cl–] = 2[Pb2+] = 2P.
ПР(PbCl2) = [Pb2+][ Cl—]2 = Р(2Р)2 = 1,6× 10-5.
Р(PbCl2) = 278× 1,6× 10–2 = 4,413 г/л, где 278 — М(PbCl2) (г/моль)
В этой задаче следует обратить внимание на то, что в квадрат возводится удвоенное значение растворимости: (2Р)2, т.е. растворимость умножается на стехиометрический коэффициент, и полученная величина возводится в степень, равную стехиометрическому коэффициенту.
Задача 3. Вычислите растворимость (моль/л) PbCl2 в 0,1 М растворе KCl, если ПР (PbCl2) = 1,6× 10–5 при 298 К.
Решение. Суммарная концентрация хлорид-ионов составляет
[Cl–] = (2Р + 0,1) моль/л
Хлорид-ионы образуются при диссоциации PbCl2. В его насыщенном растворе:
PbCl2(к) + aq ↔ Pb2+(насыщ.р-р) + 2 Cl—(насыщ.р-р)
а также за счет диссоциации неассоциированного электролита KCl в его 0,1М растворе:
KCl → K+ + Cl—
Запишем выражение для ПР(PbCl2): ПР = Р (2Р + 0,1)2. Слагаемым 2Р по сравнению со вторым слагаемым 0,1 можно пренебречь. Следовательно, ПР = Р(0,1)2. Растворимость PbCl2, равная концентрации ионов Pb2+, составляет Р = 1,6·10–3 моль/л.
В воде растворимость PbCl2 равна 1,6× 10–2 моль/л (см. предыдущую задачу), в растворе KCl растворимость PbCl2 уменьшилась и составила 1,6× 10–3 моль/л.
Задача 4. Смешали 100 мл 0,01 н раствора CuCl2 и 300 мл 0,1 н раствора Na2S. Выпадет ли осадок cульфида меди, если ПР(CuS) = 6,3× 10–36? Примите, что соли в растворе диссоциированы полностью и объем полученного раствора равен 400 мл.
Решение. Осадок выпадет, если [Сu2+][S2–] > ПР(СuS), т.е. если произведение концентраций ионов Сu2+ и S2– в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
Молярные концентрации растворов равны:
См (СuCl2) = 1/2× 0,01 = 0,005M
См (Na2S) = 1/2× 0,1 = 0,05M
До смешения растворов: [Сu2+] = 0,005 M, [S2–] = 0,05М.
После смешения растворов концентрации ионов изменятся и станут равными:
[Сu2+] = 0,005× 0,1:0,4 = 0,00125M
[S2–] = 0,05× 0,3:0,4 = 0,0375М
Следовательно, произведение концентраций ионов равно:
[Сu2+][S2–] = 0,00125× 0,0375 = 4,7× 10–5(моль/л)2
Поскольку [Сu2+][S2–] = 4,7·10–5 >> 6,3·10–36, то осадок выпадет.
Задача 5. При 298 К произведение растворимости BaSO4 равно 1× 10–10. Определите, в каком объеме воды растворяется 1 г сульфата бария.
Решение.
BaSO4(к) + aq ↔ Ba2+(насыщ.р-р) + SO42– (насыщ.р-р)
Примем растворимость BaSO4 за Р моль/л.
Растворимость BaSO4 равна концентрации ионов Ba2+ и SO42– в растворе: [Ba2+] = [SO42–].
ПР(BaSO4) = [Ba2+]·[SO42–] = Р·Р = 1× 10-10
Р = √ПР = 1× 10-5 моль/л или 233× 10–5 = 2,33× 10–3 г/л,
где 233 — М(BaSO4) (г/моль).
Следовательно, 1 г BaSO4 растворяются в 1/2,33× 10–3 = 429,2 л воды.
Задачи для самостоятельного решения
1. При некоторой температуре растворимость карбоната серебра равна 10-4 моль/л. Рассчитайте ПР этой соли.
2. При некоторой температуре в 20 л воды растворяется 4×10-3 моль фторида кальция. Рассчитайте ПР этой соли.
3. При некоторой температуре в 10 л воды растворяется 1,112 г хлорида свинца. Рассчитайте ПР этой соли.
4. При некоторой температуре рН насыщенного раствора гидроксида кальция составляет 13. Рассчитайте величину ПР этого основания.
5. ПР сульфата серебра при комнатной температуре составляет 5,02× 10-5. Рассчитайте растворимость этой сли в воде. Какой объем воды понадобится для растворения 1 г этой соли?
6. Вычислить растворимость Ag2SO4 в воде (моль/л и г/л), если произведение растворимости при 298 К для этой соли равно 1,2× 10–5.
7. Вычислить растворимость (моль/л) Ni(OH)2 в 0,15 М растворе Ni(NO3)2, если ПР(Ni(OH)2) = 1,2× 10–16 при 298 К.
8. Смешали 150 мл 0,1 н раствора FeCl2 и 350 мл 0,01 М раствора NaOH. Выпадет ли осадок Fe(OH)2, если ПР(Fe(OH)2) = 1,6× 10–15. Принять, что объем полученного раствора равен 500 мл (осаждение гидроксида проводят в инертной атмосфере).
|
Произведение концентраций ионов равно: |
9. При 298 К произведение растворимости Ag2CrO4 равно 4,7× 10–12. Определить, сколько г Ag2CrO4 можно растворить в 100 л воды при этой температуре.
10. При 298 К растворимость PbS в 0,015 М водном растворе K2S равна 4,1× 10–26 моль/л. Определить Go298 процесса растворения PbS.
Растворимость. Произведение растворимости
Растворение
вещества в заданном количестве
растворителя происходит до состояния
насыщения.
Насыщенный раствор
–
раствор, находящийся в динамическом
равновесии с растворяющимся веществом.
Молярная концентрация растворенного
вещества в насыщенном растворе называется
растворимостью
этого вещества при данной температуре
Р(х) = См(х).
При растворении электролита, например,
соли, в раствор переходят не молекулы,
а ионы. В этом случае в насыщенном
растворе равновесие устанавливается
между солью в кристаллическом состоянии
и ионами, перешедшими в раствор:
СаСО3(кр)
=
Ca2++
СО32-.
Константа равновесия
этого процесса:
Крав.
=
[Ca2+]
•
[СО32-]/
[СаСО3(кр)]
Концентрация
СаСО3(кр)
является величиной постоянной, тогда
Крав.
• [СаСО3(кр)]
=
[Ca2+]
•
[СО32-]
=
ПР или ПР
=
(P(x))2.
ПР – называется
произведением растворимости
труднорастворимого электролита (ТРЭ).
При постоянной
температуре в насыщенном растворе
электролита произведение концентраций
ионов с учетом стехиометрических
коэффициентов в уравнении диссоциации
есть величина постоянная при. Значения
ПР для известных ТРЭ помещены в справочник.
Для
ТРЭ типа А2В3
=
2А+3
+
3В2-
выражение для произведения растворимости
имеет вид:
ПР
=
[Аа+]2
•
[Вв-]3
=
[2Р(х)]2
•
[3Р(х)]3
= 108
Р(х)5.
Исходя из значений
ПР можно количественно оценить условия
образования и растворения осадков,
рассчитать растворимость Р(х) и молярную
концентрацию ионов электролита в его
насыщенном растворе (см. таблицу ниже).
При увеличении
концентрации одного из ионов ТРЭ в его
насыщенном растворе (например, путем
введения хорошо растворимого электролита,
содержащего тот же ион) произведение
концентраций ионов электролита (ПК)
становится больше ПР. При этом равновесие
между твердой фазой и раствором смещается
в сторону образования осадка.
Условием
образования осадка является превышение
произведения концентраций ионов
малорастворимого
электролита
над его произведением растворимости,
т.е.
ПК
> ПР.
Например,
если в насыщенный раствор AgCI
добавить сильный
электролит KCI,
то
появление в растворе одноименного иона
(CI–)
приводит к смещению равновесия в сторону
образования
осадка (←).
Когда устанавится
новое равновесие, при котором произведение
концентраций ионов электролита вновь
становится равным ПР, то в растворе
появится осадок,
концентрация ионов Ag+
будет меньше, а концентрация ионов CI–
– больше, чем было до добавления KCI.
AgCI↓
<=> AgCI <=> Ag+
+ CI–
Осадок нас.р-р
раствор
Напротив, если в
насыщенном растворе электролита
уменьшить концентрацию одного из ионов
(например, связав его каким-либо другим
ионом), произведение концентраций ионов
будет меньше значения ПР, раствор станет
ненасыщенным, а равновесие между жидкой
фазой и осадком сместится в сторону
растворения осадка (→).
Условием
растворения
осадка малорастворимого электролита
является недонасыщение раствора, т.е
при условии, когда произведение
концентраций его ионов меньше значения
ПР
т.е.
ПК
< ПР.
Пример
1.
Растворимость Аg3РО4
в воде при
20°C равна
0.0065 г/л.
Рассчитайте значение ПР (Аg3РО4).
Решение.
Растворимость Аg3РО4
или молярная концентрация соли в
насыщенном
растворе, равна:
т
(Аg3РО4)
0.0065
Р
(Аg3РО4)
= ——————————— = ——————
=
l,6
•l0-5
моль/л
М
(Аg3РО4)
• V(z)
418,58 • 1
Диссоциации
фосфата серебра идет по уравнению:
Аg3РО4
=
3Ag+
+
РО43–.
Видно,
что из
1
моля соли образуется
3
моля ионов
Ag+
и
1
моль ионов
Р043–,
поэтому [Р043–]
=
P(x), a [Ag+]
=
3Р(х).
Отсюда находим ПР:
ПР
=
[Ag+]3
•
[РО43–]
=
(3Р)3
•
Р
= (4,8 •10-5)
3
•l,6•10–5
=
1,77
•10–18.
Пример
2.
Произведение растворимости йодида
свинца при 20°С равно
8•10–9.
Вычислить
растворимость соли (в моль/л и в г/л) при
указанной
температуре.
Решение.
Обозначим искомую растворимость через
Р
(моль/л). Тогда в насыщенном растворе
РbI2
содержится
Р
моль/л ионов Рb2+
и
2Р
моль/ л ионов
I–.Отсюда
ПР(РbI2)
=
[Рb2+]
[I–]2
= Р(2Р)2
=
4 Р3
и
Р
= (
ПР(РbI2)/4
)1/3
=
(
8
•
10-9/
4)1/3
= 1,3
10-3
моль/л.
Молярная
масса РbI2
равна
461
г/моль, поэтому растворимость РbI2,
выраженная в г/л, составит 1,3
10-3
моль/ л • 461 г/ моль = 0,6
г/л.
Пример
3.
Во сколько раз растворимость оксалата
кальция СаС2О4
в
0,1
М
растворе оксалата аммония
(NH4)2С2О4
меньше, чем в воде? Диссоциацию оксалата
аммония на ионы считать полной.
Решение.
Вычислим сначала растворимость оксалата
кальция в воде. Обозначив концентрацию
соли в насыщенном растворе через
Р
(моль/ л), можем записать:
ПР(СаС2О4)
=
[Са2+]
[С2О42-]
= Р2
.
Отсюда,
используя значение ПР(СаС2О4)=
2 10-9,
Р
=
(ПР(СаС2О4)1/2
=
( 2
10-9
)1/2
=
4,5 •
10-5
моль/л.
Теперь
найдем растворимость той же соли в
0,1
М раствора (NH4)2С2О4;
обозначим ее через
Р‘.
Концентрация ионов Са2+
в насыщенном растворе тоже будет равна
Р’,
а концентрация ионов С2О42-составит
(0,1 + Р’).
Поскольку
Р‘<<0,1,
то
величиной
Р’
по сравнению с
0,1М
можно пренебречь и считать, что [С2О42-]
= 0,1
моль/л. Тогда можно записать:
ПР(СаС2О4)
= 2
•10-9
= Р’
•
0,1
и
Р’
= 2 •
10-9/
0,1
=
2 •
10-8
моль/л.
Таким
образом, в присутствии (NH4)2С2О4
растворимость СаС2О4
уменьшилась в
4,5•10-5
/
(2•10-8)
раз,т. е. приблизительно в
2200
раз.
Пример
4.
Смешаны равные объемы
0,01
М. растворов хлорида кальция и сульфата
натрия. Образуется ли осадок сульфата
кальция?
Решение.
Найдем произведение концентраций ионов
Са2+
и
SO42-
и сравним его с произведением растворимости
сульфата кальция. Исходные молярные
концентрации растворов
CaCl2
и
Na2S04
одинаковы и равны
0,01
моль/л. Поскольку при смешении исходных
растворов общий объем раствора вдвое
возрастет, то концентрации ионов [Са2+]
и
[SО42-]
вдвое уменьшатся по сравнению с исходными.
Таким
образом, [Са2+]
=
[SО42-]
=
0,005 = 5 •
10–3
моль/л.
Находим
произведение концентраций ионов ПК
= [Са2+]
[SО42-]
=
(5 •
10–3)2
= 2,5 •
10–5.
ПР(CaSO4)
=
1,3•10–4.
Найденное значение произведения
концентрации ионов меньше этой величины;
следовательно, раствор
будет
ненасыщенным относительно сульфата
кальция, и осадок не образуется.
Для решения
задач на ПР , ПК, растворимость можно
воспользоваться таблицей, приведенной
ниже.
|
Параметры го раствора |
Тип электролита |
|||
|
АВ |
А2В |
А3В |
А2В32А+3В |
|
|
См (эл-та), моль/л |
Р |
Р |
Р |
Р |
|
См (А), моль/л |
Р |
2 Р |
3 Р |
2 Р |
|
См (В), моль/л |
Р |
Р |
Р |
3 Р |
|
Масса эл-та, г/л |
М(АВ) Р |
М(А2В) |
М(А3В) |
М(А2В3) |
|
Масса (А)эл-та, |
М(А) Р |
2М(А) Р |
3М(А) Р |
2М(А) Р |
|
Масса (В), г/л |
М(В) Р |
М(В) Р |
М(В) Р |
3М(В) Р |
|
ПР электролита |
Из справочника |
Из справочника |
Из справочника |
Из справочника |
|
ПР электролита |
Р2 |
4Р3 |
27Р4 |
108Р5 |
|
Р |
(ПР)1/2 |
(ПР/4)1/3 |
(ПР/27)1/4 |
(ПР/108)1/5 |
ЗАДАЧИ
-
Вычислить
произведение растворимости РbВr2
при 25°С,
если
растворимость соли при этой температуре
равна 1,32
•
10-2
моль/л. -
В
500
мл воды при 18°С растворяется
0,0166
г
Ag2CrО4
.Чему
равно произведение растворимости этой
соли? -
Для
растворения
1,16
г РbI2
потребовалось
2
л воды. Найти
произведение
растворимости соли. -
Исходя
из произведения растворимости карбоната
кальция,
найти
массу СаСО3,
которая содержится в
100
мл его насыщенного
раствора. -
Вычислить
объем воды, необходимый для растворения
при
25°С
1
г
BaSО4. -
Рассчитайте
молярную концентрацию ионов свинца
(Pb2+)
в
насыщенном
растворе иодида свинца. ПР
(PbJ2)
= 10-8. -
Рассчитайте
ПР соли
NiC2O4,
если в
100
мл насыщенного раствора этой соли
содержится
0,001174
г ионов никеля. -
Для
растворения
0,72
г карбоната кальция потребовалось
15
л
воды.
Вычислите ПР карбоната кальция, считая,
что объем раствора равен
объему
растворителя. -
Рассчитайте,
в каком объеме насыщенного раствора
хлорида
свинца
(II)
содержится
0,1
г ионов свинца, ПР
(PbCl2)
= l,6•10-5. -
Рассчитайте
массу кальция в виде ионов Са+2
которая находится
в
500
мл насыщенного раствора сульфата
кальция, ПР (СаSО4)
= 1,3 •
10-4. -
Рассчитайте
массу кальция в виде ионов Са+2
которая находится
в
500
мл насыщенного раствора сульфата
кальция, ПР (СаSО4)
= 1,3 •
10-4. -
Сколько
литров воды потребуется для растворения
0,1
г хлорида
серебра
для получения насыщенного раствора,
ПР
(AgCl) = 1
•
10–10
. -
Выпадет
ли осадок сульфата кальция, если к
200
мл
0,002
молярного раствора хлорида кальция
добавить
2000
мл
0,00001
молярного
раствора
сульфата калия, ПР(СаSО4)
=
10–4. -
14.
Рассчитайте, в каком объеме насыщенного
раствора содержится
0.1
г иодида серебра,
ПP(AgI)=8,3•10-17. -
15.В
насыщенном растворе хромата серебра
молярная концентрация
иона
СrО-2
равна
0.0001
моль/л. Рассчитайте ПР хромата серебра
и молярную концентрацию иона серебра
в этом растворе.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Решение расчётных задач по химии на вычисление произведения растворимости соли
Задача 559.
Растворимость СаСО3 при 35 °С равна 6,9 . 10-5 моль/л. Вычислить произведение растворимости этой соли.
Решение:
Уравнение диссоциации СаСО3 имеет вид:
СаСО3 ⇔ Са2+ + СО32-
При растворении каждого моля СаСО3 в раствор переходит 1 моль ионов Са2+ и 1 моль ионов СО32-. Следовательно, в насыщенном растворе СаСО3 содержится по 6,9 . 10-5 моль/л ионов Са2+ и СО32- (Са2+ = СО32-).
Отсюда находим произведение растворимости СаСО3:
ПР(СаСО3) = [Са2+] . [СО32-] = 6,9 . 10-5 . 6,9 . 10-5 = 4,76 . 10-9.
Ответ: 4,76 . 10-9.
Задача 560.
Вычислить произведение растворимости RbВг2 при 25 °С, если растворимость соли при этой температуре равна 1,32 . 10-2 молы/л.
Решение:
Уравнение диссоциации RbВг2 имеет вид:
RbBr2 ⇔ Rb2+ + 2Br–.
При растворении каждого моля RbВг2 в раствор переходит 1 моль ионов Rb2+ и 2 моль ионов Br–. Следовательно, в насыщенном растворе RbВг2 содержится по 1,32 . 10-2 моль/л ионов Rb2+ и (2 . 1,32 . 10-2) моль/л ионов Br–. Отсюда находим произведение растворимости RbВг2:
ПР(RbBr2) = [Rb2+] . [Br–]2 = 1,32 . 10-2 . (2 . 1,32 . 10-2)2 = 9,2 . 10-6.
Ответ: 9,2 . 10-6.
Задача 561.
В 500 мл воды при 18 °С растворяется 0,0166 г Ag2CrO4. Чему равно произведение растворимости этой соли?
Решение:
M(Ag2CrO4) = 332 г/моль.
Находим массу Ag2CrO4 в 1 л раствора из пропорции:
Рассчитаем молярную концентрацию раствора по формуле: 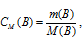
При растворении каждого моля Ag2CrO4 в раствор переходит 2 моля ионов Ag+ и 1 моль ионов CrO42-. Следовательно, в насыщенном растворе Ag2CrO4 концентрации ионов составляют: [Ag+] = (2 . 1 . 10-4) моль/л; [CrO42-] = 1 . 10-4 моль/л.
Отсюда
ПР(Ag2CrO4) = [Ag+]2 . [CrO42-] = (2 . 1 . 10-4)2 . 1 . 10–4 = 4 . 10-12.
Ответ: 4 . 10-12.
Задачи 562.
Для растворения 1,16 г PbI2 потребовалось 2 л воды. Найти произведение растворимости соли.
Решение:
M(PbI2) = 461,008 г/моль.
Находим массу PbI2 в 1 л раствора из пропорции:
2 : 1,16 = 1 : x; x = (1 . 1,16)/2 = 0,58 г.
Рассчитаем молярную концентрацию насыщенного раствора по формуле 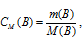
При растворении каждого моля PbI2 в раствор переходит 2 моля ионов I– и 1 моль ионов Pb2+. Следовательно, в насыщенном растворе PbI2 концентрации ионов составляют: [I–] = (2 . 1,26 . 10-3) моль/л; [Pb2+] = 1,26 . 10-3 моль/л.
Отсюда
ПР(PbI2) = [Pb2+] . [I–]2 = 1,26 . 10-3 . (2 . 1,26 . 10–3)2 = 8 . 10-9.
Ответ: 8 . 10-9.
Допустим, у меня соль AgBr, известно ее произведение растворимости. Надо найти ее растворимость. Здесь рассуждаю так: AgBrAg^+ + Br^-, ПР=[Ag^+][br^-]. Здесь получается, что концентрации Ag^+, Br^- и AgBr ( как я поняла, [AgBr] и есть ее растворимость) равны (потому, что объем равный, следовательно, имеем равные концентрации. Или нет? Подскажите, пожалуйста). А что делать, если те же условия, но дана соль PbCl2? Как в таком случае найти растворимость? Если можно, с ссылкой на формулы. Заранее спасибо.
. Из уравнения диссоциации малорастворимого электролита:
. PbCl2 Pb^(2+) + 2Cl^(-), – видно, что при диссоциации 1 моль соли образуется столько же катиона и вдвое больше анионов.
. Т.о. концентрация катиона равна молярной концентрации растворённой соли (условно говоря, растворимости в единицах молярной концентрации), а концентрация аниона в два раза больше.
.
. В сухом остатке, ПРсоли = Cсоли • (2Ссоли)^2 = 4Ссоли^3, откуда
. Ссоли составляет корень кубический из величины (ПР/4).
. В общем виде Ссоли (растворимость, моль/л) равна корень степени (m+n) из величины (ПР/(m^2•n^2)), где m и n – индексы при катионе и анионе в соли соответственно.
. С уважением
P.S. Видимо, я несколько припоздал со своим объяснением.
Изменено 14 Ноября, 2017 в 20:01 пользователем Nemo_78
Содержание:
- Растворимость электролитов
- Растворимость гидроксидов и солей
- Произведение растворимости малорастворимых электролитов
- Солевой эффект
Произведение растворимости характеризует растворимость труднорастворимого электролита при данной температуре. Из двух однотипных солей, например, CaSO 4 с ПР = 2,5∙10 –5 и BaSO 4 с ПР = 1,1∙10 –10, большей растворимостью обладает та соль, у которой ПР больше.
На странице -> решение задач по химии собраны решения задач и заданий с решёнными примерами по всем темам химии.
Растворимость электролитов
Растворимость гидроксидов и солей. Произведение растворимости малорастворимых электролитов. Влияние на растворимость одно- и разноименных ионов. Солевой эффект.
Растворимость гидроксидов и солей
Растворимость вещества определяют его равновесным содержанием в единице объема или массы растворителя или насыщенного раствора. Чаще растворимость выражают в массовых долях. Форма записи процесса растворения может отражать либо сам факт перехода в раствор
либо более детальную картину электролитической диссоциации
Растворимость солей и гидроксидов различна. Так, соли и гидроксиды щелочных металлов являются сильными электролитами и в подавляющем большинстве хорошо растворимы в воде. Хорошо растворимые основания образуют элементы II группы—барий и стронций; гидроксид кальция обладает средней растворимостью, магний и бериллий образуют малорастворимые формы гидроксидов. Основания всех остальных металлов представляют собой малорастворимые соединения.
Гидроксиды кислотного типа типично неметаллических элементов обычно хорошо растворимы. К ним относятся высшие кислоты хлора 






Соли классифицируются по растворимости весьма сложно. Ниже приведена краткая характеристика хЛори-дов, нитратов, карбонатов и сульфатов щелочных и щелочно-земельных металлов.
Из табл. 12.1 видно, что хлориды элементов I и II А-подгрупп хорошо растворимы в воде. Численное значение их растворимости находится в сложной зависимости от их состояния и положения второго элемента соли в периодической системе. Так, растворимость хлоридов щелочных металлов проходит через минимум, достигая наименьшего значения в случае КСl, а наибольшего — в случае CsCl. С энергетической точки зрения растворимость хлоридов некоторых
щелочных металлов связана с температурой следующим образом:
Из сравнения этих процессов следует, что различие в растворимости солей определяется превышением энтропии растворения CsCI над энтропией растворения KCI на 15,7 э. е., что объясняется большим размером иона цезия по сравнению с ионом калия.
Растворимость дихлоридов элементов 11 А-подгруппы иосит ионный характер. Хлориды могут быть не только безводными солями, но и кристаллогидратами с различным содержанием кристаллизационной воды. Температурная зависимость растворимости трихлоридов (например, 
Как следует из табл. 12.2 сульфаты щелочных металлов хорошо растворимы. Наличие кристаллогидратов у сульфатов лития и натрия способствует их растворимости. Однако у сульфатов щелочно-земельных металлов, расположенных в той же последовательности, растворимость резко уменьшается.
Нитраты —соли азотной кислоты, обладают высокой растворимостью (табл. 12.3), которая следует иной закономерности, чем ранее рассмотренные хлориды и сульфаты.
Из табл. 12.4 следует, что растворимость карбонатов высока только в случае щелочных металлов, кроме лития.
Напротив, карбонаты щелочно-земельных металлов и практически всех остальных металлов периодической системы—соединения малорастворимые.
Следует отметить, что соли кислые и основны
Произведение растворимости малорастворимых электролитов
Рассмотрим малорастворимые соли и гидраты, насыщенные растворы которых весьма разбавлены и потому их можно квалифицировать как идеальные. Такие вещества в своей растворенной части нацело диссоциированы на ионы, т. е. молекулярные формы соединений в растворе отсутствуют. Используем в качестве примера равновесие процесса растворения малорастворимого карбоната серебра

константа этого гетерогенного равновесия имеет вид

Исходя из стандартных значений термодинамических характеристик 







Сделав подстановку равенства (12.3) в выражение для константы равновесия (12.2), получаем
откуда находим растворимость соли, численно равную
или 
Константа равновесия растворимости малорастворимых солей и гидратов получила название произведения растворимости L. В общем виде равновесие

характеризуют произведением растворимости

Из уравнения (12.4) следует, что


Подставив концентрации (12.6) и (12.7) в уравнение
(12.5), получаем выражение для растворимости соли
Для солей, диссоциирующих на два иона, справедливо соотношение
Значения растворимости и произведения растворимости некоторых труднорастворимых солей и гидратов при 25 °С приведены в приложении XIII.
Добавление к растворам малорастворимых солей и гидратов хорошо растворимых соединений, дающих при растворении уже имеющиеся в растворе ионы, способствует уменьшению растворимости исходных солен и гидратов. Рассмотрим это явление на примере соли AgCl, для которой 





отсюда
Растворимость AgCl в растворе
что примерно в 1000 раз меньше, чем растворимость AgCl в чистой воде.
Солевой эффект
Растворимость малорастворимых солей и гидратов зависит не только от избыточного содержания в растворе одного из ионов растворяющегося образца (одноименных ионов), но также и от содержания «посторонних» ионов. Так, например, в присутствии





где у— коэффициент активности ионов, для нахождения которого можно использовать уравнение
здесь 

Используя эти соотношения, можно решать практические задачи на растворимость с учетом различных «посторонних» ионов, содержащихся в растворе.
Задача 1. В 1 л раствора содержится 500 мг 

осадок. Малорастворимая соль какого из указанных катионов выпадает в осадок первой?
Прежде всего находим концентрации содержащихся в растворе катионов
При добавлении к этому раствору легкорастворимой соли 
Концентрация ионов 

а для выпадения в осадок соли
Поскольку минимальной величиной концентрации, необходимой для начала осаждения, характеризуется 
Задача 2. Избыток твердой малорастворимой соли 


В этой системе возможна реакция обмена
или

В результате кроме 



Коистаита равновесия (12.8) может быть записана следующим образом:
Отсюда
Услуги по химии:
- Заказать химию
- Заказать контрольную работу по химии
- Помощь по химии
Лекции по химии:
- Основные понятия и законы химии
- Атомно-молекулярное учение
- Периодический закон Д. И. Менделеева
- Химическая связь
- Скорость химических реакций
- Растворы
- Окислительно-восстановительные реакции
- Дисперсные системы
- Атомно-молекулярная теория
- Строение атома в химии
- Простые вещества
- Химические соединения
- Электролитическая диссоциация
- Химия и электрический ток
- Чистые вещества и смеси
- Изменения состояния вещества
- Атомы. Молекулы. Вещества
- Воздух
- Химические реакции
- Закономерности химических реакций
- Периодическая таблица химических элементов
- Относительная атомная масса химических элементов
- Химические формулы
- Движение электронов в атомах
- Формулы веществ и уравнения химических реакций
- Химическая активность металлов
- Количество вещества
- Стехиометрические расчёты
- Энергия в химических реакциях
- Вода
- Необратимые реакции
- Кинетика
- Химическое равновесие
- Разработка новых веществ и материалов
- Зеленая химия
- Термохимия
- Правило фаз Гиббса
- Диаграммы растворимости
- Законы Рауля
- Растворы электролитов
- Гидролиз солей и нейтрализация
- Электрохимические процессы
- Электрохимия
- Кинетика химических реакций
- Катализ
- Строение вещества в химии
- Строение твердого тела и жидкости
- Протекание химических реакций
- Комплексные соединения
Лекции по неорганической химии:
- Важнейшие классы неорганических соединений
- Водород и галогены
- Подгруппа кислорода
- Подгруппа азота
- Подгруппа углерода
- Общие свойства металлов
- Металлы главных подгрупп
- Металлы побочных подгрупп
- Свойства элементов первых трёх периодов периодической системы
- Классификация неорганических веществ
- Углерод
- Качественный анализ неорганических соединений
- Металлы и сплавы
- Металлы и неметаллы
- Производство металлов
- Переходные металлы
- Элементы 1 (1А), 2 IIA и 13 IIIA групп и соединения
- Элементы 17(VIIA), 16(VIA) 15(VA), 14(IVA) групп и их соединения
- Важнейшие S -элементы и их соединения
- Важнейшие d элементы и их соединения
- Важнейшие р-элементы и их соединения
- Производство неорганических соединений и сплавов
- Главная подгруппа шестой группы
- Главная подгруппа пятой группы
- Главная подгруппа четвертой группы
- Первая группа периодической системы
- Вторая группа периодической системы
- Третья группа периодической системы
- Побочные подгруппы четвертой, пятой, шестой и седьмой групп
- Восьмая группа периодической системы
- Водород
- Кислород
- Озон
- Водород
- Галогены
- Естественные семейства химических элементов и их свойства
- Химические элементы и соединения в организме человека
- Геологические химические соединения
Лекции по органической химии:
- Органическая химия
- Углеводороды
- Кислородсодержащие органические соединения
- Азотсодержащие органические соединения
- Теория А. М. Бутлерова
- Соединения ароматического ряда
- Циклические соединения
- Карбонильные соединения
- Амины и аминокислоты
- Химия живого вещества
- Синтетические полимеры
- Органический синтез
- Элементы 14(IVA) группы
- Азот и сера
- Растворы кислот и оснований