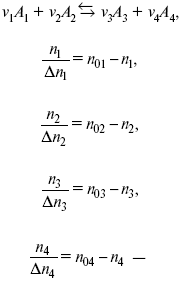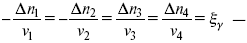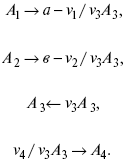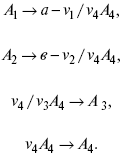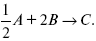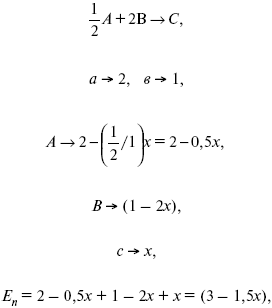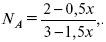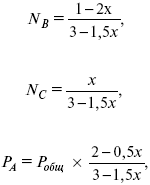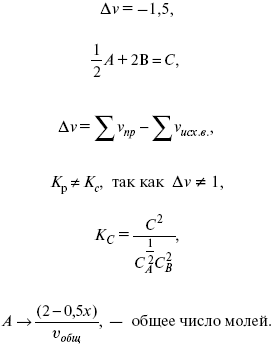Равновесный
состав системы, если известен начальный
состав, можно рассчитать, применяя закон
действующих масс и составляя уравнения
материального баланса. Например, для
гетерогенной реакции aA(г)+bB(г)+
dD(к)=eE(г)
(1.24)
алгоритм расчета
может быть следующий.
-
Расчет
Кр
или Кс
реакции для заданной температуры по
уравнениям (1.21) и (1.20) или(1.21а). -
Составление
уравнений материального баланса с
учетом стехиометрии реакции и условий
задачи. В соответствии с уравнением
реакции (1.24) для получения e
молей вещества Е(г) расходуется a
молей вещества А(г) и b
молей вещества В(г). Соответственно для
получения x
молей Е требуется xa/e
молей вещества А и xb/e
молей вещества В. Количества молей
исходных веществ при равновесии равны
количеству молей в начале реакции за
вычетом количества прореагировавших
молей до установления равновесия.
Количества молей продуктов по достижению
равновесия равны количеству молей
продуктов в начале реакции (часто оно
равно нулю) плюс количество молей
образовавшихся в результате реакции
к моменту достижения равновесия. Выше
изложенное удобно представить в виде
таблицы
|
Компонент |
А |
В |
Е |
|
Нач.состав(моль) |
n0A |
n0B |
n0E |
|
Прореагировало (образовалось)моль |
∆nА |
∆nB |
∆nЕ |
|
Равновесный |
n0A |
n0B |
n0E |
-
Подстановка
полученных выражений для nравн
в (1.19а).
Имеем
Кр=
(n0E
+ x
)e/[(
n0A
– xa/e)a(n0B
– xb/e)b](P0/Σniравн)∆ν
(1.25),
где
Σni
=(n0A–
xa/e)+(
n0B
– xb/e)
+ (n0E
+ x)
-
Решение
данного уравнения относительно х
и нахождение равновесного состава.
Если по условию
заданы начальные концентрации или
начальные парциальные давления
компонентов и реакция идет при сохранении
постоянного объема реакционной смеси,
то в соответствующие строки таблицы
записывают молярные концентрации или
парциальные давления компонентов.
|
Компонент |
А |
В |
Е |
|
Нач.концентрации,моль/л (парц.давления,отн.ед) |
с0A (р0A) |
с0B (р0B) |
с0E (р0E) |
|
Изменение (парц.давления,отн.ед.) |
∆сА (∆рА |
∆сB (∆рB |
∆сЕ (∆рЕ |
|
Равновесные (равн.парц.давления) |
с0A (р0A |
с0B (р0B |
с0E (р0E |
После подстановки
полученных выражений для равновесных
концентраций и давлений в (1.18) и (1.19)
имеем
Кр=
(р0E
+ x
)e/[(
р0A
– xa/e)a(р0B
– xb/e)b]
(1.26)
Кс=
(с0E
+ x
)e/[(
с0A
– xa/e)a(с0B
– xb/e)b]
(1.27)
Уравнения
решают относительно х
и рассчитывают либо равновесные
концентрации, либо равновесные давления.
В последнем случае сумма равновесных
парциальных давлений равна общему
давлению в системе по достижению
равновесия Ркон,
а сумма начальных парциальных давлений
равна общему давлению в начале реакции
Рнач.
Сравнив одно и другое, можно узнать, как
изменилось давление в системе в результате
реакции.
Пример
11. Реакцию
С(к) + СО2(г)
= 2СО(г) проводят при 1000 К при постоянном
давлении 2атм. Определить равновесный
состав системы, если в начале реакции
система состояла из 5 молей СО2
и 1 кг углерода, а продукт отсутствовал.
Какая масса углерода вступила в реакцию?
Решение.
Используем значение Кр
1000 = 1,039 из
Примера 8. Примем, что в результате
протекания реакции до установления
равновесия прореагировало х
молей СО2,
следовательно, осталось (5 – х)
молей СО2,
при этом в соответствии с уравнением
реакции в реакцию также вступило х
молей углерода и образовалось 2х
молей СО. Подставляем эти выражения для
равновесных молей СО2
и СО в уравнение (1.25), учитывая, что
вещества в твердом состоянии не входят
в выражение для константы равновесия:
Кр
= [(2х)2/(5-х)].[2/(5-x
+2x)]1
= 1,039. Решая
относительно х,
получаем удовлетворяющее условию
значение х
= 1,7 моль. Таким образом, при равновесии
число молей СО2
равно 5-1,7=3,3, а равновесное число молей
СО равно 3,4. В реакцию также вступило
1,7 моля углерода, то есть 12.1,7=20,4
грамма.
Пример
12. Определите
равновесные концентрации СО2
и СО, если реакция С(к) + СО2(г)
= 2СО(г) протекает при 1000 К в закрытом
сосуде объемом 2 л, продукты в начальный
момент отсутствуют, а исходная масса
газообразного СО2
равна 44г,твердого углерода – избыток.
Оцените, как изменится давление в системе
при равновесии по сравнению с исходным.
Решение.
Рассчитаем
начальную
молярную концентрацию СО2:
44/(44.2)=0,5моль/л.
Используем
значение Кс1000=0,013,
полученное в Примере 8. Примем, что в
результате протекания реакции до
установления равновесия прореагировало
х
моль/л СО2
и образовалось в соответствии со
стехиометрией реакции 2х
моль/л СО. Тогда равновесная концентрация
СО2 составит
(0,5-х)
моль/л.
Таблица материального
баланса будет иметь очень простой вид:
|
Компонент |
С |
СО2 |
СО |
|
Нач.концентрации,моль/л |
– |
0,5 |
0 |
|
Изменение |
– |
х |
2 |
|
Равновесные |
– |
0,5 |
2 |
После подстановки
полученных выражений для равновесных
концентраций
в уравнение (1.27), имеем Кс
= (2х)2/(0,5-х)=0,013.
(Очередной раз отметим, что вещества в
твердом состоянии не входят в константу
равновесия). Решая уравнение относительно
х,
находим х=
0,0387моль/л. Таким образом, равновесная
концентрация СО равна 2.
0,0387= 0,0774моль/л, а сравнСО2
=
0,5-0,0387=0,4613 моль/л.
Найдем
исходное давление в системе: Р0
=
сRT=0,5.0,082.1000=
41атм. При равновесии Р=(2х+0,5-х)RT=44,173
атм, то есть давление увеличилось на
3,173атм, поскольку в результате реакции
увеличивается число молей газообразных
веществ.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
ВикиЧтение
Физическая химия: конспект лекций
Березовчук А В
5. Расчет равновесного состава химического равновесия
Равновесный состав можно рассчитать только для газовой системы
равновесная концентрация.
Исходная концентрация всех компонентов
Изменение каждого компонента по числу молей (или стехиометрическому коэффициенту):
??– (пробег реакции) – химическая переменная.
Она показывает изменение количества вещества по числу молей. Если реакция не началась, то ?? = 0. Если количество исходных веществ превратилось в такое же количество продуктов реакции, то ?? = 1.
3H2 + N2 = 2NH3; ??= 1,
1,5H2 + 0,5N2 = NH3; ??= 0,5,
v1 А 1 + v2А2 = v3А3+ v4А4, – газовая реакция.
Рассчитать равновесный состав по третьему компоненту при условии, что А = а моль/л; В = в моль/л.
Рассчитываем по 4 компоненту:
Задача.
Газообразные вещества реагируют по уравнению:
Общее давление в газовой смеси – Робщ, общий объем – Vоб . Рассчитать KP и Kс.
Найти парциальное давление каждого компонента.
Вещества А и В превращаются в С в количестве Х. Исходные вещества А= 2 моль, В= 1 моль.
Для того, чтобы найти парциальное давление, мы должны Роб умножить на мольную долю. Мольная доля определяется отношением числа молей каждого компонента, отнесенного к общему числу молей всех компонентов.
где En – общее число молей, участвующих в этой газовой смеси.
где NA – мольная доля А.
где РА – парциальное давление.
Расчет Kc:
?v= l – 0,5 – 2 = – 1,5,
где ?v– изменение количества молей.
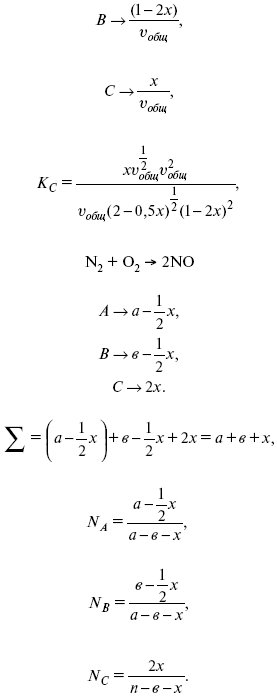
Данный текст является ознакомительным фрагментом.
Читайте также
ФИГУРЫ РАВНОВЕСИЯ ВРАЩАЮЩЕЙСЯ ЖИДКОСТИ
ФИГУРЫ РАВНОВЕСИЯ ВРАЩАЮЩЕЙСЯ ЖИДКОСТИ
Вкратце остановимся на проблеме фигур равновесия вращающейся жидкости, в разработку которой основной вклад внес А.М. Ляпунов.Ньютон показал, что под влиянием центробежных сил и взаимного притяжения своих частиц однородная
1. Понятие химического равновесия. Закон действующих масс
1. Понятие химического равновесия. Закон действующих масс
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический, термодинамический. В кинетическом – ?пр = ?обр, в
4. Расчет KP (метод Темкина-Шварцмана)
4. Расчет KP (метод Темкина-Шварцмана)
1-й способ:
термодинамический метод расчета Kp.2-й способ:
Пример. Расчет Kp для реакции PbS04 распадается на РbО и S03.
Результаты вычислений занесены в таблицу 2.Таблица 2Результаты
1. Суть физико-химического анализа
1. Суть физико-химического анализа
Задача физико-химического анализа состоит в установлении зависимости свойств равновесной системы от параметров состояния. Под параметрами состояния обычно понимают: состав, давление, температуру. Зависимости выражаются в виде
3. Физико-химические методы анализа состава сплавов
3. Физико-химические методы анализа состава сплавов
Различают термический и рентгеноструктурный анализ.Физико-химический анализ – область химии, изучающая посредством сочетания физических и геометрических методов превращения, происходящие в равновесных
5. Исследование явления высокотемпературной сверхпроводимости в оксидах сложного состава
5. Исследование явления высокотемпературной сверхпроводимости в оксидах сложного состава
В настоящее время наиболее изучены оксиды на основе Cu и Bi, в состав оксидов, помимо Cu, Bi, входят щелочно-земельные металлы – B a, C a, Sr, р.з.м. (редкоземельные) – лантаниды, Ir, известны
Глава 6 Звезда — газовый шар, находящийся в состоянии равновесия
Глава 6 Звезда — газовый шар, находящийся в состоянии равновесия
Представляется почти очевидным тот факт, что подавляющее большинство звезд не меняет своих свойств в течение огромных промежутков времени. Это утверждение совершенно очевидно для интервала времени по
РАСЧЕТ РИСКОВ
РАСЧЕТ РИСКОВ
В идеале одним из первых шагов должен быть расчет рисков. Иногда мы, люди, просто неверно оцениваем вероятности. Когда журналист Джон Оливер расспрашивал Уолтера Вагнера, одного из истцов в деле против БАКа, о черных дырах, то Вагнер полностью потерял
ВЫБОР ПРОЦЕССА ХИМИЧЕСКОГО РАЗДЕЛЕНИЯ
ВЫБОР ПРОЦЕССА ХИМИЧЕСКОГО РАЗДЕЛЕНИЯ
8.20. Задача заключается в химическом выделении плутония с дневной производительностью, скажем, в несколько граммов из нескольких тысяч граммов урана, загрязненного большими количествами опасно радиоактивных продуктов деления,
Куприянчик
Г.Г.
Учитель
химии ГУО «Гимназия № 2 г. Пинска»
Задачи на БИС
(табличный метод: было – израсходовано – стало)
Умение
решать расчётные задачи – это важная составляющая для успешной сдачи ЦТ. И
каждому учащему для того, чтобы научиться быстро и качественно решать задачи,
необходимо их решить немалое количество. Со временем у учащихся появляется
навык решения задач несколькими способами, и чем более простой способ решения
задачи они выберут, тем быстрее решиться задача. Учителю необходимо научить,
показать различные способы решения тех или иных задач. В данной статье я
предлагаю рассмотреть табличный метод решения задач на равновесие. Такого рода
задачи я называю – задачи на БИС (было – израсходовано – стало). Данный метод
не является новым, его используют уже давно многие учителя. Однако в литературе
он не часто встречаем. Сам метод является очень удобным. Я полагаю, он будет
полезен для молодых учителей.
Задача
1. Некоторое количество азота и водорода
смешали в сосуде емкостью 3дм3 и нагрели в присутствии железного
катализатора до установления химического равновесия. Определите исходные
концентрации (моль/дм3) веществ в сосуде,
если известно, что равновесная смесь содержала 1,0 моль азота , 2,4 моль
водорода и 0,7 моль аммиака.
Решение:
1)Записываем уравнение
реакции N2+3H2=2NH3.
Решение очень удобно оформлять в виде таблицы (сначала
вносятся известные данные, затем по ходу решения заполняется таблица): стало –
это равновесные количества веществ или концентрации веществ, израсходовано –
это сколько прореагировало, было – исходные количества или концентрации.
|
N2 |
H2 |
NH3 |
|
|
Было |
1,35 |
3,45 |
— |
|
Израсходовано |
0,35 |
1,05 |
— |
|
Стало |
1,0 |
2,4 |
0,7 |
2)По уравнению реакции
находим химическое количество прореагировавшего азота: n(N2)=0,35
моль (вносим в таблицу).
3)Находим
прореагировавшее химическое количество водорода: n(H2)
= 0,35*3= 1,05 моль (вносим в таблицу).
4)Затем находим nисх(N2)=1,0+0,35=1,35
моль.
5)Находим концентрацию
исходного азота: сисх
(N2)=n/V=1,35/3=0,45моль/дм3
6)Находим сисх(H2)=3,45/3=1,15
моль/дм3 .
Ответ:
сисх
(N2)=0,45моль/дм3,
сисх(H2)=1,15
моль/дм3 .
Задача 2.В
гомогенной системе установилось равновесие:
2SO2+O2
↔ 2SO3
Равновесные химические
количества (моль) SO2,
O2
и SO3
соответственно равны 0,1, 0,2 , 0,6.
Определите исходные
химические количества SO2
и O2.
Решение
1)Записываем уравнение
реакции 2SO2+O2=2SO3.
Вносим известные значения
в таблицу и заполняем по мере решения.
|
SO2 |
O2 |
SO3 |
|
|
Было |
0,7 |
0,5 |
— |
|
Израсходовано |
0,6 |
0,3 |
— |
|
Стало |
0,1 |
0,2 |
0,6 |
2)Если SO3
образовалось n(SO3)=
0,6 моль, то значит, прореагировало n(SO2)=
0,6 моль (по уравнению реакции), а химическое количество прореагировавшего O2
по уравнению будет в 2 раза меньше nпрор(O2)=0,6/2=0,3моль.
3)Находим химическое
количество исходного SO2:
nисх(SO2)=0,1+0,6=0,7(моль),
nисхO2=0,2+0,3=0,5(моль).
Ответ: nисх(SO2)=0,7(моль),
nисхO2=0,5(моль).
Задача
3.В замкнутый сосуд поместили 6 моль H2
и 3 моль O2.
Через некоторое время установилось равновесие 2H2(г)
+ O2(г)
=2H2O
(г) и образовалась вода химическим количеством 1,5 моль. Как изменилось
давление в сосуде к моменту установления равновесия?
Решение
1)Записываем уравнение 2H2(г)
+ O2(г)
=2H2O.
Вносим в таблицу значение
количества воды и по мере решения заполняем эту таблицу.
|
H2 |
O2 |
H2O |
|
|
Было |
6 |
3 |
— |
|
Израсходовано |
1,5 |
0,75 |
— |
|
Стало |
4,5 |
2,25 |
1,5 |
2)Находим химическое
количество прореагировавшего водорода: nпрор(H2)=n(H2O);
nпрор(H2)=1,5
моль.
2)Находим химическое
количество прореагировавшего (израсходовано) кислорода: nпрор
(O2)=1,5/2=0,75
моль
3)Находим равновесные
химические количества (стало) H2
и O2;
nравн(H2)=4,5
моль
nравн(O2)=3-0,75=2,25
моль.
4) Находим исходное
количество водорода и кислорода: nисх
(смеси H2+O2)=9
моль
5)Находим
количество равновесной смеси: n2
(смеси)=4,5+2,25+1,5=8,25(моль)
6)Находим изменение
давление по количествам: ∆р = nисх(смеси)
/ n2
(смеси)= 9/8,25=1,091 (давление уменьшится), так как уменьшилось химическое
количество.
Ответ: уменьшилось
в 1,091 раза.
Задача
4.Равновесные
молярные концентрации СO, O2 и CO2 после
установления равновесия 2CO(г) + O2(г) = 2CO2(г) равны
0,3; 0,2 и 0,1 (моль/дм3) соответственно. Рассчитайте объемную долю кислорода в
исходной газовой смеси (исходная молярная концентрация CO2 равна
нулю).
Решение
1)Записываем
уравнение 2СО(г) + O2(г)
=2СO2(Г)
2)Вносим
в таблицу значение равновесных молярных концентраций веществ.
|
СО |
O2 |
СО2 |
|
|
Было |
0,4 |
0,25 |
— |
|
Израсходовано |
0,1 |
0,05 |
— |
|
Стало |
0,3 |
0,2 |
0,1 |
3)По уравнению находим молярные
концентрации прореагировавших угарного газа СО и кислорода: cпрор(CO)=c(CO2)=0,1моль/дм3,
спрор(О2)==
=0,05 (моль/дм3).
4)Затем находим
исходные молярные концентрации угарного газа и кислорода:
сисх(CO)=
cпрор(CO)
+ cравн
(СО) =0,3+0,1=0,4 (моль/дм3); сисх(О2)=
спрор(О2)+ сравн(О2)=0,2+0,05=0,25 (моль/дм3).
5) Находим мольную
долю кислорода в смеси, которая будет равна объёмной доле: если
предположить, что объём смеси равен 1 дм3, то n(O2)=0,25
моль, n(CO)=0,4
моль, мольная доля равна
ᵡ(О2)
= ᵠ = =
=
0,385.
Ответ: ᵡ (О2)=0,385.
Задача 5.В
гомогенной системе установилось равновесие:
2SO2(г)+O2(г)
↔ 2SO3(г)
Равновесная молярная
концентрация SO3
равна 0,3 моль/дм3.Рассчитай равновесную молярную концентрацию
оксида серы(II), если известно, что к
моменту установления равновесия прореагировало 60 % от начального химического
количества оксида серы(II).
Решение
1)Записываем уравнение реакции2SO2(г)+O2(г)
↔ 2SO3(г).
Вносим известные значения
в таблицу и заполняем по мере решения.
|
SO2 |
SO3 |
|
|
Было |
0,5 |
— |
|
Израсходовано |
0,3 |
— |
|
Стало |
0,2 |
0,3 |
2) Находим по уравнению
молярную концентрацию израсходованного оксида SO2:
c(SO2)=c(SO3)=0,3моль/дм3.
3)Так как SO2
к моменту установления равновесия прореагировало 60 % от начального
химического количества, находим исходную молярную концентрацию SO2:
сисх(SO2)=0,3/0,6=0,5
моль/дм3.
4) Находим равновесную
молярную концентрацию SO2:
сравн(SO2)=сисх–
сизр=0,5-0,3=0,2 моль/дм3.
Ответ: сравн(SO2)=0,2
моль/дм3.
Задание 23 в ЕГЭ по химии 2022 года – принципиально новое, вот, что написано в спецификации экзамена:
Давайте разберем, необходимую для решения задания теорию:
Обратимые реакции – это реакции, в которых при одних и тех же условиях реагенты превращаются в продукты и продукты в реагенты (в записи реакции это отражают двумя противоположно направленными стрелочками), например:
В реактор мы помещаем азот N₂ и водород H₂ (идет только прямая реакция), как только в системе появляется аммиак NH₃ – он начинает разлагаться (начинается обратная реакция).
И в какой-то момент система приходит к состоянию равновесия: сколько аммиака образовалось в прямой реакции, столько и разложилось в обратной. Значит, несмотря на то, что прямая и обратная реакции непрерывно идут – концентрации веществ остаются постоянными (равновесные концентрации).
Расчёт равновесных концентраций:
Как мы уже разобрали, понятие равновесие завязано на понятии скорости реакции, поэтому и расчет равновесных концентраций будет идти через расчет скоростей прямой и обратной реакции.
Решим задание из демо-версии:
Фраза “реактор постоянного объема” дана для вашей уверенности, что концентрация будет изменяться только в процессе химических реакций, давление и объем системы – постоянные величины, следовательно мы может оперировать концентрацией так же, как количеством вещества. И решается это задание, как стандартная расчетная задача по уравнению реакции:
Вся информация о начальной и конечной концентрации вещества известна для продукта реакции – SO₃:
Начальная концентрация C1 = 0 моль/л
Равновесная концентрация С2 = 0,4 моль/л
Ответ: 25
Реши еще одно задание самостоятельно – ответы пиши в комментарии:
23.1
В реактор постоянного объема поместили некоторое количество водорода и йода. В результате протекания обратимой реакции
H₂ + I₂ = 2 HI
В реакционной системе установилось химическое равновесие.
Используя данные, приведенные в таблице, определите равновесные концентрации H₂ (Х) и HI (Y)
Выберите из списка номера правильных ответов.
1) 0,025 моль/л
2) 0,05 моль/л
3) 0,1 моль/л
4) 0,15 моль/л
5) 0,2 моль/л
6) 0,3 моль/л