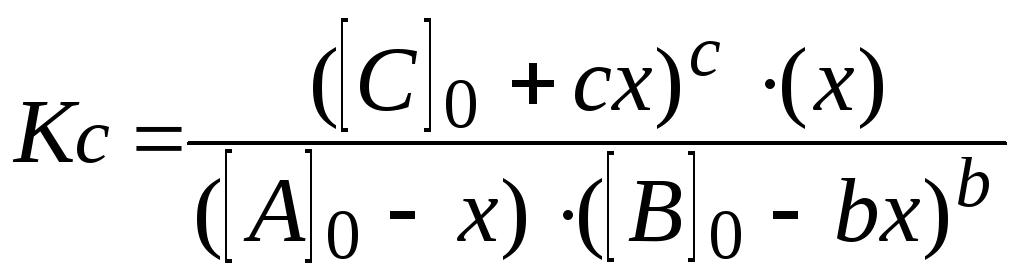Задание 23 в ЕГЭ по химии 2022 года – принципиально новое, вот, что написано в спецификации экзамена:
Давайте разберем, необходимую для решения задания теорию:
Обратимые реакции – это реакции, в которых при одних и тех же условиях реагенты превращаются в продукты и продукты в реагенты (в записи реакции это отражают двумя противоположно направленными стрелочками), например:
В реактор мы помещаем азот N₂ и водород H₂ (идет только прямая реакция), как только в системе появляется аммиак NH₃ – он начинает разлагаться (начинается обратная реакция).
И в какой-то момент система приходит к состоянию равновесия: сколько аммиака образовалось в прямой реакции, столько и разложилось в обратной. Значит, несмотря на то, что прямая и обратная реакции непрерывно идут – концентрации веществ остаются постоянными (равновесные концентрации).
Расчёт равновесных концентраций:
Как мы уже разобрали, понятие равновесие завязано на понятии скорости реакции, поэтому и расчет равновесных концентраций будет идти через расчет скоростей прямой и обратной реакции.
Решим задание из демо-версии:
Фраза “реактор постоянного объема” дана для вашей уверенности, что концентрация будет изменяться только в процессе химических реакций, давление и объем системы – постоянные величины, следовательно мы может оперировать концентрацией так же, как количеством вещества. И решается это задание, как стандартная расчетная задача по уравнению реакции:
Вся информация о начальной и конечной концентрации вещества известна для продукта реакции – SO₃:
Начальная концентрация C1 = 0 моль/л
Равновесная концентрация С2 = 0,4 моль/л
Ответ: 25
Реши еще одно задание самостоятельно – ответы пиши в комментарии:
23.1
В реактор постоянного объема поместили некоторое количество водорода и йода. В результате протекания обратимой реакции
H₂ + I₂ = 2 HI
В реакционной системе установилось химическое равновесие.
Используя данные, приведенные в таблице, определите равновесные концентрации H₂ (Х) и HI (Y)
Выберите из списка номера правильных ответов.
1) 0,025 моль/л
2) 0,05 моль/л
3) 0,1 моль/л
4) 0,15 моль/л
5) 0,2 моль/л
6) 0,3 моль/л
Как вычислить равновесную концентрацию
В ходе химической реакции устанавливается равновесие, когда скорость прямой реакции (в ходе которой исходные вещества превращаются в продукты) становится равной скорости обратной реакции (когда продукты превращаются в исходные вещества). Концентрации всех этих веществ тогда называются равновесными.

Инструкция
В первую очередь вспомните, что такое константа равновесия. Это – величина, характеризующая отношение концентраций (или парциальных давлений) продуктов реакции к концентрациям исходных веществ. Например, если реакция протекает по схеме: А + В = С + D, то Кр = [C][D]/[A][B].
Если же схема протекания реакции такая: 2А + В = 2С, то Кр вычисляется по такой формуле:[C]^2/[B][A]^2. То есть индексы превращаются в показатель степени, в которую нужно возвести концентрацию того или иного компонента.
Рассмотрите пример. Предположим, протекает та самая первая реакция: А + B = C + D. Требуется определить равновесные концентрации всех компонентов, если известно, что начальные концентрации исходных веществ А и В были равны 2 моль/литр, а константа равновесия может быть принята за 1.
Снова запишите формулу константы равновесия для этого конкретного случая: Кр = [C][D]/[A][B]. Учитывая, что Кр = 1, получите: [C][D] = [A][B].
Начальные концентрации веществ А и В вам известны (заданы по условиям задачи). Начальные концентрации продуктов реакции С и D были равны 0, а потом увеличились до неких равновесных значений. Обозначьте равновесную концентрацию вещества С за х, тогда равновесная концентрация вещества А (из которого образовалось С) будет равна (2-х).
Поскольку схема реакции свидетельствует, что из 1 моля вещества А образуется 1 моль вещества С, а из 1 моля вещества В – 1 моль вещества D, то, соответственно, равновесная концентрация D также будет = х, а равновесная концентрация В = (2-х).
Подставив эти величины в формулу, получите: (2-х) (2-х) = х^2. Решив это уравнение, получите: 4х = 4, то есть, х = 1.
Следовательно, равновесные концентрации продуктов реакции C и D равны 1 моль/литр. Но поскольку равновесные концентрации исходных веществ А и В вычисляются по формуле (2-х), то и они также будут равны 1 моль/литр. Задача решена.
Источники:
- Обратимые и необратимые процессы
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Зная
величины констант равновесия и используя
стехиометрические соотношения реакции
(закон сохранения массы), рассчитывают
равновесный состав продуктов по
следующей схеме.
-
Пишут
уравнение реакции.
2.
Пишут под формулами уравнения начальные
концентрации исходных веществ (в
моль/л). Если начальные концентрации
продуктов реакции не оговариваются в
условии задачи, они обычно принимаются
равными нулю.
3.
Принимают, что в ходе реакции до состояния
равновесия прореагировало x
моль/л какого-либо вещества. Обычно за
x
принимают изменение концентрации того
реагента, стехиометрический коэффициент
при котором в уравнении реакции
наименьший, чтобы избежать дробных
коэффициентов при неизвестном x.
Например, прореагировало x
моль/л вещества А.
4.
По уравнению реакции определяют изменение
концентраций других веществ.
5.
Определяют равновесные концентрации
веществ. При протекании реакции в прямом
направлении до состояния равновесия
происходит уменьшение концентраций
исходных веществ и увеличение концентраций
продуктов реакции.
А
+ b
В
c
С + D
начальное
состояние
А0
В0
С0
0
число молей
по уравнению
1 b
c
1
изменение
концентраций
x
b
x
c
x
x
равновесное
состояние
А0
–
x
В0
–
bx
С0
+ c
x
x
6.
Пишут выражение закона действующих
масс. Подставляют в него найденные
значения равновесных концентраций.
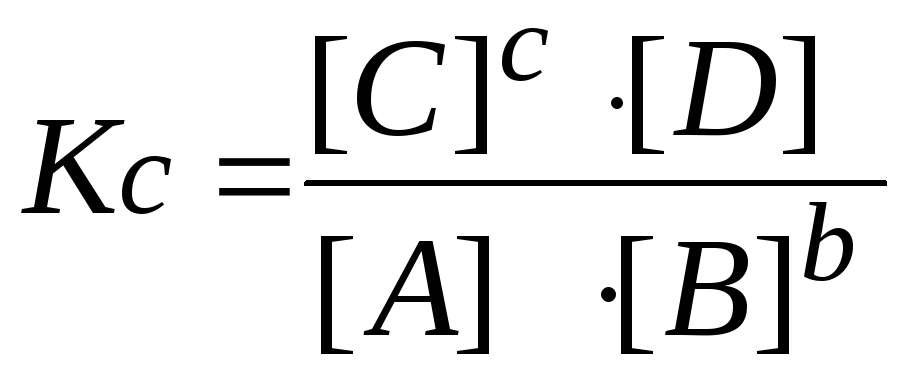
7.
Решают уравнение. При этом учитывают,
что отрицательный корень не имеет
физического смысла, и убыль концентрации
исходного вещества не может быть больше
величины самой концентрации (начальная
концентрация исходного вещества не
может быть меньше его остаточной
равновесной концентрации).
-
Находят
равновесные концентрации.
А
= А0–
x;
B
= B0
–
b
x;
C
= С0
+
cx;
D
=
x.
4. Смещение химического равновесия. Принцип Ле Шателье
Истинное
химическое равновесие является
динамическим и подвижным: изменение
внешних условий (температуры, давления,
концентраций реагирующих веществ) ведет
к смещению равновесия в сторону прямой
или обратной реакции.
Характер
влияния внешних факторов на равновесные
системы выражает принцип Ле Шателье.
Если
на систему, находящуюся в состоянии
равновесия, оказать внешнее воздействие,
то смещение равновесия происходит в
сторону той реакции (прямой или обратной),
которая ослабляет эффект внешнего
воздействия.
4.1. Изменение концентраций
Равновесное
состояние в системе
H2
(г)
+ I2
(г)
2 HI
(г)
характеризуется
(для одной и той же температуры) константой
равновесия:
.
Если,
например, в систему добавить водород,
т.е. увеличить его концентрацию, то
скорость прямой реакции увеличится (в
соответствии с законом действующих
масс):
пр
= kпр
[H2]
[I2],
пр
обр,
равновесие
сместится вправо. Концентрация
йодоводорода будет увеличиваться, а
концентрация водорода и йода будет
уменьшаться. Процесс будет протекать
до тех пор, пока не установится новое
равновесие. Новые равновесные концентрации
всех компонентов будут другими, но
соотношение между ними, определяемое
константой равновесия, останется
постоянным.
Если
в систему ввести дополнительное
количество йодоводорода, то скорость
обратной реакции увеличится:
обр
=
kобр
[HI]
2
,
обр
пр
,
равновесие
сместится влево.
В
соответствии с принципом Ле Шателье:
–
при увеличении концентрации какого-либо
из веществ, участвующих в равновесии,
равновесие смещается в сторону расхода
этого вещества;
–
при уменьшении концентрации какого-либо
из веществ равновесие смещается в
сторону образования этого вещества.
Удаление
из системы продуктов (или продукта)
реакции ведет к смещению равновесия
в сторону прямой реакции, а уменьшение
концентрации
исходных (или исходного) веществ,
приводит к сдвигу равновесия в направлении
обратной реакции.
Соседние файлы в папке Кинетика_лекции
- #
- #
- #
- #
Вычислить равновесные концентрации
Реакция протекает по уравнению A + B = 2C. Вычислите равновесные концентрации реагирующих веществ, если исходные концентрации веществ А и В соответственно равны 0,5 и 0,7 моль/л, а константа равновесия реакции 50.
Решение задачи
К моменту равновесия концентрации веществ А и В понизятся, а концентрация вещества С увеличится. На каждый моль веществ А и В образуется 2 моль вещества С; поэтому, если понижение концентрации веществ А и В обозначить через х моль, то увеличение концентрации вещества С будет равно 2х моль. Вычислить равновесные концентрации.
Равновесные концентрации реагирующих веществ будут:
[А] = 0,5 –х (моль/л);
[В] = 0,7 – х (моль/л);
[С] = 2х (моль/л).
Где:
K – константа химического равновесия;
[С], [А], [В] – равновесные концентрации соответственно азота, водорода, аммиака, моль/л.
Получаем:
К = 4 х2 /(0,5 — х) (0,7-х) = 50
46 х2 – 60х + 17,5 = 0.
Решая это уравнение, получаем:
х1 = 0,86;
х2 = 0,44.
По условию задачи справедливо значение х2. Вычислить равновесные концентрации. Отсюда равновесные концентрации реагирующих веществ равны:
[А] = 0,5 –0,44 = 0,06 (моль/л);
[В] = 0,7 – 0,44 = 0,26 (моль/л);
[С] = 2 ⋅ 0,44 = 0,88 (моль/л).
Ответ:
равновесная концентрация вещества А равна 0,06 моль/л;
равновесная концентрация вещества В равна 0,26 моль/л;
равновесная концентрация вещества С равна 0,88 моль/л.
Похожие задачи
Расчет равновесных концентраций веществ, константы равновесия реакции
Определение равновесных концентраций веществ
Задача 52.
Константа равновесия реакции FeO(тв.) + CO(г) = Fe(тв.) + CO2(г) при некоторой температуре равна 0,5. Найти равновесные концентрации CO и CO2, если начальные концентрации этих веществ составляли: [CO] = 0,05 моль/л, [CO2] = 0,01 моль/л.
Решение:
Уравнение реакции имеет вид:
FeO(тв.) + CO(г) = Fe(тв.) + CO2(г)
К = 0,5.
Начальные концентрации [CO] = 0,05 моль/л; [CO2] = 0,01 моль/л. По мере течения реакции концентрация исходных веществ уменьшается, а концентрация продуктов реакции увеличивается. Изменение концентрации идет в строгом соответствии со стехиометрическими соотношениями, которые берутся из уравнения реакции, примем изменение концентрации [СО] до равновесия равному “х” моль/л тогда в момент равновесия его концентрация станет (0,05 – х), а у СО2 увеличится на х, т.е. будет (0,01 + х). Коэффициенты в уравнении одинаковы n(CO) = n(CO2). Для момента равновесия концентрации взяты равновесны.
Запишем выражение константы равновесия для реакции, получим:
К = [CO2]/[CO];
0,5 = (0,01 + х)/(0,05 – х);
0,01 + х = 0,5(0,05 – х);
0,01 + x = 0,025 – 0,5x;
x + 0,5x = 0,025 – 0,01;
1,5x = 0,015;
x = 0,01.
Таким образом, x = 0,01моль/л. Отсюда в момент равновесия равновесные концентрации будут равны:
[CO2]равн. = 0,01 + 0,01 = 0,02 моль/л;
[CO]равн. = 0,05 – 0,01 = 0,04 моль/л.
Ответ: [CO2]равн. = 0,02 моль/л; [CO]равн. = 0,04 моль/л.
Расчет константы равновесия
Задача 53.
Реакция идет по уравнению: А + 2В = С + D. К моменту равновесия прореагировало 20% вещества В. Чему равна константа равновесия, если исходные концентрации (моль/л) веществ А = 3; В = 4?
Решение:
Согласно условию, прореагировало 20% вещества (В). Это составило 4 * 0,2 = 0,8 моль. Исходя из стехиометрических коэффициентов, расходование 0,8 молей идет на получение по 0,4 молей веществ (С) и (D). Столько же израсходовано вещества (А). Если начальные концентрации веществ (А) и (В) 3 и 4 моль соответственно, то равновесная их концентрация составила:
вещества (А) – 3 – 0,4 = 2,6 моль/л;
вещества (В) – 4 – 0,8 = 3,2 моль/л.
Выражение константы равновесия данной реакции:
К = [С][D]/[А][В]2 = [0,4][0,4]/[2,6][3,2]2 = 0,16/26,624 = 6 . 10-3 моль/л.
Ответ: К = 6 . 10-3 моль/л.