| Ядерная физика |
|---|
 |
| Атомное ядро · Радиоактивный распад · Ядерная реакция · Термоядерная реакция |
|
Основные термины Атомное ядро · Изотопы · Изобары · Капельная модель ядра · Период полураспада · Массовое число · Составное ядро · Цепная ядерная реакция · Ядерное эффективное сечение |
|
Распад ядер Закон радиоактивного распада · Альфа-распад · Бета-распад · Кластерный распад |
|
Сложный распад Электронный захват · Двойной бета-распад · Двойной электронный захват · Внутренняя конверсия · Изомерный переход |
|
Излучения Ионизирующее излучение · Нейтронный распад · Позитронный распад · Протонный распад · Гамма излучение · Фоторасщепление |
|
Захваты Электронный захват · Нейтронный захват (r-процесс · s-процесс) · Протонный захват (p-процесс · rp-процесс) · Нейтронизация |
|
Деление ядра Спонтанное деление |
|
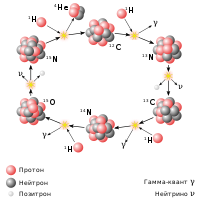
Нуклеосинтез Первичный нуклеосинтез · Протон-протонный цикл · CNO-цикл · Тройная гелиевая реакция · Гелиевая вспышка · Ядерное горение углерода · Углеродная детонация · Ядерное горение кислорода · Ядерное горение неона · Ядерное горение кремния · Реакции скалывания |
| См. также: Портал:Физика |
А́томное ядро́ — центральная часть атома, в которой сосредоточена основная его масса (более 99,9 %). Ядро заряжено положительно, заряд ядра определяет химический элемент, к которому относят атом. Размеры ядер различных атомов составляют несколько фемтометров, что более чем в 10 тысяч раз меньше размеров самого атома. Атомные ядра изучает ядерная физика.
Атомное ядро состоит из нуклонов — положительно заряженных протонов и нейтральных нейтронов, которые связаны между собой при помощи сильного взаимодействия. Протон и нейтрон обладают собственным моментом количества движения (спином), равным 
Атомное ядро, рассматриваемое как класс частиц с определённым числом протонов и нейтронов, принято называть нуклидом.
В некоторых редких случаях могут образовываться короткоживущие экзотические атомы, у которых вместо нуклона ядром служат иные частицы.
Количество протонов в ядре называется его зарядовым числом 



Как и любая квантовая система, ядра могут находиться в метастабильном возбуждённом состоянии, причём в отдельных случаях время жизни такого состояния исчисляется годами. Такие возбуждённые состояния ядер называются ядерными изомерами[1][2][3].
История[править | править код]
В 1911 году Резерфорд в своём докладе «Рассеяние α- и β-лучей и строение атома» в философском обществе Манчестера заявил[4]:
Рассеяние заряженных частиц может быть объяснено, если предположить такой атом, который состоит из центрального электрического заряда, сосредоточенного в точке и окружённого однородным сферическим распределением противоположного электричества равной величины. При таком устройстве атома α- и β-частицы, когда они проходят на близком расстоянии от центра атома, испытывают большие отклонения, хотя вероятность такого отклонения мала.
Таким образом Резерфорд открыл атомное ядро, с этого момента и ведёт начало ядерная физика, изучающая строение и свойства атомных ядер.
После обнаружения стабильных изотопов элементов, ядру самого лёгкого атома была отведена роль структурной частицы всех ядер. С 1920 года ядро атома водорода имеет официальный термин — протон. В 1921 году Лиза Мейтнер предложила[5] первую, протон-электронную, модель строения атомного ядра, согласно которой оно состоит из протонов, электронов и альфа-частиц[6]:96. Однако в 1929 году произошла «азотная катастрофа» — В. Гайтлер и Г. Герцберг установили[7], что ядро атома азота подчиняется статистике Бозе — Эйнштейна, а не статистике Ферми — Дирака, как предсказывала протон-электронная модель[8][9]:374. Таким образом, эта модель вступила в противоречие с экспериментальными результатами измерений спинов и магнитных моментов ядер[10]. В 1932 году Джеймсом Чедвиком была открыта новая электрически нейтральная частица, названная нейтроном. В том же году Иваненко[11] и, ссылаясь на работу первого[12], Гейзенберг выдвинули гипотезу о протон-нейтронной структуре ядра. В дальнейшем, с развитием ядерной физики и её приложений, эта гипотеза была полностью подтверждена[13].
Теории строения атомного ядра[править | править код]
В процессе развития физики выдвигались различные гипотезы строения атомного ядра; тем не менее, каждая из них способна описать лишь ограниченную совокупность ядерных свойств. Некоторые модели могут взаимоисключать друг друга.
Наиболее известными являются следующие:
- Капельная модель ядра — предложена в 1936 году Нильсом Бором.
- Оболочечная модель ядра — предложена в 30-х годах XX века.
- Обобщённая модель Бора — Моттельсона
- Кластерная модель ядра
- Модель нуклонных ассоциаций
- Оптическая модель ядра
- Сверхтекучая модель ядра
- Статистическая модель ядра
Ядерно-физические характеристики[править | править код]
Зарядовым числом 


Заряд[править | править код]
Число протонов в ядре 
Впервые заряды атомных ядер определил Генри Мозли в 1913 году. Свои экспериментальные наблюдения учёный интерпретировал зависимостью длины волны рентгеновского излучения от некоторой константы 
, где


Из чего Мозли сделал вывод, что найденная в его опытах константа атома, определяющая длину волны характеристического рентгеновского излучения и совпадающая с порядковым номером элемента, может быть только зарядом атомного ядра, что стало известно под названием закон Мозли[2].
Масса[править | править код]
Из-за разницы в числе нейтронов 

Кроме того, в ядерной физике часто используется энергетический эквивалент массы. Согласно соотношению Эйнштейна, каждому значению массы 
, где
— скорость света в вакууме.
Соотношение между а. е. м. и её энергетическим эквивалентом в джоулях:
,
а так как 1 электронвольт = 1,602176⋅10−19 Дж, то энергетический эквивалент а. е. м. в МэВ равен[1][3]:
.
Радиус[править | править код]
Анализ распада тяжёлых ядер уточнил оценку Резерфорда[сн 3] и связал радиус ядра 

, где
— константа.
Так как радиус ядра не является чисто геометрической характеристикой и связан прежде всего с радиусом действия ядерных сил, то значение 



Моменты ядра[править | править код]
Как и составляющие его нуклоны, ядро имеет собственные моменты.
Спин[править | править код]
Поскольку нуклоны обладают собственным механическим моментом, или спином, равным 

Несмотря на то, что число нуклонов в ядре может быть очень велико, спины ядер обычно невелики и составляют не более нескольких 
Магнитный момент[править | править код]
Измерения спинов стали возможными благодаря наличию непосредственно связанных с ними магнитных моментов. Они измеряются в магнетонах и у различных ядер равны от −2 до +5 ядерных магнетонов. Из-за относительно большой массы нуклонов магнитные моменты ядер очень малы по сравнению с магнитными моментами электронов, поэтому их измерение гораздо сложнее. Как и спины, магнитные моменты измеряются спектроскопическими методами, наиболее точным является метод ядерного магнитного резонанса.
Магнитный момент чётно-чётных пар, как и спин, равен нулю. Магнитные моменты ядер с непарными нуклонами образуются собственными моментами этих нуклонов и моментом, связанным с орбитальным движением непарного протона[10].
Электрический квадрупольный момент[править | править код]
Атомные ядра, спин которых больше или равен единице, имеют отличные от нуля квадрупольные моменты, что говорит об их не точно сферической форме. Квадрупольный момент имеет знак плюс, если ядро вытянуто вдоль оси спина (веретенообразное тело), и знак минус, если ядро растянуто в плоскости, перпендикулярной оси спина (чечевицеобразное тело). Известны ядра с положительными и отрицательными квадрупольными моментами. Отсутствие сферической симметрии у электрического поля, создаваемого ядром с ненулевым квадрупольным моментом, приводит к образованию дополнительных энергетических уровней атомных электронов и появлению в спектрах атомов линий сверхтонкой структуры, расстояния между которыми зависят от квадрупольного момента[2].
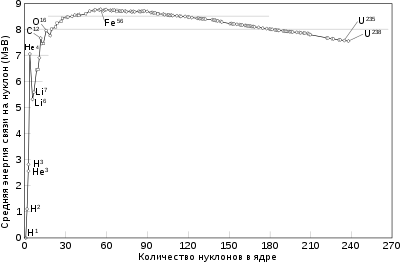
Энергия связи[править | править код]
Большая энергия связи нуклонов, входящих в ядро, говорит о существовании ядерных сил, поскольку известные гравитационные силы слишком малы, чтобы преодолеть взаимное электростатическое отталкивание протонов в ядре. Связь нуклонов осуществляется чрезвычайно короткодействующими силами, которые возникают вследствие непрерывного обмена частицами, называемыми пи-мезонами, между нуклонами в ядре.
Экспериментально было обнаружено, что для всех стабильных ядер масса ядра меньше суммы масс составляющих его нуклонов, взятых по отдельности. Эта разница называется дефектом массы или избытком массы и определяется соотношением:
,
где 


Согласно принципу эквивалентности массы и энергии дефект массы представляет собой массу, эквивалентную работе, затраченной ядерными силами, чтобы собрать все нуклоны вместе при образовании ядра. Эта величина равна изменению потенциальной энергии нуклонов в результате их объединения в ядро.
Энергия, эквивалентная дефекту массы, называется энергией связи ядра и равна:
,
где 
Другим важным параметром ядра является энергия связи, приходящаяся на один нуклон ядра, которую можно вычислить, разделив энергию связи ядра на число содержащихся в нём нуклонов:
Эта величина представляет собой среднюю энергию, которую нужно затратить, чтобы удалить один нуклон из ядра, или среднее изменение энергии связи ядра, когда свободный протон или нейтрон поглощается в нём.
Как видно из поясняющего рисунка, при малых значениях массовых чисел удельная энергия связи ядер резко возрастает и достигает максимума при 



Такой характер поведения средней энергии связи указывает на свойство ядерных сил достигать насыщения, то есть на возможность взаимодействия нуклона только с малым числом «партнёров». Если бы ядерные силы не обладали свойством насыщения, то в пределах радиуса действия ядерных сил каждый нуклон взаимодействовал бы с каждым из остальных и энергия взаимодействия была бы пропорциональна 

Общая закономерность зависимости энергии связи от массового числа описывается формулой Вайцзеккера в рамках теории капельной модели ядра[1][2][14][15].
Устойчивость ядер[править | править код]
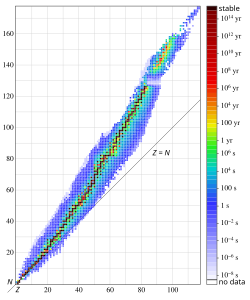
Зависимость числа нейтронов N от числа протонов Z в атомных ядрах (N=A-Z).
Из факта убывания средней энергии связи для нуклидов с массовыми числами больше или меньше 50-60 следует, что для ядер с малыми 

Детальные исследования показали, что устойчивость ядер также существенно зависит от параметра 



Если рассмотреть таблицу стабильных нуклидов, встречающихся в природе, можно обратить внимание на их распределение по чётным и нечётным значениям 







| Z | N=A-Z | A | Число нуклидов |
|---|---|---|---|
| Чётное | Чётное | Чётное | 167 |
| Чётное | Нечётное | Нечётное | 55 |
| Нечётное | Чётное | Нечётное | 53 |
| Нечётное | Нечётное | Чётное | 4 |
Таким образом, чётность числа протонов или нейтронов создаёт некоторый запас устойчивости, который приводит к возможности существования нескольких стабильных нуклидов, различающихся соответственно по числу нейтронов для изотопов и по числу протонов для изотонов. Также чётность числа нейтронов в составе тяжёлых ядер определяет их способность делиться под воздействием нейтронов[2].
Ядерные силы[править | править код]
Ядерные силы — это силы, удерживающие нуклоны в ядре, представляющие собой большие силы притяжения, действующие только на малых расстояниях. Они обладают свойствами насыщения, в связи с чем ядерным силам приписывается обменный характер (с помощью пи-мезонов). Ядерные силы зависят от спина, не зависят от электрического заряда и не являются центральными силами[2].
Уровни ядра[править | править код]
В отличие от свободных частиц, для которых энергия может принимать любые значения (так называемый непрерывный спектр), связанные частицы (то есть частицы, кинетическая энергия которых меньше абсолютного значения потенциальной), согласно квантовой механике, могут находиться в состояниях только с определёнными дискретными значениями энергий, так называемый дискретный спектр. Так как ядро — система связанных нуклонов, оно обладает дискретным спектром энергий. Обычно оно находится в наиболее низком энергетическом состоянии, называемым основным. Если передать ядру энергию, оно перейдёт в возбуждённое состояние.
Расположение энергетических уровней ядра в первом приближении:
, где:






С ростом энергии возбуждения уровни сближаются быстрее у тяжёлых ядер, также плотность уровней зависит от чётности числа нейтронов в ядре. Для ядер с чётными (особенно магическими) числами нейтронов плотность уровней меньше, чем для ядер с нечётными, при равных энергиях возбуждения первый возбуждённый уровень в ядре с чётным числом нейтронов расположен выше, чем в ядре с нечётным.
Во всех возбуждённых состояниях ядро может находиться лишь конечное время, до тех пор, пока возбуждение не будет снято тем или иным путём. Состояния, энергия возбуждения которых меньше энергии связи частицы или группы частиц в данном ядре, называются связанными; в этом случае возбуждение может сниматься лишь гамма-излучением. Состояния с энергией возбуждения, превышающей энергию связи частиц, называются квазистационарными. В этом случае ядро может испустить частицу или гамма-квант[1].
Ядерные реакции[править | править код]
Ядерная реакция — процесс превращения атомных ядер, происходящий при их взаимодействии с элементарными частицами, гамма-квантами и друг с другом.
Радиоактивность[править | править код]
Лишь небольшая часть нуклидов являются стабильными. В большинстве случаев ядерные силы оказываются неспособны обеспечить их постоянную целостность, и ядра рано или поздно распадаются. Это явление получило название радиоактивности.
Система обозначений ядер[править | править код]
Для обозначения атомных ядер используется следующая система:
Таким образом, состав ядра оказывается полностью определён, так как 
Пример такого обозначения:

Иногда, однако, для полноты вокруг обозначения элемента указывают все характеризующие ядро его атома числа:
- слева снизу — зарядовое число
, то есть, то же самое, что указано символом элемента;
- слева сверху — массовое число
;
- справа снизу — изотопическое число
[источник не указан 1369 дней (обс.)];
- если речь идёт о ядерных изомерах, к массовому числу приписывается буква из последовательности m, n, p, q, … (иногда используют последовательность m1, m2, m3, …). Иногда эту букву указывают в качестве самостоятельного индекса справа сверху.
Примеры таких обозначений:




Обозначения атомных ядер совпадают с таковыми для нуклидов.
По историческим и иным причинам, некоторые ядра имеют самостоятельные названия. Например, ядро 4He называется α-частицей, ядро дейтерия 2H (или D) — дейтроном, а ядро трития 3H (или T) — тритоном. Последние два ядра являются изотопами водорода и поэтому могут входить в состав молекул воды, давая в итоге так называемую тяжёлую воду.
Примечания[править | править код]
- Использованная литература
- ↑ 1 2 3 4 5 6 7 Бартоломей Г.Г., Байбаков В.Д., Алхутов М.С., Бать Г.А. Основы теории и методы расчета ядерных энергетических реакторов. — М.: Энергоатомиздат, 1982. — С. 512.
- ↑ 1 2 3 4 5 6 7 8 Климов А. Н. Ядерная физика и ядерные реакторы. — М.: Энергоатомиздат, 1985. — С. 352.
- ↑ 1 2 Ганев И. Х. Физика и расчёт реактора. — М.: Энергоиздат, 1981. — С. 368.
- ↑
Кудрявцев П. С. Открытие атомного ядра // Курс истории физики. — 2-е изд., испр. и доп. — М.: Просвещение, 1982. — 448 с. - ↑ Meitner, L. Über die verschiedenen Arten des radioaktiven Zerfalls und die Möglichkeit ihrer Deutung aus der Kernstruktur (нем.) // Zeitschrift für Physik : magazin. — 1921. — Bd. 4. — S. 146—156.
- ↑ Мухин К. Привлекательный мир микрофизики // Наука и жизнь. — 2015. — № 10. — С. 96—103.
- ↑ W. Heitler, G. Herzberg. Gehorchen die Stickstoffkerne der Boseschen Statistik? (нем.) // Naturwissenschaften (англ.) (рус. : magazin. — 1929. — Bd. 17. — S. 673.
- ↑ А. И. Ахиезер, М. П. Рекало. Биография элементарных частиц. — Киев: Наукова думка, 1979. — С. 18.
- ↑ Ю. А. Храмов. Физики:Биографический справочник. — 2-е изд. — М.: Наука, 1983.
- ↑ 1 2 Мухин К. Н. Экспериментальная ядерная физика. — М.: Энергоатомиздат, 1983.
- ↑ Iwanenko, D.D., The neutron hypothesis, Nature 129 (1932) 798.
- ↑ Г. А. Сарданашвили. Дмитрий Иваненко – суперзвезда советской физики. Ненаписанные мемуары. — Либроком. — 2010. — С. 12.
- ↑ Глесстон С. Атом. Атомное ядро. Атомная энергия. — М.: Изд-во иностр. лит., 1961.
- ↑ I.R.Cameron, University of New Brunswick. Nuclear fission reactors. — Canada, New Brunswick: Plenum Press, 1982.
- ↑ Камерон И. Ядерные реакторы. — М.: Энергоатомиздат, 1987. — С. 320.
- ↑ Rohlf, James William. Modern Physics from α to Z°. — John Wiley & Sons, 1994. — С. 664. — ISBN 0471572705.
Литература[править | править код]
- М. Айзенберг, В. Грайнер. Модели ядер, коллективные и одночастичные явления. — М.: Атомиздат, 1975. — 454 c.
- М. Айзенберг, В. Грайнер. Микроскопическая теория ядра. — М.: Атомиздат, 1976. — 488 с.
- К. Бракнер Теория ядерной материи. — М., Мир, 1964. — 302 с.
- О. Бор, Б. Моттельсон. Структура атомного ядра. — В 2-х т. — М.: Мир, 1971—1977.
- В. П. Крайнов. Лекции по микроскопической теории атомного ядра. — М.: Атомиздат, 1973. — 224 с.
- В. В. Маляров. Основы терии атомного ядра. 2-ое изд. — М.: Наука, 1967. — 512 с.
- Р. Натаф. Модели ядер и ядерная спектроскопия. — М.: Мир, 1968. — 404 с.
- С. М. Поликарпов. Необычные ядра и атомы. — М.: Наука, 1977. — 152 с.
- Дж. Рейнуотер. Как возникла модель сфероидальных ядер. Успехи физических наук, 1976, Том 120. Вып. 4, с. 529—541. (Нобелевская лекция по физике 1975 г.)
- А. Г. Ситенко. Теория ядерных реакций. — М.: Энергоатомиздат, 1983. — 352 с.
- А. Г. Ситенко, В. К. Тартаковский. Лекции по теории ядра. — М.: Атомиздат, 1972. — 352 с.
- Л. Слив М. И. Стрикман, Л. Л. Франкфурт. Проблемы построения микроскопической теории ядра и квантовая хромодинамика, Успехи физических наук, 1976, Том 145. Вып. 4, с. 553—592.
- В. Г. Соловьев. Теория атомного ядра. Ядерные модели. — М.: Энергоиздат, 1981. — 296с.
- В. Г. Соловьев. Теория сложных ядр. — М.: Наука, 1971. — 560 с.
- Журнал: Физика элементарных частиц и атомного ядра (ЭЧАЯ) (Архив статей с 1970 г.)
Ссылки[править | править код]
- Ядро атомное — Физическая энциклопедия
- Колебательные возбуждения ядер — Физическая энциклопедия
- Ядерные модели — Физическая энциклопедия
- Капельная модель ядра — Физическая энциклопедия
- Ядерная материя — Физическая энциклопедия
- Ядерные цепные реакции — Физическая энциклопедия
- Деформированные ядра — Физическая энциклопедия
- Б. С. Ишханов, Э. И. Кэбин, Физика ядра и частиц, XX век. МГУ, 2000.
- Ядерная энергия
Основными характеристиками атомных ядер являются электрический заряд, масса, спин, энергия связи и так далее.
Заряд ядра
Ядро каждого из атомов обладает положительным зарядом. В качестве носителя положительного заряда выступает протон. По той причине, что заряд протона численно эквивалентен заряду электрона e, можно записать, что заряд ядра элемента равен +Ze (Z выражает собой целое число, которое указывает на порядковый номер химического элемента в периодической системе химических элементов Д. И. Менделеева). Значение Z также характеризует число протонов, входящих в состав ядра и количество электронов в атоме. Именно из-за этого его определяют как атомный номер ядра. Электрический заряд представляет собой одну из основных характеристик атомного ядра, от которой зависят оптические, химические и иные свойства атомов.
Масса ядра
Существует также другая значимая характеристика ядра, а именно масса. Массу атомов и ядер принято выражать в атомных единицах массы (а.е.м.), в качестве атомной единицы массы выступает 112 массы нуклида углерода C612:
где NA=6,022·1023 моль-1 обозначает число Авогадро.
Кроме того, есть другой способ выражения атомной массы: исходя из соотношения Эйнштейна E=mc2, ее выражают в единицах энергии. По той причине, что масса протона mp=1.00728 а.е.м.=938,28 МэВ, масса нейтрона mn=1.00866а.е.м.=939,57МэВ, а масса электрона me=5,49⋅10-4 а.е.м.=0,511МэВ,
Из приведенных выше значений видно, что масса электрона несущественно мала, если сравнивать ее с массой ядра, поэтому масса ядра практически эквивалентна массе всего атома и отлична от целых чисел.
Масса ядра, которая выражается в а.е.м. и округляется до целого числа носит название массового числа и обозначается с помощью буквы A. Она характеризует количество нуклонов, находящихся в составе ядра.
Количество нейтронов в ядре эквивалентно N=A−Z. В качестве обозначения ядер используют символ XZA, в котором X определяется как химический символ этого элемента.
Атомные ядра, обладающие одинаковым числом протонов, однако при этом отличающимися друг от друга массовыми числами, носят название изотопов.
В некоторых элементах количество стабильных и нестабильных изотопов достигает десятков, в качестве примера, уран обладает 14 изотопами: от U92227 до U92240. Большая часть химических элементов, которые существуют в природе, являются смесью нескольких изотопов. Как раз наличие изотопов объясняет следующее явление: некоторые природные элементы обладают массой, которая является отличной от целых чисел. В качестве примера рассмотрим природный хлор, который состоит из 75% C1735l и 24% C1737l, а его атомная масса эквивалентна 35,5 а.е.м. В большей части атомов, исключая водород, изотопы обладают практически равными физическими и химическими свойствами. Однако, за своими, исключительно ядерными свойствами, изотопы значительно отличаются друг от друга. Какие-то из них могут представлять собой стабильные изотопы, а другие – радиоактивные.
Ядра с эквивалентными массовыми числами, но отличающимися значениями Z носят название изобар, в качестве примера, A1840r, C2040a.
Ядра с одинаковым числом нейтронов определяют как изотоны.
Среди легких ядер встречаются и так называемые «зеркальные» пары ядер. Это такие пары ядер, в которых числа Z и A−Z меняются местами. В качестве примера подобных ядер можно привести C613 и N713 или H13 и H23e.
Размер атомного ядра
Принимая форму атомного ядра приблизительно сферической, мы имеем возможность ввести понятие его радиуса R. Обратим внимание на то, что в некоторых ядрах есть небольшое отклонение от симметрии в распределении электрического заряда. Более того, атомные ядра представляют собой не статические, а динамические системы, и понятие радиуса ядра нельзя представлять как радиус шара. Именно из-за этого факта, в качестве размеров атомного ядра нужно принимать ту область, в которой проявляются ядерные силы. В процессе создания количественной теории рассеивания α-частиц Э. Резерфорд исходил из тех предположений, что атомное ядро и α – частица взаимодействуют по закону Кулона, Другими словами из того, что электрическое поле вокруг ядра обладает сферической симметрией.
Это работает в отношении α – частиц, обладающих достаточно малым значением энергии E. При этом частица не имеет возможности преодолеть кулоновский потенциальный барьер и в последствии не достигает области, в которой наблюдается действие ядерных сил. Одновременно с повышением энергии частицы до некоторого граничного значения Eгр, α-частица достигает данной границы. В таком случае в рассеянии α-частиц возникает некоторое отклонение от формулы Резерфорда.
Опытным путем было определено, что радиус R ядра является зависимым от числа нуклонов, которые входят в состав ядра.
Размеры ядер определяют экспериментальным путем по рассеянию протонов, быстрых нейтронов или же электронов высоких энергий. Существует также целый список иных косвенных способов получения значений размеров ядер. Они основываются:
- на связи времени жизни α – радиоактивных ядер с энергией выпущенных ими α – частиц;
- на оптических свойствах, носящих название мезоатомов, в которых один из электронов временно захвачен мюоном;
- на сравнении энергий связи парных зеркальных атомов.
Данные способы подтверждают эмпирическую зависимость R=R0A1/3, а также благодаря таким измерениям определено значение постоянной R0=1,2-1,5·10-15 м. Обратим свое внимание также на тот факт, что за единицу расстояний в атомной физике и физике элементарных частиц принимают единицу измерения «ферми», которая равняется 10-15 м 1 ф=10-15 м. Радиусы атомных ядер определяются их массовым числом и находятся в промежутке от 2·10-15 до 10-14 м. Если из формулы R=R0A1/3 выразить R0 и записать его в следующем виде 4πR33A=const, то можно заметить, что на каждый нуклон приходится примерно одинаковый объем. Из данного факта можно сделать вывод о том, что плотность ядерного вещества для всех ядер так же приблизительно одинакова. Как можно заметить, плотность ядерного вещества довольно велика. Этот факт основывается на действие ядерных сил.
Энергия связи. Дефект масс ядер
Величину ∆m, что определяет разницу масс между массой нуклонов, которые формируют ядро, и массой ядра, называют дефектом массы ядра.
Важные сведения о свойствах ядра могут быть получены даже при отсутствии знаний о подробностях взаимодействия между нуклонами ядра, на основании закона сохранения энергии и закона пропорциональности массы и энергии. Поскольку в результате каждого изменения массы ∆m происходит соответствующее изменение энергии ∆E(∆E=∆mc2), то при образовании ядра выделяется некоторое количество энергии. Исходя из закона сохранения энергии можно сделать вывод о том, что ровно такое же количество энергии необходимо для того, чтобы разделить ядро на составляющие его элементы, другими словами отдалить нуклоны друг от друга на такие расстояния, при которых взаимодействия между ними не происходит. Данную энергию определяют как энергию связи ядра.
Заметим, что данная формула довольно неудобная в применении, так как в таблицах приводиться не массы ядер, а массы, которые относятся к массам нейтральных атомов. По этой причине ради удобства вычислений формулу преобразуют таким образом, чтобы в нее входили не массы атомов, а массы ядер. Для достижения этой цели в правой части формулы добавим и отнимем массу Z электронов (me). В таком случае Eсв=Zmp+me+A-Zmn-mя+Zmec2=ZmH11+A-Zmn-mac2 — масса атома водорода, ma — масса атома.
В ядерной физике энергию зачастую выражают в мегаэлектрон-вольтах (МэВ). Если речь идет о практическом применении ядерной энергии, то ее измеряют в джоулях. В случае сравнения энергии двух ядер используют массовую единицу энергии — соотношение между массой и энергией (E=mc2). Массовая единица энергии (le) равняется энергии, что соответствует массе в одну а.е.м. Она равняется 931,502 МэВ.
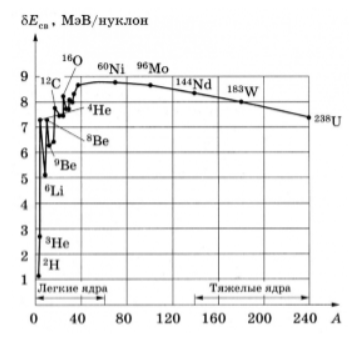
Рисунок 1
Кроме энергии, важное значение имеет удельная энергия связи ядра — энергия связи, которая припадает на один нуклон: ω=Ecв/A. Эта величина меняется сравнительно медленно по сравнению со сменой массового числа A, имея почти постоянную величину 8.6 МэВ в средней части периодической системы и уменьшается до ее краев.
Дефект массы
Энергия связи в МэВ: Eсв=∆m·931,502=0,030359·931,502=28,3 МэВ;
Удельная энергия связи: ω=EсвA=28,3 МэВ4≈7.1 МэВ.
Все, наверное, помнят со школы, что атомы, а тем более — атомные ядра, настолько маленькие, что их не увидеть и не пощупать. Из этого может сложиться впечатление, что раз эти размеры относятся к микромиру, то и определить их можно только с помощью очень сложных физических экспериментов. Но это вовсе не так. Существуют вполне макроскопические и даже повседневные явления, которые позволяют оценить эти размеры хотя бы по порядку величины. В одной из задач мы уже выясняли, как можно прикинуть размер атома, исходя из известных термодинамических характеристик вещества. Обратимся теперь к атомному ядру.
Ядра, конечно, изучать труднее, чем сами атомы. В формировании свойств материи они играют довольно-таки второстепенную роль. Они придают веществу массивность, держат около себя электроны, но сами ядра непосредственно друг с другом не взаимодействуют. Так получается потому, что они очень маленькие, намного меньше самих атомов (рис. 1). И по этой причине определить их размер труднее, чем размер атомов.

В этой задаче, однако, для оценки размера ядра мы воспользуемся одной подсказкой, которую нам предоставляет природа, — явлением радиоактивности.
Известно, что в ходе некоторых ядерных превращений из ядер вылетают нейтроны. В отличие от протонов или электронов, нейтроны электрически не заряжены. В своем полете сквозь вещество они практически не чувствуют электронные оболочки атомов. Они пролетают один атом за другим насквозь, не отклоняясь от своей траектории, пока не столкнутся лоб в лоб с каким-нибудь ядром вещества. Для простоты мы будем считать, что каждый быстрый нейтрон, врезающийся в ядро, вызывает какое-то существенное взаимодействие: это может быть поглощение, упругое рассеяние или какое-нибудь изменение внутри ядра.
Такое «наплевательское отношение» нейтронов к электромагнитным взаимодействиям приводит к тому, что нейтронный поток обладает высокой проникающей способностью (рис. 2). Длина свободного пробега нейтрона (то есть расстояние между отдельными актами столкновений) может быть довольно большой, намного больше, чем для электронов или рентгеновского излучения. Самое важное для нас тут то, что эта длина измеряется напрямую в простейшем лабораторном опыте по экранированию нейтронного потока пластинками разной толщины. Результаты получаются такие: для быстрых нейтронов с энергией порядка 1 МэВ длина свободного пробега в твердом веществе, например алюминии, составляет около 10 см — вполне макроскопический размер.

Задача
Опираясь на приведенные выше числа и рассуждения, оцените по порядку величины размер атомного ядра алюминия.
Подсказка 1
Нарисуйте схематично несколько атомов, плотно прижавшихся друг к другу своими электронными оболочками. Отметьте внутри них атомные ядра, не забывая о том, что они очень маленькие. Нейтроны не обращают внимание на электронные оболочки, для них сплошное вещество — это как бы очень разреженный и почти неподвижный «газ» из атомных ядер. С учетом этого нарисуйте прямую траекторию нейтрона и попытайтесь понять, как длина свободного пробега связана с размером ядра.
Подсказка 2
Вообще-то формула для связи длины свободного пробега с параметрами среды нам уже встречалась в задаче Столкновение фотонов. Там мы говорили про сечение рассеяния фотонов друг на друге, и это была довольно абстрактная величина. Сейчас всё проще: мы считаем, что сечение рассеяния для нейтрон-ядерного столкновения просто совпадает с геометрическим сечением системы «ядро + нейтрон».
Решение
На рис. 3 в очень упрощенном виде показано сплошное вещество с точки зрения заряженных частиц или фотонов, а также с точки зрения нейтрона. Нейтрон практически «не видит» электроны, для него существуют только атомные ядра. Радиус ядра мы обозначим через R, а характерное расстояние между ними — через a. Обратите внимание, что a — это типичное межатомное расстояние, оно много больше размера ядра R. Сам нейтрон мы для простейших оценок будем считать точечным. При желании оценку можно уточнить, связав размер нейтрона с размером ядра и его массовым числом. Однако оценку по порядку величины это уточнение не изменит.

Связь между длиной свободного пробега L, сечением столкновения σ и концентрацией ядер n уже подробно обсуждалась в решении задачи про столкновение фотонов. Записывается она просто: Lσn = 1. В нашем случае сечение столкновения — это просто поперечное сечение ядра, σ = πR2, а концентрация выражается через расстояние между ядрами, n = 1/a3. Подставив эти выражения, мы получаем ответ для оценки радиуса ядра:
![]()
Межатомное расстояние a — это для сплошного вещества просто размер атомов, то есть несколько ангстрем. Для более точной оценки можно вычислить концентрацию ядер через плотность вещества и массу ядра; для алюминия это даст a = 2,5 Å. Взяв L = 0,1 м, получим R ≈ 7·10−15 м.
Найденное значение примерно вдвое превышает реальный радиус ядра алюминия. Это совершенно приемлемая точность для столь простой оценки по порядку величины.
Послесловие
Эта задача может послужить вступлением для самых разных рассказов о том, как нейтроны или, более широко, отдельные элементарные частицы, взаимодействуют с веществом. Мы здесь ограничимся только несколькими самыми общими набросками.
Во-первых, надо сразу сказать, что в реальном эксперименте размеры ядер измеряются совсем не такими методами. Самый стандартный способ — это улучшенная разновидность классического опыта Резерфорда: размер ядра можно узнать по тому, как на нем рассеиваются заряженные частицы. Но тут есть любопытный момент: оказывается, у ядра может быть несколько разных размеров: протонный радиус, материальный радиус, зарядовый радиус и т.д. В отдельных случаях, например для ядер с нейтронным гало, эти размеры могут существенно различаться. Поэтому современная экспериментальная физика использует сразу несколько разных методов для измерения размеров и изучения структуры ядер (см. введение в эту область физики в нашей новости Оптические исследования помогают изучать ядра с нейтронным гало).

Далее, почему в этой задаче использовались нейтроны, а не электроны или протоны? Отчасти ответ уже понятен из решения. Заряженные частицы, а также фотоны, чувствуют не только и не столько ядра, сколько электронные оболочки атомов, а значит, использовать их движение для измерения размеров ядра затруднительно. Но тут есть и второй аспект. Взаимодействие нейтронов с ядрами короткодействующее; оно имеет место только в том случае, когда нейтрон приблизится к ядру на расстояние порядка ядерного размера. Поэтому траектория нейтрона в веществе представляет собой ломаную линию с четко определенными точками излома и прямыми участками (рис. 4). А вот траектория заряженных частиц из-за дальнодействующего электромагнитного взаимодействия постоянно отклоняется из стороны в сторону, но, правда, на небольшие углы. Более того, это взаимодействие приводит к ионизации вещества (выбиванию новых электронов) и к излучению фотонов. В итоге заряженная частица в веществе просто не имеет четко определенной длины свободного пробега. Подробнее про возникающие здесь явления см. в онлайн курсе Взаимодействие частиц с веществом.
В этой задаче мы для простоты считали, что сечение рассеяния нейтрона на ядре чисто геометрическое: столкновение происходит, если траектория нейтрона попадает строго в ядро. На самом деле в микромире, который описывается квантовыми законами, ситуация может сильно отличаться от этого предположения. Более того, это отличие сильно зависит от энергии нейтронов (рис. 5). Так, при энергиях около 1 МэВ сечение рассеяния обычно составляет несколько барн (1 б = 10−24 см2; в нашей задаче сечение получилось примерно 0,5 б). Для тепловых нейтронов (энергия порядка 0,025 эВ) сечение захвата нейтрона составляет порой многие тысячи (!) барн, то есть на несколько порядков больше геометрического размера ядра (см. периодическую таблицу сечений захвата нейтрона). Существуют даже медицинские технологии, которые используют эту особенность ядерной физики, например, бор-нейтронозахватная терапия для борьбы с трудными формами рака. А в промежуточной области энергий наблюдаются резкие и узкие всплески сечения, которые возникают из-за сложной структуры ядра.

Особняком стоят здесь холодные нейтроны. Благодаря своей малой скорости и большой длине волны, они чувствуют не отдельные атомные ядра, а сразу их большой коллектив (см. новость Холодные нейтронные лучи прощупывают предметы, не внося никаких возмущений). Из-за этого при достаточно низкой скорости они могут вообще коллективно отражаться от вещества; материал словно выталкивает из себя такие нейтроны. Это позволяет в буквальном смысле держать ультрахолодные нейтроны в «металлической бутылке» и проводить с ним разные эксперименты (см. например новости Измерения времени жизни нейтрона, выполненные разными методами, по-прежнему расходятся и Нейтроны в гравитационном поле Земли позволяют проверить модели темной энергии и темной материи, а также задачу Нейтроны в ловушке).

Ну и наконец, нейтроны открывают бесчисленные возможности не только для фундаментальной физики, но и для прикладных исследований. Не пытаясь даже перечислить все конкретные области применения, просто упомянем индустриальную диагностику устройств, внутрь которых не заглянешь другими методами (рис. 6), материаловедение, биомедицинские науки вкупе с фармакологией, геофизику. Все эти применения так или иначе опираются на высокую проникающую способность нейтронов в веществе.
Екатерина Владимировна Мосина
Эксперт по предмету «Физика»
Задать вопрос автору статьи
Основными характеристиками атомных ядер, которые определяют их индивидуальность являются электрический заряд, масса, спин, энергия связи и т.д.
Заряд ядра
Ядро любого атома заряжено положительно. Носителем положительного заряда является протон. Поскольку заряд протона численно равен заряду электрона $e$, то можно записать что заряд ядра равен $+Ze$ ($Z$ — целое число, которое указывает на порядковый номер химического элемента в периодической системе химических элементов Д. И. Менделеева). Число $Z$ также определяет количество протонов в ядре и количество электронов в атоме. Поэтому его называют атомным номером ядра. Электрический заряд является одной с основных характеристик атомного ядра, от которой зависят оптические, химические и другие свойства атомов.
Масса ядра
Другой важной характеристикой ядра является его масса. Массу атомов и ядер принято выражать в атомных единицах массы (а.е.м.). за атомную единицу массы принято считать $1/12$ массы нуклида углерода $^{12}_6C$:
Сделаем домашку
с вашим ребенком за 380 ₽
Уделите время себе, а мы сделаем всю домашку с вашим ребенком в режиме online
Бесплатное пробное занятие
*количество мест ограничено
где $N_A=6,022cdot 10^{23} моль^-1$ — число Авогадро.
Согласно соотношению Эйнштейна $E=mc^2$, массу атомов также выражают в единицах энергии. Поскольку:
- масса протона $m_p=1.00728 а.е.м.=938,28 МэВ$,
- масса нейтрона $m_n=1.00866 а.е.м.=939,57 МэВ$,
- масса электрона $m_e=5,49cdot 10^{-4} а.е.м.=0,511 МэВ$,
Как видно масса электрона пренебрежительно мала в сравнении с массой ядра, то масса ядра почти совпадает с массой атома.
Масса отличается от целых чисел. Масса ядра, выражена в а.е.м. и округлена до целого числа называется массовым числом, обозначается буквой $A$ и определяет количество нуклонов в ядре. Число нейтронов в ядре равно $N=A-Z$.
Для обозначения ядер применяется символ $^A_ZX$, где под $X$ подразумевается химический символ данного элемента. Атомные ядра с одинаковым количеством протонов но разными массовыми числами называют изотопами. В некоторых элементов число стабильных и нестабильных изотопов достигает десятков, например, уран имеет $14$ изотопов: от $^{227}_{92}U $до $^{240}_{92}U$.
«Характеристики ядра» 👇
Большинство химических элементов существующих в природе, представляют собой смесь нескольких изотопов. Именно наличие изотопов объясняет тот факт, что некоторые природные элементы имеют массу, которая отличается от целых чисел. Например, природный хлор состоит с $75%$ $^{35}_{17}Cl$ и $24%$ $^{37}_{17}Cl$, а его атомная масса равна $35,5$ а.е.м. в большинства атомов, кроме водорода, изотопы имеют почти одинаковые физические и химические свойства. Но за своими исключительно ядерными свойствами изотопы существенно разнятся. Одни с них могут быть стабильными, другие — радиоактивными.
Ядра с одинаковыми массовыми числами, но разными значениями $Z$ называют изобарами, например, $^{40}_{18}Ar$, $^{40}_{20}Ca$. Ядра с одинаковым количеством нейтронов называют изотонами. Среди легких ядер встречаются так называемые «зеркальные» пары ядер. Это такие пары ядер в которых числа $Z$ и $A-Z$ меняются местами. Примерами таких ядер могут быть $^{13}_6C $и $^{13_7}N$ или $^3_1H$ и $^3_2He$.
Размер атомного ядра
Считая атомное ядро приблизительно сферическим, можно ввести понятия его радиуса $R$. Отметим, что в некоторых ядрах есть небольшое отклонение от симметрии в распределении электрического заряда. Кроме того, атомные ядра не статические, а динамические системы, и понятие радиуса ядра не можно представлять как радиус шара. По этой причине, за размеры ядра необходимо брать ту область, в которой проявляются ядерные силы.
При создании количественной теории рассеивания $alpha $ — частиц Э. Резерфорд исходил с предположений, что атомное ядро и $alpha $ — частица взаимодействуют по закону Кулона, т.е. что электрическое поле вокруг ядра имеет сферическую симметрию. Рассеивание $alpha $ — частицы происходит в полном соответствии с формулой Резерфорда:
Это имеет место для $alpha $ — частиц энергия которых $E$ достаточно мала. При этом частица не способна преодолеть кулоновский потенциальный барьер и в последствии не достигает области действия ядерных сил. С увеличением энергии частицы до некоторого граничного значения $E_{гр}$ $alpha $ — частица достигает этой границы. Тога в рассеивании $alpha $ — частиц наблюдается отклонение от формулы Резерфорда. Из соотношения
Опыты показывают, что радиус $R$ ядра зависит от количества нуклонов, которые входят до состава ядра. Эта зависимость может выражаться эмпирической формулой:
где $R_0$ — постоянная, $A$ — массовое число.
Размеры ядер определяют экспериментально по рассеиванию протонов, быстрых нейтронов или электронов высоких энергий. Существует ряд других непрямых методов определения размеров ядер. Они обоснованы на связи время жизни $alpha $ — радиоактивных ядер с энергией выпущенных ими $alpha $ — частиц; на оптических свойствах, так называемых, мезоатомов, в которых один с электронов временно захвачен мюоном; на сравнении энергии связи пары зеркальных атомов. Эти методы подтверждают эмпирическую зависимость $R=R_0A^{1/3}$, а также с помощью этих измерений установлено значение постоянной $R_0=left(1,2-1,5right)cdot 10^{-15} м$.
Отметим также, что за единицу расстояний в атомной физике и физике элементарных частиц берут единицу измерения «ферми», который равняется
${10}^{-15} м$ (1 ф=${10}^{-15} м)$.
Радиусы атомных ядер зависят от их массового числа и находятся в промежутке от $2cdot 10^{-15} м до 10^{-14} м$. если с формулы $R=R_0A^{1/3}$ выразить $R_0$ и записать его в виде $left(frac{4pi R^3}{3A}right)=const$, то можно увидеть что на каждый нуклон припадает приблизительно одинаковый объем. Это значит, что плотность ядерного вещества для всех ядер так же приблизительно одинакова. Выходя с существующих ведомостей о размерах атомных ядер, найдем среднее значение плотности вещества ядра:
Как видим, плотность ядерного вещества очень большая. Это обусловлено действием ядерных сил.
Энергия связи. Дефект масс ядер
При сравнении суммы масс покоя нуклонов, которые образуют ядро с массой ядра было замечено, что для всех химических элементов справедливо неравенство:
где $m_p$ — масса протона, $m_n$ — масса нейтрона, $m_я$ — масса ядра. Величину $triangle m$, что выражает разницу масс между массой нуклонов, которые образуют ядро, и массой ядра, называют дефектом массы ядра
Важные сведения о свойствах ядра можно получить не вникая в подробности взаимодействия между нуклонами ядра, на основании закона сохранения энергии и закона пропорциональности массы и энергии. По сколько в результате любого изменения массы $triangle m$ происходит соответствующее изменение энергии $triangle E$ ($triangle E=triangle mc^2$), то при образовании ядра выделяется определенное количество энергии. По закону сохранения энергии такое же количество энергии необходимо, чтоб разделить ядро на составляющие частицы, т.е. отдалить нуклоны один от одного на такие же расстояния, при которых отсутствует взаимодействие между ними. Эту энергию называют энергией связи ядра.
Если ядро имеет $Z$ протонов и массовое число $A$, то энергия связи равна:
Замечание 1
Отметим, что этой формулой не совсем удобно пользоваться, т.к. в таблицах приводиться не массы ядер, а массы, которые определяют массы нейтральных атомов. Поэтому для удобства вычислений формулу преобразуют таким образом, чтобы в нее входили массы атомов, а не ядер. С этой целью в правой части формулы добавим и отнимем массу $Z$ электронов $(m_e)$. Тогда
[E_{св}=left[Zleft(m_p+m_eright)+left(A-Zright)m_n-(m_я+Zm_e)right]c^2==left[Zm_{{}^1_1H}+left(A-Zright)m_n-m_aright]c^2.]
$m_{{}^1_1H}$ — масса атома водорода, $m_a$ — масса атома.
В ядерной физике энергию часто выражают в мегаэлектрон-вольтах (МэВ). Если речь идет о практическом применении ядерной энергии, то ее измеряют в джоулях. В случае сравнения энергии двух ядер используют массовую единицу энергии — соотношение между массой и энергией ($E=mc^2$). Массовая единица энергии ($le$) равняется энергии, что соответствует массе в одну а.е.м. Она равняется $931,502$ МэВ.
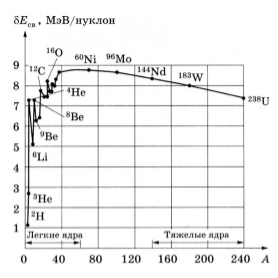
Рисунок 1.
Кроме энергии, важное значение имеет удельная энергия связи — энергия связи, которая припадает на один нуклон: $w=E_{св}/A$. Эта величина меняется сравнительно медленно по сравнению со сменой массового числа $A$, имея почти постоянную величину $8.6$ МэВ в средней части периодической системы и уменьшается до ее краев.
Для примера рассчитаем дефект массы, энергию связи и удельную энергию связи ядра атома гелия.
Дефект массы
Энергия связи в МэВ: $E_{св}=triangle mcdot 931,502=0,030359cdot 931,502=28,3 МэВ$;
Удельная энергия связи: $w=frac{E_{св}}{A}=frac{28,3 МэВ}{4approx 7.1 МэВ}.$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
407
атомного ядра
и элементарных
частиц
Глава 32
Элементы физики
атомного ядра
§251. Размер, состав и заряд атомного ядра. Массовое и зарядовое числа
Э.
Резерфорд, исследуя прохождение -частиц
с энергией в несколько мегаэлектрон-вольт
через тонкие пленки золота (см. §208),
пришел к выводу о том, что атом состоит
из положительно заряженного ядра и
окружающих его электронов. Проанализировав
эти опыты, Резерфорд также показал, что
атомные ядра имеют размеры примерно
10-14—10-15
м (линейные размеры атома примерно
10–10
м).
Атомное
ядро состоит из элементарных частиц
— протонов
и нейтронов (протонно-нейтронная
модель ядра была предложена советским
физиком Д. Д. Иваненко (р. 1904), а впоследствии
развита В. Гейзенбергом).
Протон
(р)
имеет
положительный заряд, равный заряду
электрона, и массу покоя mp=1,6726•10-27
кг
1836me,
где me
— масса
электрона. Нейтрон (n)
—
нейтральная частица с массой покоя
mn=1,6749•10-27кг
1839me,.
Протоны и нейтроны называются нуклонами
(от
лат. nucleus
—
ядро). Общее число нуклонов в атомном
ядре называется массовым
числом А.
Атомное
ядро характеризуется зарядом
Ze,
где
е
—
заряд протона, Z
—
зарядовое
число ядра,
равное числу протонов в ядре и
совпадающее с порядковым номером
химического элемента в Периодической
системе элементов Менделеева. Известные
в настоящее время 107 элементов таблицы
Менделеева имеют зарядовые числа ядер
от Z=1
до
Z=107.
Ядро
обозначается тем же символом, что и
нейтральный атом: AZХ,
где X
—
символ химического элемента, Z
—
атомный номер (число протонов в ядре),
А
— массовое
число (число нуклонов в ядре).
Сейчас
протонно-нейтронная модель ядра не
вызывает сомнений. Рассматривалась
также гипотеза о протонно-электронном
строении ядра, но она не выдержала
экспериментальной проверки. Так, если
придерживаться этой гипотезы, то
массовое число А
должно
представлять собой число протонов в
ядре, а разность между массовым числом
и числом электронов должна быть равна
заряду ядра. Эта модель согласовывалась
со значениями изотопных масс и зарядов,
но противоречила значениям спинов и
магнитных моментов ядер, энергии связи
ядра и т. д. Кроме того, она оказалась
несовместимой с соотношением
неопределенностей (см. §215). В результате
гипотеза о протонно-электронном строении
ядра была отвергнута.
Так как атом
нейтрален, то заряд ядра определяет и
число электронов в атоме. От числа же
электронов зависит их распределение
по состояниям в атоме, от которого, в
свою очередь, зависят химические
свойства атома. Следовательно, заряд
ядра определяет специфику данного
химического элемента, т. е. определяет
число электронов в атоме, конфигурацию
их электронных оболочек, величину и
характер внутриатомного электрического
поля.
Ядра
с одинаковыми Z,
но
разными А
(т.
е. с разными числами нейтронов N
=
408
А —
Z)
называются
изотопами,
а
ядра с одинаковыми A,
но разными Z
—
изобарами.
Например,
водород (Z=1)
имеет
три изотопа: 11Н
— протий (Z=1,
N=0),
21Н
— дейтерий (Z=1,
N=1),
31Н
— тритий (Z=
1,
N=
2), олово — десять, и т. д. В подавляющем
большинстве случаев изотопы одного и
того же химического элемента обладают
одинаковыми химическими и почти
одинаковыми физическими свойствами
(исключение составляют, например,
изотопы водорода), определяющимися
в основном структурой электронных
оболочек, которая является одинаковой
для всех изотопов данного элемента.
Примером ядер-изобар могут служить ядра
104Be,
105B,
106C.
В
настоящее время известно более 2000
ядер, отличающихся либо Z,
либо
A,
либо тем и другим.
Радиус
ядра задается
эмпирической формулой
R
=R0A1/3,
(251.1)
где
R0=(1,3—1,7)
10-15м.
Однако при употреблении этого термина
необходимо соблюдать осторожность
(из-за его неоднозначности, например
из-за размытости границы ядра). Из формулы
(251.1) вытекает, что объем ядра
пропорционален числу нуклонов в ядре.
Следовательно, плотность ядерного
вещества примерно одинакова для всех
ядер (1017
кг/м3).
Соседние файлы в папке Трофимова
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #


