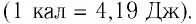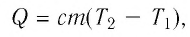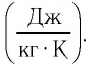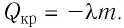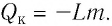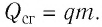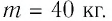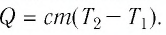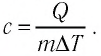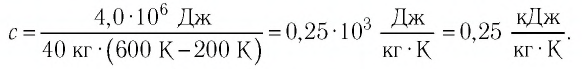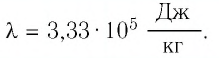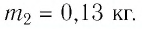Количество теплоты — еще один изученный нами вид энергии. Эту энергию тело получает или отдает при теплопередаче. Мы установили, что количество теплоты, необходимое для нагревания тела, зависит от массы тела, разности температур и рода вещества. Нам известен физический смысл удельной теплоемкости и некоторые ее табличные значения для разных веществ. В этом уроке мы перейдем к численному расчету количества теплоты, необходимой для нагревания тела или выделяемого им при охлаждении.
Зачем это нужно? На самом деле, на практике очень часто используют подобные расчеты.
При строительстве зданий и проектировании систем отопления важно знать, какое количество теплоты необходимо отдавать для полного обогрева всех помещений. С другой стороны, также необходима информация о том, какое количество теплоты будет уходить через окна, стены и двери.
Формула для расчета количества теплоты
Допустим, на нужно узнать, какое количество теплоты получила при нагревании железная деталь. Масса детали $3 space кг$. Деталь нагрелась от $20 degree C$ до $300 degree C$.
Возьмем значение теплоемкости железа из таблицы — $460 frac{Дж}{кг cdot degree C}$. Объясним смысл этой величины: на нагревание куска железа массой $1 space кг$ на $1 degree C$ необходимо затратить количество теплоты, равное $460 space Дж$.
- Масса детали у нас в 3 раза больше, значит, на ее нагрев потребуется в 3 раза большее количество теплоты — $1380 space Дж$
- Температура изменилась не на $1 degree C$, а на $280 degree C$
- Значит, необходимо в 280 раз большее количество теплоты: $1380 space Дж cdot 280 = 386 400 space Дж$
Тогда, формула для расчета количества теплоты, необходимой для нагревания тела или выделяемого им при охлаждении примет вид:
$Q = cm(t_2 — t_1)$,
где $Q$ — количество теплоты,
$c$ — удельная теплоемкость вещества, из которого состоит тело,
$m$ — масса тела,
$t_1$ — начальная температура тела,
$t_2$ — конечная температура тела.
Чтобы рассчитать количество теплоты, которое необходимо затратить для нагревания тела или выделяемое им при охлаждении, нужно удельную теплоемкость умножить на массу тела и на разность конечной и начальной температур.
Рассмотрим подробнее особенности расчета количества теплоты на примерах решения задач.
Расчет количества теплоты, затраченного на нагревание двух тел
В железный котелок массой $4 space кг$ налили воду массой $10 space кг$ (рисунок 1). Их температура $25 degree C$. Какое количество теплоты нужно затратить, чтобы нагреть котелок и воду до температуры $100 degree C$?
Обратите внимание, что нагреваться будут сразу два тела: и котелок, и вода в нем. Между постоянно будет происходить теплообмен. Поэтому их температуры мы можем считать одинаковыми.
Отметим, что массы котелка и воды различные. Также они имеют различные теплоемкости. Значит, полученные ими количества теплоты будет различными.
Теперь мы можем записать условие задачи и решить ее.
Дано:
$m_1 = 4 space кг$
$c_1 = 460 frac{Дж}{кг cdot degree C}$
$m_2 = 10 space кг$
$c_2 = 4200 frac{Дж}{кг cdot degree C}$
$t_1 = 25 degree C$
$t_2 = 100 degree C$
Q-?
Посмотреть решение и ответ
Скрыть
Решение:
Для расчета полученного количества теплоты используем формулу $Q = cm(t_2 — t_1)$.
Запишем эту формулу для количества теплоты, полученного котелком:
$Q_1 = c_1m_1(t_2 — t_1)$.
Рассчитаем это количество теплоты:
$Q_1 = 460 frac{Дж}{кг cdot degree C} cdot 4 space кг cdot (100 degree C — 25 degree C) = 1840 frac{Дж}{degree C} cdot 75 degree C = 138 000 space Дж = 138 space кДж$.
Количество теплоты, полученное водой при нагревании будет равно:
$Q_2 = c_2m_2(t_2 — t_1)$.
Подставим численные значения и рассчитаем:
$Q_2 = 4200 frac{Дж}{кг cdot degree C} cdot 10 space кг cdot (100 degree C — 25 degree C) = 42000 frac{Дж}{degree C} cdot 75 degree C = 3 150 000 space Дж = 3150 space кДж$.
Общее количество теплоты, затраченное на нагревание котелка и воды:
$Q = Q_1 +Q_2$,
$Q = 138 space кДж + 3150 space кДж = 3288 space кДж$.
Ответ: $Q = 3288 space кДж$.
Расчет количества теплоты при смешивании жидкостей
Горячую воду разбавили холодной и получили температуру смеси $30 degree C$. Горячей воды с температурой $100 degree C$ при этом было $0.3 space кг$. Холодная вода имела массу $1.4 space кг$ и температуру $15 degree C$. Рассчитайте, какое количество теплоты было отдано горячей водой при остывании и получила холодная вода при нагревании. Сравните эти количества теплоты.
Дано:
$c_1 = c_2 = c = 4200 frac{Дж}{кг cdot degree C}$
$m_1 = 0.3 space кг$
$m_2 = 1.4 space кг$
$t_1 = 100 degree C$
$t_2 = 15 degree C$
$t = 30 degree C$
$Q_1 — ?$
$Q_2 — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Запишем формулу для расчета количества теплоты, отданного горячей водой при остывании от $100 degree C$ до $30 degree C$:
$Q_1 = cm_1(t_1 — t)$.
Рассчитаем эту величину:
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 0.3 space кг cdot (100 degree C — 30 degree C) = 1260 frac{Дж}{degree C} cdot 70 degree C = 88 200 space Дж = 88.2 space кДж$.
Запишем формулу для расчета количества теплоты, полученного холодной водой при нагревании от $15 degree C$ до $30 degree C$:
$Q_2 = cm_2(t — t_2)$.
Рассчитаем эту величину:
$Q_1 = 4200 frac{Дж}{кг cdot degree C} cdot 1.4 space кг cdot (30 degree C — 15 degree C) = 5880 frac{Дж}{degree C} cdot 15 degree C = 88 200 space Дж = 88.2 space кДж$.
$Q_1 = Q_2 = 88.2 space кДж$.
Ответ: $Q_1 = Q_2 = 88.2 space кДж$.
В ходе решения этой задачи мы увидели, что количество теплоты, отданное горячей водой, и количество теплоты, полученное холодной водой, равны. Другие опыты дают схожие результаты.
Значит,
Если между телами происходит теплоообмен, то внутренняя энергия всех нагревающихся тел увеличивается на столько, на сколько уменьшается внутренняя энергия остывающих тел.
На практике часто получается так, что отданная горячей водой энергия больше, чем полученная холодной. На самом деле, горячая вода при охлаждении передает какую-то часть своей внутренней энергии воздуху и сосуду, в котором происходит смешивание.
Есть 2 способа учесть этот фактор:
- Если мы максимально сократим потери энергии, то добьемся приблизительного равенства отданной и полученной энергий
- Если рассчитать и учесть потери энергии, то можно получить точное равенство
Расчет температуры при известной величине количества теплоты
При нагревании куска меди было затрачено $22 space кДж$. Масса этого куска составляет $300 space г$. Начальная температура была равна $20 degree C$. До какой температуры нагрели кусок меди?
Дано:
$m = 300 space г$
$t_1 = 20 degree C$
$c = 400 frac{Дж}{кг cdot degree C}$
$Q = 22 space кДж$
СИ:
$0.3 space кг$
$22 000 space Дж$
$t_2 — ?$
Посмотреть решение и ответ
Скрыть
Решение:
Запишем формулу для расчета количества теплоты:
$Q = cm(t_2 — t_1)$.
Постепенно выразим из этой формулы искомую температуру $t_2$:
$t_2 — t_1 = frac{Q}{cm}$,
$t_2 = frac{Q}{cm} + t_1$.
Рассчитаем $t_2$:
$t_2 = frac{22 000 space Дж}{400 frac{Дж}{кг cdot degree C} cdot 0.3 space кг} + 20 degree C approx 183 degree C + 20 degree C approx 203 degree C$.
Ответ: $t_2 approx 203 degree C$.
- Подробности
- Обновлено 08.02.2019 16:27
- Просмотров: 464
Назад в “Оглавление” – смотреть
1. Что нужно знать, чтобы вычислить количество теплоты, полученное телом при нагревании или выделенное им при остывании?
Чтобы вычислить количество теплоты, полученное телом при нагревании или выделенное им при остывании, надо знать удельную теплоемкость вещества, массу тела, конечную и начальную температуру.
2.
Как рассчитывают количество теплоты, сообщённое телу при его нагревании или выделяющееся при его охлаждении?
Чтобы подсчитать количество теплоты, необходимое для нагревания тела или выделяемое им при охлаждении, нужно удельную теплоемкость вещества умножить на массу тела и на разность между большей и меньшей его температурами:
Q = cm(t2-t1)
где с – удельная теплоемкость вещества (Дж/кг °С)
m – масса тела (кг)
(t2-t1) – разность конечной и начальной температур (°С)
Например:
Задача1
В железный котел массой 10 кг налита вода массой 20 кг.
Какое количество теплоты нужно передать котлу с водой для изменения их температуры от 10 до 100 °С?
Оба тела — и котел, и вода — будут нагреваться вместе.
Между ними происходит теплообмен, и их температуры можно считать одинаковыми, т. е. температура котла и воды изменяется на 100°С — 10°С=90°С.
Но количества теплоты, полученные котлом и водой, не будут одинаковыми, ведь их массы и удельные теплоемкости различны.
Задача 2
Смешали воду массой 0,8 кг, имеющую температуру 25°С, и кипяток массой 0,2 кг.
Температуру полученной смеси измерили, и она оказалась равной 40 °С.
Вычислить, какое количество теплоты отдал кипяток при остывании и получила холодная вода при нагревании.
Сравнить эти количества теплоты.
4. Какой вывод можно сделать из опыта по смешиванию холодной и горячей воды? Почему на практике эти энергии не равны?
Количество теплоты, отданное горячей водой, и количество теплоты, полученное холодной водой, равны между собой.
То есть, если между телами происходит теплообмен, то внутренняя энергия всех нагревающихся тел увеличивается настолько, насколько уменьшается внутренняя энергия остывающих тел.
Однако на практике обычно получается, что отданная горячей водой энергия больше энергии, полученной холодной водой.
Это объясняется тем, что часть энергии передается окружающему воздуху, а часть энергии — сосуду, в котором смешивали воду.
Равенство отданной и полученной энергий будет тем точнее, чем меньше потери энергии.
Назад в “Оглавление” – смотреть
Содержание:
Количество теплоты:
В чём причина изменения внутренней энергии макроскопического тела при теплообмене?
Теплообмен
Другим способом изменения внутренней энергии термодинамической системы является теплообмен.
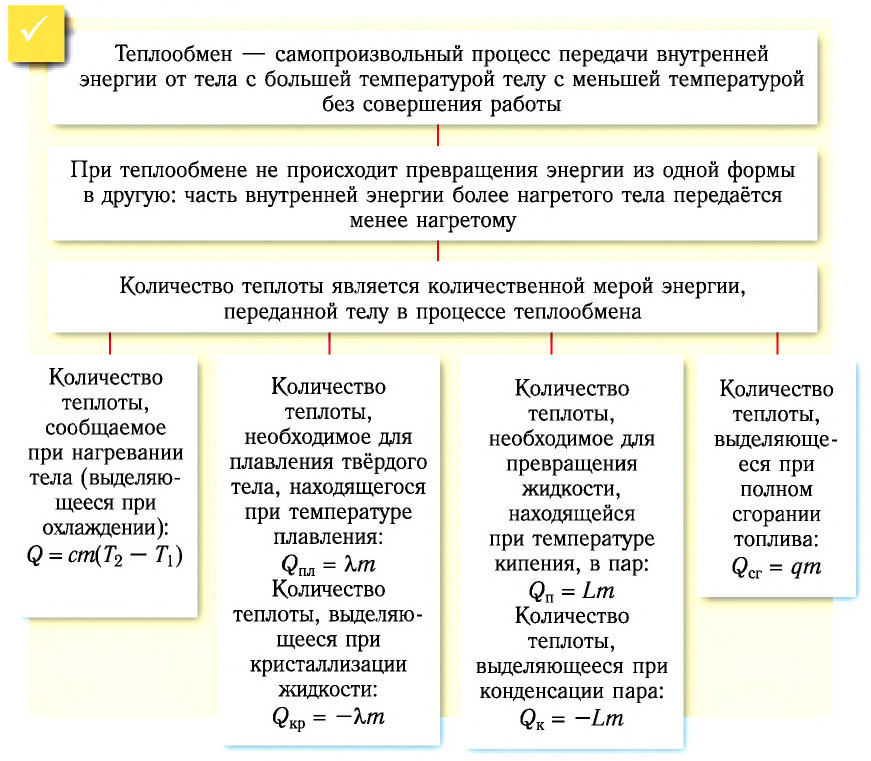
Теплообмен — самопроизвольный процесс передачи внутренней энергии от тела с большей температурой телу с меньшей температурой без совершения работы.
Теплообмен между контактирующими телами называют теплопередачей. За счёт переданной при этом энергии увеличивается внутренняя энергия одного тела и уменьшается внутренняя энергия другого. Если, например, привести в соприкосновение два тела с разными температурами, то частицы более нагретого тела будут передавать часть своей кинетической энергии частицам менее нагретого тела. В результате внутренняя энергия одного тела уменьшается, а другого увеличивается.
Таким образом, при теплопередаче не происходит превращения энергии из одной формы в другую: часть внутренней энергии более нагретого тела передаётся менее нагретому.
Количество теплоты и удельная теплоёмкость
Количественной мерой энергии, сообщённой телу (или отданной им) в процессе теплообмена, является количество теплоты.
В СИ единицей количества теплоты Q является джоуль (Дж). Иногда для измерения количества теплоты используют внесистемную единицу — калорию
Если процесс теплообмена не сопровождается изменением агрегатного состояния вещества, то
где 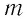
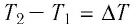
Удельная теплоёмкость зависит от свойств данного вещества и, как показывает опыт, в достаточно большом интервале температур практически не изменяется. Однако удельная теплоёмкость газа зависит от того, при каком процессе (изобарном или изохорном) осуществляется теплообмен.
Интересно знать:
Физическая величина, равная произведению массы тела на удельную теплоёмкость вещества, носит название теплоёмкость тела. Обозначают теплоёмкость С и измеряют в джоулях, деленных на кельвин 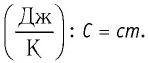
Удельная теплота плавления
Физическую величину, численно равную количеству теплоты, необходимому для превращения кристаллического вещества массой 1 кг, взятого при температуре плавления, в жидкость той же температуры, называют удельной теплотой плавления 
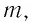
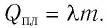
Удельная теплота парообразования
Физическую величину, численно равную количеству теплоты, которое необходимо передать жидкости массой 1 кг, находящейся при температуре кипения, для превращения её при постоянной температуре в пар, называют удельной теплотой парообразования L. Единицей измерения этой величины является джоуль, делённый на килограмм 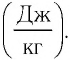
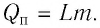
Удельная теплота сгорания топлива
Физическую величину, численно равную количеству теплоты, выделяющемуся при полном сгорании топлива массой 1 кг, называют удельной теплотой сгорания 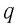
Это количество теплоты передаётся телам, образующим термодинамическую систему, и по отношению к ним является положительной величиной.
- Заказать решение задач по физике
Примеры решения задач
Пример №1
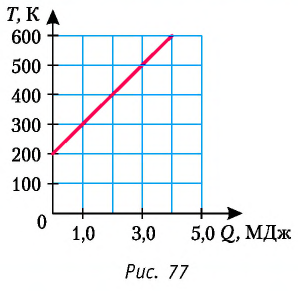
На рисунке 77 представлен график зависимости абсолютной температуры нагреваемого тела от переданного ему количества теплоты. Воспользовавшись таблицей на с. 84, определите вещество, из которого изготовлено тело, если его масса
Решение:
Для того чтобы определить вещество, из которого изготовлено тело, найдём его удельную теплоёмкость с. Анализируя график, делаем вывод, что при нагревании тела от температуры 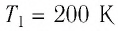
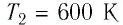
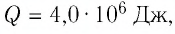
Следовательно, удельная теплоёмкость вещества
Полученное значение удельной теплоёмкости соответствует олову.
Ответ: 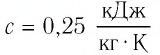
Пример №2
В налитую в сосуд воду, масса которой 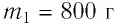
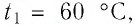
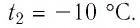
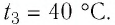
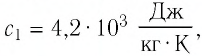
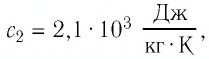
Решение:
Ответ:
- Расчет количества теплоты при нагревании и охлаждении
- Удельная теплота сгорания топлива
- Плавление и кристаллизация в физике
- Испарение жидкостей в физике
- Конвекция в физике
- Излучение тепла в физике
- Виды излучений в физике
- Инфракрасные излучения
Тела, температура которых отличается, могут обмениваться тепловой энергией. То есть, между телами будет происходить теплообмен. Самостоятельно тепловая энергия переходит от более нагретых тел к менее нагретым.
Что такое теплообмен и при каких условиях он происходит
Тела, имеющие различные температуры, будут обмениваться тепловой энергией. Этот процесс называется теплообменом.
Теплообмен – процесс обмена тепловой энергией между телами, имеющими различные температуры.
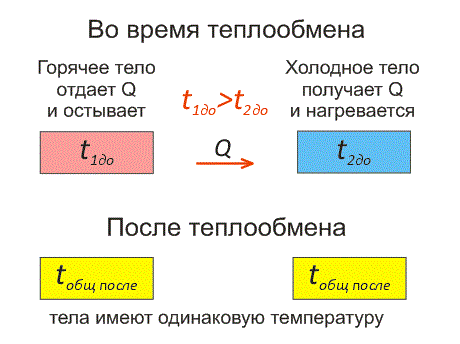
Рассмотрим два тела, имеющие различные температуры (рис. 1).
Тело, имеющее более высокую температуру, будет остывать и отдавать тепловую энергию телу, имеющему низкую температуру. А тело с низкой температурой будет получать количество теплоты и нагреваться.
Рис.1. Два тела во время теплообмена и после
На рисунке, горячее тело имеет розовый оттенок, а холодное изображено голубым цветом.
Когда температуры тел выравниваются, теплообмен прекращается.
Чтобы теплообмен происходил, нужно, чтобы тела имели различные температуры.
Когда температура тел выравняется, теплообмен прекратится.
Тепловое равновесие — это состояние, при котором тела имеют одинаковую температуру.
Уравнение теплового баланса и сохранение тепловой энергии
Когда тело остывает, оно отдает тепловую энергию (теплоту). Утерянное количество теплоты Q имеет знак «минус».
А когда тело нагревается – оно получает тепловую энергию. Приобретенное количество теплоты Q имеет знак «плюс».
Эти факты отражены на рисунке 2.
Рис. 2. Полученное количество теплоты имеет знак «+», а отданное Q – знак «-»
Закон сохранения тепловой энергии: Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом.
Примечание: Существует и другая формулировка закона сохранения энергии: Энергия не появляется сама собой и не исчезает бесследно. Она переходит из одного вида в другой.
Уравнение теплового баланса
Тот факт, что тепловая энергия сохраняется, можно записать с помощью математики в виде уравнения. Такую запись называют уравнением теплового баланса.
Запишем уравнение теплового баланса для двух тел, обменивающихся тепловой энергией:
[large boxed{ Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 }]
(large Q_{text{остывания горяч}} left( text{Дж} right) ) – это количество теплоты горячее тело теряет.
(large Q_{text{нагревания холод}} left( text{Дж} right) ) – это количество теплоты холодное тело получает.
В левой части уравнения складываем количество теплоты каждого из тел, участвующих в теплообмене.
Записываем ноль в правой части уравнения, когда теплообмен с окружающей средой отсутствует. То есть, теплообмен происходит только между рассматриваемыми телами.
В некоторых учебниках применяют сокращения:
[large Q_{1} + Q_{2} = 0 ]
Примечание: Складывая два числа мы получим ноль, когда эти числа будут:
- равными по модулю и
- имеют различные знаки (одно число — знак «плюс», а второе – знак «минус»).
Если несколько тел участвуют в процессе теплообмена
Иногда в процессе теплообмена участвуют несколько тел. Тогда, для каждого тела нужно записать формулу количества теплоты Q. А потом все количества теплоты подставить в уравнение для теплового баланса:
[large boxed{ Q_{1} + Q_{2} + Q_{3} + ldots + Q_{n} = 0 } ]
При этом:
- Q для каждого нагреваемого тела будет обладать знаком «+»,
- Q для каждого охлаждаемого тела — знаком «-».
Пример расчетов для теплообмена между холодным и горячим телом
К горячей воде, массой 200 грамм, имеющей температуру +80 градусов Цельсия, добавили холодную воду, в количестве 100 грамм при температуре +15 градусов Цельсия. Какую температуру будет иметь смесь после установления теплового равновесия? Считать, что окружающая среда в теплообмене не участвует.
Примечание: Здесь мы рассматриваем упрощенную задачу, для того, чтобы облегчить понимание закона сохранения энергии. Мы не учитываем в этой задаче, что вода содержится в емкости. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
При решении других задач обязательно учитывайте, что емкость, в которой будет содержаться вещество, имеет массу. И часть тепловой энергии будет затрачиваться на то, чтобы изменить температуру емкости.
Решение:
В условии сказано, что окружающая среда в теплообмене не участвует. Поэтому, будем считать рассматриваемую систему замкнутой. А в замкнутых системах выполняются законы сохранения. Например, закон сохранения энергии.
Иными словами, с сосудом и окружающим воздухом теплообмен не происходит и, все тепловая энергия, отданная горячей водой, будет получена холодной водой.
1). Запишем уравнение теплового баланса, в правой части которого можно записать ноль:
[large Q_{text{остывания горяч}} + Q_{text{нагревания холод}} = 0 ]
2). Теперь запишем формулу для каждого количества теплоты:
[large Q_{text{остывания горяч}} = c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) ]
[large Q_{text{нагревания холодн}} = c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) ]
Примечания:
- (large c_{text{воды}} ) – удельную теплоемкость воды находим в справочнике;
- Массу воды переводим в килограммы;
- Горячая вода остывает и отдает тепловую энергию. Поэтому, разность (large (t_{text{общ}} — t_{text{горяч}} ) ) будет иметь знак «минус», потому, что конечная температура горячей воды меньше ее начальной температуры;
- Холодная вода получает тепловую энергию и нагревается. Из-за этого, разность (large (t_{text{общ}} — t_{text{холодн}} ) ) будет иметь знак «плюс», потому, что конечная температура холодной воды больше ее начальной температуры;
3). Подставим выражения для каждого Q в уравнение баланса:
[large c_{text{воды}} cdot m_{text{горяч}} cdot (t_{text{общ}} — t_{text{горяч}} ) + c_{text{воды}} cdot m_{text{холодн}} cdot (t_{text{общ}} — t_{text{холодн}} ) = 0 ]
4). Для удобства, заменим символы числами:
[large 4200 cdot 0,2 cdot (t_{text{общ}} — 80 ) + 4200 cdot 0,1 cdot (t_{text{общ}} — 15 ) = 0 ]
Проведем упрощение:
[large 840 cdot (t_{text{общ}} — 80 ) + 420 cdot (t_{text{общ}} — 15 ) = 0 ]
Раскрыв скобки и решив это уравнение, получим ответ:
[large t_{text{общ}} = 58,33 ]
Ответ: Температура смеси после прекращения теплообмена будет равна 58,33 градуса Цельсия.
Задача для самостоятельного решения:
В алюминиевом калориметре массой 100 грамм находится керосин массой 250 грамм при температуре +80 градусов Цельсия. В керосин поместили свинцовый шарик, массой 300 грамм. Начальная температура шарика +20 градусов Цельсия. Найдите температуру тел после установления теплового равновесия. Внешняя среда в теплообмене не участвует.
Примечание к решению: В левой части уравнения теплового баланса теперь будут находиться три слагаемых. Потому, что мы учитываем три количества теплоты:
- (large Q_{1} ) – охлаждение алюминия от температуры +80 градусов до конечной температуры;
- (large Q_{2} ) – охлаждение керосина от температуры +80 градусов до конечной температуры;
- (large Q_{3} ) – нагревание свинца от температуры +20 градусов до конечной температуры;
А справа в уравнение теплового баланса запишем ноль. Так как внешняя среда в теплообмене не участвует.
Выводы
- Если тела имеют различную температуру, то между ними возможен обмен тепловой энергией, т. е. теплообмен;
- Когда тела будут иметь равную температуру, теплообмен прекратится;
- Тело с высокой температурой, отдает тепловую энергию (теплоту) и остывает. Отданное количество теплоты Q имеет знак «минус»;
- А тело с низкой температурой получает тепловую энергию и нагревается. Полученное количество теплоты Q имеет знак «плюс»;
- Количество теплоты, отданное горячим телом равно количеству теплоты, полученному холодным телом. Это – закон сохранения тепловой энергии;
- Сохранение тепловой энергии можно записать в виде уравнения теплового баланса;
- В левой части уравнения складываем количества теплоты (всех тел, участвующих в теплообмене);
- В правой части уравнения записываем ноль, когда теплообмен с окружающей средой отсутствует.
План урока:
Изменение внутренней энергии в расчетах
Что означает удельная теплоемкость?
Какое количество тепла выделяется или поглощается?
Термос. Сосуд Дьюара. Калориметр
Где взять тепло?
Изменение внутренней энергии в расчетах
Работа и теплообмен (теплопередача) – два пути, изменяющих внутреннюю энергию. В преодолении этих путей внутренняя энергия изменяется или на величину совершенной работы А или на величину Q – количество переданной (может быть и отданной) теплоты.
(В седьмом классе было введена буква Δ для обозначения изменения какой-нибудь физической величины. Это использование прописной греческой буквы общепринято).
Пусть через ΔU обозначается изменение внутренней энергии. Тогда ΔU = U2 – U1. Здесь U2 – конечная, а U1 – начальная внутренняя энергия.
В зависимости от пути изменения ΔU можно определить следующими способами:
ΔU = А (если совершается работа) или ΔU = Q (если произошел теплообмен). Изменение ΔU может одновременно пройти двумя способами. И тогда для общего случая:
Источник
Согласно уравнению ΔU = Q + A,
Источник
Величина ΔU находится математическими расчетами. Результат вычислений бывает как отрицательной, так и положительной:
- U2 ˃ U1, то есть энергия растет, тогда ΔU ˃ 0;
- U2 ˂ U1, то есть энергия убывает, тогда ΔU˂ 0.
Слагаемые работа и количество теплоты в равенстве ΔU = Q + A так же могут обладать разными знаками:
- работает внешняя сила, значит, А˃ 0;
- работает само тело – А˂ 0;
- тело получает тепло – Q ˃ 0;
- тело отдает тепло – Q ˂ 0.
На примере это выглядит так.
Внимательно изучив уравнение ΔU = Q + A, можно заметить следующее: если систему рассматриваемых тел изолировать, то есть не выполнять работу, и не дать возможности обмена теплом с внешней средой, то внутренняя энергия тела не сможет изменяться. Это утверждение определяет закон сохранения внутренней энергии и означает, что тепловое движение постоянно.
Еще один важный вывод следует для двух тел, находящихся в изолированном состоянии. При плотном контакте этих тел, начинается процесс теплообмена, что будет продолжаться до той поры, пока температура не выровняется у обоих тел.
Источник
Тела изолированы, а значит, изменяется только их внутренняя энергия, причем на величину тепла (ΔU = Q). Тело холодное получило тепло, а теплое – это тепло отдало.
Почему в нем присутствует знак модуля? Дело в том, что получение тепла имеет положительное значение, а отдача тепла – отрицательное. Но модули этих чисел равны (модуль – это абсолютное числовое значение величины).
Что означает удельная теплоемкость?
Удельное княжество, удельные земли, удел, как судьба или участь, конечно же, не имеют никакого отношения к физике. Но все же они обозначают что-то отдельное, часть, долю. Вот и в случае с теплотой используется понятие удельной теплоемкости вещества, как величины, связанной с частью, а вернее, с единицей объема этого вещества.
Такой простой опыт можно провести в домашних условиях. В равные емкости налить молока и воды одной массы. Нагревать на одинаковых горелках. Термометром для жидкостей следить за температурой обоих веществ. Не пройдет и минуты, станет заметно, что молоко нагревается быстрее.

Это значит, что для нагрева воды до той же температуры, что и молоко, нужно тепла больше.
Следует вывод:
Величина, которая характеризует степень поглощения (или выделения) тепла веществом в физике называется удельной теплоемкостью. Чтобы выяснить, что она означает, надо взять единицу массы вещества (1 кг) нагреть его на 1о С. То количество джоулей тепла, которое поглотится телом при этом и является удельной теплоемкостью данного вещества. Или наоборот, то количество тепла, которое выделится при охлаждении 1 кг вещества на 1о С – это та же самая удельная теплоемкость. Обозначают эту величину буквой c.
Источник
Теперь объяснима разница в нагревании молока и воды. Удельные теплоемкости этих веществ различны: вода – 4200 Дж/кг∙оС, молоко – 4020 (нежирное) и 3875 Дж/кг∙оС (жирное). Это значит, что нагреть молоко легче, чем воду. Из веществ, приведенных в таблице, вода – самое теплоемкое вещество.
Стоит обратить внимание, что в разных агрегатных состояниях, удельная теплоемкость одного и того же вещества различна. Это зависит от того, что структура вещества в разных состояниях различна.
Источник
Какое количество тепла выделяется или поглощается?
Чтобы ответить на этот вопрос, надо выяснить от чего зависит количество теплоты. Зависимость от рода вещества показана на примере нагревания молока и воды. Но этого недостаточно.
Источник
Нетрудно догадаться, что тепла понадобится больше, если нужно нагреть воду до горячего состояния, а не сделать ее только теплой. В процессе охлаждения тепла выделится больше от горячей воды, чем от теплой. А характеризует степень нагретости тела температура. Значит, чем больше разница в начальной и конечной температуре, тем большее количество тепла выделяется или поглощается телом.
Разность температур – это Δt = tкон – tнач .
Теперь еще одна зависимость. Даже младший школьник мог наблюдать у себя на кухне, что целая кастрюля воды нагреваться будет намного дольше, чем половина кастрюли, если ее греть.
Источник
Это значит, количество тепла, потребляемого телом или выделяемого им, зависит от массы тела.
Получается прямая зависимость тепла от трех величин:
- характеристики вещества (удельной теплоемкости);
- величины, на которую изменится температура;
- количественной характеристики тела (массы).
Итак,
Следует обратить внимание на Δt. Если tкон ˃ tнач, разность температур положительна, значит тело нагревается, идет процесс потребления тепла. Если tкон ˂ tнач, разность температур отрицательна, тело охлаждается, происходит выделение тепла.
Термос. Сосуд Дьюара. Калориметр
Достаточно часто требуется остановить или задержать процесс остывания. В бытовых целях для этого используются термосы. Устройство их несложно. Главную роль здесь играет прослойка с низкой теплопроводностью между стенками двойного стеклянного (бывает и из другого вещества) сосуда.
Источник
Для сохранения повышенных или пониженных температур веществ в промышленности, медицине, ветеринарии, косметологии, лабораториях используют теплонепроницаемый сосуд, который носит название своего изобретателя – сосуд Дьюара.
Источник
Состоит сосуд из двух основных резервуаров, изготовленных из термостойкого алюминия. Меньший резервуар находится внутри большего и скреплен с ним небольшими прочными перемычками. Внешний резервуар покрыт защитным веществом, а внутренний очень хорошо отполирован. Сосуд закрыт непроводящей тепло пенопластиковой крышкой. Устройство сосуда Дьюара аналогично строению обычного бытового термоса, но термос – это упрощенный вариант дьюаровского изобретения.
Изначально сосуды Дьюара применялись для легко испаряющихся жидкостей. Теперь же эти сосуды используют для поддержания и сохранения свойств веществ при необходимых температурах. Чаще других в таких сосудах хранят жидкий азот, применение которого очень разнообразно:
- удаление недоброкачественных и доброкачественных опухолей в медицине;
- удаление бородавок и папиллом в косметологии;
- транспортировка биоматериалов для искусственного оплодотворения животных в ветеринарии;
- научные исследования в лабораториях;
- достижение прочности металлов в машиностроении;
- шоу, развлечения.
приготовление мороженого, заморозка сметаны или фруктов в кулинарии

При исследованиях в школе и проведении опытов вместо сосудов Дьюара и термосов используют более простой прибор, который называют калориметром
Источник
Такое приспособление не может исключить полную связь содержимого внутреннего сосуда с внешней средой. Чтобы потеря тепла во внешнюю среду была минимальной, нужно опыты проводить достаточно быстро.
Используя калориметр, в условиях учебного класса можно проверить справедливость уравнения теплового баланса. Для этого понадобится одинаковое количество (например, 50 г) холодной и горячей воды, калориметр и термометр.
Пусть в первом калориметре температура горячей воды 80оС, а во втором – комнатная температура, равная 20оС.
Нужно аккуратно холодную воду перелить в калориметр с горячей водой. Полученную смесь осторожно перемешать термометром (трубочку или ложку для смешивания брать не стоит, чтобы лишний раз не нарушать выбранную изолированную систему тел).
Начальные температуры воды и температуру смеси записать и использовать в дальнейших расчетах. Учитывая табличное значение удельной теплоемкости воды (4200 Дэ/кг о С), взятую массу (50 г = 0, 05 кг), вычисления будут следующими:
Конечно, такой результат может получиться лишь теоретически. В опыте с калориметром есть недостаток в том, что существует недостаточная изоляция системы рассматриваемых тел. Тепло горячей воды попадает во внешнюю среду, так как калориметр с горячей водой не закрыт. Нельзя забывать, что измерения проводятся с определенной долей погрешности.
Но суть проделанных набольших исследований понятна и подтверждает уравнение теплового баланса.
Где взять тепло?
Ответ прост. При сгорании топлива, виды которого разнообразны.
Источник
Отопительная ценность, например, каменного угля определяется количеством тепла, выделяющегося в процессе сгорания одного его килограмма.
Откуда в угле берется тепло? По одной из теорий топливные материалы, такие как уголь и торф, образовались из растений.
Некогда почти вся земля была покрыта растительностью, главным образом гигантскими лесными чащами. На месте сваленных бурей деревьев вырастали новые. С течением времени образовался толстый слой гниющего дерева. Некоторые пространства земного шара были опустошены буйными ураганами или сползающими ледниками. Пространства эти со временем покрыл ил, нанесенный волнами рек и морей. Или же землю засыпал песок пустынь. В таких условиях бревна, находящиеся под большим давлением и без доступа воздуха, образовали слой вещества, которое теперь называют каменным углем.
Долгое время тепло от сгорания топлива измерялось в калориях (1 кал) – это количество тепла, необходимое для нагревания 1 г воды на 1оС. Большая калория – килокалория (1 ккал) – количество тепла, необходимое для повышения температуры 1 килограмма воды на 1оС.
Сейчас вместо калорий и килокалорий используются Джоули и единицы, производные от 1 Джоуля.
Эта величина тепла называется удельной теплотой сгорания топлива и обозначается буквой q.
Источник
Например, табличное значение для природного газа, который сейчас очень широко применяется, q = 4,4 ∙ 107 Дж/кг означает: при сгорании 1 кг природного газа выделяется 4,4 ∙ 107 Джоулей тепла.
Если сгорает не один килограмм топлива, то полученное количество выделившегося тепла определяется формулой Q = qm.
Само тепло получается, как результат изменения опять же внутренней энергии сгорающего топлива. Горение происходит всегда с участием кислорода. При этом атомы кислорода, соединившись с атомами углерода (содержится и в древесном угле, и в каменном, и в нефти, и бензине), образуют продукт горения – это углекислый газ. Его молекулы обладают кинетической энергией большей, чем молекулы кислорода и углерода, отдельно взятые. Следовательно, внутренняя энергия становится больше и проявляется в виде выделения тепла.
Процесс увеличения энергии во время горения называют выделением энергии, то есть выделением тепла.
Чтобы можно было использовать тепло от сгоревшего топлива, человеком с давних пор применяются и простые, и сложные приспособления. Это костер, свеча, печь, газовая горелка, спиртовка, тепловые машины, двигатели.
На службе человека находятся и такие мощные преобразователи тепла, как тепловые электростанции.