Очень часто можно встретить задачу, в которой из одного раствора отбирают определенный объем и перемещают в другой объем растворителя, доводя его «до метки». Отобранный объем раствора называют аликвотой, а уровень, до которого доводят раствор – верхний или нижний мениск. Эти термины активно применяются в аналитической химии, при, так называемом, титриметрическом методе анализа. В данном случае мы говорим, что произошел процесс “разбавления“, то есть уменьшение концентрации вещества за счет добавления растворителя.
Как правило, в задачах, где имеются подобные формулировки, требуется найти либо количество вещества в исходном растворе, либо концентрацию исходного раствора, либо концентрацию вещества в разбавленном растворе.
Рассмотрим следующий пример разбавления:
40 г гидроксида натрия растворили в 500 мл колбе. Затем отобрали аликвоту пипеткой 50 мл и перенесли в колбу объемом 250 мл, добавив до уровня воду. Какая концентрация гидроксида натрия будет в разбавленном растворе?
Попробуем понять логику данной задачи. Вначале приготовили раствор с определенной концентрацией. Какой? Легко рассчитать, зная количество вещества гидроксида натрия (а его легко рассчитать, поделив массу гидроксида натрия на его молярную массу), и поделив это количество на объем раствора, выраженное в литрах.
Чему же равен объем полученного раствора? Объему сосуда, в котором он помещен, то есть 500 мл или 0,5 л. (Тогда концентрация гидроксида натрия составляет 2 моль/л. Проверь сам расчетами).
Что сделали дальше? Взяли часть вещества. Все вещество (1 моль) находится в объеме 500 мл, а взяли только 50 мл (аликвота показывает, сколько вещества взяли для дальнейшей работы). Тогда очевидно, количество вещества, которое окажется в аликвоте будет в 10 раз меньше того, что было в колбе (ведь взяли объем в 10 раз меньше – 50 мл от 500 мл).
И это количество составит всего 1/10, то есть 0,1 моль.
Что же дальше? А дальше это вещество поместили в 250 мл колбу и добавили воду до отметки, то есть довели объем раствора до данного значения (250 мл).
Опять не трудно рассчитать концентрацию полученного раствора: 0,1/0,250=0,4 моль/л.
Если мы теперь внимательно посмотрим на наши логические действия, то заметим, что все время умножали и делили одни объемы на другие.
При делении объема аликвоты на объем сосуда, в который помещается данная аликвота мы получаем “степень разбавления”. Умножая степень разбавления на исходную концентрацию раствора, мы получаем концентрацию разбавленного раствора. Вот и вся премудрость!
При нахождении концентрации исходного раствора поступаем с точностью до наоборот.
При разбавлении и концентрировании
растворов количество вещества (количества
вещества эквивалента) остается постоянным.
Пример 6. Какой объем раствора HCl,
С1(HCl) = 6 моль/л, необходимо
использовать для приготовления 250 мл
раствора этой кислоты с концентрацией
С2(HCl) = 2,5 моль/л.
Решение:
V(HCl) =
![]()
n(HCl) = const;
n(HCl) = C2(HCl)·V2 = 2,5·0,25 = 0,625 моль
V(HCl) =
![]()
= 0,104 л = 104 мл
Ответ: необходимо использовать 104
мл раствора.
Пример 7. До какого объема следует
упарить 3,5 л раствора серной кислоты,
С1(![]() H2SO4) = 0,04 моль/л,
H2SO4) = 0,04 моль/л,
чтобы получить раствор с концентрацией
кислоты 0,2 моль/л.
Решение:
Величина n(H2SO4) определяется
из данных условия:
n(H2SO4) = n(![]() H2SO4)·
H2SO4)·![]()
= С1(![]() H2SO4)·
H2SO4)·![]() ·V
·V
= 0,04·![]() ·3,5
·3,5
= 0,07 моль
Отсюда V =
![]()
=
![]()
= 0,35 л = 350 мл
Ответ: исходный раствор следует
упарить до объема 350 мл.
2. 3. Расчеты, связанные со смешиванием растворов различной концентрации
При смешивании растворов количество
вещества n(X) (количества вещества
эквивалента) в полученном растворе
равно сумме количества вещества
(количества вещества эквивалента) в
смешиваемых растворах n 1(X), n
2(X) … n n(X):
n(X) = n 1(X) + n 2(X) + n 3(X) +…+
n n(X),
При смешивании растворов объем
полученного раствора не равен сумме
объемов смешиваемых растворов. Это
явление называют контракцией растворов.
Поэтому объем полученного раствора
следует рассчитывать.
При решении задач на смешивание растворов
часто приходится производить перерасчет
одной концентрации в другую.
Пример 8. Рассчитать массовую долю
1,25 н. раствора фосфорной кислоты, если
плотность раствора составляет 1,05 г/мл.
Решение:
ω(H3PO4) =
![]()
Объем раствора принимаем за 1 л (1000 мл).
Тогда масса раствора равна:
m(р-ра) = V·ρ = 1000·1,05 = 1050 г
Фактор эквивалентности H3PO4
=
![]()
Количество вещества: n(![]() H3PO4)
H3PO4)
= C(![]() H3PO4)·V
H3PO4)·V
= 1,25·1 = 1,25 моль
Масса H3PO4 в растворе:
m(H3PO4) = n(![]() H3PO4)·M(
H3PO4)·M(![]() H3PO4)
H3PO4)
= n(![]() H3PO4)·
H3PO4)·![]() ·M(H3PO4)
·M(H3PO4)
m(H3PO4) = 1,25·![]() ·98
·98
= 40,83 г
Массовая доля H3PO4 в растворе:
ω(H3PO4) =
![]()
= 0,039 или 3,9%
Ответ: ω(H3PO4) = 0,039 или
3,9%.
Пример 9. Смешали 3 литра раствора
H3PO4 (C(H3PO4) = 0,1 моль/л)
и 2 литра раствора H3PO4
(ω(H3PO4) = 90%, ρ = 1,05 г/мл). Вычислить
молярную концентрацию и молярную
концентрацию эквивалента полученного
раствора (контракцией можно пренебречь).
Решение:
Фактор эквивалентности H3PO4
=
![]()
С(H3PO4) =
![]()
С(![]() H3PO4)
H3PO4)
=
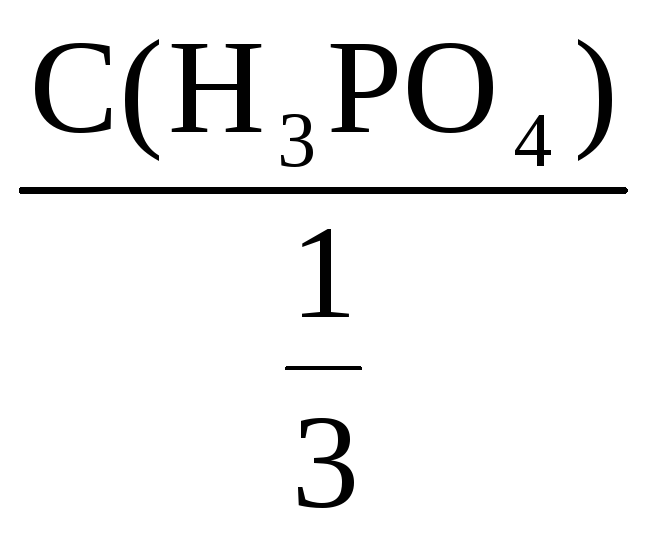
= 3·С(H3PO4)
Поскольку по условию задачи контракцией
пренебрегаем, то:
V = V1 +V2 = 3,0 + 2,0 = 5,0 л
Количества вещества в полученном
растворе определяется по формуле:
n(H3PO4) = n1(H3PO4)
+ n2(H3PO4)
Количества вещества в первом исходном
растворе:
n1(H3PO4) = C(H3PO4)·V1
= 0,1·3 = 0,3 моль
Количества вещества во втором исходном
растворе:
n2(H3PO4) =
![]()
=
![]()
=
![]()
= 1,928 моль
Отсюда n(H3PO4) = 0,3 + 1,928 = 2,228
моль
С(H3PO4) =
![]()
= 0,446 моль/л
С(![]() H3PO4)
H3PO4)
= 3·0,446 = 1,337 моль/л
Ответ: молярная концентрация
полученного раствора H3PO4
равна 0,446 моль/л, молярная концентрация
эквивалента этого раствора равна 1,337
моль/л.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Разбавле́ние — уменьшение концентрации химического вещества в растворе добавлением растворителя или смешиванием с менее концентрированным раствором. При разбавлении сохраняется количество растворенного вещества.
Расчет растворов[править | править код]
Для приготовления растворов определенной концентрации следует тщательно рассчитывать массы и объемы смешиваемых растворов, исходя из сохранения количества растворенного вещества при разбавлении:


где 





Пример[править | править код]
Запись концентраций 



Друг над другом пишутся процентные концентрации (массовые или объемные) соответственно разбавляемого раствора и разбавителя (для чистого растворителя пишется 0 %). Справа посередине пишется желаемая концентрация (её значение должно быть между концентрациями разбавляемого раствора и разбавителя). Далее производится вычитание по диагоналям от большего значения меньшего и полученные разности записываются напротив исходных растворов. Полученные цифры являются массами (если были взяты массовые проценты) или объемами (если были взяты объемные проценты) соответствующих растворов, которые необходимо взять для приготовления раствора, с концентрацией записанной в середине. Затем полученные значения приводят к необходимым массам или объемам по условиям задания (для перевода массовых единиц в объемы может понадобится знать плотность растворов).

Действительно, чтобы из 50%-го раствора (по массовой концентрации) и воды (0 %) получить 18%-й раствор, следует взять 

Техника разбавления[править | править код]
При приготовлении растворов кислот требуется соблюдать правила техники безопасности: использовать очки, перчатки и фартуки. Во избежание резкой экзотермической реакции следует постепенно добавлять кислоту в воду.
Download Article
Download Article
Dilution is the process of making a concentrated solution less concentrated. There are a variety of reasons why one might want to perform a dilution. For example, biochemists dilute solutions from their concentrated form to create new solutions for use in their experiments. As a more casual type of dilution, bartenders often dilute hard liquor with a soft drink or juice to make a cocktail more palatable. For diluting solutions in lab experiments, the formal formula for calculating a dilution is C1V1 = C2V2, where C1 and C2 represent the concentrations of the initial and final solutions, respectively, and V1 and V2 represent their volumes.
-

1
Determine what you do and don’t know. Performing a dilution in chemistry usually means taking a small amount of a solution whose concentration you know, then adding a neutral liquid (like water) to make a new solution with a larger volume but a lower concentration. This is done very frequently in chemistry labs, as, for efficiency’s sake, reagents are often stored at relatively high concentrations which are then diluted for use in experiments. Usually, in most real-world situations, you will know the concentration of your starting solution and both the concentration and volume you want in your second solution, but not the volume of the first solution you need to use to get there.[1]
- However, in other situations (especially in schoolwork problems), you may need to find some other part of the puzzle – for instance, you may be given an initial volume and concentration, then asked to find the final concentration if you dilute the solution to a given volume. In the case of any dilution, it’s helpful to take stock of known and unknown variables before beginning.
- Let’s tackle an example problem. Say that we’re tasked with diluting a 5 M (molar) solution with water to make 1 liter (0.3 US gal) of a 1 mM (millimolar) solution. In this case, we know the concentration of the solution we’re starting with and the target volume and concentration we want, but not how much of the initial solution we need to add water to get there.
- Reminder: In chemistry, M is a measure of concentration called Molarity, which indicates moles of a substance per liter.
-

2
Plug your values into the formula C1V1 = C2V2. In this formula, C1 is the concentration of the starting solution, V1 is the volume of the starting solution, C2 is the concentration of the final solution, and V2 is the volume of the final solution. Plugging your known values into this equation will allow you to find the unknown value with minimum difficulty.[2]
- You may find it helpful to put a question mark in front of the variable that you are solving for.
- Let’s continue our example. We would plug our known values in as follows:
- C1V1 = C2V2
- (5 M)V1 = (1 mM)(1 L). Our two concentrations have different units. Let’s stop here and proceed to the next step.
Advertisement
-

3
Account for any differences in units. Because dilutions involve changes in concentration (which can sometimes be quite large), it’s not uncommon for two variables in your equation to be in different units. Though this is easily overlooked, mismatching units in your equation can cause your answer to be orders of magnitude off. Before solving, convert all values with differing concentration and/or volume units.[3]
- In our example, we use different units for concentration M (molar) and mM (millimolar). Let’s convert our second measurement to M:
- 1 mM × 1 M/1,000 mM (There are 1,000 mM per 1 M.)
- = 0.001 M
- In our example, we use different units for concentration M (molar) and mM (millimolar). Let’s convert our second measurement to M:
-

4
Solve to find the missing variable. When all your units match, solve your equation. This almost always can be done with simple algebra.[4]
- We left our example problem here: (5 M)V1 = (1 mM)(1 L). Let’s solve for V1 with our new units.
- (5 M)V1 = (0.001 M)(1 L)
- V1 = (0.001 M)(1 L)/(5 M).
- V1 = 0.0002 L., or 0.2 mL.
- We left our example problem here: (5 M)V1 = (1 mM)(1 L). Let’s solve for V1 with our new units.
-

5
Understand how to use your answer practically. Let’s say you have found your missing value, but you’re unsure of how to apply this new information to a real-world dilution you need to perform. This is understandable – the language of math and science sometimes doesn’t lend itself to the real world. When you know all four values in the equation C1V1 = C2V2, perform your dilution as follows:[5]
- Measure the volume V1 of the solution with concentration C1. Then, add enough diluting liquid (water, etc.) to make a total volume V2. This new solution will have your desired concentration (C2).
- In our example, for instance, we would first measure 0.2 milliliters (0.007 fl oz) of our 5 M solution. Next, we would add enough water to increase the volume of the solution to 1 L: 1 L – 0.0002 L = 0.9998 L, or 999.8 milliliters (33.8 fl oz). In other words, we would add 999.8 milliliters (33.8 fl oz) of water to our tiny sample of solution. Our new, diluted solution has a concentration of 1 mM, which is what we wanted in the first place.
Advertisement
-

1
Read any packaging for information. There are a wide variety of reasons why you might want to make a dilution at home, in the kitchen, or in another non-chemistry lab setting. For instance, the simple act of making orange juice from concentrate is a dilution. In many cases, products that need to be diluted include information about the dilution that needs to be made somewhere on the packaging. They may even have precise directions to follow. Here are some things to look for when searching for information:[6]
- The volume of the product to use
- The volume of the diluting liquid to use
- The type of diluting liquid to be used (usually water)
- Special mixing instructions
- You probably won’t see information about the precise concentrations of the liquids being used. This information is superfluous to the average consumer.
-

2
Add the substance acting as the dilute to the concentrated solution. For simple household dilutions, such as the ones you might make in the kitchen, you only really need to know the volume of concentrate you’re using and the approximate final concentration you’d like before beginning. Dilute the concentrate with an appropriate amount of diluting liquid, which is determined relative to the initial volume of concentrate being used.[7]
See below:- For example, if we want to dilute 1 cup of concentrated orange juice to 1/4 its initial concentration, we would add 3 cups of water to the concentrate. Our final mixture would have 1 cup of concentrate in 4 cups of total liquid – 1/4 its initial concentration.[8]
- Here’s a more complex example: If we wanted to dilute 2/3 cup of concentrate to 1/4 its initial concentration, we would add 2 cups of water, because 2/3 cup is 1/4th of 2&2/3 cups total liquid.
- Be sure to add your substances to a vessel that’s big enough to accommodate the final volume you want – a large bowl or similar container.
- For example, if we want to dilute 1 cup of concentrated orange juice to 1/4 its initial concentration, we would add 3 cups of water to the concentrate. Our final mixture would have 1 cup of concentrate in 4 cups of total liquid – 1/4 its initial concentration.[8]
-

3
Ignore the volume of powders in most cases. Adding powders (like certain drink mixes) to liquids usually doesn’t need to be thought of as a “dilution.” The volume change created by the addition of a small amount of powder to a liquid is usually small enough that it can be effectively ignored. In other words, when adding small amounts of powder to a liquid, just add the powder to the final volume of liquid you want and mix.
Advertisement
Add New Question
-
Question
How can I prepare 5% of hydrochloric acid solution from concentrate HCl?

Measure out 5 ml. of HCl acid, transfer it to a 100 ml. volumetric flask, and fill the flask to the mark with deionized water.
-
Question
Why should I dilute cleaning chemicals?

If they are concentrated, the fumes can be very harmful if they are breathed in, as they can damage the ‘hairs’ in the trachea. Furthermore, if they touch the skin, they can cause severe to mild irritation. Apart from this, they can also be harmful to the surface that you are trying to clean, especially if it is wood, or other such sensitive materials. All this is because cleaning products are usually strong alkalis.
-
Question
How do I dilute a 0.9 percent solution of 500 ml to a .45 percent solution?

Provided that your solvent (a major component) is nearly pure, then you need another 500 ml. Hence you will have 0.45 percent solution since you haven’t changed the solute (a minor component). This is because you increased the total solution to 1L.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
-
Follow any safety guidelines provided by the manufacturing company or that your company requires. This is especially important if you need to dilute an acid solution.[9]
-
Working with an acid solution may require more detailed steps and safety guidelines than diluting non-acid solutions.[10]
Advertisement
References
About This Article
Article SummaryX
To dilute solutions, such as simple household solutions, make sure you know the volume of concentrate you’re using and the approximate final concentration you’d like to wind up with. For example, if you want to dilute 1 cup of concentrated orange juice to ¼ its initial concentration, add 3 cups of water for a total of 4 cups liquid. To learn how to accurately dilute concentrates with dilution equations, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 391,300 times.
Did this article help you?
Разбавление раствора — это уменьшение концентрации вещества путем добавления растворителя или менее концентрированного раствора, при этом количество вещества остается неизменным. Разбавление растворов происходит постоянно, как в научных биохимических экспериментах, так и на кухне при приготовлении напитков.
Количество вещества и молярная масса
Для начала следует разобраться с такими понятиями, как моль и количества вещества. Итак, моль — это такое количество химического вещества, в котором содержится 6,022 × 1023 частиц, атомов или молекул. Значение 6,022 × 1023 — это число Авогадро, выбранное как количество атомов, которые содержатся в 12 граммах углерода-12. Следовательно, моль любого вещества — это 6,022 × 1023 его структурных единиц. Например, если говорится об одном моле простого атомарного гелия He, то имеется в виду 6,022 × 1023 атомов. Если же речь идет об одном моле соляной кислоты HCl, то подразумевается 6,022 × 1023 молекул.
Молярная масса — масса в граммах одного моля вещества. Этот параметр легко определить при помощи периодической таблицы, суммировав атомные веса элементов, составляющих молекулу. Например, один моль воды H20 весит 18 грамм, так как атомный вес кислорода составляет 16 единиц, а водорода — 1 единицу. Следовательно, по формуле H2O молярная масса выражается как 16 + 1 × 2 = 18.
Раствор и концентрация
Раствор — это однородная смесь растворенного вещества и растворителя. Раствор можно приготовить при помощи смешения жидкости и твердого вещества или жидкости и газа. В этих случаях жидкость выступает в роли растворителя, а газ или твердое тело — растворенного вещества. Если смешиваются две жидкости, то растворителем считается менее концентрированная жидкость. При этом разбавление растворов — это как раз о концентрации, но как она выражается?
Молярность или молярная концентрация — это количество вещества в молях в 1 литре раствора. Например, раствор соляной кислоты с молярностью в 2 моля записывается как 2M HCl. Это означает, что в одном литре раствора соляной кислоты содержится 2 моля вещества, а так как молярная масса хлороводорода составляет 36,46 грамм на моль, то в литре раствора содержится 36,46 × 2 = 72,92 грамма соляной кислоты.
Концентрация растворов может измеряться и по-другому. Моляльность — это количество вещества в молях в 1 килограмме растворителя. Обратите внимание на разность между молярностью и моляльностью: в первом случае измеряется количество вещества по отношению к литру раствора, во втором — к килограмму растворителя. Например, если растворить 36,46 г соляной кислоты в 1 литре этанола, то его молярность будет равна 1 моль/л. Моляльность же выражается по отношению к килограмму растворителя, в роли которого в примере выступает этанол. Масса 1 литра этанола составляет 789 грамм (0,789 кг), поэтому моляльность раствора будет равна 1 моль / 0,789 кг = 1,26 моль/кг.
Понятно, что если взять литр этанола и залить им соляную кислоту, то раствор получит меньшую молярность, так как в сумме объем раствора будет несколько больше, чем один литр. Во избежание таких ошибок требуется добавить в колбу требуемую массу вещества, и только после этого долить растворитель до заданной отметки.
Разбавление раствора
Самый банальный пример разбавления раствора — это смешение алкогольных напитков с водой, соком или содовой. Из примера видно, что разбавление растворов требуется для уменьшения их концентрации, и если при смешивании коктейлей снижается крепость «раствора», то в химии снижается молярность. Важно помнить, что количество молей растворенного вещества при этом не изменяется. Параметры раствора при разбавлении подчиняются следующему закону:
c1 × v1 = c2 × v2,
где c1 и v1 — молярная концентрация и объем раствора до разбавления, а c2 и v2 — после разбавления.
Это элементарная пропорция, при помощи которой легко регулировать желаемую концентрацию или объем разбавленного раствора. Рассмотрим подробнее.
Определение концентрации
Посчитаем молярную концентрацию раствора, полученного путем разбавления 200 мл 5М раствора до 5 литров. Для правильного расчета выразим объемы растворов в одних единицах измерения и запишем пропорцию:
5 × 200 = с2 × 5 000
Теперь достаточно выразить концентрацию c2 = (5 × 200) / 5000 = 0,2 М. Таким образом, разбавление раствора до 5 литров снизило его молярность до 0,2 молей.
Определение объема
Теперь определим, какой объем раствора необходим, чтобы концентрация 200 мл 5М снизилась до 2М. Вновь запишем пропорцию:
5 × 200 = 2 × v2
Выразим объем и получим v2 = 5 × 200 / 2 = 500 мл. Следовательно, для уменьшения концентрации раствора до 2 моль требуется увеличить объем раствора до 500 мл.
Наша программа представляет собой калькулятор, который вычисляет финальную концентрацию разбавленного вещества. В элементарной пропорции наибольшую трудность вызывает приведение единиц к одной размерности. Например, что делать, если требуется разбавить раствор молярностью 30 наномоль для получения раствора с концентрацией 5 фемтомоль? Для решения подобных задач и разработан наш калькулятор. Для решения задачи требуется ввести значения в соответствующие ячейки и выбрать единицы измерения.
Заключение
Разбавление растворов — практическая задача, которая встречается не только в химической лаборатории, но и на кухне. Для простых бытовых расчетов легко использовать пропорцию, но для более точных вычислений используйте наш онлайн-калькулятор.
