Как составить уравнение химической реакции: пошаговая инструкция
Превращение одних веществ в другие — обычное явление, которое происходит в ходе химических реакций. Для того чтобы обозначить, как протекают такие процессы, используют специальную систему уравнений. Так, например, горение метана (мы можем наблюдать его каждый день, когда зажигаем газовую плиту) протекает по следующей схеме:
СН4 + 2О2 → СО2 + Н2О
Расшифровать уравнение реакции можно следующим образом. Две молекулы кислорода соединяются с молекулой метана и в результате формируют две молекулы воды и молекулу углекислого газа. Можно отметить, что во время протекания реакции связи между некоторыми атомами (например, водорода и углерода) разрываются. Вместо них появляются новые, благодаря которым и формируются углекислород и вода.
Особенности записи формул химических реакций
Уравнения химических реакций: способы решения заданий
Для удобства записи уравнения химических реакций делают предельно схематичными: их записывают только при помощи латинских букв и цифр. В левой части уравнения указываются реагенты (те вещества, которые взаимодействуют между собой), а в правой — так называемые продукты реакции (те вещества, которые формируются после завершения процесса). При записи уравнения важно помнить о двух правилах.
- Атомы не исчезают никуда и не появляются из ниоткуда (соответственно, их число в обоих частях формулы должно быть одинаковым).
- Общая масса реагентов не может отличаться от итоговой массы продуктов реакции (именно по этой причине записи протекания реакций называют уравнениями).
Какими бывают химические реакции
Выделяют четыре варианта взаимодействия химических веществ друг с другом.
| Тип реакции | Пример | Особенности |
| Соединения | Формула образования воды:
2H2 + O2 = 2H2O |
Несколько реагентов (простых или сложных веществ) создают один продукт. |
| Разложения | При нагревании известняка он разделяется на углекислый газ и негашеную известь:
Стрелка, направленная вверх, показывает, что сформировавшийся газ улетучился и больше не участвует в процессе. |
Одно вещество распадается на несколько простых компонентов. |
| Замещения | При образовании хлорида цинка атомы цинка встают на место атомов водорода, который включен в состав хлороводорода:
Zn + 2HCl = H2↓ + ZnCl2 Направленная вниз стрелка показывает, что вещество осталось в осадке. |
В таких реакциях обязательно участвуют простое и сложное вещества. При более активные атомы простого вещества вытесняют (замещают) компоненты сложного. |
| Обмена | CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl | В таких реакциях обязательно участвуют два сложных вещества, которые обмениваются атомами. Важно помнить: в уравнениях обмена обязательно формируются газ, осадок или вода. |
Как расставить коэффициенты в химических уравнениях
Чтобы уравнение реакции было верным, крайне важно правильно расставить в нем коэффициенты. С помощью этих цифр указывается, какое число молекул необходимо для протекания реакции. Внешне коэффициент выглядит как число, поставленное перед формулой вещества (например, 2NaCl). Важно не перепутать их с индексами: последние как раз ставятся под символом химического элемента и указывают на количество атомов (например, H2).
Если вам требуется узнать, сколько атомов конкретного вещества участвует в реакции, следует индекс умножит на коэффициент. Например, при использовании двух молекул воды (2H₂O) речь идет о четырех атомах водорода и двух атомах кислорода. При решении уравнения реакции задача ученика — подобрать коэффициент и узнать, сколько молекул участвует в процессе.
Помочь разобраться в этом нелегком деле могут наши репетиторы по химии в Москве. Ведь, согласитесь, поспеть за школьной программой порой непросто и некоторые темы требуют более детального изучения, чем отведенные несколько школьных уроков.
Как составить уравнение химической реакции: пошаговая инструкция
- Подготовьте схему реакции. Для этого потребуется выделить реагенты и продукты реакции. Например, для формирования оксида магния схема будет выглядеть так: Mg + O2 → MgO.
- Расставьте коэффициенты. Из предыдущего примера видно, что в левой части уравнения представлено два атома кислорода, а в правой — только один. Поэтому в продукте реакции нужно увеличить количество молекул: Mg + O2 → 2MgO. Теперь у нас есть равное количество атомов кислорода, а вот с магнием возникла проблема. Уравняем и его число: 2Mg + O2 = 2MgO. Обратите внимание, что знак равно можно ставить только после того, как уравнение решено, до этого используется символ горизонтальной стрелки.
Уравнения химических реакций: способы решения заданий
В качестве завершающего примера предложим реакцию разложения нитрата калия. Он образует два вещества: кислород и нитрит калия. Схема реакции выглядит следующим образом: KNO₃ → KNO₂ + О₂. Если с атомами азота и калия все в порядке, то кислорода до момента начала реакции было три, а вот по завершении разложения стало уже четыре. Чтобы уравнять части поставим перед реагентом удвоенный коэффициент: 2KNO₃ → KNO₂ + О₂.
Теперь нужно разобраться с цифрами. До реакции мы имеем по два атома азота и калия и шест атомов кислорода. После же разложения атомов азота и калия по одному, а атомов кислорода всего четыре. Чтобы создать равенство, потребуется поставить удвоенный коэффициент перед нитритом калия в продуктах реакции: 2KNO₃ = 2KNO₂ + О₂. В итоге мы получили равное количество атомов в обеих частях: по два калия и азота и шесть кислорода. Важность уравнений состоит в том, что они не только дают определить, какие вещества получатся в ходе протекания реакции, но и позволяют понять количественное соотношение используемых реагентов.
Как расставлять коэффициенты в химических уравнениях
Содержание:
Все химические реакции, проходящие в окружающем мире можно описать при помощи специальных уравнений, представляющих собой химические формулы и математические знаки с коэффициентами. И от правильно расставленных коэффициентов в химических уравнениях порой зависит не много не мало, а то какой собственно и будет химическая реакция и будет ли она вообще. В нашей статье мы расскажем о том, как правильно расставлять коэффициенты в химии, чтобы химические уравнения были записаны верно.
Пример разбора простых реакций
Главное правило, которым следует руководствоваться при составлении химических уравнений – принцип сохранения энергии вещества, то есть, сколько есть атомов каждого химического элемента в левой части уравнения, столько должно быть и в правой части того же уравнения.
Для примера возьмем химическую реакцию взаимодействия кальция (Ca) с кислородом (O2). Но для начала объясним, почему вообще кислород (как и некоторые другие химических элементы) в химических уравнениях записывается с индексом «2». Дело в том, что одна молекула кислорода имеет 2 атома, поэтому его записывают как O2. В свою очередь, к примеру, одна молекула воды, состоящая из кислорода и водорода, имеет всем известную формулу H2O. Это означает, что каждая молекула воды состоит из двух атомов водорода и одного атома кислорода. Заметьте, что по своему усмотрению индексы в химических уравнениях и формулах менять нельзя, так как они изначально должны быть написаны правильно.
Теперь вернемся к нашему простому примеру реакции взаимодействия кальция и кислорода. Ее можно записать следующим образом:
О чем говорит эта запись? О том, что в результате химической реакции взаимодействия кальция с кислородом образуется оксид кальция, который записан формулой CaO. Но также обратите внимание, что в правой части оксид кальция мы записали с коэффициентом 2 – 2CaO. Это значит, что каждый из двух атомов кислорода сцепился со своим атомом кальция, но тогда происходит несоответствие – в правой стороне у нас два атома кальция, в то время как в левой только лишь один. А значит, чтобы запись была правильной в левой части мы должны перед кальцием поставить коэффициент 2:
Теперь мы можем проверить наше уравнение – с левой стороны у нас два атома кальция и с правой тоже два, а значит между обеими частями можно вполне справедливо поставить знак равенства:
Разберем еще один простой пример, из взаимодействия кислорода и водорода как мы знаем, рождается одно из самых ценным и необычных веществ во Вселенной (и это без преувеличения) – вода, основа жизни на нашей планете. Образование воды можно записать следующим уравнением:
Но где же здесь закралась ошибка? Давайте разберем: в левой части у нас два атома кислорода, а в правой только один. Значит перед формулой воды необходимо поставить коэффициент 2:
Умножение 2 молекул воды на 2 атома водорода даст нам 4 атома водорода с правой стороны, но ведь с левой стороны атомов водорода лишь два! Значить перед водородом в уравнении мы также должны поставить коэффициент 2 и теперь получим правильное химическое уравнение, где вместо стрелочки → можно уже смело поставить знак равенства.
Пример разбора сложной реакции
Теперь давайте разберем то, как проставлять коэффициенты в более сложных химических уравнениях:
Перед вами запись так званой реакции нейтрализации – взаимодействие кислоты и основания, в результате которого образуются соли и вода.
Что же мы имеем тут: с левой стороны у нас один атом натрия (Na), а с правой индекс говорит, что атомов натрия уже стало два. Значит логично, что химическую формулу основания гидроксида натрия NaOH надо умножить на 2. Или другими словами поставить перед ней коэффициент 2:
Количество серы в серной кислоте (H2SO4) и соли сульфате натрия (Na2SO4) у нас одинаковое, тут все хорошо, а вот с количеством кислорода и водорода опять несоответствие, с левой стороны кислорода 6, а с правой 5. Водорода с правой стороны 4, а с левой только 2, непорядок. Чтобы правильно записать это химическое уравнение надо сравнять количество кислорода и водорода в левой и правой части уравнения, к счастью тут сделать это просто, надо перед H2O поставить коэффициент 2.
Таким образом, количество всех химических элементов в правой и левой части уравнения у нас сравнялись, а значит, мы неспроста поставили знак равенства.
Для закрепления материала разберем еще один пример сложного уравнения.
Это уравнение отображает химическую реакцию гидроксида бария (Ba(OH)2) с азотной кислотой (HNO3) в результате которой образуется нитрат бария (Ba(NO3)2) и вода.
Пример этот нам интересен тем, что тут используются скобки. Они означают, что если множитель стоит за скобками, то каждый элемент умножается на него. Начнем же разбирать это уравнение, первое, что бросается в глаза, несоответствие азота N, слева он один, а вот справа, если принимать во внимание скобки, его уже два. Получим следующее:
Теперь у нас слева стало 4 атома водорода, а справа только 2. Значит, перед формулой воды также ставим коэффициент 2.
Теперь все элементы уравнены, и мы справедливо поставили знак равенства.
Видео
И чтобы окончательно закрепить материал, рекомендуем посмотреть это образовательное видео.
Реагенты и классы веществ, которые с ними взаимодействуют
ЗАДАНИЕ 25 ЕГЭ по химии
Качественные реакции на неорганические вещества и ионы. Качественные реакции органических соединений.
Качественные реакции на неорганические газообразные вещества
| Название газа | Способ распознавания | Способ собирания |
| O2 кислород | тлеющая лучинка – в кислороде вспыхивает. | Собирают кислород в пробирку отверстием вверх (O2 тяжелее воздуха) |
| CO2 углекислый газ | 1. тлеющая лучинкав углекислом газе гаснет 2. известковая вода (раствор Ca(OH)2) в углекислом газе мутнеет из-за образования осадка CaCO3 | Собирают углекислый газ в пробирку отверстием вверх (CO2 тяжелее воздуха) |
| H2 Водород | пламя: если водорода много – будет хлопок-взрыв, если водород смешан с воздухом – «лающий» звук | Собирают водород методом вытеснения воды или просто в пробирку отверстием вниз (водород легче воздуха) |
| NH3 Аммиак | 1. запаху нашатырного спирта 2. по посинению лакмусовой бумаги. | Собирают аммиак в пробирку отверстием вниз (NH3 легче воздуха) |
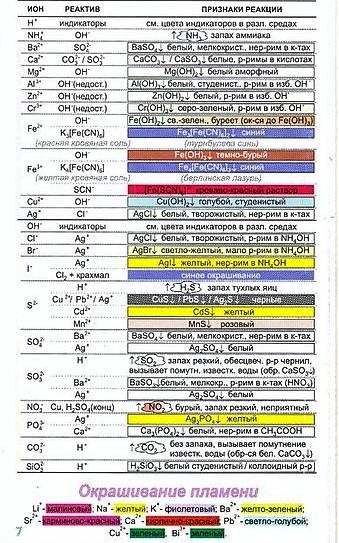
Качественные реакции на катионы
| Катион | Чем распознать | Уравнение реакции | Признаки реакции |
| Н + | Индикатор Zn | Zn + 2H + = Zn 2+ + H2 | Красный цвет H2 проверяют горящей спичкой |
| Ag + | Cl – и HNO3 | Ag + + Cl – = AgCl¯ | Белый творожистый осадок, нерастворимый в HNO3 |
| NH4 + | OH – | NH4 + + OH – = NH3 + H2O | Влажна лакмусовая бумажка синеет, так как NH3 + H2O = NH4 + + OH – |
| Ba 2+ | SO4 2 – | Ba 2+ + SO4 2 – = BaSO4¯ | Белый осадок, нерастворимый в HNO3 |
| Cu 2+ | Fe ° | Fe ° + Cu 2+ = Cu ° + Fe 2+ | Красный налет меди |
| Fe 3+ | OH – CNS – K4[Fe(CN)6] | Fe 3+ + 3 OH – = Fe(OH)3¯ Fe 3+ + 3CNS – = Fe(CNS)3 4Fe 3+ + 3[Fe(CN)6] 4- = Fe4[Fe(CN)6]3¯ | Осадок бурого цвета Раствор красного цвета Осадок синего цвета – ”берлинская лазурь” |
| Fe 2+ | OH – K3[Fe(CN)6] | Fe 2+ + 2 OH – = Fe(OH)2¯ 4 Fe(OH)2 + O2 + H2O= = 4 Fe(OH)3¯ 3 Fe 2+ + 2[Fe(CN)6] 3- = Fe3[Fe(CN)6]2¯ | Зеленый осадок, быстро буреющий на воздухе Осадок синего цвета – “ турнбуленова синь“ |
| Al 3+ | OH – | Al 3+ + 3 OH – = Al(OH)3¯ Al(OH)3¯ + OH – + 2 H2O = [Al(OH)4(H2O)2] – | Белый осадок, растворимый в избытке щелочи |
| Na + | Внести соли, содержащие катионы в пламя спиртовки. Распознаются по цвету пламени | Желтый цвет пламени | |
| K + | Фиолетово-розовый цвет пламени | ||
| Ca 2+ | Кирпично-красный цвет пламени |
Качественные реакции на анионы
| Анион | Чем распознать | Уравнение реакции | Признаки реакции |
| ОН – | Индикатор | Лакмус синий Фенолфталеин малиновый | |
| Сl – | Ag + и HNO3 | Ag + + Cl – = AgCl¯ | Белый творожистый осадок, нерастворимый в HNO3 |
| Br – | Ag + и HNO3 | Ag + + Br – = AgBr¯ | Cветло-желтый осадок, нерастворимый в HNO3 |
| I – | Ag + и HNO3 Cl2 – вода, крахмал | Ag + + I – = AgI¯ 2I – + Cl2 = 2Cl – + I2 | Желтый осадок, нерастворимый в HNO3 Бурый раствор иода от крахмала синеет |
| SO4 2 – | Ba 2+ и HNO3 | Ba 2+ + SO4 2 – = BaSO4¯ | Белый осадок, нерастворимый в НNO3 |
| NO3 – | H2SO4 (k) и Cu | 2 NaNO3 + H2SO4= 2 HNO3 (k) + Na2SO4 4HNO3 + Cu = Cu(NO3)2 + 2NO2 + 2 H2O | Выделяется бурый газ NO2 и соль голубого цвета Cu(NO3)2 |
| CO3 2 – | H + и Са(OH)2 | CO3 2 – + 2 H + = H2O + CO2 CO2 + Ca(OH)2 = CaCO3¯ + H2O | Выделение пузырьков газа СО2 и последующее помутнение известковой воды |
| S 2 – | H + и Сu 2+ | S 2 – + 2 H + = H2S Сu 2+ + S 2 – = CuS¯ | Выделение газа с запахом тухлых яиц Осадок коричневого цвета |
| SO3 2 – | H + Ba 2+ и HNO3 | SO3 2 – + 2 H + = H2O + SO2 Ba 2+ + SO3 2 – = BaSO3¯ BaSO3¯ + 2 H + = Ba 2+ + SO2 + H2O | Запах горящей серы Белый осадок, растворимый в HNO3 |
| SiO3 2 – | H + | 2 H + + SiO3 2 – = H2SiO3¯ | Студенистый осадок кремниевой кислоты |
| PO4 3 – | Ag + и HNO3 | 3Ag + + PO4 3 – = Ag3PO4¯ | Осадок желтого цвета, растворимый в HNO3 вследствие образования кислой соли |
Реагенты и классы веществ, которые с ними взаимодействуют
[spoiler title=”источники:”]
http://www.poznavayka.org/himiya/kak-rasstavlyat-koefficzienty-v-himicheskih-uravneniyah/
http://poisk-ru.ru/s3231t7.html
[/spoiler]
объясните пожалуйста что такое реактивы и реагенты примеры задач с ответом и объяснением?
Знаток
(306),
на голосовании
9 лет назад
Голосование за лучший ответ
NiNa Martushova
Искусственный Интеллект
(153334)
9 лет назад
Реактивами (реагентами) называются все вещества, которые используются для различных химических анализов и лабораторных работ. Реагенты в более узком значении – это вещества, которые вступают в химические реакции (левая часть уравнения), из которых получаются продукты этой реакции (правая часть) .
2Na+2H2O = 2NaOH+H2.
Определение характера среды раствора кислот и щелочей с помощью индикаторов. Качественные реакции на ионы в растворе.
В задании 18 ОГЭ по химии мы демонстрируем знания индикаторов и pH, а также качественные реакции на ионы в растворе.
Теория к заданию №18 ОГЭ по химии
Индикаторы
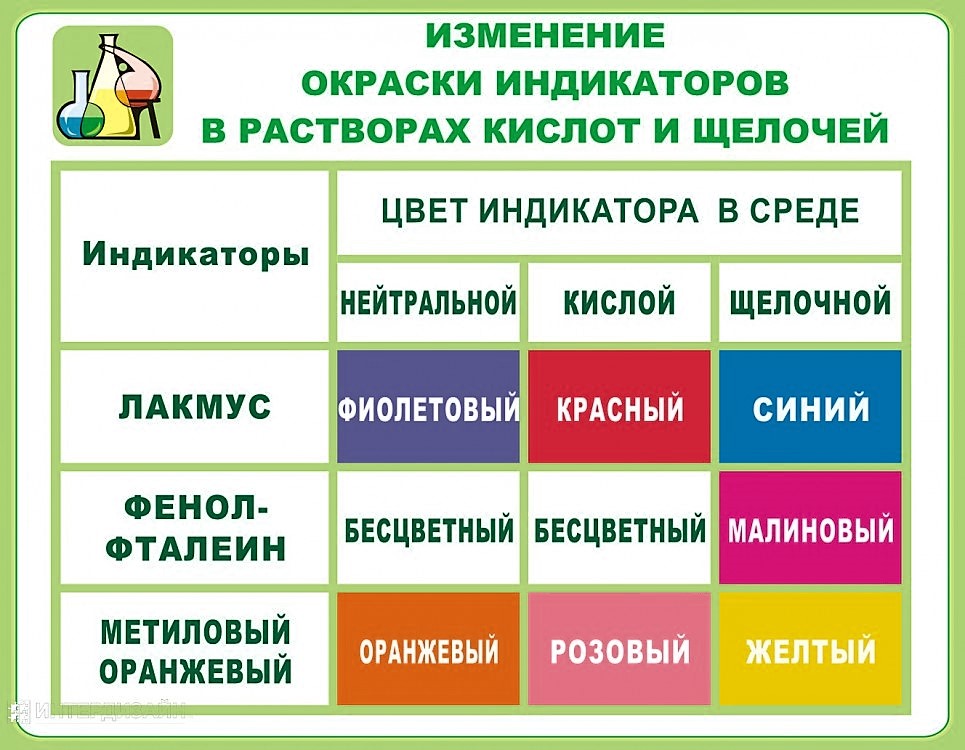
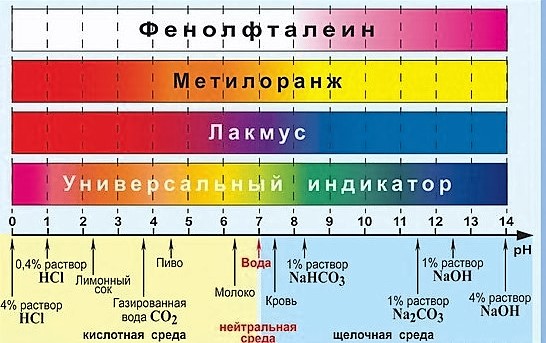
Индикатор – химическое вещество, меняющее окраску в зависимости от pH среды.
Самые известные индикаторы – фенолфталеин, метилоранж, лакмус и универсальный индикатор. Их цвета в зависимости от среды на картинке ниже:
А вот ещё цвета индикаторов более подробно с жизненными примерами:
С индикаторами мы разобрались, перейдем к качественным реакциям на ионы.
Качественные реакции на ионы
Качественные реакции на катионы и анионы представлены в таблице ниже.
Как правильно справиться с заданием 18 в тесте ОГЭ по химии?
Для этого необходимо выбрать качественную реакцию на один из предоставленных вариантов и убедится, что данный реактив не вступает в реакцию со вторым веществом.
Разбор типовых вариантов задания №18 ОГЭ по химии
Первый вариант задания
Установите соответствие между двумя веществами и реактивом, с помощью которого можно различить эти вещества.
Вещества:
А) Na2CO3 и Na2SiO3
Б) К2CO3 и Li2CO3
В) Na2SO4 и NaOH
Реактив:
1) CuCl2
2) HCl
3) MgO
4) K3PO4
Рассмотрим каждый случай.
Na2CO3 и Na2SiO3
- с хлоридом меди реакция не идет в обоих случаях, так как карбонат и силикат меди разлагается в водном растворе
- с соляной кислотой в случае карбоната натрия выделяется газ, а в случае силиката выпадает осадок – это качественная реакция на силикаты
- с оксидом магния данные вещества не реагируют, и оксид магния не вступает в реакции ионного обмена
- с фосфатом также нет качественных реакций на натрий
К2CO3 и Li2CO3
- с хлоридом меди данные вещества не реагируют (на самом деле выпадает осадок гидроксида меди, но этой реакцией не отличить два реагента)
- с соляной кислотой оба реагируют с выделением углекислого газа
- с оксидом магния данные вещества не реагируют, и оксид магния не вступает в реакции ионного обмена
- с фосфатом выпадает литий в виде фосфата, а калий нет
Na2SO4 и NaOH
У нас остался последний вариант – это хлорид меди. Действительно, с гидроксидом натрия выпадает гидроксид меди, а с сульфатом реакция не идет.
Ответ: 241
Определение и примеры реагента
На чтение 2 мин. Просмотров 105 Опубликовано 27.05.2021
Реагенты – это исходные вещества в химической реакции. Реагенты претерпевают химические изменения, в результате которых химические связи разрываются и образуются новые, в результате чего образуются продукты.
Формулирование химических уравнений
In В химическом уравнении реагенты перечислены слева от стрелки, а продукты – справа. Если стрелка химической реакции указывает как влево, так и вправо, то вещества по обе стороны от стрелки являются реагентами, а также продуктами (реакция протекает одновременно в обоих направлениях). В сбалансированном химическом уравнении количество атомов каждого элемента одинаково для реагентов и продуктов. Термин «реагент» впервые появился в употреблении примерно в 1900-1920 годах. Термин «реагент» иногда используется взаимозаменяемо
Примеры реагентов
Общая реакция может быть выражена уравнением:
A + B → C
В этом примере A и B являются реагентами а C – продукт. Однако в реакции не обязательно должно быть несколько реагентов. В реакции разложения, например:
C → A + B
C – реагент, а A и B – продукты. Вы можете определить реагенты, потому что они находятся в конце стрелки, которая указывает на продукты.
H 2 (газообразный водород) и O 2 (газообразный кислород) являются реагентами в реакции, образующей жидкую воду:
2 H 2 (g) + O 2 (g) → 2 H 2 O (l).
Обратите внимание, масса сохраняется в этом уравнении. Как в реагенте, так и в продукте уравнения есть четыре атома водорода и два атома кислорода. Состояние вещества (s = твердое тело, l = жидкость, g = газ, водный = водный) указывается после каждой химической формулы.
Задание с одним из самых низких процентов выполнения в первой части ЕГЭ по химии – задание №8. Но такое ли оно сложное, и как можно повысить свои шансы на максимальный балл?
Дисклеймер: если вы не любите читать длинные статьи, то всю эту информацию можно посмотреть в видео-разборе 👇
Что представляет собой задание №8 ЕГЭ по химии?
Это задание первой части повышенного уровня сложности, которое дает 2 балла.
В задании необходимо установить соответствие между веществом и набором реагентов, с которым это вещество может реагировать.
Какие вещества могут встретиться в этом задании?
Для этого обратимся к спецификатору – документу, в котором обозначены все темы, которые проверяются в том или ином задании. В задании №8 ЕГЭ по химии проверяется знание химических свойств металлов (щелочных, щелочноземельных, магния, алюминия, меди, цинка, хрома, железа), неметаллов (водорода, галогенов, кислорода, серы, азота, фосфора, углерода, кремния) и сложных веществ (оксидов, кислот, оснований, амфотерных гидроксидов и солей).
Сначала может показаться, что без идеальных знаний по неорганической химии это задание не решить, но, как и во многих других заданиях ЕГЭ, в задании №8 есть некие маркеры, которые помогут вам быстрее найти правильный ответ и решить это задание на 2 балла из 2.
Как не ошибиться в задании №8?
Будьте последовательны! Продумывайте каждый вариант ответа. Для удобства вы можете составить таблицу, в которой можно вычеркивать все неподходящие ответы. Такой способ решения сведет вероятность ошибки к минимуму. Не забывайте, что ответы в таком типе заданий могут повторяться.
Нужно помнить про свойства основных классов соединений!
1. Вещества, имеющие
кислотный характер, реагируют с веществами основного характера. Этот принцип выполняется примерно в 99% случаев, за исключением единичных реакций.
2. Амфотерные оксиды (ZnO, BeO, Al₂O₃, Cr₂O₃, Fe₂O₃) и соответствующие им гидроксиды реагируют как с веществами, имеющими кислотный характер (кислотами, кислотными оксидами), так и с веществами основного характера (щелочами, основными оксидами).
С водой амфотерные оксиды НЕ реагируют!
3. С водой реагируют практически все кислотные оксиды (кроме SiO₂), а среди основных – только оксиды щелочных и щелочноземельных металлов.
4. Между веществами-электролитами протекают реакции ионного обмена. Обязательно нужно проверить, будут ли выполняться условия их протекания. Проверяйте, РАСТВОРИМЫ ЛИ СОЛИ В ВОДЕ!
5. Оксиды, как правило, НЕ реагируют с солями, но кислотные и амфотерные оксиды реагируют при сильном нагревании с солями летучих кислот: карбонатами и сульфитами:
Na₂CO₃ + Al₂O₃ = 2NaAlO₂ + CO₂;
CaCO₃ + SiO₂ = CaSiO₃ + CO₂.
6. Кислород НЕ реагирует с хлором, а фосфор и кремний – с водородом.
7. Более активный металл вытесняет менее активный из раствора соли:
CuSO₄ + Fe = FeSO₄ + Cu,
НО это правило не применимо к активным металлам (левее магния), т.к. они реагируют с водой, а не с солью!
8. Не забывайте об окислительно-восстановительных реакциях:
Cr₂O₃ + 2Al = 2Cr + Al₂O₃;
FeO + CO(С, Н₂) = Fe + CO₂(СО, Н₂О).
На основе типичных химических реакций этих классов соединений мы нашли для вас самые распространенные реагенты. Такой список типичных реакций не стоит заучивать, но можно использовать для повторения типичных свойств.
Если веществом являются:
1. Щелочные металлы, то ищем список реагентов, в котором есть вода, кислоты, любые неметаллы (галогены, водород, кислород, сера, азот, фосфор, углерод или кремний). Если щелочной металл – литий, то для него в качестве реагента обычно встречается азот;
2. Mg, то ищем список реагентов, в котором есть CO₂, O₂, SiO₂, кислоты и любые неметаллы;
3. Щелочноземельные металлы (Ca, Sr, Ba), то ищем список реагентов, в котором есть вода, кислоты, кислород и другие неметаллы;
3. Al, Zn, то ищем список реагентов, в котором есть соли и оксиды менее активных металлов, щелочи или кислоты, неметаллы (кислород, галогены, сера);
4. Fe, Cr, то ищем список реагентов, в котором есть кислоты, кислород, сера или оксиды этих металлов (восстанавливается с +3 до +2 (Fe + Fe₂О₃ = 3FeO));
5. Cu, то ищем список реагентов, в котором есть кислоты-окислители (HNO₃, H₂SO₄(конц.)), хлорид железа (III), кислород.
6. Щелочи, то ищем список реагентов, в котором есть кислоты, кислотные оксиды, амфотерные вещества.
7. Оксиды металлов I группы, то ищем список реагентов, в котором есть кислоты, кислотные оксиды, вода.
8. Гидроксиды металлов II группы, то ищем список реагентов, в котором есть CO₂, SO₂. Если это щелочи, то также подходят вещества с амфотерными свойствами, растворимые карбонаты, сульфиты и сульфаты (качественные реакции на катионы кальция, стронция и бария);
9. Al₂O₃ и Al(OH)₃, то ищем список реагентов, в котором есть вещества с кислотным характером, щелочи или основные оксиды, образованные щелочными и щелочноземельными металлами. Для амфотерных оксидов очень часто встречаются карбонаты и сульфиты (аналогично для ZnO и Zn(OH)₂);
11. FeO, то ищем список реагентов, в котором есть типичные восстановители (углерод, угарный газ или водород, более активные металлы), кислоты-окислители, кислород.
12. Fe₂O₃, то ищем список реагентов, в котором есть типичные восстановители: C, CO, H₂ или Al, или другой более активный металл, а также кислоты или щелочи.
13. Fe(OH)₃, то ищем список реагентов, в котором есть кислоты и твердые щелочи.
14. CuO, то ищем список реагентов, в котором есть Al или металлы активнее, чем медь, СО, С, Н₂, NH₃, кислоты или кислотные оксиды, а также спирты.
15. Cu(OH)₂, то ищем список реагентов, в котором есть кислоты, многоатомные спирты или альдегиды.
16. Серебро, то ищем список реагентов, в котором есть кислоты-окислители и сера, а если растворимые соли серебра, то галогениды.
17. H₂, то ищем список реагентов, в котором есть кислород, азот, активные металлы, оксиды металлов, которые им можно восстановить (если ориентироваться на ряд активности металлов, то начиная с оксида марганца и правее);
18. O₂, то ищем список реагентов, в котором есть любые простые вещества (кроме галогенов, серебра, золота), водородные соединения (NH₃, PH₃, H₂S, SiH₄ и др.), сульфиды металлов, а также оксиды в промежуточной степени окисления.
19. F₂ и HF, то ищем список реагентов, в котором есть соединения кремния и лития.
20. Другие галогены, то ищем список реагентов, в котором есть щелочь, водород, сера, фосфор, соли или водородные соединения галогенов с меньшей окислительной способностью, сероводород и сульфиты, а также соединения S(IV);
21. S и Р, то ищем список реагентов, в котором есть кислород, щелочь, металлы.
22. C и СО – типичные восстановители, поэтому ищем оксиды металлов, а также водород и кислород, СО также реагируют с твердой щелочью;
23. CO₂, то ищем список реагентов, в котором есть гидроксид кальция, карбонаты, оксиды щелочных, щелочноземельных металлов и магния.
Спасибо, что прочитали эту статью до конца!
На этом канале и на нашем Ютуб-канале регулярно выходят разборы заданий второй части, следите за обновлениями! Также подписывайтесь на наш Инстаграм, в котором вы найдете еще больше полезного материала для подготовки к ЕГЭ по химии. Готовьтесь экзаменам бесплатно 😉
Читайте нашу последнюю статью: Решив такую 34 задачу, решишь любую