Печатать эту главу
Задача №2.
Энергия для ионизации атома натрия Ei=5,12 эВ. Найти ридберговскую поправку σ(s) для этого атома.
|
Дано: E=5,12 эВ |
Решение: |
|---|---|
|
Найти: σ(s)=? |
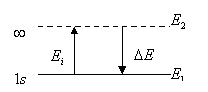
Энергия квантового перехода равна разности уровней энергии квантовых состояний, между которыми происходит переход
где E2 – верхний уровень, E1 – нижний уровень, то есть E2>E1. Энергией Ei ионизации атома называется энергия, необходимая для удаления из атома электрона, находящегося в основном состоянии 1s. Она равна
|
ΔE=E(∞)-E(1s)=-E(1s), |
(2) |
где E(∞) – уровень энергии удаленного электрона вне атома, принимается равной нулю, E(1s) – уровень энергии электрона в 1s состоянии. Спектральный терм Tn,i атома щелочного металла связан с соответствующим уровнем En,l энергии соотношением
Выражение для терма Tn,l определяется эмпирической формулой Ридберга
|
( T_{n,l}=frac{R}{{[n+sigma(s)]}^2} ). |
(4) |
Комбинируя формулы (2), (3) и (4) получаем
|
( E(1s)=+frac{chR}{{[n+sigma(s)]}^2} ). |
(5) |
Решая уравнение (5), находим
|
( sigma(1s)=sqrt{frac{chR}{E_i}}-n ). |
(6) |
Величина chR в энергетических единицах равна 13,6 эВ, для основного состояния атома натрия n=3.
Расчет:
|
( sigma(1s)=sqrt{frac{13,6}{5,12}}-3=-1,37 ). |
(7) |
-
Атомы щелочных металлов
В некотором смысле
атомы щелочных металлов являются
водородоподобными, однако не полностью.
Дело в том, что внешний электрон
деформирует электронный остов и тем
самым искажает поле, в котором движется.
В первом приближении поле остова можно
рассматривать как суперпозицию поля
точечного заряда +е, и поля точечного
диполя, расположенного в центре остова.
При этом ось диполя направлена все время
к внешнему электрону. Поэтому движение
последнего происходит так, как если бы
поле остова, несмотря на искажение,
сохранялось сферически симметричным.
Это позволяет
представить потенциальную энергию
внешнего электрона в поле такого остова
как:
U(r)
= -e2/r
– Ce2/r2,
(6.18)
где С – некоторая
постоянная.
Решение УШ для
электрона с потенциальной энергией
(6.18) приводит к тому, что теперь разрешенные
состояния энергии Е в области E
< 0 (для связных состояний внешнего
электрона) будет зависеть не только от
главного квантового числа n
(как в случае атома водорода), но и от
орбитального квантового числа l:
Enl
= -ћR/(n
+ l)2,
(6.19)
где l)
– ридберговская поправка (или
квантовый дефект), зависящая от l
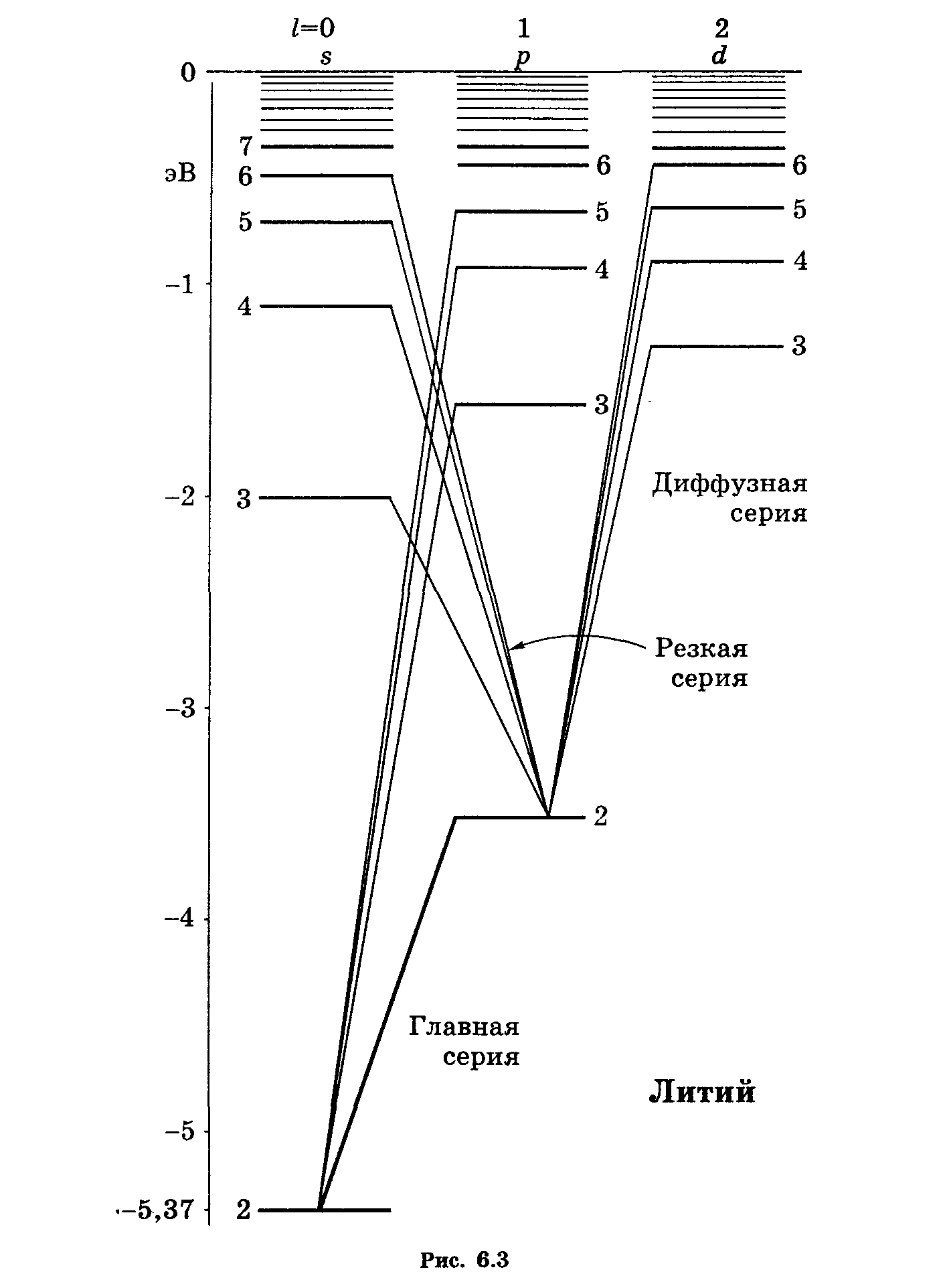
. Заметим, ц лития (см. рис. 6.3) основным
состоянием является 2s ,
так как состояние с n = 1
уже занято двумя электронами, входящими
в состав остова.
Энергетическому
уровню (6.19) соответствует терм, имеющий
согласно 2.30 вид:
Tnl
= R/(n + l)2
(6.20).
Систематику
энергетических уровней атома принято
назвать системой термов. Терм T
– это величина, определяемая согласно
=
R(1/no2
– 1/n2) (2.16) и En
= -me4Z2/2ћ2n2
(2.25) как:
Tn
= R/n2
= |En|/ћ,
где R
– постоянная Ридберга. В отличие от
энергии En,
терм – величина положительная, и чем
выше уровень, тем больше его значение.
Терм имеет ту же размерность, что и
частота ,
т.е. с-1. Соответствующая частота
фотона, испущенного при переходе атома
из состояния с квантовым числом n1
в состояние с квантовым числом n2,
определяется формулой:
12
= T2 –
T1 =
R/n22
– R/n12.
(2.31)
Все серии хххх
представляются в виде обобщенной формулы
Бальмера:
= R(1/no2
– 1/n2) (2.16).
Энергия En
электрона на n-й стационарной
орбите определяется формулой
En
= -me4Z2/2ћ2n2
(2.25).
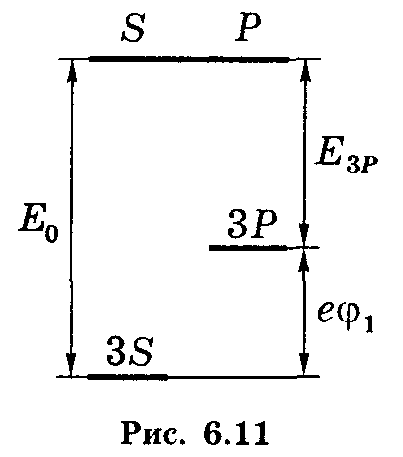
1.4.х. Найти
ридберговскую поправку 3Р терма атома
Na , первый потенциал
возбуждения которого 1
= 2,10 В, а энергия связи валентного
электрона в основном 3S-
состоянии Ео = 5,14 эВ.
1.4.х. Используем
формулу Enl
= -ħR/(n + l)2
(6.19), которая содержит искомую
поправку P.
Согласно рис. 6.11. энергию 3Р – состояния
можно представить как:
E3P
= -(Eo
– e1)
= -(5,14 – 2,19) эВ
(имея
в виду, что энергия уровня равна с
обратным знаком энергии связи на этом
уровне). Таким образом, имеем:
1.4.х. Найти
энергию связи валентного электрона в
основном состоянии атома лития, если
известно, что длины волн головной линии
резкой серии и ее коротковолновой
границы равны соответственно 1
= 813 нм и K
= 350 нм.
1.4.х. Согласно
формуле Enl
= -ħR/(n + l)2
энергия связи в 2s-
состоянии равна:
Задача сводится
к нахождению поправки s.
Из рис. 6.3 и формулы 6.19 можно записать:
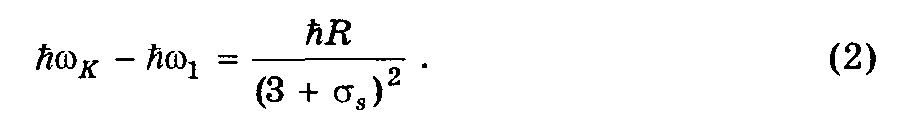
Т.к.
= 2c//
перепишем (2) как:
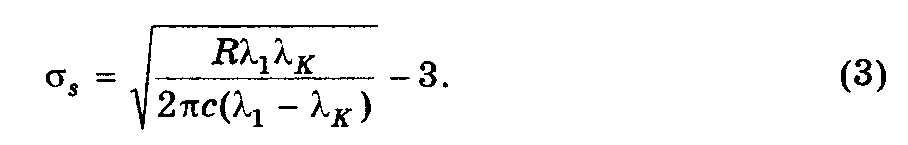
Подставив (3) в (1)
получим: Eсв =
ћR/[(R1K/2c)1/2
– 1]2 = 5,3 эВ, где
= 1
–K.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 мая 2021 года; проверки требуют 2 правки.
Формула Ридберга в том виде, в котором она была представлена в ноябре 1888 года
Фо́рмула Ри́дберга — эмпирическая формула, описывающая длины волн в спектрах излучения атомов химических элементов. Предложена шведским учёным Йоханнесом Ридбергом и представлена 5 ноября 1888 года.
Формула Ридберга для водородоподобных атомов выглядит следующим образом:
- где
— длина волны света в вакууме;
— постоянная Ридберга в общем случае различна для разных химических элементов;
— атомный номер, или число протонов в ядре атома данного элемента;
и
— целые числа, такие что
.
История[править | править код]
В 1880-х годах, Ридберг работал над формулой, описывающей взаимосвязь между длинами волн в спектрах щелочных металлов. Он заметил, что линии образуют серии, и обнаружил, что может уменьшить трудоёмкость расчётов, введя спектроскопическое волновое число (величина, равная 


Сначала он проверил формулу 




Затем Ридберг проверил формулу 


Ридберг переписал формулу Бальмера, используя обозначения волновых чисел, в следующем виде:
Это преобразование подсказало, что формула Бальмера для водорода может являться частным случаем при 


Величина 


Как подчеркнул Нильс Бор[1], выражение результатов через волновые числа, а не через длины волн, было ключом к открытию Ридберга. Фундаментальная роль волновых чисел была особо подчёркнута открытием комбинационного принципа Ридберга — Ритца в 1908 году. Фундаментальная причина важности волновых чисел лежит в области квантовой механики, так как энергия фотонов с разной длиной волны прямо пропорциональна волновым числам.
Волновые числа световых волн пропорциональны частоте 


Классическое выражение Ридберга (в работе 1888 года) для длин волн спектральных серий не имело физическое объяснение. Пред-квантовое объяснение Ритца (1908 год) механизма «образования» спектральных серий состояло в том, что электроны в атоме ведут себя как постоянные магниты, и что эти магниты могут колебаться относительно атомного ядра (по крайней мере в течение некоторого времени), порождая электромагнитное излучение[2]. Это явление впервые было понято Нильсом Бором в 1913 году так, как оно включено в описание Боровская модель атома.
В боровской модели атома целые числа Ридберга (и Бальмера) 


Формула Ридберга для атома водорода[править | править код]
Схема энергетических уровней атома водорода и спектральные серии
- где
— длина волны электромагнитного излучения в вакууме;
— постоянная Ридберга;
и
— целые числа, причём
Принимая 


| n | m | Название серии | Коротковолновая граница серии |
|---|---|---|---|
| 1 | 2 → ∞ | Серия Лаймана | 91,13 нм (Ультрафиолетовая часть спектра) |
| 2 | 3 → ∞ | Серия Бальмера | 364,51 нм (Видимая часть спектра) |
| 3 | 4 → ∞ | Серия Пашена | 820,14 нм (Инфракрасная часть спектра) |
| 4 | 5 → ∞ | Серия Брэккета | 1458,03 нм (Инфракрасная часть спектра) |
| 5 | 6 → ∞ | Серия Пфунда | 2278,17 нм (Инфракрасная часть спектра) |
| 6 | 7 → ∞ | Серия Хэмпфри | 3280,56 нм (Инфракрасная часть спектра) |
Формула Ридберга для любых водородоподобных атомов[править | править код]
Формула для атома водорода, приведённая выше, может быть дополнена для применения к любым водородоподобным атомам:
- где
— длина волны излучения в вакууме;
— постоянная Ридберга для данного химического элемента;
— порядковый номер элемента в периодической таблице, то есть, количество протонов в атомных ядрах данного элемента;
и
— целые числа, причём
Важно заметить, что эта формула применима только для водородоподобных атомов, то есть для таких атомов, которые содержат в электронной оболочке только один электрон. Такими атомами являются, например, 
Формула Ридберга позволяет получать правильные значения длин волн для атомов, находящихся в высоких степенях возбуждения, когда эффективный заряд ядра можно считать таким же как и у водорода, когда все, кроме одного, заряды в ядре экранированы другими электронами, и центр атома имеет эффективный положительный заряд, равный +1.
Для других спектральных переходов в многоэлектронных атомах, формула Ридберга даёт некорректные результаты, поскольку величина экранирования внутренних электронов для переходов внешних электронов варьируется, и нет возможности сделать в формуле подобную простую «компенсирующую» «ослабление действия заряда ядра» поправку, как приведено выше.
Формула Ридберга для характеристического рентгеновского излучения[править | править код]
При определённом изменении (замене 







^{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f58d7d9abf0edc483508136d5386c7f80986cc6)


Примечания[править | править код]
- ↑ Bohr, N. Rydberg’s discovery of the spectral laws // Collected works / Kalckar, J.. — Amsterdam: North-Holland Publ. Cy., 1985. — Т. 10. — С. 373—379.
- ↑ Ritz, W. Magnetische Atomfelder und Serienspektren (нем.) // Annalen der Physik : magazin. — 1908. — Bd. 330, Nr. 4. — S. 660—696. — doi:10.1002/andp.19083300403.
Ссылки[править | править код]
- Sutton, Mike. Getting the numbers right: The lonely struggle of the 19th century physicist/chemist Johannes Rydberg (англ.) // Chemistry World (англ.) (рус. : magazine. — 2004. — July (vol. 1, no. 7). — P. 38—41. — ISSN 1473-7604.
- Martinson, I.; Curtis, L.J. Janne Rydberg – his life and work (англ.) // Nuclear Instruments and Methods in Physics Research Section B (англ.) (рус.. — 2005. — Vol. 235, no. 1—4. — P. 17—22. — doi:10.1016/j.nimb.2005.03.137. — Bibcode: 2005NIMPB.235…17M.
|
|
Макеты страниц
Спектры испускания атомов щелочных металлов, подобно спектру водорода, состоят из нескольких серий линий. Наиболее интенсивные из них получили названия: главная, резкая, диффузная и основная (или серия Бергмана). Эти названия имеют следующее происхождение. Главная серия названа так потому, что наблюдается и при поглощении. Следовательно, она соответствует переходам атома в Основное состояние. Резкая и диффузная серии состоят соответственно из резких и размытых (диффузных) линий. Серия Бергмана была названа основной (фундаментальной) за свое сходство с сериями водорода.
Линии серий атома 
Из рис. 29.1 видно, что энергия состояния оказывается зависящей, кроме квантового числа 
На схеме уровней атома водорода различные ряды термов (с совпадающими по высоте уровнями) отличаются значениями момента импульса электрона. Естественно предположить, что различные ряды термов щелочных металлов также отличаются значениями момента импульса валентного электрона.

Рис. 29.1,
Поскольку уровни различных рядов в этом случае лежат на неодинаковой высоте, следует принять, что энергия валентного электрона в атоме щелочного металла зависит от величины момента импульса электрона (чего мы не наблюдали для водорода).
Предположение о зависимости энергии валентного электрона щелочных атомов от квантового числа 


Решение уравнения Шрёдингера для электрона, движущегося в центрально-симметричном некулоновском поле, дает результат, аналогичный результату для водородного атома, с тем отличием, что энергетические уровни зависят не только от квантового числа 


Таким образом, в этом случае снимается вырождение по 



Момент импульса атома в целом слагается из моментов всех электронов, входящих в состав атома. Значение результирующего момента определяется квантовым числом L (см. § 24). Каждому столбцу уровней на рис. 29.1 соответствует свое значение 
Использованные на схеме рис. 29.1 обозначения S, Р, D, F являются первыми буквами английских названий серий: sharp — резкий, principal — главный, diffuse — размытый, fundamental — основной. Каждая из серий возникает за счет переходов с уровней, принадлежащих соответствующему ряду. После того, как было выяснено, что различные ряды уровней отличаются значением квантового числа L, обозначения S, Р, Д F (или s, р, d, f) были применены для обозначения состояний с соответствующими значениями L (или l).
Исследования оптических спектров ионов щелочных металлов показали, что момент импульса атомного остатка (т. е. ядра и остальных электронов, кроме наименее связанного валентного электрона, удаляющегося при ионизации) равен нулю. Следовательно, момент атома щелочного металла равен моменту его валентного электрона, и L атома совпадает с l этого электрона.
Для l валентного электрона атомов щелочных металлов действует такое же правило отбора, как и для l электрона водородного атома (см. формулу (28.5)).
При возбуждении атома щелочного металла и при испускании им света изменяется только состояние валентного электрона. Поэтому схему уровней щелочного атома можно считать тождественной схеме уровней валентного электрона.
Обозначим термы, отвечающие столбцам уровней, помеченным на рис. 29.1 буквами S, Р, D, F, символами 

Еще в конце прошлого столетия Ридберг установил, что термы щелочных металлов с большой степенью точности можно представить с помощью эмпирической формулы

Здесь R — постоянная Ридберга (см. (12.3)), 



Заметим, что терм (29.2) отличается от терма водородного атома (см. (12.5)) только наличием поправки а. Для 
Подставив эмпирические выражения в соотношения (29.1), получим формулы для частот спектральных серий натрия:

Поправки s, p, d, f в этих формулах имеют значения (29.3).
Оглавление
- ПРЕДИСЛОВИЕ
- МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ
- ЧАСТЬ 1. КВАНТОВАЯ ОПТИКА
- § 1. Тепловое излучение и люминесценция
- § 2. Закон Кирхгофа
- § 3. Равновесная плотность энергии излучения
- § 4. Закон Стефана — Больцмана и закон Вина
- § 5. Стоячие волны в пространстве трех измерений
- § 6. Формула Рэлея — Джинса
- § 7. Формула Планка
- ГЛАВА II. ФОТОНЫ
- § 8. Тормозное рентгеновское излучение
- § 9. Фотоэффект
- § 10. Опыт Боте. Фотоны
- § 11. Эффект Комптона
- ЧАСТЬ 2. АТОМНАЯ ФИЗИКА
- § 12. Закономерности в атомных спектрах
- § 13. Модель атома Томсона
- § 14. Опыты по рассеянию а-частиц. Ядерная модель атома
- § 15. Постулаты Бора. Опыт Франка и Герца
- § 16. Правило квантования круговых орбит
- § 17. Элементарная боровская теория водородного атома
- ГЛАВА IV. ЭЛЕМЕНТЫ КВАНТОВОЙ МЕХАНИКИ
- § 18. Гипотеза де-Бройля. Волновые свойства вещества
- § 19. Необычные свойства микрочастиц
- § 20. Принцип неопределенности
- § 21. Уравнение Шрёдингера
- § 22. Смысл пси-функции
- § 23. Квантование энергии
- § 24. Квантование момента импульса
- § 25. Принцип суперпозиции
- § 26. Прохождение частиц через потенциальный барьер
- § 27. Гармонический осциллятор
- ГЛАВА V. ФИЗИКА АТОМОВ И МОЛЕКУЛ
- § 28. Атом водорода
- § 29. Спектры щелочных металлов
- § 30. Ширина спектральных линий
- § 31. Мультиплетность спектров и спин электрона
- § 32. Результирующий механический момент многоэлектронного атома
- § 33. Магнитный момент атома
- § 34. Эффект Зеемана
- § 35. Электронный парамагнитный резонанс
- § 36. Принцип Паули. Распределение электронов по энергетическим уровням атома
- § 37. Периодическая система элементов Менделеева
- § 38. Рентгеновские спектры
- § 39. Энергия молекулы
- § 40. Молекулярные спектры
- § 41. Комбинационное рассеяние света
- § 42. Вынужденное излучение
- § 43. Лазеры
- § 44. Нелинейная оптика
- ЧАСТЬ 3. ФИЗИКА ТВЕРДОГО ТЕЛА
- § 45. Кристаллическая решетка. Индексы Миллера
- § 46. Теплоемкость кристаллов. Теория Эйнштейна
- § 47. Колебания систем с большим числом степеней свободы
- § 48. Теория Дебая
- § 49. Фононы
- § 50. Эффект Мёссбауэра
- ГЛАВА VII. ЗОННАЯ ТЕОРИЯ ТВЕРДЫХ ТЕЛ
- § 51. Квантовая теория свободных электронов в металле
- § 52. Распределение Ферми — Дирака
- § 53. Энергетические зоны в кристаллах
- § 54. Динамика электронов в кристаллической решетке
- ГЛАВА VIII. ЭЛЕКТРОПРОВОДНОСТЬ МЕТАЛЛОВ И ПОЛУПРОВОДНИКОВ
- § 55. Электропроводность металлов
- § 56. Сверхпроводимость
- § 57. Полупроводники
- § 58. Собственная проводимость полупроводников
- § 59. Примесная проводимость полупроводников
- ГЛАВА IX. КОНТАКТНЫЕ И ТЕРМОЭЛЕКТРИЧЕСКИЕ ЯВЛЕНИЯ
- § 60. Работа выхода
- § 61. Термоэлектронная эмиссия. Электронные лампы
- § 62. Контактная разность потенциалов
- § 63. Термоэлектрические явления
- § 64. Полупроводниковые диоды и триоды
- § 65. Внутренний фотоэффект
- ЧАСТЬ 4. ФИЗИКА АТОМНОГО ЯДРА И ЭЛЕМЕНТАРНЫХ ЧАСТИЦ
- § 66. Состав и характеристики атомного ядра
- § 67. Масса и энергия связи ядра
- § 68. Модели атомного ядра
- § 69. Ядерные силы
- § 70. Радиоактивность
- § 71. Ядерные реакции
- § 72. Деление ядер
- § 73. Термоядерные реакции
- ГЛАВА XI. ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ
- § 74. Виды взаимодействий и классы элементарных частиц
- § 75. Методы регистрации элементарных частиц
- § 76. Космические лучи
- § 77. Частицы и античастицы
- § 78. Изотопический спин
- § 79. Странные частицы
- § 80. Несохранение четности в слабых взаимодействиях
- § 81. Нейтрино
- § 82. Систематика элементарных частиц
- § 83. Кварки
- § 84. Великое объединение
- ПРИЛОЖЕНИЯ
- I. ГРАВИТАЦИОННОЕ ВЗАИМОДЕЙСТВИЕ