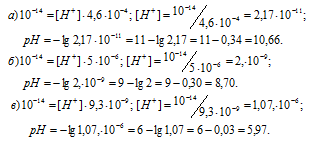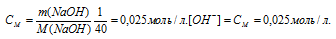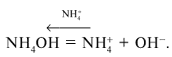Вычислить рН 1-процентного раствора уксусной кислоты (CH3COOH), считая, что плотность раствора равна 1 г/мл, а константа диссоциации К = 1, 8 ⋅ 10-5.
Решение задачи
Запишем уравнение диссоциации уксусной кислоты (CH3COOH):
Вычислить pH
Найдем молярную концентрацию уксусной кислоты (CH3COOH). Для этого будем использовать формулу перехода от массовой доли к молярности:
Где:
ρ — плотность раствора, г/л;
ω — массовая доля растворенного вещества в долях от 1;
M1 — молярная масса растворенного вещества, г/моль.
Вычислить pH
Молярная концентрация показывает количество растворенного вещества (моль), содержащегося в 1 л раствора.
Учитывая, что молярная масса уксусной кислоты (CH3COOH) равна 60 г/моль (смотри таблицу Менделеева) и если раствор 1-процентный, то массовая доля уксусной кислоты (CH3COOH) в нем 0,01 получаем:
M = 1000 ⋅ 0,01 /60 = 0,17 (моль/л).
Вычислить pH
Учитывая, что уксусная кислота (CH3COOH) – это слабая одноосновная кислота, найдем равновесную концентрацию ионов водорода по формуле:
Где:
K – константа диссоциации кислоты;
C — молярная концентрация кислоты.
Получаем:
Вычислить pH раствора по формуле:
Водородный показатель (pH) раствора численно равен отрицательному десятичному логарифму концентрации ионов водорода в этом растворе.
pH = — lg [1,75 ⋅ 10-3]
pH = 3 – lg 1,75
pH = 2,76
Ответ:
pH раствора 2,76.
Расчет рН растворов сильных и слабых электролитов
Сильные
кислоты и основания
(табл.2.1) в растворах диссоциируют пол-
ностью,
поэтому концентрация ионов водорода и
ионов гидроксила равна
общей
концентрации сильного электролита.
Для
сильных оснований:
[OH–]
= См;
для
сильных
кислот:
[H+]
=
См.
Таблица
2.1
Сильные электролиты
-
Класс
Формулы
электролитовКислота
HNO3,
H2SO4,
HCl, HBr, HI, HMnO4,
HClO4Основание
LiOH ,
KOH, RbOH, CsOH, NaOH, Ba(OH)2,
Ca(OH)2,
Sr(OH)2Соль
Растворимые
соли
Слабым
электролитом
принято считать химические соединения,
молекулы которых даже в сильно разбавленных
растворах не полностью диссоциируют
на ионы. Степень диссоциации слабых
электролитов для децимолярных растворов
(0,1М) меньше 3%. Примеры слабых электролитов:
все органические кислоты, некоторые
неорганические кислоты (например, H2S,
HCN), большинство гидроксидов (например,
Zn(OH)2,
Cu(OH)2).
Для
растворов слабых
кислот
концентрация ионов водорода [H+]
в растворе рассчитывается по формуле:
где:
Кк –
константа диссоциации слабой кислоты;
Ск –
концентрация кислоты, моль/дм3.
Для
растворов слабых
оснований
концентрация гидроксильных ионов
рассчитывается по формуле:
где:
Ко –
константа диссоциации слабого основания;
Сосн. –
концентрация основания, моль/дм3.
Таблица
2.2
Константы диссоциации слабых кислот и оснований при 25 оС
|
Формула |
Константа |
|
СH3COOH |
1,86 |
|
HCN |
7,2 |
|
HOCl |
5,0 |
|
HBO2 |
7,5 |
|
HOBr |
2,5 |
|
HF |
6,2 |
|
HNO2 |
5,1 |
|
HIO |
2,3 |
|
HOCN |
2,7 |
|
NH4OH |
1,79 |
|
AgOH |
5,0 |
2.2.
Примеры решения индивидуального задания
Пример
№1.
Условие
задания: Определить
концентрацию
водородных и гидроксильных ионов в
растворе, если
рН =5,5.
Решение
Концентрация
ионов водорода рассчитывается по
формуле:
[Н+]
= 10-рН
[Н+]
= 10-5,5
=
3,16 •10-6
моль/дм3
Концентрация
гидроксильных ионов рассчитывается по
формуле:
[OН–]
= 10-рOН
рОН
= 14 – рН = 14 – 5,5 = 8,5
[OН–]
= 10 -8,5
=
3 • 10-9
моль/дм3
Пример
№ 2.
Условие
задания: Вычислить
рН 0,001 М раствора HС1.
Решение
Кислота
HС1 является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
HС1⇄
Н+
+
С1–
Поэтому
концентрация ионов [Н+]
равна общей концентрации кислоты:
[Н+]
= См = 0,001 М.
[Н+]
= 0,001= 1·10-3
моль/дм3
Тогда:
рН
= – lg[H+]
= – lg 1 • 10-3
= 3
Пример
№ 3.
Условие
задания:
Вычислить
рН 0,002 М раствора NaOH.
Решение
Основание
NaOH является сильным электролитом
(табл.2.1) и в разбавленных растворах
практически полностью диссоциирует на
ионы:
NaOH
⇄Na++OH–
Поэтому
концентрация гидроксильных ионов равна
общей концентрации основания: [ОH–]=
См
= 0,002
М.
Тогда:
рОН
= – lg[ОН–]
= – lgСм = – lg 2 •10-3
= 2,7
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – 2,7 = 11,3
Пример
№4.
Условие
задания: Вычислить
рН 0,04 М раствора NH4OH,
если
константа диссоциации Кд(NH4OH)
= 1,79·10-5
(табл.2.2).
Решение
Основание
NH4OH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
гидроксильных ионов [ОH–]
в растворе слабого основания рассчитывается
по формуле:
моль/дм3
рОН
= – lg[ОH–]
= – lg 8,5·10-2
= 1,1
Исходя
из формулы: рН + рОН = 14, находим рН
раствора:
рН
= 14 – рOН = 14 – 1,1 = 12,9
Пример
№5.
Условие
задания: Вычислить
рН
0,17
М раствора
уксусной
кислоты (CH3COOH),
если константа диссоциации Кд(CH3COOH)
= 1,86 • 10-5
(табл.2.2).
Решение
Кислота
CH3COOH
является слабым электролитом и в
разбавленных растворах очень незначительно
диссоциирует на ионы.
Концентрация
ионов водорода [H+]
в растворе слабой кислоты рассчитывается
по формуле:
Тогда:
моль/дм3
Вычисляем
pH
раствора по формуле: рН = – lg [H+]
pH
= – lg 1,78 • 10-3
=
2,75
2.3.
Индивидуальные задания
Условия
заданий
(табл.
2.3):
Задание
№ 1.
Вычислить концентрацию водородных и
гидроксильных ионов в растворе при
определенном значении рН (см. пример №
1);
Задание
№ 2.
Вычислить рН раствора сильного электролита
(кислоты, основания) при заданной
концентрации (см. пример № 2, 3);
Задание
№ 3.
Вычислить рН раствора слабого электролита
(кислоты, основания) при заданной
концентрации (см. пример № 4, 5).
Таблица
2.3
Состав
исследуемой воды
|
№ задания |
Условия |
||||
|
Задание № 1 |
Задание |
Задание |
|||
|
рН |
Сильный |
Концентрация, |
Слабый электролит |
Концентрация, |
|
|
1 |
6,05 |
НСl |
0,033 |
NH4OH |
0,01 |
|
2 |
8,5 |
HNO3 |
0,091 |
HCN |
0,09 |
|
3 |
5,5 |
HI |
0,032 |
HOCl |
0,05 |
|
4 |
7,7 |
NaOH |
0,054 |
HBO2 |
0,36 |
|
5 |
6,3 |
HBr |
0,076 |
HOBr |
0,22 |
|
6 |
6,5 |
KOH |
0,045 |
HF |
0,63 |
|
7 |
8,9 |
HClO4 |
0,027 |
HNO2 |
0,55 |
|
8 |
8,5 |
HMnO4 |
0,005 |
HOI |
0,03 |
|
9 |
6,5 |
CsOH |
0,008 |
HOCN |
0,19 |
|
10 |
6,1 |
HNO3 |
0,004 |
NH4OH |
0,082 |
|
11 |
6,5 |
HI |
0,001 |
AgOH |
0,04 |
|
12 |
6,9 |
LiOH |
0,009 |
СH3COOH |
0,26 |
|
13 |
8,8 |
HBr |
0,005 |
HCN |
0,075 |
|
14 |
6,9 |
RbOH |
0,036 |
HOCl |
0,07 |
|
15 |
7,3 |
HClO4 |
0,0022 |
HBO2 |
0,15 |
|
16 |
6,3 |
HMnO4 |
0,063 |
HOBr |
0,23 |
|
17 |
7,4 |
KOH |
0,055 |
HF |
0,34 |
|
18 |
6,7 |
HNO3 |
0,003 |
HNO2 |
0,18 |
|
19 |
8,2 |
HI |
0,019 |
HOI |
0,39 |
|
20 |
8,3 |
HNO3 |
0,082 |
HOCN |
0,15 |
|
21 |
6,1 |
CsOH |
0,004 |
NH4OH |
0,33 |
|
22 |
6,9 |
HCl |
0,026 |
AgOH |
0,091 |
|
23 |
8,2 |
HClO4 |
0,075 |
HBO2 |
0,32 |
|
24 |
8,6 |
HMnO4 |
0,007 |
HOBr |
0,054 |
|
25 |
8,5 |
LiOH |
0,015 |
HF |
0,076 |
|
26 |
8,2 |
HNO3 |
0,0023 |
HNO2 |
0,045 |
|
27 |
8,0 |
HI |
0,034 |
HOI |
0,27 |
Продолжение
табл. 2.3
|
28 |
7,9 |
NaOH |
0,018 |
HOCN |
0,35 |
|
29 |
7,9 |
HBr |
0,039 |
NH4OH |
0,08 |
|
30 |
8,1 |
HCl |
0,015 |
AgOH |
0,4 |
|
31 |
6,1 |
HNO3 |
0,003 |
NH4OH |
0,032 |
|
32 |
6,5 |
HI |
0,002 |
AgOH |
0,02 |
|
33 |
6,9 |
LiOH |
0,008 |
СH3COOH |
0,24 |
|
34 |
8,8 |
HBr |
0,003 |
HCN |
0,073 |
|
35 |
6,9 |
RbOH |
0,033 |
HOCl |
0,072 |
|
36 |
7,3 |
HClO4 |
0,0012 |
HBO2 |
0,16 |
|
37 |
6,3 |
HMnO4 |
0,033 |
HOBr |
0,24 |
|
38 |
7,4 |
KOH |
0,045 |
HF |
0,35 |
|
39 |
6,7 |
HNO3 |
0,004 |
HNO2 |
0,28 |
|
40 |
8,2 |
HI |
0,029 |
HOI |
0,29 |
|
41 |
8,3 |
HNO3 |
0,081 |
HOCN |
0,05 |
|
42 |
6,1 |
CsOH |
0,006 |
NH4OH |
0,033 |
|
43 |
6,9 |
HCl |
0,023 |
AgOH |
0,29 |
|
44 |
8,2 |
HClO4 |
0,078 |
HBO2 |
0,62 |
|
45 |
8,6 |
HMnO4 |
0,006 |
HOBr |
0,024 |
|
46 |
8,5 |
LiOH |
0,012 |
HF |
0,036 |
|
47 |
8,2 |
HNO3 |
0,0021 |
HNO2 |
0,025 |
|
48 |
8,0 |
HI |
0,037 |
HOI |
0,027 |
|
49 |
7,9 |
NaOH |
0,013 |
HOCN |
0,015 |
|
50 |
7,9 |
HBr |
0,034 |
NH4OH |
0,08 |
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #
Решение по химии на определение рН раствора электролита
Задача 538.
Вычислить рН растворов, в которых концентрация ионов Н+ (в моль/л) равна: а) 2 . 10-7 моль/л; б) 8,1 . 10-3 моль/л; в) 2,7 . 10-10 моль/л.
Решение:
Степень кислотности или щёлочности раствора выражается отрицательным десятичным логарифмом
концентрации водородных ионов и называется водородным показателем рН:
рН = -lg[H+]
Округляя значение логарифма до 0,01, получим:
а) рН = -lg2 . 10-7 = 7 -lg2 = 7 – 0,30 = 6,70;
б) рН = -lg8,1 . 10-3 = 3 -lg8,1 = 3 – 0,90 = 2,10;
в) рН = -lg2,7 . 10-10 = 10 -lg2,7 = 10 – 0,43 = 9,57.
Ответ: а) 6,70; б) 2,09; в) 9,57.
Задача 539.
Вычислить рН растворов, в которых концентрация ионов OH– (в моль/л) равна: а) 4,6 . 10-4 моль/л; 6) 5 . 10-6 моль/л; в) 9,3 . 10-9 моль/л.
Решение:
Зная концентрацию иона OH– можно рассчитать концентрацию ионов H+ из соотношения:
K(H2O) = [H+] . [OH–] = 10-14.
Округлив значение логарифма до 0,01, получим:
Ответ: а) 10,66; б) 8,70; в) 5,97.
Задача 540.
Вычислить рН 0,01 н. раствора уксусной кислоты, в котором степень диссоциации кислоты равна 0,042.
Решение:
Из выражения [H+] = 
[H+] = 0,042 . 0,01 = 4,2 . 10-4 моль/л.
Степень кислотности или щёлочности раствора выражается отрицательным десятичным логарифмом концентрации водородных ионов и называется водородным показателем рН:
рН = -lg[H+]
Округляя значение логарифма до 0,01, получим:
рН = -lg4,2 . 10-4 = 4 -lg4,2 = 4 – 0,62 = 3,38;
Ответ: 3,38.
Задача 541.
Определить рН раствора, в 1 л которого содержится 0,1 г NаОН. Диссоциацию щелочи считать полной.
Решение:
Так как едкий натр – сильный электролит, который в водных растворах диссоциирует полностью, то концентрация гидроксид-ионов равна концентрации раствора. Находим молярную концентрацию раствора:
Находим pOH раствора:
pOH = -lg[OH–] = -lg2,5 . 10-3 = 3 -lg2,5 = 3 – 0,40 = 2,60.
Так как pH + pOH = pH2O, то получим:
pH + pOH = 14; pH = 14 – pOH = 14 – 2,6 = 11,4.
Ответ: = 11,4.
- Назад
- 1
- 2
- 3
- 4
- 5
- 6
- Далее
- Страница 1 из 6
Рекомендуемые сообщения
Решение задач по фото за 30 минут! Мы онлайн – кликай!
-
- Поделиться
В этой задаче я что-то запуталась, можете помочь? Вычислить pH раствора содержащего 1,20 г уксусной кислоты в 200,0 мл раствора. К(CH3COOH)=1,8*10^-5
Ссылка на комментарий
–>
-
- Поделиться
В этой задаче я что-то запуталась, можете помочь? Вычислить pH раствора содержащего 1,20 г уксусной кислоты в 200,0 мл раствора. К(CH3COOH)=1,8*10^-5
Cм(СН3COOH) = (m/M)*1000/V
[H+] = (Кд*См)1/2
рН = – lg[H+]
Ссылка на комментарий
-
- Поделиться
В этой задаче я что-то запуталась, можете помочь? Вычислить pH раствора содержащего 1,20 г уксусной кислоты в 200,0 мл раствора. К(CH3COOH)=1,8*10^-5
Изменено 12 Февраля, 2012 в 18:36 пользователем Че Гулливер
Ссылка на комментарий
- Автор
-
- Поделиться
Cм(СН3COOH) = (m/M)*1000/V
[H+] = (Кд*См)1/2
рН = – lg[H+]
а Кд это что?
Ссылка на комментарий
-
- Поделиться
Cm = n/v = 0,02/0,2 = 0,01 М
Неужели????
Kr = Kw/Ka = 10^-14/1,8*10^-5 = 5,5*10^-10
Это что? Уксусная кислота умеет гидролизоваться сама по себе?
Ссылка на комментарий
- Автор
-
- Поделиться
Cпаибо наогромнейшее!!!!!!
Ссылка на комментарий
- Автор
-
- Поделиться
помогите подсчитать сколько будет pH = -lg(0,18*10^-2,5)
Ссылка на комментарий
-
- Поделиться
помогите подсчитать сколько будет pH = -lg(0,18*10^-2,5)
А калькулятором не пробовали пользоваться? например встроенный в windows очень даже неплохо это делает.
Ссылка на комментарий
- Автор
-
- Поделиться
А калькулятором не пробовали пользоваться? например встроенный в windows очень даже неплохо это делает.
я такое даже на калькуляторе не подсчитаю((((
Ссылка на комментарий
- Назад
- 1
- 2
- 3
- 4
- 5
- 6
- Далее
- Страница 1 из 6
Для публикации сообщений создайте учётную запись или авторизуйтесь
Вы должны быть пользователем, чтобы оставить комментарий
Войти
Уже есть аккаунт? Войти в систему.
Войти
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИКЗАДАЧНИК
ЛАБОРАТОРНЫЙ ПРАКТИКУМ
НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3/2004
§ 7.2. Слабые кислоты и основания
Если вы будете заниматься исследовательской
работой, вам понадобится знание среды раствора и
его рН. Сейчас вы познакомитесь с растворами
слабых электролитов, узнаете, как рассчитать рН
раствора, зная концентрацию соли и константу
равновесия диссоциации слабого электролита.
Расчет концентрации ионов водорода и
гидроксид-ионов в растворах слабых кислот и
слабых оснований несколько сложнее, чем расчет
для сильных кислот и оснований (щелочей), и
проводится с использованием констант их
диссоциации.
Уксусная кислота – слабый электролит и в очень
незначительной степени диссоциирует по
уравнению:
СН3СООН = СН3СОО– + Н+.
Константа диссоциации (равновесия) К
уксусной кислоты:
Ккисл = [СН3СОО–]
[Н+]/[СН3СООН].
Учитывая, что в растворе уксусной кислоты
концентрации ионов водорода и ацетат-ионов
равны, т.е. [СН3СОО–] = [Н+], а сама
она – слабый электролит и поэтому в состоянии
диссоциации находится лишь малая часть ее
молекул, концентрацию непродиссоциировавших
молекул СН3СООН можно считать равной
концентрации кислоты скисл. Тогда
получаем:
Ккисл = [Н+]2/скисл,
откуда
Пример. Константа диссоциации
уксусной кислоты (данные справочника) равна:
Ккисл = 1,86•10–5. Требуется
рассчитать концентрацию ионов водорода и рН в 0,1М
и 0,01М растворах уксусной кислоты.
Для 0,1М раствора имеем:
рН = –lg (1,36•10–3) = 2,87.
Посмотрим, как скажется на концентрации ионов
водорода и рН раствора разбавление в 10 раз.
Для 0,01М раствора имеем:
рН = –lg (4,31•10–4) = 3,37.
Разбавление уксусной кислоты в 10 раз привело к
понижению концентрации ионов водорода в 1,36•10–3/4,31•10–4
= 3,1 раза, при этом рН повысился на 3,37 – 2,87 = 0,5
единицы рН.
Вспомните, как изменится концентрация ионов
водорода и рН при разбавлении в 10 раз 0,1М
раствора соляной кислоты.
Аналогично определяют
концентрацию ионов водорода и рН раствора
гидроксида аммония:
NH4OH = + OH–,
константа диссоциации которого равна Косн
= 1,79•10–5. Сначала рассчитывают
концентрацию гидроксид-ионов:
и рОН. затем – концентрацию ионов водорода:
[Н+] = Кв/[ОН–] = 10–14/[ОН–]
и определяют рН = 14 – рОН. В 0,01М растворе
гидроксида аммония рН = 10,6. Проверьте.
Если в растворе сильной кислоты или сильного
основания увеличить концентрацию одноименного
иона введением соответствующей соли, например в
раствор НСl или NаОН добавить хлорид натрия NаCl, то
концентрации ионов водорода или гидроксид-ионов
практически не изменяются. Если же такую
операцию, т. е. увеличение концентрации
одноименного иона, провести с раствором слабой
кислоты или слабого основания, то наблюдается
резкое изменение рН раствора.
Рассмотрим, как изменится рН раствора уксусной
кислоты при введении в раствор ацетата натрия
NаСН3СОО, т. е. одноименного
ацетат-иона СН3СОО–.
Согласно принципу Ле Шателье равновесие реакции
диссоциации
сместится влево в результате увеличения
концентрации ацетат-ионов СН3СОО–,
образующихся при полной диссоциации ацетата
натрия как сильного электролита. Такое смещение
равновесия диссоциации уксусной кислоты
означает уменьшение концентрации ионов
водорода, т. е. увеличение рН раствора.
Пример. Рассчитать рН 0,01М
раствора уксусной кислоты, содержащей 0,01 моль/л
ацетата натрия NаСН3СОО.
В выражении константы равновесия
Ккисл = [СН3СОО–][Н+]/[СН3СООН]
= 1,86•10–5
концентрация ацетат-ионов определяется в
основном концентрацией хорошо диссоциирующей
соли NаСН3СОО. Поэтому можно записать:
Из этого соотношения находим концентрацию
ионов водорода:
Откуда рН = 4,73.
Таким образом, в результате введения в 1 л 0,01М
раствора уксусной кислоты 0,01 моль
NаСН3СОО концентрация ионов водорода
уменьшилась в 23 раза (4,31•10–4/1,86•10–5 =
23), а значение рН возросло на 1,36 (4,73 – 3,37 = 1,36)
единицы (значение рН = 3,37 из предыдущего примера).
Аналогично при введении в раствор
слабого основания NН4ОН хлорида аммония NH4Cl
положение равновесия диссоциации гидроксида
аммония смещается в менее основную область и
среда раствора становится более кислотной:
Следовательно, одноименный ион (за исключением
иона водорода и гидроксид-иона), введенный в
раствор слабой кислоты или слабого основания,
изменяет рН таким образом, что среда раствора
приближается к нейтральной. Одноименные ионы в
такого типа системах ведут себя как
нейтрализующие агенты: анион нейтрализует
слабую кислоту, выполняя роль основания, а катион
нейтрализует слабое основание, выполняя роль
кислоты. Такое необычное, с нашей точки зрения,
поведение веществ характерно для многих явлений
природы, показывая нам всеобщую связь и
взаимозависимость объектов окружающего нас мира
и нас самих от него.