У этого термина существуют и другие значения, см. Ртуть (значения).
Иное название этого понятия — «Mercury»; см. также другие значения.
| Ртуть | |||
|---|---|---|---|
| ← Золото | Таллий → | |||
|
|||
| Внешний вид простого вещества | |||
| Тяжёлый жидкий металл серебристо-белого цвета | |||

Жидкая ртуть в ампуле |
|||
| Свойства атома | |||
| Название, символ, номер | Ртуть / Hydrargyrum (Hg), 80 | ||
| Атомная масса (молярная масса) |
200,592(3)[1] а. е. м. (г/моль) | ||
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 | ||
| Радиус атома | 157 пм | ||
| Химические свойства | |||
| Ковалентный радиус | 149 пм | ||
| Радиус иона | (+2e) 110 (+1e) 127 пм | ||
| Электроотрицательность | 2,00 (шкала Полинга) | ||
| Электродный потенциал | Hg ← Hg2+ 0,854 В | ||
| Степени окисления | +2, +1 | ||
| Энергия ионизации (первый электрон) |
1 006,0 (10,43) кДж/моль (эВ) | ||
| Термодинамические свойства простого вещества | |||
| Плотность (при н. у.) | 13,546 (20 °C) г/см³ | ||
| Температура плавления | 234,32 K (−38,83 °C)[2] | ||
| Температура кипения | 629,88 K (356,73 °C)[2] | ||
| Уд. теплота плавления | 2,295 кДж/моль | ||
| Уд. теплота испарения | 58,5 кДж/моль | ||
| Молярная теплоёмкость | 27,98[3] Дж/(K·моль) | ||
| Молярный объём | 14,81 см³/моль | ||
| Кристаллическая решётка простого вещества | |||
| Структура решётки | ромбоэдрическая | ||
| Параметры решётки | ahex = 3,464; сhex = 6,708 Å | ||
| Отношение c/a | 1,94 | ||
| Температура Дебая | 100,00 K | ||
| Прочие характеристики | |||
| Теплопроводность | (300 K) 8,3 Вт/(м·К) | ||
| Номер CAS | 7439-97-6 | ||
| Эмиссионный спектр | |||
|
|
Ртуть (Hg, от лат. Hydrargyrum) — элемент шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80, относящийся к подгруппе цинка, 12-й группе (по устаревшей классификации — побочной подгруппе II группы). Простое вещество ртуть — переходный металл, при комнатной температуре представляющий собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты, контаминант. Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии (второй такой элемент — бром).
История[править | править код]
Ртуть — один из семи металлов, известных с древнейших времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом её основного минерала — киновари. Киноварная краска применялась на территории современной Турции с 8 тыс. лет до н. э., киноварные месторождения юго-восточных провинций современного Китая разрабатывались с 4 тыс. лет до н. э. В древнем Египте киноварь и металлическую ртуть использовали с 3-го тысячелетия до н. э., в древней Индии — с 1—2 тысячелетий до н. э. В Египте был найден сосуд с ртутью, датированный XV−XVI веками до н. э. В Египте, Месопотамии и Китае был известен способ получения ртути из киновари при помощи меди и уксуса. В VII веке до н. э. ассирийские ремесленники применяли ртуть для золочения металлических поверхностей (амальгамирование). Aмальгамирование было известно древним грекам и римлянам, они знали и о токсичности самой ртути и её соединений, в частности сулемы. Ртуть и киноварь упоминаются в «Естественной истории» Плиния Старшего.[4][5][6]
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски[7].
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании[источник не указан 3380 дней]. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов.
С XV века ртуть применялась в качестве лекарственного средства, в 1530 году её медицинское применение описал Парацельс. С XVI века ртуть применялась в Мексике для извлечения серебра из руды, а извлечение золота ртутью известно издревле[8].
Составной частью всех металлов ртуть стал считать арабский алхимик Джабир (Гебер) в IX веке[8]. Алхимики вслед полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий: название планеты алхимиками широко использовалось метонимией ртути (иногда как двойной меркурий). Твёрдая ртуть впервые была получена российскими учеными Ломоносовым и Брауном, которые 24 декабря 1759 года благодаря державшимся две недели сорокаградусным морозам[9] смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.; было показано, что ртуть и в жидком, и в твёрдом состоянии проводит электрический ток[10].
Происхождение названия[править | править код]
Русское название ртути происходит от праслав. *rьtǫtь, связанного с лит. rìsti «катиться»[11].
В 350 году Аристотель назвал ртуть «жидким серебром» (хютос аргюрон), в I веке н. э. Диоскорид называет её «серебряной водой» (хюдраргюрон). Латинское название hydrargyrum впервые встречается у Плиния, и химический знак Hg происходит от него[12].
Из-за легкоподвижности капелек ртути на гладкой поверхности алхимики называли её меркурием в честь греко-римского бога Гермеса (Меркурия) — быстро перемещающегося вестника богов[8].
Нахождение в природе[править | править код]
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами[13]. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями[14].
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg6Cl4O[15] (по другим данным Hg6OCl3(OH)[16], Hg6HCl3O2[17]).
Месторождения и добыча[править | править код]
Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
Ртуть считается редким металлом.[18] Среднее содержание в земной коре — 0,08 миллионной доли[19], но в рудных месторождениях ртуть уже сконцентрирована в десятки тысяч раз: наибольшее содержание доходит до 2,5 %, 0,1 % руды считаются бедными[13]. Часто ртутные месторождения связаны с вулканической активностью[20].
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден), которое наряду с рудниками Словении (Идрия), Италии, США и Мексике было закрыто из-за выработки или падения цен на ртуть. Цены на ртуть были весьма волатильны, в 2006 году они составляли $650 за стандартную в индустрии упаковку 76 фунтов (34 кг)[21]. В 2012 году ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества[22].
Китай является крупнейшим в мире производителем ртути, на долю него в 2012 году приходилось более 72 % мирового объёма производства. Другими крупнейшими производителями ртути являются Кыргызстан, Чили, Россия и Перу. Наибольшими запасами ртути располагает Мексика[23].
В Российской Империи добыча киновари в незначительных количествах начата в 1759 году на Ильдикайском месторождении в Забайкалье. В небольших количествах россыпная киноварь добывалась в Приамурье. В XIX веке разрабатывались месторождения Бирксуйского рудного поля (Южная Фергана) и Хпека (Южный Дагестан). В 1887 году вступило в строй Никитовское ртутное месторождение (в Украине), где до 1908 года годовое производство варьировалось в пределах 47,3-615,9 тонн, существенная часть ртути шла на экспорт. К XXI веку добыча руды и производство первичной ртути на Никитовском месторождении прекратились[24].
К XXI веку в России, согласно Государственному балансу запасов полезных ископаемых, есть 24 месторождения ртутных руд низкого качества, в большинстве своём киноварных с запасами не более 2 тыс. тонн ртути. Четыре сравнительно крупных месторождения — Тамватнейское (14 тыс. т), Западнопалянское (10,1 тыс. т), Чаган- Узунское (14 тыс. т), «Звездочка» (3 тыс. т)[24].
В бывшем СССР наибольшее производство ртути — в Киргизии (Хайдаркан — Айдаркен), с десятикратным отставанием за ней следует Таджикистан. Незначительные количества ртути получают попутно с цинком в Казахстане[24].
В окружающей среде[править | править код]
Содержание ртути в ледниках(?) за 270 лет
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1950-е годы[18], что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы[править | править код]
Природная ртуть состоит из смеси 7 стабильных изотопов: 196Hg (распространённость 0,155 %), 198Hg (10,04 %), 199Hg (16,94 %), 200Hg (23,14 %), 201Hg (13,17 %), 202Hg (29,74 %), 204Hg (6,82 %)[25]. Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210[26]. Из них наиболее устойчива ртуть-194 (период полураспада 444 года).
Прочие радиоактивные изотопы имеют период полураспада менее года.
Получение[править | править код]
Ртуть получают обжигом киновари (сульфида ртути(II)) на воздухе[27]:
- металлотермическим методом[27]:
- или обжигом киновари с известью[27]:
Метод основан на неустойчивости оксида ртути (II), который при нагревании разлагается. Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности[27].
Полученная ртуть очень загрязнена. Сначала её фильтрованием через отверстие избавляют от механических примесей, затем мелкими каплями пропускают сквозь колонку, заполненную азотной кислотой, высушивают концентрированной серной кислотой и перегоняют в вакууме[27].
Физические свойства[править | править код]
Переливание ртути из сосуда в сосуд
Электронная оболочка атома ртути обладает заполненными электронными подуровнями, последние из которых — 4f14 5d10 6s2. Главное отличие ртути от двух других металлов с аналогичной структурой электронного облака, цинка (3d 4s) и кадмия (4d 5s) — заполненность f-подуровня, находящегося по энергии ниже 6s-подуровня. Орбитали f-электронов имеют сложную форму и большой размер, они плохо экранируют заряд ядра. Поэтому удерживающие силы, действующие на 6s-электроны, относительно велики, и 6s-подуровень намного более стабилен, чем у любых других металлов. Этим обусловлены уникальные физические и химические свойства ртути. Так, ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления составляет 234,32 K (−38,83 °C)[2], кипит при 629,88 K (356,73 °C)[2], критическая точка — 1750 K (1477 °C), 152 МПа (1500 атм). Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы — амальгамы. Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W, Co[3].
Плотность ртути при нормальных условиях — 13 596 кг/м3[28].
| t, °С | ρ, г/см3 (103 кг/м3) |
t, °С | ρ, г/см3 (103 кг/м3) |
|---|---|---|---|
| 0 | 13,5950 | 50 | 13,4725 |
| 5 | 13,5827 | 55 | 13,4601 |
| 10 | 13,5704 | 60 | 13,4480 |
| 15 | 13,5580 | 65 | 13,4358 |
| 20 | 13,5457 | 70 | 13,4237 |
| 25 | 13,5335 | 75 | 13,4116 |
| 30 | 13,5212 | 80 | 13,3995 |
| 35 | 13,5090 | 90 | 13,3753 |
| 40 | 13,4967 | 100 | 13,3514 |
| 45 | 13,4845 | 300 | 12,875 |
| t, °C | P, мм рт. ст. | t, °C | P, мм рт. ст. | t, °C | P, мм рт. ст. | t, °C | P, мм рт. ст. |
|---|---|---|---|---|---|---|---|
| −89 | 10−10 | −42 | 10−6 | 46 | 10−2 | 254 | 100 |
| −79 | 10−9 | −25 | 10−5 | 82 | 10−1 | 357 | 760 |
| −68 | 10−8 | −6 | 10−4 | 125 | 1,0 | ||
| −55 | 10−7 | 17 | 10−3 | 202 | 10 |
Почти все соединения ртути, кроме киновари, в большей или меньшей степени летучи[31].
Растиранием с жиром получают серую ртутную мазь, длительным встряхиванием — очень мелкие капельки, похожие на чёрный порошок[31].
Химические свойства[править | править код]
Характерные степени окисления[править | править код]
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +1 | Hg2O | ⟨Hg2(OH)2⟩ | Слабоосновный | Склонность к диспропорционированию. Гидроксид не получен, существуют только соответствующие соли. |
| +2 | HgO | ⟨Hg(OH)2⟩ | Очень слабое основание, иногда — амфотерный | Гидроксид существует только в очень разбавленных (<10−4 моль/л) растворах. |
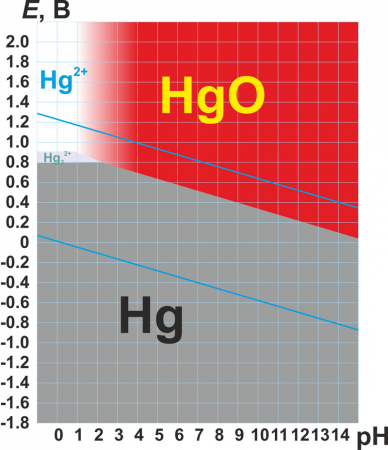
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ с ковалентной связью металл — металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. При нагревании, подщелачивании среды общая электронная пара остаётся у одного атома — происходит диспропорционирование:
подщелачивании:
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, конпропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4 моль/л) растворах. В более концентрированных растворах он дегидратируется:
В очень концентрированной щёлочи оксид ртути частично растворяется с образованием гидроксокомплекса:
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С иодом (−1), серой (−2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл — углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов группы 12 именно у ртути появляется возможность разрушения очень устойчивой электронной оболочки 6d10, что приводит к возможности существования соединений ртути(IV), но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, сообщалось, что при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4[33][34]. Однако более новые исследования не подтвердили его существование[35].
Свойства металлической ртути[править | править код]
Ртуть — малоактивный металл. В сухом воздухе не изменяется[31].
Отношение к простым веществам[править | править код]
При нагревании до 300 °C ртуть вступает в реакцию с кислородом[31]:
При этом образуется оксид ртути(II) красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ:
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути(II):
- Эта реакция идёт и при комнатной температуре при длительном соприкосновении или растирании веществ в ступке[31].
С хлором реагирует при комнатной температуре достаточно энергично[31]:

Ртуть также реагирует с другими галогенами (причём на холоде — медленно).[источник не указан 176 дней]
С одноатомным водородом при температуре жидкого азота образуется соединение ![{displaystyle {ce {Hg{}+H->[-190^{circ }{text{C}}]HgH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ee6f765a79923f4f21050c55ae29e16b3318cbae)
В электрохимическом ряду ртуть стоит близ благородных металлов и вытесняет их из растворов солей. Сама ртуть вытесняется даже медью[31].
Отношение к кислотам[править | править код]
В ряду Бекетова ртуть стоит правее водорода, поэтому она не взаимодействует с кислотами с вытеснением водорода и не растворяется в растворах кислот, не обладающих окислительными свойствами (например, разбавленной серной или соляной)[31], но растворяется в царской водке[36]:
При растворении в разбавленной азотной кислоте на холоде образуется нитрат диртути Hg2(NO3)2 и смесь окислов азота[31]:
в при растворении в горячей и концентрированной азотной кислоте образуется нитрат ртути (II)[31]:
На холоду ртуть под слоем серной кислоты хранится месяцами, взаимодействует с нею только при нагревании, с образованием сульфата ртути (II)[31]:
При растворении ртути в концентрированной хлорной кислоте образуется растворимый перхлорат[источник не указан 58 дней].
Отношение к щелочам[править | править код]
Со щелочами ртуть не взаимодействует[31].
Окисление ртути[править | править код]
Ртуть можно окислить также щелочным раствором перманганата калия:
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
Амальгамы[править | править код]
Амальгамы (от греч. «малагма» — мягкое тело, по-русски сортучки, сортутки) — растворы металлов в ртути. На кривых плавкости систем металл-ртуть находят определённые химические соединения. Например, в амальгамах калия найдено 5: 


В ртути легко растворяются золото, серебро и медь, что является основанием одного из методов добычи серебра и золота. Также амальгама золота при нагревании испаряет ртуть, оставляя огневую позолоту. Амальгама олова использовалась для изготовления зеркал[37].
В целом растворимость металлов в ртути при движении вниз по группам периодической системы возрастает[31]. Весьма малорастворимы в ртути железо и никель (0,0007 и 0,00014)[31].
Применение ртути и её соединений[править | править код]
В медицине[править | править код]
В связи с высокой токсичностью ртуть почти полностью вытеснена из медицинских препаратов. Её соединения (в частности, мертиолят) иногда используются в малых количествах как консервант для вакцин[38]. Сама ртуть сохраняется в ртутных медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до 1960-х годов соединения ртути использовались в медицине очень активно[39]:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — ртутные диуретики;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей);
- ртутная мазь — взвесь металлической ртути в мазевой основе, широко использовалась до появления препаратов висмута и антибиотиков при лечении сифилиса и для дезинсекции при вшивости.
При завороте кишок больному вливали в желудок стакан ртути. По мнению древних врачевателей, предлагавших такой метод лечения, ртуть благодаря своей тяжести и подвижности должна была пройти по кишечнику и под своим весом расправить его перекрутившиеся части[7].
Планета Меркурий (проявление ртути) в виде врача с лекарством. Миниатюра XV века
Препараты ртути применяли с XVI века (в СССР — вплоть до 1963 года, в США — до конца 1970-х годов) для лечения сифилиса. Это было обусловлено тем, что бледная трепонема, вызывающая сифилис, обладает высокой чувствительностью к органическим и неорганическим соединениям, блокирующим сульфгидрильные группы тиоловых ферментов — соединениям ртути, мышьяка, висмута и иода. Однако такое лечение было недостаточно эффективно и весьма токсично для организма больного, приводя к полному выпадению волос и высокому риску развития серьёзных осложнений; причём возможности повышения дозы препаратов ртути или мышьяка при недостаточной противосифилитической активности стандартных доз ограничивались именно токсичностью для организма больного[40]. Также применялись методики общей меркуризации организма, при которой больной помещался в нагревающуюся ёмкость, куда подавались пары ртути. Данная методика, хотя и была относительно эффективна, несла риск смертельного отравления ртутью, что привело к вытеснению её из клинической практики.
Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб. Но после появления светоотверждаемых материалов это применение стало редким.
Радиоактивный изотоп ртуть-203 (T1/2 = 53 с) используется в радиофармакологии[источник не указан 3380 дней].
В технике[править | править код]
- Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент термического расширения почти не зависит от температуры и (в) обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
- Парами ртути заполняют люминесцентные лампы тлеющего и дугового разряда. В спектре испускания паров ртути много ультрафиолетового света, и, чтобы преобразовать его в видимый, стекло ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жёсткого ультрафиолета (254 нм), в каковом качестве и используются для обеззараживания помещений. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
- Ртутные электрические вентили применяются в мощных выпрямительных устройствах, электроприводах, электросварочных аппаратах, тяговых и выпрямительных подстанциях и т. п.[41][нет в источнике] со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
- Ртуть и сплавы на её основе использовались в герметичных выключателях, включающихся при определённом положении.
- Ртуть используется в датчиках положения.
- В некоторых химических источниках тока (например, ртутно-цинковых), в эталонных источниках напряжения (нормальный элемент Вестона).
- Ртуть также иногда применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках[42].
- Ртуть ранее входила в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде. Сейчас запрещается использовать такого типа покрытия.
- Иодид ртути(I) используется как полупроводниковый детектор радиоактивного излучения[43].
- Фульминат ртути(II) («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (детонаторы).
- Бромид ртути(I) применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
- Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
- До середины XX века ртуть широко применялась в барометрах, манометрах и сфигмоманометрах (отсюда традиция измерять давление в миллиметрах ртутного столба). Сейчас чаще применяют анероиды, но ртуть остаётся незаменимой в барометрах и манометрах особо высокой точности (например, на метеорологических станциях).
- Низкое давление насыщенного пара определяет использование ртути в качестве вакуумного материала. Так, ртутные вакуумные насосы были основными источниками вакуума в XIX и начале XX веков.
- Ранее ртуть использовали для золочения поверхностей методом амальгамирования, однако в настоящее время от этого метода отказались из-за токсичности ртути.
- Соединения ртути использовались в шляпном производстве для выделки фетра.
В металлургии[править | править код]
- Металлическая ртуть применяется для получения целого ряда важнейших сплавов[каких?].
- Ранее различные амальгамы металлов, особенно золота и серебра, широко использовались в ювелирном деле, в производстве зеркал.
- Металлическая ртуть служит катодом для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас вместо ртутных катодов часто используют электролиз с диафрагмой, но доля едкого натра и хлора, получаемых электролизом с ртутным катодом, и ныне составляет около трети.
- Ртуть используется для переработки вторичного алюминия (см. амальгамация).
- Ртуть хорошо смачивает золото, поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта технология распространена, в частности, в Амазонии.
В химической промышленности[править | править код]
- Соли ртути использовали в качестве катализатора промышленного получения ацетальдегида из ацетилена (реакция Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим окислением этана или этена.
- Реактив Несслера используется для количественного определения аммиака.
- При производстве хлора и едких щелочей путем электролиза иногда применяется жидкий ртутный катод[44].
В сельском хозяйстве[править | править код]
Высокотоксичные соединения ртути — каломель, сулему, мертиолят и другие — используют для протравливания семенного зерна и в качестве пестицидов.
Токсикология ртути[править | править код]
Ртуть и многие её соединения ядовиты[45]. Воздействие ртути — даже в небольших количествах — может вызывать серьёзные проблемы со здоровьем и представляет угрозу для внутриутробного развития плода и развития ребёнка на ранних стадиях жизни. Ртуть может оказывать токсическое воздействие на нервную, пищеварительную и иммунную системы, а также на лёгкие, почки, кожу и глаза. ВОЗ рассматривает ртуть в качестве одного из десяти основных химических веществ или групп химических веществ, представляющих значительную проблему для общественного здравоохранения[46][47].
Наиболее ядовиты пары́ и растворимые соединения ртути. Сама металлическая ртуть менее опасна, однако она постепенно испаряется даже при комнатной температуре[48]. Пары могут вызвать тяжёлое отравление, для чего достаточно, например, ртути из одного разбитого медицинского термометра. Ртуть и её соединения (сулема, каломель, киноварь, цианид ртути) поражают нервную систему, печень, почки, желудочно-кишечный тракт, при вдыхании — дыхательные пути (а проникновение ртути в организм чаще происходит именно при вдыхании её паров, не имеющих запаха). По классу опасности ртуть относится к первому классу (чрезвычайно опасное химическое вещество). Опасный загрязнитель окружающей среды, особенно опасны выбросы в воду, поскольку в результате деятельности населяющих дно микроорганизмов происходит образование растворимой в воде и токсичной метилртути, накапливающейся в рыбе. Ртуть — типичный представитель кумулятивных ядов.
Органические соединения ртути (диметилртуть и др.) в целом намного токсичнее, чем неорганические, прежде всего из-за их липофильности и способности более эффективно взаимодействовать с элементами ферментативных систем организма.
В норме общее количество ртути в организме человека массой 70 кг составляет около 6 мг. В большинстве тканей организма её относительное содержание 0,2—0,7 мг/кг, в костях 0,5 мг/кг, в крови 0,008 мг/кг[49].
Гигиеническое нормирование концентраций ртути[править | править код]
| Среда | место | продолжительность воздействия |
концентрация | единицы |
|---|---|---|---|---|
| Воздух | в населённых пунктах и в жилых помещениях[50] | среднесуточная | 0,0003 | мг/м3 |
| воздуха в рабочей зоне[51] | макс. разовая | 0,01 | ||
| среднесменная | 0,005 | |||
| Вода | сточная, для неорганических соединений в пересчёте на Hg (II) | 0,005 | мг/л | |
| хозяйственно-питьевого и культурного водопользования | 0,0005 | |||
| рыбохозяйственных водоёмов | 0,00001 | |||
| морских водоёмов | 0,0001 |
Демеркуризация[править | править код]
Демеркуризацией называется очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров. В быту самой частой ситуацией для демеркуризации является ртуть, вылившаяся из разбитого ртутного термометра, что не представляет серьёзной опасности, но требует аккуратности и соблюдения правил безопасности. Необходимо связаться с экстренными службами и выяснить, что делать. Необходимо проветривать помещение. Выбрасывать ртуть в бытовой мусор или сливать в канализацию нельзя. Также нельзя использовать пылесос для сбора ртути — он разобьёт ртуть на мельчайшие капли и ускорит её испарение, таким образом концентрация паров ртути повысится вплоть до опасного уровня[52].
Запрет использования содержащей ртуть продукции[править | править код]
С 2020 года международная конвенция, названная в память массового отравления ртутью и подписанная многими странами, запрещает производство, экспорт и импорт нескольких различных видов ртутьсодержащих продуктов, применяемых в быту, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давления[53]. Конвенция вводит регулирование использования ртути и ограничивает ряд промышленных процессов и отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота), производство цемента[53].
См. также[править | править код]
- Красная ртуть
- Болезнь Минамата
- Отравления ртутью
- Ртутная лампа
- Бром
Примечания[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 3 4 Mercury: physical properties (англ.). WebElements. Дата обращения: 17 августа 2013. Архивировано 26 июля 2013 года.
- ↑ 1 2 Химическая энциклопедия : в 5 т. / Под ред. Н. С. Зефирова. — Москва : Советская энциклопедия, 1995. — Т. 4. — С. 278. — 639 с. — 20 000 экз. — ISBN 5—85270—039—8. — ISBN 5-82270-092-4 (т. 4).
- ↑ Что вы знаете и чего не знаете о ртути и ее соединениях // Химия и жизнь. — 1968. — № 6. — P. 37.
- ↑ Фигуровский Н. А. Очерк общей истории химии. От древнейших времен до начала XIX в.. — Наука, 1969. — С. 37.
- ↑ Янин Е. П. Ртуть, человек, окружающая среда. Дата обращения: 26 сентября 2020. Архивировано 5 мая 2021 года.
- ↑ 1 2 Венецкий С. И. Серебряная вода // Рассказы о металлах. — Москва, 1979. — С. 208—209. — 240 с. — 60 000 экз.
- ↑ 1 2 3 Меншуткин, 1933.
- ↑ Меншуткин, 1933, с. 310.
- ↑ А. А. Шейпак. 7.1 Первые семь металлов // История науки и техники. — М.: МГИУ, 2010. — Т. Ч. II. — С. 38.
- ↑ Фасмер М. Этимологический словарь русского языка. — Прогресс. — М., 1964–1973. — Т. 3. — С. 509—510. Архивная копия от 2 декабря 2013 на Wayback Machine
- ↑ проф. Б. Н. Меншуткин. Курс общей химии (неорганической). — 4-е, совершенно переработанное. — Л.: Госхимизлат, ленинградское отделение, 1933. — С. 307. — 738 с. — 20 200 экз.
- ↑ 1 2 Rytuba, James J (2003). “Mercury from mineral deposits and potential environmental impact”. Environmental Geology. 43 (3): 326—338. DOI:10.1007/s00254-002-0629-5. S2CID 127179672.
- ↑ Вольфсон, Ф. И. Главнейшие типы рудных месторождений / Ф. И. Вольфсон, А. В. Дружинин. — М. : Недра, 1975. — 392 с.
- ↑ Эглестонит — статья из Геологического словаря: т.2. — М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978.
- ↑ Эглестонит — wiki.web.ru. wiki.web.ru. Дата обращения: 6 ноября 2019. Архивировано 6 ноября 2019 года.
- ↑ Eglestonite. Дата обращения: 13 ноября 2019. Архивировано 26 сентября 2020 года.
- ↑ 1 2 Ebany J. Martinez-Finley, Michael Aschner. Recent Advances in Mercury Research (англ.) // Current environmental health reports. — 2014-06. — Vol. 1, iss. 2. — P. 163. — doi:10.1007/s40572-014-0014-z. Архивировано 23 сентября 2021 года.
- ↑ Ehrlich, H. L. Geomicrobiology / Ehrlich, H. L., Newman D. K.. — CRC Press, 2008. — P. 265. — ISBN 978-0-8493-7906-2.
- ↑ Mercury Recycling in the United States in 2000. USGS. Дата обращения: 7 июля 2009. Архивировано 26 марта 2009 года.
- ↑ Brooks, W. E. Mercury. U.S. Geological Survey (2007). Дата обращения: 30 мая 2008. Архивировано 27 мая 2008 года.
- ↑ Almadén and Idrija. Heritage of Mercury. Архивировано 11 июля 2017 года.. UNESCO World Heritage Centre
- ↑ Мировое потребление и производство ртути идет на снижение.
- ↑ 1 2 3 Оценка поступлений ртути в окружающую среду с территории Российской Федерации (2005). — Доклад группы российских экспертов при координационной поддержке COWI совместно с Министерством природных ресурсов РФ (МПР РФ).
- ↑ Meija, Juris. Certification of natural isotopic abundance inorganic mercury reference material NIMS-1 for absolute isotopic composition and atomic weight : [англ.] / Juris Meija, Lu Yang, Ralph E. Sturgeon … [] // Journal of Analytical Atomic Spectrometry. — 2010. — Vol. 25, no. 3. — P. 384–389. — doi:10.1039/B926288A.
- ↑ Audi, G. The NUBASE evaluation of nuclear and decay properties : [англ.] : [арх. 23 сентября 2008] / G. Audi, A. H. Wapstra, C. Thibault … [] // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — Bibcode: 2003NuPhA.729….3A. — doi:10.1016/j.nuclphysa.2003.11.001.
- ↑ 1 2 3 4 5 Меншуткин, 1933, с. 308.
- ↑ Таблицы физических величин, 1976, с. 58.
- ↑ H. L. Clever. Mercury in Liquids, Compressed Gases, Molten Salts and Other Elements. IUPAC SDS. Vol. 29 — Density of Liquid Mercury (англ.). IUPAC SOLUBILITY DATA. NIST (1987). Дата обращения: 29 сентября 2017. Архивировано 31 января 2017 года.
- ↑ Таблицы физических величин, 1976, с. 199.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Меншуткин, 1933, с. 311.
- ↑ Рассчитано по данным, взятым из: Справочник химика. — Т. 3. — М.; Л.: Химия, 1965.
- ↑ Получен фторид Hg(IV): Новости химии @ChemPort.Ru. Дата обращения: 29 апреля 2008. Архивировано 17 октября 2007 года.
- ↑ Wang, Xuefang. Mercury Is a Transition Metal : The First Experimental Evidence for HgF4 : [англ.] / Xuefang Wang, Lester Andrews, Sebastian Riedel … [] // Angewandte Chemie International Edition. — 2007. — Vol. 46, no. 44. — P. 8371−8375. — doi:10.1002/anie.200703710.
- ↑ Is mercury a transition metal? Архивировано 12 октября 2016 года..
- ↑ Реми Г. Курс неорганической химии. — Т. 2. — М.: Мир, 1966.
- ↑ Меншуткин, 1933, с. 312.
- ↑ Государственная фармакопея российской федерации. — Научный центр экспертизы средств медицинского применения, 2008.
- ↑ Закусов В. В. Фармакология. — М.: Медицина, 1966.
- ↑ Ртуть (Hg). Основные средства лечения сифилиса. www.medical-enc.ru. Дата обращения: 18 февраля 2017. Архивировано 19 февраля 2017 года.
- ↑ Ртуть / Каспаров А. А. // Ремень — Сафи. — М. : Советская энциклопедия, 1975. — С. 333—334. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 22).
- ↑ Приборостроение и автоматизация. Справочник. Изд. «Машиностроение» М. 1964
- ↑ Аликбаева Л. А. и др. Полупроводниковые детекторы // Новый справочник химика и технолога / ред.: А. В. Москвин, В. В. Семенова, В. Ф. Теплых. — СПб.: НПО “Профессионал”, 2005. — Радиоактивные вещества. Вредные вещества. Гигиенические нормативы. — 1142 с. — ISBN 5-98371-025-7.
- ↑ Зарецкий С. А., Сучков В. Н., Животинский П. Б. Электрохимическая технология неорганических веществ и химические источники тока : Учебник для учащихся техникумов / Под ред. С. А. Зарецкого. — М.: Высшая школа, 1980. — С. 36. — 423 с.
- ↑ Мишин В. П.; Рубцов А. Ф. (суд.), Серебряков Л. А. (фарм.), Трахтенберг И. М. (гиг.), Цивильно М. А. (псих.). Ртуть // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1984. — Т. 22 : Растворители — Сахаров. — С. 401—406. — 544 с. : ил.
- ↑ Информационный бюллетень ВОЗ N°361. Дата обращения: 28 июня 2013. Архивировано 29 марта 2013 года.
- ↑ : Ha, E., et al., Current progress on understanding the impact of mercury on human health. Environ. Res. (2016), http://dx.doi.org/10.1016/j.envres.2016.06.042i
- ↑ Metallic Mercury — ToxFAQs. Архивировано 8 сентября 2015 года. / Agency for Toxic Substances and Disease Registry (ATSDR), CDC, США
- ↑ Emsley J. Nature’s Building Blocks: An A-Z Guide to the Elements (англ.). — Oxford: Oxford University Press, 2001. — P. 254. — 538 p. — ISBN 9780198503415. Архивная копия от 21 марта 2020 на Wayback Machine
- ↑ СанПиН 1.2.3685-21 «Гигиенические нормативы и требования к обеспечению безопасности и (или) безвредности для человека факторов среды обитания». Дата обращения: 12 июня 2021. Архивировано 4 января 2022 года.
- ↑ МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ. РТУТЬ. Технические условия (Mercury. Specifications) ГОСТ 4658-73. Дата обращения: 12 июня 2021. Архивировано 18 мая 2021 года.
- ↑ Водовозов, Алексей. Мифы о лихорадке : [лекция] : [видео] : 39:00−46:22. — Гиперион, 2019. — 23 января.
- ↑ 1 2 Республика Беларусь подписала Минаматскую конвенцию о ртути, ООН (24 сентября 2014). Архивировано 25 октября 2015 года. Дата обращения: 25 сентября 2014.
Литература[править | править код]
- Ртуть : [арх. 17 ноября 2022] // Пустырник — Румчерод [Электронный ресурс]. — 2015. — (Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов ; 2004—2017, т. 28). — ISBN 978-5-85270-365-1.
- Ртутные руды // Горная энциклопедия: [в 5 томах] / гл. ред. Е. А. Козловский. — М.: «Советская энциклопедия», 1989. — Т. 4. Ортин — Социосфера. — С. 409—410. — 623 с. — 55 700 экз. — ISBN 5-85270-007-X.
- Ртуть // Горная энциклопедия: [в 5 томах] / гл. ред. Е. А. Козловский. — М.: «Советская энциклопедия», 1989. — Т. 4. Ортин — Социосфера. — С. 410—412. — 623 с. — 55 700 экз. — ISBN 5-85270-007-X.
- Ртуть // Популярная библиотека химических элементов / Сост. В. В. Станцо, М. Б. Черненко. — М.: Наука, 1983. — Кн. 2. Серебро-нильсборий и далее. — 572 с.
- Ртуть // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 278—280. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Венецкий, С. И. Серебряная вода // Рассказы о металлах. — М. : Металлургия, 1979. — С. 208—209. — 240 с. — 60 000 экз.
- Таблицы физических величин / под ред. акад. И. К. Кикоина. — М.: Атомиздат, 1976. — 1005 с.
Ссылки[править | править код]
- Месторождения ртути в открытой Геоэнциклопедии.
Все знают про такой необычный металл, как ртуть. Все помнят как она выглядит и как ее пары опасны для человека.
Но знаете ли вы, как добывают ртуть?
Добыча ртути во все времена не обходилась для человечества без потерь. Но интерес к нему был всегда, особенно у ремесленников в Средней Азии. Именно здесь появились первые ртутные рудники в 6-4 веках до нашей эры.
Где содержится ртуть?
Металл содержится в минерале, который называется киноварью — красным камнем, используемым с самых древних времён как натуральный и качественный краситель. Ртуть есть и в других минеральных образований (примерно 20 наименований), но в них этого редкого металла содержится мало.
Особенности месторождений ртути
В промышленном производстве ртуть незаменима, потому что является единственным жидким металлом. Другого такого вещества в текучем виде при стандартной температуре со свойствами, характерными металлам, в природе нет. Поэтому ценность его высокая и поисками месторождений киновари занимаются во всех странах. Из Древнего Китая и Индии в наши дни пришла вера в целебные свойства этого вещества. Там его считали кровью дракона и придавали священные качества получаемому из него серебристому металлу. Со временем его целебные свойства подтвердила наука. Во все века алхимики из соединения ртути и серы пытались получить золото, это значительно повышало ценность металла.
Как получают ртуть
Киноварь содержит более 85% сульфида ртути, другого такого богатого полезным ископаемым минерала геологи не знают. Минеральные конгломераты встречается в виде зернообразных или ромбообразных фрагментов в породах, залегающих на небольшой глубине. Ртутные тела содержатся в кварцитовых, доломитовых и сланцевых отложениях. Ртуть выделяют из руды с помощью нагревания, в этом случае она стекает из каменных образований небольшими каплями, которые собирают в специальные защищённые резервуары.
Разработка месторождений ртути
В практике горнодобывающих работ разработка ртутных тел проводится несколькими способами.
1. Подземные рудники. В них порода дробится с помощью взрывов, затем доставляется на поверхность. Извлечение металла производится путём окислительно-дистиляционного обжига, при котором образуются пары ртути при высоких температурах. Готовый продукт выделяют из фазы газообразного состояния в стадию конденсата и собирают.
2. Способом закачивания в штольни газов, разогретых до 1000 градусов. Этот процесс вызывает переход металла в газовую фазу. Перед началом процедуры рассыпают в ящики с дном в виде сетки сорбент и располагают его в штольне на стеллажах. Затем начинается охлаждение энергоносителя, в результате чего на сорбент выпадает ртутосодержащий конденсат. Его собирают и отправляют на фабрику для извлечения чистого металла.
Есть и другие технологии добычи ртути, но все они сводятся к тому, что в первичных ореолах залегания руды делаются просечки, в них вводится раскалённый газ для образования ртутных паров и сорбент, который потом извлекают с накопившимся на нём ртутным конденсатом и отправляют на предприятие, где получают металл.
В каких странах есть промышленные ртутные месторождения
Значительные ртутные богатства залегают в недрах нескольких стран. Это, Испания, Италия, Китай, Канада, Мексика, США, государствах Средней Азии. Испания является самой богатой на месторождения ртути, здесь 75% мировых запасов металла и самый крупный рудник — Альмаден. Его начали разрабатывать более двух тысячелетий назад.
В России основные разработки ведутся в Забайкалье, на Камчатке, Алтае, Кавказе. Известными богатыми месторождениями ртути являются рудники ближнего зарубежья — Никитовский в Украине и Хайдаркен в Узбекистане (Ферганская долина).
[источники]
Источник: https://kipmu.ru/kak-dobyvayut-rtut/
Этот загадочный металл сводил с ума алхимиков, которые считали его живым серебром, озадачивает современных физиков – известные законы бессильны перед ртутью… С одним только названием – шарада!
Она способна поразить воображение, хотя так привычна даже в быту – в старых термометрах. Зеркально-блестящая, серебристо-яркая, исключительно прыгучая и всегда – шариками. Прямо диво дивное и чудо чудное! Так мне казалось в детстве)
Но поговорим по-взрослому. “Ртуть – единственный жидкий металл”, так ведь известно многим со школы. Нет, не единственный. Все металлы могут быть жидкими, хватило бы температуры воздействия.
- Есть среди них тугоплавкие – которые можно расплавить высокими температурами. Это вольфрам, никель, платина и др
- Есть легкоплавкие. Свинец, олово, индий и др Наверху их списка три сильно отличных от других: рубидий (расплавится в очень жаркий день), галлий и цезий (условно: расплавятся у человека на ладони. Галлий безопасен, цезий моментально вызовет сильный ожог). А ртуть – далеко отстоящий лидер, она плавится при температуре чуть менее МИНУС 39°С.
То есть, правильная формулировка: ртуть – единственный на сегодня известный металл, находящийся в жидком агрегатном состоянии при обычных на поверхности Земли условиях.
И в этом её загадка.
- Франций – это очень и очень спорно. Некоторые и вовсе заявляют, что его не существует. Но можно оппонировать в комментариях.
Убийственное долголетие
Не сразу врачеватели поняли, что пары ртути смертельно опасны. И пытались не только исцелять “живым серебром” ото всего подряд, но и здоровым людям обещали продлить жизнь. Теперь в медицине она служит только для консервации некоторых в акцин.
Но её применяют в сельском хозяйстве, увы. И в некоторых производствах, с выбросами которых она попадает в атмосферу и морскую воду.
А в недрах Земли как самородное полезное ископаемое этот металл – огромнейшая редкость. Добывают ртуть из сульфидных минералов, в основном, из киновари. Да, да, той же, что была источником красной краски некоторое время назад.
- Либо киноварь дробят, доставляют на завод и там нагревают, из паров получают чистое вещество.
- Либо в штольни помещают сорбент и закачивают туда газ в 1000°С. Ртуть испаряется, при остывании конденсант с ртутью оседает на сорбент. И его доставляют на завод для переработки в чистую ртуть.
Такой диссонанс: редкий металл, но его почти негде использовать, и потому он – дешёвый. Как известный Неуловимый Джо…
Не похожа ни на что
Но это в промышленном смысле. А для науки ртуть – тайна. Потому что чёткого ответа о её необычности пока нет. Есть попытки объяснений. Вот какое выбрала я.
У ртути тяжёлое атомное ядро. При таком не хватает свободных электронов на внешней оболочке атомов, и тогда частота колебаний атомов не позволяет установить фиксированную кристаллическую решётку.
Согласны или есть другие предположения?
Обычно сравнивают строение атома ртути и золота, ведь они почти не отличаются. А сами металлы совсем не похожи. Феномен.
А на закуску о названии. Ведь только мы называем этот металл ртутью. Ранее было: рътоть. От общеславянского корня ret(h), родственный литовский ritu – катать, бежать. Бегающая, катающаяся.
В остальных языках этот металл называется меркурием вслед за алхимиками. Они знали семь планет и семь металлов, которые и нарекли по именам планет. “Живому серебру” достался Меркурий.
Но обратите внимание на обозначение – Hg. Это от латинского названия элемента Hydrargyrum (гидраргирум) – “вода-серебро”.
Для работы проектов iXBT.com нужны файлы cookie и сервисы аналитики.
Продолжая посещать сайты проектов вы соглашаетесь с нашей
Политикой в отношении файлов cookie
Все мы знаем, что ртуть является жидким металлом и ранее частенько применялась в изготовлении градусников. И, возможно, вы его когда-нибудь ломали. В этом случае по полу растекались маленькие зеркально-серебристые шарики. Но как, если это металл? Металлов на нашей планете довольно много и все они могут принимать жидкое состояние в зависимости от температуры плавления. И если для одних металлов температура плавления составляет более 3000 градусов, то для других хватит тепла ваших рук.
Температура плавления ртути составляет менее – 39 градусов цельсия. Поэтому ртуть можно считать единственным на сегодня известным металлом, находящимся в агрегатном состоянии при обычных условиях.
Так как же добывается ртуть, ведь она жидкая при положительных температурах. Во-первых, жидкие капли ртути можно обнаружить в природе. Образуются такие капли на срезах ртутных минералов и постепенно скапливаются в небольших количествах. Но основную массу ртути добывают промышленным способом из сульфидных минералов, к примеру, киноварь. Которая с древности использовалась в качестве красителя.
А во-вторых добыча производится в шахтах и рудниках. Породу высвобождают взрывом и дробят на небольшие фракции для подъема на поверхность. После транспортировки на завод по переработке, добытую руду нагревают до 400 градусов. Ртуть в минералах при такой температуре начинает закипать и испаряться. Остается лишь собрать полученные пары ртути, переведя их в стадию конденсата.
Есть и другой способ добычи. Когда в шахтах на подготовленных стеллажах размещают ящики, заполненные специальным сорбентом. Внутрь шахты закачивают нагретый до 1000 градусов специальный газ. Минералы содержащие ртуть нагреваются и металл переходит в газообразное состояние. После охлаждения на поверхности сорбента оседает конденсат, содержащий частички ртути. После остывания сорбента его отправляют на завод для дальнейшей переработки в чистую ртуть.
Пары ртути действительно ядовиты, но об этом мало кто задумывался, потому как не знали. В древние времена ее использовали чуть ли не стаканами, пытаясь вылечить различные болезни. Принимали внутрь для излечения от заворота кишок, но эффект был негативным. В наше время ртуть может применяться не только в градусниках и барометрах, но и для консервации вакцин. Парами ртути наполняются люминесцентные и газоразрядные лампы. Сулему используют для протравки семян и в качестве антисептика. А оксид ртути и киноварь может добавляться в медицинские препараты для лечения заболеваний глаз и кожи.
Источник https://www.youtube.com/watch?v=sfIRYuaGta8
Сейчас на главной
Новости
Публикации

Мини-ПК — универсальная штука, котороя может быть заменой полноценного большого системного блока, переносным рабочим место, небольшим сервером для какого-то сервиса, а иногда можно и…

Привет. К написанию этого материала меня подтолкнула необязательность одного знаменитого «мобильного аналитика». Тот обещал на нескольких примерах рассказать, как санкции пагубно повлияли на…

Сегодня расскажу свои советы по 3Д печати: что нужно
докупить, чтобы процесс печати был комфортным для печатника. Ниже будут
исключительно личные советы, из моего личного опыта. Я не призываю…

Классическая живопись эпохи Возрождения вызывает в основном положительные эмоции. Вспомнить жемчужину итальянского Высокого Возрождения — портрет Моны Лизы кисти великого Леонардо да Винчи. Ее…

Решив не отставать от своих конкурентов, компания Tripowin тоже представила динамические наушники, но уже не на 10, а на 11 мм излучателе. Назвали их скромно – Piccolo. Настройку сделали, как…

Классическая блочная аудиотехника вышла из моды, не вписалась в современную реальность. Но музыку с приемлемым качеством слушать хочется, поэтому появляются компромиссные и недорогие аудио…
|
|
|
| Название, символ, номер | Ртуть / Hydrargyrum (Hg), 80 |
|---|---|
| Атомная масса (молярная масса) |
200,592(3) а. е. м. (г/моль) |
| Электронная конфигурация | [Xe] 4f14 5d10 6s2 |
| Радиус атома | 157 пм |
| Ковалентный радиус | 149 пм |
| Радиус иона | (+2e) 110 (+1e) 127 пм |
| Электроотрицательность | 2,00 (шкала Полинга) |
| Электродный потенциал | Hg←Hg2+ 0,854 В |
| Степени окисления | +2, +1 |
| Энергия ионизации (первый электрон) |
1 006,0 (10,43) кДж/моль (эВ) |
| Плотность (при н. у.) | 13,546 (20 °C) г/см³ |
| Температура плавления | 234,32 K (-38,83 °C) |
| Температура кипения | 629,88 K (356,73 °C) |
| Уд. теплота плавления | 2,295 кДж/моль |
| Уд. теплота испарения | 58,5 кДж/моль |
| Молярная теплоёмкость | 27,98 Дж/(K·моль) |
| Молярный объём | 14,81 см³/моль |
| Структура решётки | ромбоэдрическая |
| Параметры решётки | ahex=3,464 сhex=6,708 Å |
| Отношение c/a | 1,94 |
| Температура Дебая | 100,00 K |
| Теплопроводность | (300 K) 8,3 Вт/(м·К) |
| Номер CAS | 7439-97-6 |
Содержание
- 1 История
- 1.1 Происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 3 В окружающей среде
- 4 Изотопы
- 5 Получение
- 6 Физические свойства
- 7 Химические свойства
- 7.1 Характерные степени окисления
- 7.2 Свойства металлической ртути
- 8 Применение ртути и её соединений
- 8.1 Медицина
- 8.2 Техника
- 8.3 Металлургия
- 8.4 Химическая промышленность
- 8.5 Сельское хозяйство
- 9 Токсикология ртути
- 9.1 Гигиеническое нормирование концентраций ртути
- 9.2 Демеркуризация
- 9.3 Запрет использования содержащей ртуть продукции
История
Астрономический символ планеты Меркурий
Ртуть известна с древних времён. Нередко её находили в самородном виде (жидкие капли на горных породах), но чаще получали обжигом природной киновари. Древние греки и римляне использовали ртуть для очистки золота (амальгамирование), знали о токсичности самой ртути и её соединений, в частности сулемы. Много веков алхимики считали ртуть главной составной частью всех металлов и полагали, что если жидкой ртути возвратить твёрдость при помощи серы или мышьяка, то получится золото. Выделение ртути в чистом виде было описано шведским химиком Георгом Брандтом в 1735 году. Для представления элемента как у алхимиков, так и в настоящее время используется символ планеты Меркурий. Но принадлежность ртути к металлам была доказана только трудами Ломоносова и Брауна, которые в декабре 1759 года смогли заморозить ртуть и установить её металлические свойства в твёрдом состоянии: ковкость, электропроводность и др.
Происхождение названия
Русское название ртути происходит от праслав. *rьtǫtь, связанного с лит. rìsti «катиться». Символ Hg заимствован от латинского алхимического названия этого элемента hydrargyrum (от др.-греч. ὕδωρ «вода» и ἄργυρος «серебро»).
Нахождение в природе
Ртуть — относительно редкий элемент в земной коре со средней концентрацией 83 мг/т. Однако ввиду того, что ртуть слабо связывается химически с наиболее распространёнными в земной коре элементами, ртутные руды могут быть очень концентрированными по сравнению с обычными породами. Наиболее богатые ртутью руды содержат до 2,5 % ртути. Основная форма нахождения ртути в природе — рассеянная, и только 0,02 % её заключено в месторождениях. Содержание ртути в различных типах изверженных пород близки между собой (около 100 мг/т). Из осадочных пород максимальные концентрации ртути установлены в глинистых сланцах (до 200 мг/т). В водах Мирового океана содержание ртути — 0,1 мкг/л. Важнейшей геохимической особенностью ртути является то, что среди других халькофильных элементов она обладает самым высоким потенциалом ионизации. Это определяет такие свойства ртути, как способность восстанавливаться до атомарной формы (самородной ртути), значительную химическую стойкость к кислороду и кислотам.
Ртуть присутствует в большинстве сульфидных минералов. Особенно высокие её содержания (до тысячных и сотых долей процента) устанавливаются в блёклых рудах, антимонитах, сфалеритах и реальгарах. Близость ионных радиусов двухвалентной ртути и кальция, одновалентной ртути и бария определяет их изоморфизм во флюоритах и баритах. В киновари и метациннабарите сера иногда замещается селеном или теллуром; содержание селена часто составляет сотые и десятые доли процента. Известны крайне редкие селениды ртути — тиманит (HgSe) и онофрит (смесь тиманита и сфалерита).
Ртуть является одним из наиболее чувствительных индикаторов скрытого оруденения не только ртутных, но и различных сульфидных месторождений, поэтому ореолы ртути обычно выявляются над всеми скрытыми сульфидными залежами и вдоль дорудных разрывных нарушений. Эта особенность, а также незначительное содержание ртути в породах, объясняются высокой упругостью паров ртути, возрастающей с увеличением температуры и определяющей высокую миграцию этого элемента в газовой фазе.
В обычных условиях киноварь и металлическая ртуть не растворимы в воде, но в присутствии некоторых веществ (Fe2(SO4)3, озон, пероксид водорода) растворимость в воде этих минералов достигает десятков мг/л. Особенно хорошо растворяется ртуть в сульфидах щелочных металлов с образованием, например, комплекса HgS•nNa2S. Ртуть легко сорбируется глинами, гидроксидами железа и марганца, глинистыми сланцами и углями.
В природе известно около 20 минералов ртути, но главное промышленное значение имеет киноварь HgS (86,2 % Hg). В редких случаях предметом добычи является самородная ртуть, метациннабарит HgS и блёклая руда — шватцит (до 17 % Hg). На единственном месторождении Гуитцуко (Мексика) главным рудным минералом является ливингстонит HgSb4S7. В зоне окисления ртутных месторождений образуются вторичные минералы ртути. К ним относятся, прежде всего, самородная ртуть, реже метациннабарит, отличающиеся от таких же первичных минералов большей чистотой состава. Относительно распространена каломель Hg2Cl2. На месторождении Терлингуа (Техас) распространены и другие гипергенные галоидные соединения — терлингуаит Hg2ClO, эглестонит Hg4Cl.
Месторождения
Ртуть считается редким металлом.
Одно из крупнейших в мире ртутных месторождений находится в Испании (Альмаден). Известны месторождения ртути на Кавказе (Дагестан, Армения), в Таджикистане, Словении, Киргизии (Хайдаркан — Айдаркен), Донбассе (Горловка, Никитовский ртутный комбинат).
В России находятся 23 месторождения ртути, промышленные запасы составляют 15,6 тыс. тонн (на 2002 год), из них крупнейшие разведаны на Чукотке — Западно-Палянское и Тамватнейское.
В окружающей среде
Содержание ртути в ледниках за 270 лет
До индустриальной революции осаждение ртути из атмосферы составляло около 4 нанограммов на 1 кубический дециметр льда. Природные источники, такие, как вулканы, составляют примерно половину всех выбросов атмосферной ртути. Причиной появления остальной половины является деятельность человека. В ней основную долю составляют выбросы в результате сгорания угля (главным образом в тепловых электростанциях) — 65 %, добыча золота — 11 %, выплавка цветных металлов — 6,8 %, производство цемента — 6,4 %, утилизация мусора — 3 %, производство соды — 3 %, чугуна и стали — 1,4 %, ртути (в основном для батареек) — 1,1 %, остальное — 2 %.
Одно из тяжелейших загрязнений ртутью в истории случилось в японском городе Минамата в 1956 году, что привело к более чем трём тысячам жертв, которые либо умерли, либо сильно пострадали от болезни Минамата.
Изотопы
Основная статья: Изотопы ртути
Природная ртуть состоит из смеси 7 стабильных изотопов: 196Hg (распространённость 0,155 %), 198Hg (10,04 %), 199Hg (16,94 %), 200Hg (23,14 %), 201Hg (13,17 %), 202Hg (29,74 %), 204Hg (6,82 %). Искусственным путём получены радиоактивные изотопы ртути с массовыми числами 171—210.
Получение
Ртуть получают обжигом киновари (сульфида ртути II) или металлотермическим методом:
- HgS + O2 ⟶ Hg + SO2↑
- HgS + Fe ⟶ FeS↓ + Hg
Пары ртути конденсируют и собирают. Этот способ применяли ещё алхимики древности.
На протяжении многих столетий в Европе основным и единственным месторождением ртути был Альмаден в Испании. В Новое время с ним стала конкурировать Идрия во владениях Габсбургов (современная Словения). Там же появилась первая лечебница для поражённых отравлением парами ртути рудокопов. В 2012 г. ЮНЕСКО объявило промышленную инфраструктуру Альмадена и Идрии памятником Всемирного наследия человечества.
В надписях во дворце древнеперсидских царей Ахеменидов (VI—IV века до н. э.) в Сузах упоминается, что ртутную киноварь доставляли сюда с Зеравшанских гор и использовали в качестве краски.
Физические свойства
100 граммовая гирька, не тонет в металлическая ртути, из-за разницы по плотности
Переливание ртути из сосуда в сосуд
Ртуть — единственный металл, который находится в жидком состоянии при комнатной температуре. Температура плавления составляет 234,32 K (-38,83 °C), кипит при 629,88 K (356,73 °C), критическая точка — 1750 K (1477 °C), 152 МПа (1500 атм). Обладает свойствами диамагнетика. Образует со многими металлами жидкие и твёрдые сплавы — амальгамы. Стойкие к амальгамированию металлы: V, Fe, Mo, Cs, Nb, Ta, W, Co.
Плотность ртути при нормальных условиях — 13 546 кг/м3, при других температурах — в таблице:
| Температура в °С | Плотность (ρ), 103 кг/м3 | Температура в °С | Плотность (ρ), 103 кг/м3 |
| 0 | 13,5950 | 50 | 13,4725 |
| 5 | 13,5827 | 55 | 13,4601 |
| 10 | 13,5704 | 60 | 13,4480 |
| 15 | 13,5580 | 65 | 13,4358 |
| 20 | 13,5457 | 70 | 13,4237 |
| 25 | 13,5335 | 75 | 13,4116 |
| 30 | 13,5212 | 80 | 13,3995 |
| 35 | 13,5090 | 90 | 13,3753 |
| 40 | 13,4967 | 100 | 13,3514 |
| 45 | 13,4845 | 300 | 12,875 |
Химические свойства
Характерные степени окисления
| Степень окисления | Оксид | Гидроксид | Характер | Примечания |
|---|---|---|---|---|
| +1 | Hg2O | <Hg2(OH)2или
Hg2O•H2O>* |
Слабоосновный | Склонность к диспропорционированию |
| +2 | HgO | <Hg(OH)2>** | Очень слабое основание, иногда — амфотерный |
- *Гидроксид не получен, существуют только соответствующие соли.
- **Гидроксид существует только в очень разбавленных (<10−4моль/л) растворах.
Диаграмма Пурбе системы Hg-HgO
Для ртути характерны две степени окисления: +1 и +2. В степени окисления +1 ртуть представляет собой двухъядерный катион Hg22+ со связью металл-металл. Ртуть — один из немногих металлов, способных формировать такие катионы, и у ртути они — самые устойчивые.
В степени окисления +1 ртуть склонна к диспропорционированию. Оно протекает при нагревании:
-
- Hg22+ → Hg + Hg2+
подщелачивании:
-
- Hg22+ + 2OH− → Hg + HgO + H2O
добавлении лигандов, стабилизирующих степень окисления ртути +2.
Из-за диспропорционирования и гидролиза гидроксид ртути (I) получить не удаётся.
На холоде ртуть +2 и металлическая ртуть, наоборот, сопропорционируют. Поэтому, в частности, при реакции нитрата ртути (II) со ртутью получается нитрат ртути (I):
-
- Hg + Hg(NO3)2 → Hg2(NO3)2
В степени окисления +2 ртуть образует катионы Hg2+, которые очень легко гидролизуются. При этом гидроксид ртути Hg(OH)2 существует только в очень разбавленных (<10−4моль/л) растворах. В более концентрированных растворах он дегидратируется:
-
- Hg2+ + 2OH− → HgO + H2O
В очень концентрированной щёлочи оксид ртути частично растворяется с образованием гидроксокомплекса:
-
- HgO + OH− + H2O → [Hg(OH)3]−
Ртуть в степени окисления +2 образует уникально прочные комплексы со многими лигандами, причём как жёсткими, так и мягкими по теории ЖМКО. С йодом (-1), серой (-2) и углеродом она образует очень прочные ковалентные связи. По устойчивости связей металл-углерод ртути нет равных среди других металлов, поэтому получено огромное количество ртутьорганических соединений.
Из элементов IIБ группы именно у ртути появляется возможность разрушения очень устойчивой 6d10 — электронной оболочки, что приводит к возможности существования соединений ртути IV, но они крайне малоустойчивы, поэтому эту степень окисления скорее можно отнести к курьёзной, чем к характерной. В частности, при взаимодействии атомов ртути и смеси неона и фтора при температуре 4 К получен HgF4. Однако более новые исследования не подтвердили его существование.
Свойства металлической ртути
Ртуть — малоактивный металл. Она не растворяется в растворах кислот, не обладающих окислительными свойствами, но растворяется в царской водке с образованием тетрахлорортутной кислоты:
-
- 3Hg + 2HNO3 + 12HCl → 3H2[HgCl4] + 2NO↑ + 4H2O
и азотной кислоте:
-
- Hg + 4HNO3 → Hg(NO3)2 + 2NO2↑ + 2H2O
Также с трудом растворяется в серной кислоте при нагревании, с образованием сульфата ртути:
-
- Hg + 2H2SO4 → HgSO4 + SO2↑ + 2H2O
При растворении избытка ртути в азотной кислоте на холоде образуется нитрат диртути Hg2(NO3)2.
При нагревании до 300 °C ртуть вступает в реакцию с кислородом:
-
- 2Hg + O2 →300∘C 2HgO
При этом образуется оксид ртути II красного цвета. Эта реакция обратима: при нагревании выше 340 °C оксид разлагается до простых веществ.
-
- 2HgO →>340∘C 2Hg + O2↑
Реакция разложения оксида ртути исторически является одним из первых способов получения кислорода.
При нагревании ртути с серой образуется сульфид ртути II:
-
- Hg + S →t∘C HgS
Ртуть также реагирует с галогенами (причём на холоде — медленно).
Ртуть можно окислить также щелочным раствором перманганата калия:
-
- Hg + 2KMnO4 + 3KOH → K[Hg(OH)3] + 2K2MnO4
и различными хлорсодержащими отбеливателями. Эти реакции используют для удаления металлической ртути.
Словенский город Идрия — крупнейший в Европе центр добычи ртути с XV века
Применение ртути и её соединений
Медицина
В связи с высокой токсичностью ртуть почти полностью вытеснена из медицинских препаратов. Её соединения (в частности, мертиолят) иногда используются в малых количествах как консервант для вакцин. Сама ртуть сохраняется в ртутных медицинских термометрах (один медицинский термометр содержит до 2 г ртути).
Однако вплоть до 1970-х годов соединения ртути использовались в медицине очень активно:
- хлорид ртути I (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути II, цианид ртути II , амидохлорид ртути и жёлтый оксид ртути II — антисептики (в том числе в составе мазей).
Известны случаи, когда при завороте кишок больному вливали в желудок стакан ртути. По мнению древних врачевателей, предлагавших такой метод лечения, ртуть благодаря своей тяжести и подвижности должна была пройти по кишечнику и под своим весом расправить его перекрутившиеся части.
Планета Меркурий (проявление ртути) в виде врача с лекарством. Миниатюра XV в.
Препараты ртути применяли с XVI в. (в СССР вплоть до 1963 года) для лечения сифилиса. Это было обусловлено тем, что бледная трепонема, вызывающая сифилис, обладает высокой чувствительностью к органическим и неорганическим соединениям, блокирующим сульфгидрильные группы тиоловых ферментов микроба — соединениям ртути, мышьяка, висмута и йода. Однако такое лечение было недостаточно эффективно и весьма токсично для организма больного, приводя к полному выпадению волос и высокому риску развития серьезных осложнений; причем возможности повышения дозы препаратов ртути или мышьяка при недостаточной противосифилитической активности стандартных доз ограничивались именно токсичностью для организма больного. Также применялись методики общей меркуризации организма, при которой больной помещался в нагревающуюся емкость, куда подавались пары ртути. Данная методика, хотя и была относительно эффективна, но побочные эффекты и риск смертельного отравления ртутью привел к постепенному вытеснению её из клинической практики.
Амальгаму серебра применяли в стоматологии в качестве материала зубных пломб до появления светоотверждаемых материалов.
Ртуть-203 (T1/2 = 53 сек) используется в радиофармакологии.
Техника
- Ртуть используется как рабочее тело в ртутных термометрах (особенно высокоточных), так как (а) обладает довольно широким диапазоном, в котором находится в жидком состоянии, (б) её коэффициент термического расширения почти не зависит от температуры и (в) обладает сравнительно малой теплоёмкостью. Сплав ртути с таллием используется для низкотемпературных термометров.
- Парами ртути заполняют люминесцентные лампы, поскольку пары светятся в тлеющем разряде. В спектре испускания паров ртути много ультрафиолетового света и, чтобы преобразовать его в видимый, стекло люминесцентных ламп изнутри покрывают люминофором. Без люминофора ртутные лампы являются источником жёсткого ультрафиолета (254 нм), в каковом качестве и используются для обеззараживания помещений. Такие лампы делают из кварцевого стекла, пропускающего ультрафиолет, поэтому они называются кварцевыми.
- Ртутные электрические вентили (игнитроны) в мощных выпрямительных устройствах, электроприводах, электросварочных устройствах, тяговых и выпрямительных подстанциях и т. п. со средней силой тока в сотни ампер и выпрямленным напряжением до 5 кВ.
- Ртуть и сплавы на её основе используются в герметичных выключателях, включающихся при определённом положении.
- Ртуть используется в датчиках положения.
- В некоторых химических источниках тока (например, ртутно-цинковых), в эталонных источниках напряжения (Нормальный элемент Вестона).
- Ртуть также иногда применяется в качестве рабочего тела в тяжелонагруженных гидродинамических подшипниках.
- Ртуть ранее входила в состав некоторых биоцидных красок для предотвращения обрастания корпуса судов в морской воде. Сейчас запрещается использовать такого типа покрытия.
- Йодид ртути I используется как полупроводниковый детектор радиоактивного излучения.
- Фульминат ртути II («гремучая ртуть») издавна применяется в качестве инициирующего ВВ (Детонаторы).
- Бромид ртути I применяется при термохимическом разложении воды на водород и кислород (атомно-водородная энергетика).
- Перспективно использование ртути в сплавах с цезием в качестве высокоэффективного рабочего тела в ионных двигателях.
- До середины XX века ртуть широко применялась в барометрах, манометрах и сфигмоманометрах (отсюда традиция измерять давление в миллиметрах ртутного столба).
- Низкое давление насыщенного пара определяет использование ртути в качестве вакуумного материала. Так, ртутные вакуумные насосы были основными источниками вакуума в XIX и начале XX веков.
- Ранее ртуть использовали для золочения поверхностей методом амальгамирования, однако в настоящее время от этого метода отказались из-за токсичности ртути.
- Соединения ртути использовались в шляпном производстве для выделки фетра.
Металлургия
- Металлическая ртуть применяется для получения целого ряда важнейших сплавов.
- Ранее различные амальгамы металлов, особенно золота и серебра, широко использовались в ювелирном деле, в производстве зеркал.
- Металлическая ртуть служит катодом для электролитического получения ряда активных металлов, хлора и щелочей. Сейчас вместо ртутных катодов используют электролиз с диафрагмой.
- Ртуть используется для переработки вторичного алюминия (см. амальгамация)
- Ртуть хорошо смачивает золото, поэтому ей обрабатывают золотоносные глины для выделения из них этого металла. Эта технология распространена, в частности, в Амазонии.
Химическая промышленность
- Соли ртути использовали в качестве катализатора промышленного получения ацетальдегида из ацетилена (реакция Кучерова), однако в настоящее время ацетальдегид получают прямым каталитическим окислением этана или этена.
- Реактив Несслера используется для количественного определения аммиака.
- При производстве хлора и едких щелочей путем электролиза иногда применяется жидкий ртутный катод.
Сельское хозяйство
Высокотоксичные соединения ртути — каломель, сулему, мертиолят и другие — используют для протравливания семенного зерна и в качестве пестицидов.
Токсикология ртути
Основная статья: Отравление ртутью
NFPA 704 для данного вещества (синее — опасность для здоровья, красное — огнеопасность, жёлтое — реакционноспособность)
Ртуть и все её соединения ядовиты. Воздействие ртути — даже в небольших количествах — может вызывать серьёзные проблемы со здоровьем и представляет угрозу для внутриутробного развития плода и развития ребёнка на ранних стадиях жизни. Ртуть может оказывать токсическое воздействие на нервную, пищеварительную и иммунную системы, а также на легкие, почки, кожу и глаза. ВОЗ рассматривает ртуть в качестве одного из десяти основных химических веществ или групп химических веществ, представляющих значительную проблему для общественного здравоохранения.
Наиболее ядовиты пары́ и растворимые соединения ртути. Сама металлическая ртуть менее опасна, однако она постепенно испаряется даже при комнатной температуре. Пары могут вызвать тяжёлое отравление. Ртуть и её соединения (сулема, каломель, киноварь, цианид ртути) поражают нервную систему, печень, почки, желудочно-кишечный тракт, при вдыхании — дыхательные пути (а проникновение ртути в организм чаще происходит именно при вдыхании её паров, не имеющих запаха). По классу опасности ртуть относится к первому классу (чрезвычайно опасное химическое вещество). Опасный загрязнитель окружающей среды, особенно опасны выбросы в воду, поскольку в результате деятельности населяющих дно микроорганизмов происходит образование растворимой в воде и токсичной метилртути, накапливающейся в рыбе. Ртуть — типичный представитель кумулятивных ядов.
Органические соединения ртути (диметилртуть и др.) в целом намного токсичнее, чем неорганические, прежде всего из-за их липофильности и способности более эффективно взаимодействовать с элементами ферментативных систем организма.
Гигиеническое нормирование концентраций ртути
Предельно допустимые уровни загрязнённости металлической ртутью и её парами:
- ПДК в населённых пунктах (среднесуточная) — 0,0003 мг/м³
- ПДК в жилых помещениях (среднесуточная) — 0,0003 мг/м³
- ПДК воздуха в рабочей зоне (макс. разовая) — 0,01 мг/м³
- ПДК воздуха в рабочей зоне (среднесменная) — 0,005 мг/м³
- ПДК сточных вод (для неорганических соединений в пересчёте на двухвалентную ртуть) — 0,005 мг/л
- ПДК водных объектов хозяйственно-питьевого и культурного водопользования, в воде водоёмов — 0,0005 мг/л
- ПДК рыбохозяйственных водоёмов — 0,00001 мг/л
- ПДК морских водоёмов — 0,0001 мг/л
Демеркуризация
Основная статья: Демеркуризация
Очистка помещений и предметов от загрязнений металлической ртутью и источников ртутных паров называется демеркуризацией. В быту широко применяется демеркуризация с помощью серы и хлорного железа FeCl3.
Запрет использования содержащей ртуть продукции
Основная статья: Минаматская конвенция о ртути
С 2020 года международная конвенция, названная в честь массового отравления ртутью и подписанная многими странами, запретит производство, экспорт и импорт нескольких различных видов ртутьсодержащих продуктов, применяемых в быту, в том числе электрических батарей, электрических выключателей и реле, некоторых видов компактных люминесцентных ламп (КЛЛ), люминесцентных ламп с холодным катодом или с внешним электродом, ртутных термометров и приборов измерения давления. Конвенция вводит регулирование использования ртути и ограничивает ряд промышленных процессов и отраслей, в том числе горнодобывающую (особенно непромышленную добычу золота), производство цемента.













![{displaystyle {ce {HgO + OH^- + H2O -> [Hg(OH)3]^-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6e6710707c6dea509e84f46e8f377744b2702141)
![{displaystyle {ce {2Hg{}+O2->[300~^{circ }{text{C}}]2HgO}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b0151483c33f61a8caa97688ef7a52f9938cc1df)
![{displaystyle {ce {2HgO->[>340~^{circ }{text{C}}]2Hg{}+O2uparrow }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/617b04609598dab7eec93c7b185e1a1053ddb4e3)
![{displaystyle {ce {Hg{}+S->[t~^{circ }{text{C}}]HgS}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d99595cc84db8f983cf4c668ad1297c41b643e16)
![{displaystyle {ce {3 Hg + 2 HNO3 + 12 HCl -> 3 H2[HgCl4] + 2 NO ^ + 4 H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0cb7974db5c06d9f330bbcdd8ba5a5ea6d820caf)
![{displaystyle {ce {3Hg{}+2HNO3{}+6HCl->[50{-}70~^{circ }{text{C}}]3HgCl2{}+2NOuparrow +4H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bb7130f2a4b20abe707c5cbf164e7214ff1dbfd8)



![{displaystyle {ce {Hg + 2 KMnO4 + 3 KOH -> K[Hg(OH)3] + 2 K2MnO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/56af49d6caa656a23caf000a10717578fe0cdaa0)