Как определить сильные и слабые электролиты
Электролиты – это вещества, сплавы веществ или растворы, которые имеют способность электролитически проводить гальванический ток. Определить, к каким электролитам относится вещество, можно применяя теорию электролитической диссоциации.

Инструкция
Суть данной теории заключается в том, что при расплавлении (растворении в воде) практически все электролиты раскладываются на ионы, которые бывают как положительно, так и отрицательно заряженные (что и называется электролитической диссоциацией). Под воздействием электрического тока отрицательные (анионы «-») движутся к аноду (+), а положительно заряженные (катионы, «+»), движутся к катоду (-). Электролитическая диссоциация – это обратимый процесс (обратный процесс носит название «моляризация»).
Степень (a) электролитической диссоциации находится в зависимости от природы самого электролита, растворителя, и от их концентрации. Это отношение числа молекул (n) , которые распались на ионы к общему числу введенных в раствор молекул (N). Получаете: a = n / N
Таким образом, сильные электролиты – вещества, полностью распадающиеся на ионы при растворении в воде. К сильным электролитам, как правило, относятся вещества с сильнополярными или ионными связями: это соли, которые хорошо растворимы, сильные кислоты (HCl, HI, HBr, HClO4, HNO3, H2SO4), а также сильные основания (KOH, NaOH, RbOH, Ba(OH)2, CsOH, Sr(OH)2, LiOH, Ca(OH)2). В сильном электролите вещество, растворенное в нем, находится по большей части в виде ионов (анионов и катионов); молекул, которые недиссоциированные – практически нет.
Слабые электролиты – такие вещества, которые диссоциируют на ионы лишь частично. Слабые электролиты вместе с ионами в растворе содержат молекулы недиссоциированные. Слабые электролиты не дают в растворе сильной концентрации ионов.
К слабым относятся:
– органические кислоты (почти все) (C2H5COOH, CH3COOH и пр.);
– некоторые из неорганических кислот (H2S, H2CO3 и пр.);
– практически все соли, малорастворимые в воде, гидроксид аммония, а также все основания (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
– вода.
Они практически не проводят электрический ток, или проводят, но плохо.
Обратите внимание
Хотя чистая вода проводит электрический ток очень плохо, она все-таки имеет измеримую электрическую проводимость, объясняемую тем, что вода немного диссоциирует на гидроксид-ионы и ионы водорода.
Полезный совет
Большинство электролитов – вещества агрессивные, поэтому при работе с ними будьте предельно осторожны и соблюдайте правила техники безопасности.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Сильные и слабые электролиты


4.2
Средняя оценка: 4.2
Всего получено оценок: 672.
4.2
Средняя оценка: 4.2
Всего получено оценок: 672.
Соединения и простые вещества, расплавы и растворы которых проводят электрический ток, называются электролитами. Выделяют сильные и слабые электролиты.
Что такое электролиты
Под воздействием молекул воды или при нагревании молекулы некоторых веществ распадаются на ионы. В растворе или в расплаве остаются положительно и отрицательно заряженные частицы – катионы и анионы. Они являются переносчиками электрического тока, поэтому растворы и расплавы, содержащие ионы, проводят электрический ток.
Вещества, способные распадаться на ионы, называются электролитами, а процесс распада – электролитической диссоциацией.
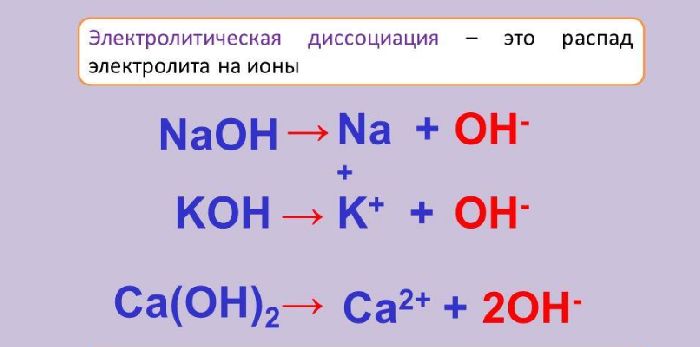
Электролиты отличаются друг от друга степенью электролитической диссоциации. Это величина, показывающая отношение распавшихся ионов к общему количеству молекул вещества. Чем больше степень диссоциации, тем быстрее растворяются или расплавляются вещества.
Степень диссоциации вычисляется по формуле α = n/N, где n – количество распавшихся молекул, N – общее количество молекул. Чтобы выразить степень диссоциации в процентах, необходимо n/N умножить на 100 %.
В зависимости от степени диссоциации выделяют два типа электролитов:
- сильные – быстро распадаются на катионы и анионы;
- слабые – затруднительно распадаются ионы.
Диссоциации подвергаются вещества с ковалентными полярными или ионными связями. Молекулы воды оттягиваю полярные молекулы вещества. Нагревание кристаллических веществ вызывает колебание ионов в узлах кристаллической решётки вплоть до её разрушения.
Различия
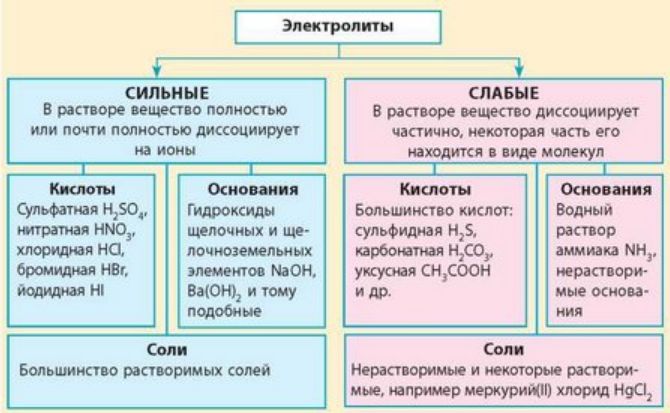
Краткая характеристика сильных и слабых электролитов представлена в таблице.
|
Признак |
Электролиты |
|
|
Сильные |
Слабые |
|
|
Соединения |
– Растворимые соли (NaCl, KF, Ca(NO3)2, K2PO4); – сильные неорганические кислоты (HNO3, H2SO4, HCl, HBr); – щёлочи (LiOH, NaOH, Ca(OH)2, Ba(OH)2) |
– Органические кислоты (CH3COOH, C2H5COOH); – разбавленные и слабые неорганические кислоты (H2S, H3PO4, HNO2, H2SiO3); – вода; – нерастворимые основания (Mg(OH)2, Fe(OH)2, Zn(OH)2); – гидроксид аммония NH4OH |
|
Степень диссоциации |
α > 30 % |
α < 3 % |
|
Обратимость диссоциации |
Необратимая |
Обратимая. Происходит моляризация – восстановление молекул |
|
Растворимость |
Полностью растворяются |
Частично растворяются |
На степень диссоциации влияют внешние факторы – температура, давление, концентрация вещества или растворителя. При неизменных условиях устанавливается равновесие – константа диссоциации.

Что мы узнали?
Из урока химии узнали, что такое электролиты. Это вещества, способные проводить электрический ток за счёт содержания положительно и отрицательно заряженных ионов – катионов и анионов. Электролиты бывают двух видов. Сильные электролиты необратимо распадаются на ионы. К ним относится большинство солей, сильные кислоты, щёлочи. Слабые электролиты плохо распадаются на ионы. Диссоциация в этом случае протекает обратимо. К слабым электролитам относятся органические и слабые кислоты, вода и нерастворимые основания.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Екатерина Давыдова
5/5
-

Лидия Маслова
5/5
Оценка доклада
4.2
Средняя оценка: 4.2
Всего получено оценок: 672.
А какая ваша оценка?
Электролиты
Электролиты — в химии это вещества, растворы или расплавы, которые при растворении проводят электрический ток и выделяют ионы.
Эти растворы проводят электричество из-за подвижности:
- положительно заряженных ионов (называются катионами)
- и отрицательно заряженных ионов (называются анионами).
В питании это минералы, которые содержатся в крови, поте и моче. Когда минералы растворяются в жидкости, они образуют электролиты, т.е. положительные или отрицательные ионы, которые используются в метаболических процессах организма.
Метаболизм — процесс поддержания жизни организма, при котором калории от потребляемой пищи превращаются в энергию
Сильные и слабые электролиты
Сильные электролиты быстро и полностью ионизируются при растворении, и в растворе не образуются нейтральные молекулы. Примеры сильных электролитов:
- NaCl (хлорид натрия),
- HNO3 (азотная кислота),
- HClO3 (хлорноватая кислота),
- CaCl2 (хлорид кальция) и др.
У слабых электролитов при растворении в воде ионизируются лишь небольшие фракции молекул, т.е. в их растворах присутствует некое количество нейтральных молекул. Примеры слабых электролитов:
- большинство органических кислот и оснований,
- NH4OH (аммиак),
- H2CO3 (угольная кислота),
- CH3COOH (уксусная кислота), и др.
Как определить сильный и слабый электролит?
Сильные электролиты полностью ионизируются, т.к. основными компонентами раствора сильных электролитов являются ионы, и степень диссоциации такого электролита стремится к 1 (т.е. степень диссоциации α ≈ 1). Слабые электролиты ионизируются только частично, т.е. степень диссоциации такого электролита стремится к 0 (или α < 1).
В таблице растворимости можно посмотреть степень диссоциации электролита.
Сильные электролиты:
- растворимые соли,
- многие неорганические кислоты,
- основания щелочных и щелочноземельных металлов.
Слабые электролиты:
- почти все органические кислоты и вода,
- некоторые неорганические кислоты,
- нерастворимые гидроксиды металлов.
Электролиты и неэлектролиты
Все электролиты при растворении в воде дают ионы и проводят электрический ток. К электролитам относятся:
- кислоты,
- основания,
- соли (почти все).
Неэлектролиты — это вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся:
- многие органические вещества (сахара, спирты, углеводы, углеводороды, бензол, альдегиды, простые и сложные эфиры, и пр.)
- вещества, в молекулах которых существуют ковалентные неполярные или малополярные связи.
Электролиты в организме
Электролиты — это минералы, которые несут электрический заряд при растворении в воде. В питании этот термин относится к минералам, которые содержатся в крови, поте и моче.
Эти минералы, растворяясь в жидкости, образуют электролиты, т.е. положительные или отрицательные ионы, которые используются в метаболических процессах.
В организме человека электролиты играют роль в:
- проведении нервных импульсов,
- сокращении мышц,
- поддержании количества жидкости (гидратации),
- поддержании кислотно-щелочного баланса.
Электролиты в организме человека включают:
- Натрий,
- Калий,
- Хлориды,
- Кальций,
- Магний,
- Хлор,
- Фосфаты,
- Гидрокарбонаты.
Узнайте также про Электролиз.
Главное их отличие в их электропроводности. Это и отражено в их названии. Сильные электролиты хорошо проводят электричество, а слабые – нет. К свойствам сильных электролитов можно отнести их способность при взаимодействии с водой растворяться в ней и практически полностью диссоциировать на ионы. Слабые электролиты при растворении в воде в то же время не распадаются (не диссоциируют) на ионы.
В разбавленных растворах значение степени диссоциации у сильных электролитов стремится к единице, тогда как у слабых оно стремится к нулю. Электролитическая диссоциация у слабого электролита является обратимым (способным вернуться в обратную сторону) процессом, а для сильного – необратимым процессом.
Сильными электролитами являются все соли и щелочи, а также некоторые сильные кислоты (например, серная кислота H2SO4, азотная кислота HNO3). А к слабым электролитам относят все слабые кислоты (например, угольная кислота H₂CO₃), а также водный раствор аммиака.
Как отличать сильные электролиты от слабых?
Мыслитель
(7915),
закрыт
12 лет назад
Павел Бескровный
Профи
(893)
12 лет назад
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ при растворении в воде практически полностью диссоциируют на ионы. У таких электролитов ЗНАЧЕНИЕ СТЕПЕНИ диссоциации стремится К ЕДИНИЦЕ в разбавленных растворах.
К сильным электролитам относят:
1) практически все соли;
2) сильные кислоты, например: H2SO4 (серная к-та) , HCl (соляная к-та) , HNO3 (азотная к-та) ;
3) все щёлочи, например: NaOH (гидроксид натрия) , KOH (гидроксид калия) .
СЛАБЫЕ ЭЛЕКТРОЛИТЫ при растворении в воде почти не диссоциируют на ионы. У таких электролитов ЗНАЧЕНИЕ СТЕПЕНИ диссоциации стремится К НУЛЮ.
К слабым электролитам относят:
1) слабые кислоты – H2S (сероводородная к-та) , H2CO3 (угольная к-та) , HNO2;
2) водный раствор аммиака NH3 * H2O
СТЕПЕНЬ ДИССОЦИАЦИИ – это отношение числа частиц, распавшихся на ионы (Nд) , к общему числу растворённых частиц (Nр) , (обозначается греческой буквой альфа) :
a= Nд / Nр . Электролитическая диссоциация – процесс обратимый для слабых электролитов. Электролиты надеюсь знаешь, что такое, раз спрашиваешь. Это по-проще, если по-сложней, то смотри выше (по ряду ЭО) .
Электролитическая диссоциация – процесс обратимый для слабых электролитов.
Если есть вопросы, то шли на мыло.
Источник: О. С. Габриелян – Химия 8 класс
ВячекВысший разум (391245)
12 лет назад
ВСё, что Вы написали, задавший вопрос ученик мог бы и сам прочесть в учебнике, но ВСЁ это не позволяет именно отличить сильные электролиты от слабых. Это даёт только эксперимент, например, измерение электропроводности, о чём не во всех учебниках и пишут-то
Татьяна Серик
Ученик
(108)
6 лет назад
Сильні електроліти-електроліти, ступінь дисоціації яких навіть у відносно концентрованих розчинах високий (близький до 1). Слабкі електроліти-електроліти, ступінь дисоціації яких навіть у розведених розчинах невеликий.
