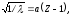Вероятно речь идёт о s-, p-, d- и f-элементах. Определить это очень просто. У s- элементов заполняются электронами s- орбитали, y p- элементов – p-орбитали и т.д. Посмотрите в Периодическую таблицу. Скажем, второй период. У элемента Li конфигурация внешнего электронного слоя 2s1, то есть на s-орбитали имеется один электрон. Значит, Li – это s-элемент. Далее стоит Be. У него s-орбиталь содержит на один электрон больше, чем у Li, то есть конфигурация Be – 2s2. Это тоже s-элемент. Следующие 6-элементов (от B до Ne) – это p-элементы. У них электроны заполняют уже не s-орбиталь как у Li и Be, а p-орбиталь. Каждый следующий атом, начиная с Be, имеет на p-орбитали на один электрон больше, чем предыдущий.
Третий период совершенно аналогичен второму. Сначала идут два s-элемента: Na и Mg, затем идут 6 p-элементов: Al – Ar.
Четвертый период начинается снова с двух s-элементов (K, Ca). Но в третьем периоде существует “вставка” из 10-ти d-элементов (от Sc до Zn). У них заполняются d-орбитали. А после цинка идут 6 p-элементов (Ga-Kr).
Пятый период аналогичен четвертому. А вот в шестом периоде возникает еще одна “вставка” из 14-ти f-элементов. Их называют Лантаноиды и обычно выносят за пределы таблицы. У лантаноидов заполняются электронами f-орбитали. Итак, шестой период, как и все предыдущие периоды начинается с двух s-элементов (Cs, Ba), затем идёт один d-элемент La, затем идёт вставка f-элементов (Лантаноиды), затем с Hf до Hg происходит заполнение d-орбиталей (это d-элементы) и заканчивается период шестью p-элементами (Tl – Rh).
Седьмой период был бы аналогичен шестому, если бы был закончен.
Если Вы заметили, количество элементов каждого семейства в одном периоде равно максимальному количеству электронов на соответствующих орбиталях. Например, s-электронов два, s-элементов в одном периоде два, p-электронов шесть, p-элементов тоже шесть в одном периоде, d-электронов 10, а f-электронов 14, такое же количество d- и f- элементов в каждом периоде.
NiNa Martushova
Искусственный Интеллект
(153334)
10 лет назад
В основе построения таблицы, – заполнение электронами энергетических уровней и подуровней атомов элементов по принципу минимальной энергии, который отражен правилами Клечковского. В связи с этим, первые два элемента всех периодов, -это s-элементы, у которых заполняется s-подуровень внешнего энергетического уровня. У р-элементов заполняется тоже внешний уровень, но р-подуровень, -это последние 6 элементов всех периодов, начиная со второго. У d-элементов заполняется d-подуровень предпоследнего уровня, – это 10 элементов, которые расположены в таблице между s- и р- элементами в больших периодах. f-элементы, -у них заполняется f-подуровень третьего снаружи уровня, – это лантоноиды и актиноиды. Их по 14.
Перейти к контенту
Панель информации
-
Вход
-
Панель информации
-
Курсы
-
Календарь
-
Входящие
Закрыть
В зависимости от того, какой подуровень
последним заполняется электронами, все
элементы делятся на четыре типа –
электронные семейства:
-
s
– элементы;
заполняется электронами s
– подуровень внешнего уровня. К ним
относятся первые два элемента каждого
периода. Валентными1являютсяs-электроны
внешнего уровня. -
p
– элементы;
заполняется электронами р – подуровень
внешнего уровня. Это последние шесть
элементов каждого периода (кроме I
и VII).
Валентными
являются s–
и p–
электроны внешнего уровня. -
d
– элементы; заполняется
электронами d
– подуровень второго снаружи уровня,
а на внешнем уровне – один или два
электрона (y
46Pd
– нуль). К ним относятся элементы
вставных декад больших периодов,
расположенных между s
– и p
– элементами (их также называют
переходными элементами). Валентными
являются s
– электроны внешнего уровня и d
– электроны предвнешнего уровня
(второго
снаружи). -
f
– элементы;
заполняется электронами f
– подуровень третьего снаружи уровня,
а на внешнем уровне остается два
электрона. Они расположены в 6 – м (4f
– элементы) и 7 – м (5f
– элементы) периодах периодической
системы. 4f
– элементы объединяют в семейство
лантаноидов, а 5f
– элементы – семейство актиноидов.
В периодической системе s – элементов
14, p – элементов 30, d – элементов 38, f –
элементов 28.
2.9. Понятие об электронных аналогах
Атомы элементов с одинаковым заполнением
внешнего энергетического уровня носят
название электронных аналогов.Например:
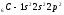
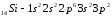
Элементы с одинаковым строением
внешнего и предвнешнего энергетических
уровней называют полными электронными
аналогами.Например:
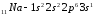
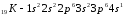
2.10. Периодический закон и периодическая система элементов д.И. Менделеева
Важнейшим событием химии в 19 веке было
открытие периодического закона, сделанное
в 1869 г. гениальным русским ученым Д.
И. Менделеевым. Периодический закон
в формулировке Д. И. Менделеева гласит:
“ свойства элементов, а потому и свойства
образуемых ими простых и сложных тел,
стоят в периодической зависимости от
их атомного веса”.
Графическим выражением этого закона
стала созданная им периодическая система
элементов.
В настоящее время известно несколько
сотен вариантов периодической системы
элементов, но все они в своей основе
содержат предложенные Менделеевым
принципы её построения. Наибольшее
распространение получили короткая
(восьмиклеточная) и длинная
(тридцатидвухклеточная) формы периодической
система элементов.
Развитие учения о строении атома вскрыло
глубокий физической смысл периодического
закона. Как было доказано, свойства
элементов зависят, прежде всего, от
заряда атомных ядер, который в свою
очередь определяет распределение
электронов на электронных оболочках
атомов. Основной характеристикой атома
является положительный заряд ядра,
численно равный порядковому номеру
элемента. В нейтральном атоме заряд
ядра и общее число электронов равны.
Распределением электронов на электронных
оболочках атомов определяются свойства
элементов и их соединений, положение
элемента в периодической системе.
Периодичность изменения свойств
химических элементов и их соединений
зависит от периодически повторяющейся
сходной структуры электронных оболочек
атомов.
В 1913 г. ученик Резерфорда английский
ученый Мозли, исследуя спектры лучей
Рентгена для различных элементов,
установил простое соотношение между
длиной волны рентгеновских лучей и
порядковым номером элемента (закон
Мозли):
Корень квадратный из величины, обратной
длине волны рентгеновских лучей,
испускаемых атомами различных элементов,
находится в линейной зависимости от
порядкового номера элемента, т. е.
где
– длина волны; Z
– порядковый номер элемента;
– постоянная, одинаковая для всех
элементов.
Из
уравнения следует, что, зная
и измерив ,
можно вычислить порядковый номер
элемента. Это экспериментальный метод
проверки правильности распределения
элементов в периодической системе по
возрастанию заряда ядра. Закон Мозли
показал, что Д.И. Менделеев правильно
расположил элементы в периодической
системе, позволил установить общее
число элементов в каждом периоде, а
главное, направил усилия ученых на
открытие предсказанных им элементов.
Вскоре несколько элементов было открыто
с помощью анализа рентгеновских спектров
(гафний, Z=72;
рений, Z=75
и др.).
Вместе с тем из закона
Мозли следует, что порядковый номер –
это не простая нумерация элементов, а
выражение конкретного внутреннего
свойства атома – величины элементарных
положительных зарядов ядра. Именно
положительный заряд ядра (а не атомная
масса) является главной характеристикой
атома.
В
свете современных представлений о
строении атома изменилась и формулировка
периодического закона: свойства
химических элементов, а также формы и
свойства их соединений находятся в
периодической зависимости от величины
заряда атомных ядер.
Семейное определение в химии
На чтение 5 мин. Просмотров 89 Опубликовано 27.05.2021
В химии семейство – это группа элементов со схожими химическими свойствами. Химические семейства обычно связаны с вертикальными столбцами периодической таблицы. Термин «семья» является синонимом термина «группа». Поскольку эти два слова на протяжении многих лет определяли разные наборы элементов, IUPAC рекомендует использовать элементы нумерации числовой системы от группы 1 до группы 18 над общими названиями семейств или групп. В этом контексте семейства различаются по орбитальному положению самого удаленного электрона. Это связано с тем, что количество валентных электронов является основным фактором при прогнозировании типов реакций, в которых будет участвовать элемент, связей, которые он будет образовывать, степени окисления и многих его химических и физических свойств.
Примеры: Группа 18 в таблице Менделеева также известна как семейство благородных газов или группа благородных газов. Эти элементы имеют 8 электронов в валентной оболочке (полный октет). Группа 1 также известна как щелочные металлы или литиевая группа. Элементы этой группы имеют один орбитальный электрон во внешней оболочке. Группа 16 также известна как кислородная группа или семейство халькогенов.
Содержание
- Названия семейств элементов
- Другие способы идентификации элемента Семейства
- Гомологи элементов
- Ключевые выводы семейства элементов
- Источники
Названия семейств элементов
Вот диаграмма, которая показывает номер ИЮПАК группы элементов, его тривиальное имя и его семейное имя. Обратите внимание, что, хотя семейства обычно представляют собой вертикальные столбцы в периодической таблице, группа 1 называется семейством лития, а не семейством водорода. Элементы f-блока между группами 2 и 3 (элементы, находящиеся под основной частью периодической таблицы) могут быть или не нумероваться. Существуют разногласия по поводу того, включает ли группа 3 лютеций (Lu) и лоуренсий (Lw), включает ли она лантан (La) и актиний (Ac), и включает ли она все лантаноиды и актиниды..
| Группа ИЮПАК | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| Семейство | литий | бериллий | скандий | титан | ванадий | хром | марганец | железо | кобальт | никель | медь | цинк | бор | автомобиль bon | азот | кислород | фтор | гелий или неон |
| Тривиальное название | щелочные металлы | щелочноземельные металлы | n/a | n/a | n/a | n/a | n/a | n/a | n/a | n/a | чеканка металлов | летучие металлы | икосагены | кристаллогены | пниктогены | халькогены | галогены | благородные газы |
| Группа CAS | IA | IIA | IIIB | IVB | VB | VIB | VIIB | VIIIB | VIIIB | VIIIB | IB | IIB | IIIA | IVA | VA | VIA | VIIA | VIIIA |
Другие способы идентификации элемента Семейства
Вероятно, лучший способ идентифицировать семейство элементов – связать его с группой IUPAC, но вы найдете ссылки на другие семейства элементов i в литературе. На самом базовом уровне иногда семейства просто считаются металлами, металлоидами или полуметаллами и неметаллами. Металлы, как правило, имеют положительное состояние окисления, высокие температуры плавления и кипения, высокую плотность, высокую твердость, высокую плотность и являются хорошими проводниками электричества и тепла. С другой стороны, неметаллы, как правило, легче, мягче, имеют более низкие температуры плавления и кипения и плохо проводят тепло и электричество. В современном мире это проблематично, потому что то, имеет ли элемент металлический характер или нет, зависит от его состояния. Например, водород может действовать как щелочной металл, а не как неметалл. Углерод может действовать как металл, а не как неметалл.
Общие семейства включают щелочные металлы, щелочноземельные металлы, переходные металлы (где лантаноиды или редкие частицы и актиниды могут рассматриваться как подмножество или как отдельные группы), основные металлы, металлоиды или полуметаллы, галогены, благородные газы и другие неметаллы.
Примерами других семейств, с которыми вы можете столкнуться, могут быть постпереходные металлы (группы с 13 по 16 периодической таблицы), платиновая группа и драгоценные металлы. металлы.
Гомологи элементов
Гомологи элементов являются членами одного семейства элементов. Поскольку гомологичные элементы обладают схожими электрохимическими свойствами, их можно использовать для прогнозирования поведения новых элементов. Это становится все более полезным для сверхтяжелых элементов, из которых приготовлено лишь несколько атомов. Однако прогнозы не всегда точны. Причина в том, что эффекты валентных электронов не столь значительны, когда в атоме очень много протонов и электронов. Более легкие гомологи чаще обладают общими свойствами.
Ключевые выводы семейства элементов
- Семейство элементов – это столбец элементов периодической таблицы.
- Каждый член семейства имеет одинаковое количество валентных электронов.
- Члены семейства обладают схожими химическими и физическими свойствами.
- Семейство элементов также называется группой элементов. Из-за возможной путаницы IUPAC предпочитает, чтобы группы элементов были помечены номером, а не именем.
- Всего существует 18 семейств или групп элементов.
Источники
- Флюк, Э. (1988). «Новые обозначения в периодической таблице» (PDF). Pure Appl. Chem . ИЮПАК. 60 (3): 431–436. doi: 10.1351/pac198860030431
- Ли, Дж. Дж. Номенклатура неорганической химии: Рекомендации 1990 . Blackwell Science, 1990. ISBN 0-632-02494-1.
-
Определение периодической таблицы в химии
-
Руководство по изучению периодической таблицы – Введение и история
-
Семейства элементов Периодической таблицы
-
Периодическая таблица групп элементов
-
Список групп периодических таблиц
-
Введение в Периодическую таблицу
-
Идентификация блоков элементов в Периодической таблице
-
Разница между группой элементов и периодом
-
Как устроена периодическая таблица сегодня?
-
Металлический символ: свойства и Тенденции
-
Периодическая таблица для детей
-
Металлы: список элементов
-
Семейство элементов Carbon
-
Какие части Периодической таблицы?
-
Определение элементов основной группы
-
Как использовать Периодическую таблицу элементов