| Сернистая кислота | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Сернистая кислота | |
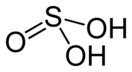
| Хим. формула | H2SO3 | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 82.07 г/моль | |
| Плотность | 1,03 г/см³ | |
| Химические свойства | ||
Константа диссоциации кислоты  |
1,81 | |
| Растворимость | ||
| • в воде | 14.73 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | 7782-99-2 | |
| PubChem | 1100 | |
| Рег. номер EINECS | 231-973-1 | |
| SMILES |
OS(=O)O |
|
| InChI |
InChI=1S/H2O3S/c1-4(2)3/h(H2,1,2,3) LSNNMFCWUKXFEE-UHFFFAOYSA-N |
|
| ChEBI | 48854 | |
| ChemSpider | 1069 | |
| Безопасность | ||
| Пиктограммы ECB |
|
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Серни́стая кислота́ (химическая формула — H2SO3) — химическая неорганическая кислота средней силы, существующая только в водном растворе. Образуется при растворении диоксида серы в воде.
Её соли и эфиры называются сульфи́тами и ги́дросульфи́тами.
Физические свойства[править | править код]
Сернистая кислота — это двухосновная кислота средней силы. Образуется при растворении диоксида серы в воде. Ввиду неустойчивости не может быть выделена в чистом виде из водных растворов.
Химические свойства[править | править код]
Кислота средней силы:
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
- Баланс реакции лежит далеко слева.
Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфиты (в избытке щёлочи):
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:

При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Необратимо окисляется кислородом до серной кислоты при +70 °C под давлением и в присутствии сульфата меди (II). Образующийся сульфит меди (II) окисляется кислородом до сульфата меди (II):

Физиологические свойства[править | править код]
Пары сернистой кислоты имеют примерно те же свойства воздействия на организм человека, что и её ангидрид, сернистый газ, — с той только разницей, что концентрация таких паров в случае кислоты будет всегда ниже. Тем не менее, сернистая кислота всегда приводит к стойкому раздражению дыхательных путей, не позволяющему человеку продолжительного пребывания в атмосфере, сколько-нибудь богатой такими парами. При постоянном действии на человека даже разрежённых испарений сернистой кислоты, сразу не производящей заметного раздражения дыхательных органов, всё равно проявляются катаральные воспаления соединительной оболочки глаз, возникают трудности дыхания, расстройство пищеварения, что, в конце концов, приводит к общему упадку сил организма.[1]
Применение[править | править код]
- Восстановитель, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей;
- Консервирование плодов, овощей, винных изделий;
- Осветление фруктовых соков, долгое время производимое при посредстве сернистого газа, на самом деле в своём механизме использует химическое воздействие сернистой кислоты;[2]
Примечания[править | править код]
- ↑ Ф. Ф. Эрисман. «Профессиональная гигиена». Избранные произведения: в 2 т. — М.: Медгиз, 1959 г.
- ↑ И. Н. Вольпер. Сахар: сладкий, горький, соленый — М.: «Химия и жизнь», № 10, 1965 г.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Сернистая кислота – это неорганическая двухосновная неустойчивая кислота средней силы. Непрочное соединение, известна только в водных растворах при концентрации не более шести процентов. При попытках выделить чистую сернистую кислоту она распадается на оксид серы (SO2) и воду (H2O). Например, при воздействии серной кислоты (H2SO4) в концентрированном виде на сульфит натрия (Na2SO3) вместо сернистой кислоты выделяется оксид серы (SO2). Вот так выглядит данная реакция:
Na2SO3 (сульфит натрия) + H2SO4 (серная кислота) = Na2SO4 (сульфат натрия) + SO2 (серы диоксид) + H2O (вода)
Раствор сернистой кислоты
При его хранении необходимо исключить доступ воздуха. Иначе сернистая кислота, медленно поглощая кислород (O2), превратится в серную.
2H2SO3 (кислота сернистая) + O2 (кислород) = 2H2SO4 (кислота серная)
Растворы сернистой кислоты имеют довольно специфический запах (напоминает запах, остающийся после зажжения спички), наличие которого можно объяснить присутствием оксида серы (SO2), химически не связанного водой.
Химические свойства сернистой кислоты
1. Сернистая кислота (формула H2SO3) может использоваться в качестве восстановителя или окислителя.
H2SO3 является хорошим восстановителем. С ее помощью можно из свободных галогенов получить галогеноводороды. Например:
H2SO3 (кислота сернистая) + Cl2 (хлор, газ) + H2O (вода) = H2SO4 (кислота серная) + 2HCl (соляная кислота)
Но при взаимодействии с сильными восстановителями данная кислота будет выполнять роль окислителя. Примером может послужить реакция сернистой кислоты с сероводородом:
H2SO3 (кислота сернистая) + 2H2S (сероводород) = 3S (сера) + 3H2O (вода)
2. Рассматриваемое нами химическое соединение образует два вида солей – сульфиты (средние) и гидросульфиты (кислые). Эти соли являются восстановителями, так же, как и (H2SO3) сернистая кислота. При их окислении образуются соли серной кислоты. При прокаливании сульфитов активных металлов образуются сульфаты и сульфиды. Это реакция самоокисления-самовосстановления. Например:
4Na2SO3 (сульфит натрия) = Na2S (сульфид натрия) + 3Na2SO4 (сульфат натрия)
Сульфиты натрия и калия (Na2SO3 и K2SO3) применяются при крашении тканей в текстильной промышленности, при отбеливании металлов, а также в фотографии. Кальция гидросульфит (Ca(HSO3)2), существующий только в растворе, используется для переработки древесного материала в специальную сульфитную целлюлозу. Из нее потом делают бумагу.
Применение сернистой кислоты
Сернистая кислота используется:
– для обесцвечивания шерсти, шелка, древесной массы, бумаги и других аналогичных веществ, не выдерживающих отбеливания при помощи более сильных окислителей (например, хлора);
– как консервант и антисептик, например, для предотвращения ферментации зерна при получении крахмала или для предотвращения процесса брожения в бочках вина;
– для сохранения продуктов, например, при консервировании овощей и плодов;
– в переработке щепы древесной в целлюлозу сульфитную, из которой потом получают бумагу. В этом случае используется раствор кальция гидросульфита (Ca(HSO3)2), который растворяет лигнин – особое вещество, связывающее волокна целлюлозы.
Сернистая кислота: получение
Данную кислоту можно получить посредством растворения сернистого газа (SO2) в воде (H2O). Вам понадобятся серная кислота в концентрированном виде (H2SO4), медь (Cu) и пробирка. Алгоритм действий:
1. Осторожно налейте в пробирку концентрированную сернистую кислоту и затем поместите туда кусочек меди. Нагрейте. Происходит следующая реакция:
Cu (медь) + 2H2SO4 (серная кислота) = CuSO4 (сульфат серы) + SO2 (сернистый газ) + H2O (вода)
2. Поток сернистого газа необходимо направить в пробирку с водой. При его растворении частично происходит химическая реакция с водой, в результате которой образуется сернистая кислота:
SO2 (сернистый газ) + H2O (вода) = H2SO3
Итак, пропуская сернистый газ через воду, можно получить сернистую кислоту. Стоит учесть, что данный газ оказывает раздражающее воздействие на оболочки дыхательных путей, может вызвать их воспаление, а также потерю аппетита. При длительном его вдыхании возможна потеря сознания. Обращаться с этим газом нужно с предельной осторожностью и внимательность.
Сернистая кислота
Сернистая кислота H2SO3 – это двухосновная кислородсодержащая кислота. При нормальных условиях — неустойчивое вещество, которое распадается на диоксид серы и воду.
Валентность серы в сернистой кислоте равна IV, а степень окисления +4.

Химические свойства
1. Сернистая кислота H2SO3 в водном растворе – двухосновная кислота средней силы. Частично диссоциирует по двум ступеням:
H2SO3 ↔ HSO3– + H+
HSO3– ↔ SO32– + H+
2. Сернистая кислота самопроизвольно распадается на диоксид серы и воду:
H2SO3 ↔ SO2 + H2O
3. Сернистая кислота взаимодействует с сильными основаниями и их оксидами.
Например, сернистая кислота реагирует с гидроксидами натрия и калия:
H2SO3 + КОН → KHSО3 + H2O
H2SO3 + 2КОН → К2SО3 + 2H2O
4. Наиболее ярко выражены восстановительные свойства сернистой кислоты. При взаимодействии с окислителями степень окисления серы повышается.
Например, сернистая кислота обесцвечивает бромную воду:
H2SO3 + Br2 + H2O → H2SO4 + 2HBr
Азотная кислота очень легко окисляет сернистую:
H2SO3 + 2HNO3 → H2SO4 + 2NO2 + H2O
Озон также окисляет сернистую кислоту:
H2SO3 + O3 → H2SO4 + O2
Качественная реакция на сернистую кислоту – обесцвечивание раствора перманганата калия:
5H2SO3 + 2KMnO4 → 2H2SO4 + 2MnSO4 + K2SO4 + 3H2O
5. В присутствии сильных восстановителей сернистая кислота может проявлять окислительные свойства.
Например, при взаимодействии с сероводородом сернистая кислота восстанавливается до молекулярной серы:
H2SO3 + 2Н2S → 3S + 3H2O
Admin
Sulfurous Acid consists of the elements Hydrogen, Sulfur, and Oxygen. Hydrogen is a colorless, odorless, tasteless, and flammable gas. Its atomic number is 1 and is represented with the symbol H. Sulfur is an abundant non-metal present in Group 16 of the periodic table. Its atomic number is 16 and is represented with the symbol S. At room temperature, It appears in bright yellow, crystalline solid form. Oxygen is a highly reactive nonmetal and a good oxidizing agent. It is present in Group 16 of the periodic table. Its atomic number is 8 and is represented by the symbol O.
What is Sulfurous Acid (H2SO3)?
Sulfurous Acid is a colorless, weak inorganic acid with a pungent burning sulfur smell. The chemical formula of Sulfurous Acid is H2SO3.
It is corrosive to metals and tissues. H2SO3 is a sulfur oxoacid, tautomer of a sulfonic acid, and conjugate acid of a Hydrogen sulfite. The other names for Sulfurous Acid are hydrogen thiosulfate, Sulfur dioxide solution, and trioxosulfuric acid. It is an intermediate species to forms Acid rain from SO2 (Sulfur dioxide).
Preparation of Sulfurous Acid (H2SO3)
- Sulfurous Acid (H2SO3) is prepared by dissolving Sulfur dioxide (SO2) in water (H2O). Its chemical reaction of it is given below-
SO2 + H2O ⇢ H2SO3
Structure of Sulfurous Acid (H2SO3)
Sulfurous acid has the chemical formula H2SO3 and a molar mass of 82.07 g/mol. The chemical structure is illustrated in the diagram below. It is made up of one sulfur atom with two single bonds to hydroxyl groups and one double bond to oxygen.

Properties of Sulfurous Acid (H2SO3)
Physical Properties of Sulfurous Acid
- Sulfurous Acid is a colorless liquid.
- The odor of Sulfurous Acid is a pungent odor.
- The molecular weight of Sulfurous Acid is 82.07 g/mol.
- Its Monoisotopic mass is 81.97 g/mol.
- The boiling point of Sulfurous Acid is -60 °C.
- The density of Sulfurous Acid is 1.03 g/mL.
Chemical Properties of Sulfurous Acid
- Sulfurous Acid is unstable and has never been isolated in its pure state. H2SO3 decomposes into Sulfur dioxide and Water. The chemical reaction is given below-
H2SO3 ⇢ SO2+H2O
- Sulfurous Acid when exposed to air turns out to be Sulfuric Acid.
2H2SO3 + O2 ⇢ 2H2SO4
Uses of Sulfurous Acid (H2SO3)
- Sulfurous Acid is used in manufacturing paper products.
- H2SO3 and its salts are used as powerful reducing agents and disinfectants.
- H2SO3 is used as an intermediate in industries.
- Sulfurous Acid is used as a mild bleaching agent for applications having chlorine-sensitive materials.
FAQs on Sulfurous Acid Formula
Question 1: Is Sulfurous Acid a strong acid or weak acid?
Answer:
Unlike sulfuric acid, sulfurous acid is a weak acid because it dissociates partially in water. Here bisulfite ion is comparatively stronger in maintaining a proton when there is a base like water.
Question 2: Determine the molar mass of Sulfurous Acid.
Answer:
Sulfurous Acid consists of 2 Hydrogens, 1 Sulfur and 3 Oxygen atoms.
Atomic weight of each Hydrogen = 1.00784
Atomic weight of sulfur = 32.065
Atomic weight of each Oxygen = 15.999
Molecular weight of H2SO4 = (2 × 1.00784) + 32.065 +(3 × 15.999)
=82.07 g/mol
Question 3: Is Sulfurous Acid hazardous to health?
Answer:
Yes, Sulfurous Acid is dangerous compound. On contact may cause burns and by inhalation it irritate the neck and throat. This compound liberates toxic, corrosive and irritating gases. It also effects reproduction.
Question 4: Sulfurous acid is soluble in water?
Answer:
Sulfurous acid is a colorless liquid soluble in water. It hydrates to sulfuric acid which in turn dissociates into Bisulfite (HSO4–) and sulfite (SO32-) ions.
Question 5: What are the uses of Sulfurous acid?
Answer:
Sulfurous acid is used in manufacturing of paper products. It acts as disinfectant, reducing agent and bleaching agent and also as an electrolyte.
Question 6: Is Sulfurous acid an electrolyte?
Answer:
In Lead acid storage batteries, Sulfurous acid (H2SO3) is used as an electrolyte. It has high electrical conductivity.
Related Article
- Types of Acids
- Sulfuric Acid Formula
- Hyposulfurous Acid Formula
Last Updated :
09 Nov, 2022
Like Article
Save Article
Сернистый газ. Сернистая кислота и её соли
I. Cернистый ангидрид; сернистый газ, оксид серы (IV) SO2

1. Физические свойства
Бесцветный газ с резким запахом; хорошо растворим в воде (в 1V H2O растворяется 40VSO2 при н.у.); более чем в два раза тяжелее воздуха, ядовит; t°пл. = -75,5°C; t°кип. = -10°С.
Обесцвечивает многие красители, убивает микроорганизмы.
2. Получение
1) При сжигании серы в кислороде: S + O2 → SO2
2) Окислением сульфидов: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
3) Обработкой солей сернистой кислоты минеральными кислотами: Na2SO3 + 2HCl → 2NaCl + SO2 + H2O
4) При окислении металлов концентрированной серной кислотой: Cu + 2H2SO4(конц) → CuSO4 + SO2 + 2H2O
3. Химические свойства
1) Реакции окисления, SO2 – восстановитель (S+4 – 2ē → S+6)
2 SO2 + O2 → 2 SO3 (катализатор – V2O5)
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
2) Реакции восстановления, SO2 – окислитель (S+4 + 4ē → S0)
SO2 + С → S + СO2 (при нагревании)
SO2 + 2H2S → 3S + 2H2O
3) Сернистый ангидрид – кислотный оксид: взаимодействие с водой
При растворении в воде образуется слабая и неустойчивая сернистая кислота H2SO3 (существует только в водном растворе)
Видео – эксперимент “Получение сернистой кислоты”
SO2 + H2O ↔ H2SO3
Видео: “Получение оксида серы (IV) и сернистой кислоты”
II. Сернистая кислота и ее соли
1. Сернистая кислота — неустойчивая двухосновная неорганическая кислота средней силы. Отвечает степени окисления серы +4. Химическая формула  .
.



2. Химические свойства
1) Сернистая кислота диссоциирует ступенчато:
H2SO3 ↔ H+ + HSO3– (первая ступень, образуется гидросульфит – анион)
HSO3– ↔ H+ + SO32- (вторая ступень, образуется анион сульфит)
H2SO3 образует два ряда солей – средние (сульфиты) и кислые (гидросульфиты).
Качественной реакцией на соли сернистой кислоты является взаимодействие соли с сильной кислотой, при этом выделяется газ SO2 с резким запахом:
Na2SO3 + 2HCl → 2NaCl + SO2 ↑+ H2O
2H+ + SO32- → SO2 ↑+ H2O
2) Раствор сернистой кислоты H2SO3 обладает восстановительными свойствами. Сернистая кислота взаимодействует с раствором йода, обесцвечивая его. При этом образуются йодоводородная и серная кислоты.
Опыт: “Свойства сернистой кислоты”
H2SO3 + I2 + H2O = H2SO4 + 2НI
3) Как и все кислоты, сернистая кислота меняет цвет растворов индикаторов. Метиловый оранжевый в растворе кислоты становится красным. В старину дамские соломенные шляпки отбеливали сернистой кислотой. Раствор сернистой кислоты отбеливает ткани из растительного материала, шерсти, шелка. Видео: “Свойства сернистой кислоты”
4) Взаимодействие со щелочами
Ba(OH)2 + SO2 → BaSO3↓(сульфит бария) + H2O
Ba(OH)2 + 2SO2 (избыток)→ Ba(HSO3)2(гидросульфит бария)
5) Взаимодействие с основными оксидами: SO2 + CaO = CaSO3
6) Водные растворы сульфитов щелочных металлов окисляются на воздухе:
2Na2SO3 + O2 → 2Na2SO4
2SO32- + O2 → 2SO42-
III. Задания для закрепления
Задание №1 Закончите уравнения химических реакций, составьте электронный баланс, укажите процессы окисления и восстановления, окислитель и восстановитель:
SO2 + Br2 + H2O→
PbS + O2 →
Задание №2 Осуществите превращения по схемам. Уравнения реакций ионного обмена напишите в полном и кратком ионном виде.
S → H2S → SO2 → Na2SO3 → BaSO3 → SO2
SO2 + Br2,H2O →А→Na2SO4→BaSO4
FeS2 → SO2→Na2SO3 +HCl→A+ O2→B→H2SO4
SO2 +KMnO4,H2O →A+ BaCl2→B
SO2→S→K2S→H2S→PbS→SO2
H2SO3 +I2→A+Cu→B+NaOH→C
K2SO3→SO2→MgSO3→SO2→KHSO3→SO2
ЦОРы
Видео – эксперимент “Получение сернистой кислоты”
Опыт: “Свойства сернистой кислоты”