| Серная кислота | ||
|---|---|---|
|
||
 |
||
| Общие | ||
| Систематическое наименование |
Серная кислота | |
| Традиционные названия | Серная кислота | |
| Хим. формула | H2SO4 | |
| Рац. формула | H2SO4 | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 98,078 ± 0,006 г/моль | |
| Плотность | 1,8356 г/см³ | |
| Динамическая вязкость | 21 мПа·с[2] | |
| Термические свойства | ||
| Температура | ||
| • плавления | +10,38 °C | |
| • кипения | +337 °C | |
| • разложения | +450 °C | |
| Удельная теплота плавления | 10,73 Дж/кг | |
| Давление пара | 0,001 ± 0,001 мм рт.ст.[3] | |
| Химические свойства | ||
Константа диссоциации кислоты  |
-3 | |
| Растворимость | ||
| • в воде | Растворима | |
| Оптические свойства | ||
| Показатель преломления | 1.397 | |
| Структура | ||
| Дипольный момент | 2.72 Д | |
| Классификация | ||
| Рег. номер CAS | 7664-93-9 | |
| PubChem | 1118 | |
| Рег. номер EINECS | 231-639-5 | |
| SMILES |
OS(O)(=O)=O |
|
| InChI |
InChI=1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4) QAOWNCQODCNURD-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E513 | |
| RTECS | WS5600000 | |
| ChEBI | 26836 | |
| Номер ООН | 1830 | |
| ChemSpider | 1086 | |
| Безопасность | ||
| Предельная концентрация | 1 мг/м3 | |
| ЛД50 | 100 мг/кг | |
| Токсичность | 2-й класс опасности[1], общетоксическое действие. | |
| Краткие характер. опасности (H) |
H290, H314 |
|
| Меры предостор. (P) |
P280, P301+P330+P331, P303+P361+P353, P305+P351+P338, P308+P311 |
|
| Сигнальное слово | опасно | |
| Пиктограммы СГС |
|
|
| NFPA 704 |
0 3 2
|
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Се́рная кислота́ (химическая формула — H2SO4) — сильная неорганическая кислота, отвечающая высшей степени окисления серы (+6).
При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с сильнокислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум). Токсична в больших дозах[4], обладает исключительно сильной коррозионной активностью.
Название[править | править код]
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом»[5][6], очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Исторические сведения[править | править код]
Серная кислота известна с древности, она встречается в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси[7]

В трудах алхимика Василия Валентина (XVI век) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV века в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешёвого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.[8]
Физические и физико-химические свойства[править | править код]
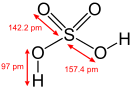
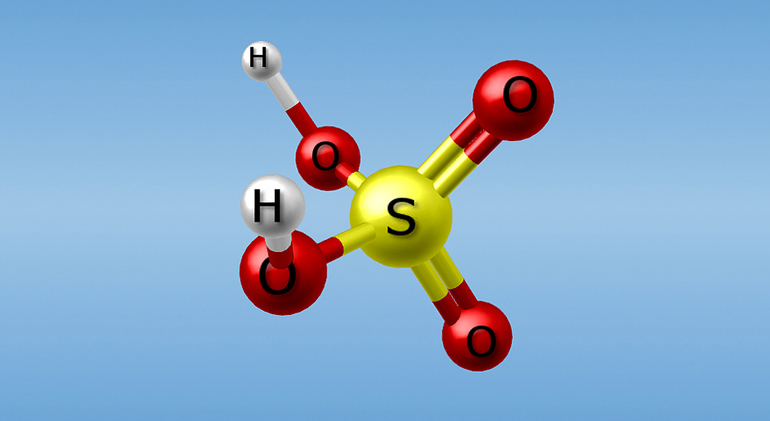
Серная кислота — это очень сильная двухосновная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3О+, HSO3+, и 2НSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
| H2SO4 | HSO4− | H3SO4+ | H3O+ | HS2O7⁻ | H2S2O7 | |
| состав, % | 99,5 | 0,18 | 0,14 | 0,09 | 0,05 | 0,04 |
Олеум[править | править код]
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, образующиеся по реакциям:
-
Сульфит
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 °C, г/см3 | Температура плавления, °C | Температура кипения, °C | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | – | 1,0661 | −5,5 | 102,0 |
| 20 | – | 1,1394 | −19,0 | 104,4 |
| 40 | – | 1,3028 | −65,2 | 113,9 |
| 60 | – | 1,4983 | −25,8 | 141,8 |
| 80 | – | 1,7272 | −3,0 | 210,2 |
| 98 | – | 1,8365 | 0,1 | 332,4 |
| 100 | – | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
Уравнение температурной зависимости константы равновесия:
При нормальном давлении степень диссоциации: 10−5 (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10−5T3/2 см2/с.
| ω, % | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 85 | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,03 | 1,064 | 1,1365 | 1,215 | 1,2991 | 1,3911 | 1,494 | 1,6059 | 1,7221 | 1,7732 | 1,7818 | 1,7897 | 1,7968 | 1,8033 | 1,8091 | 1,8142 | 1,8188 | 1,8227 | 1,826 | 1,8286 | 1,8305 | 1,8314 | 1,831 | 1,8292 | 1,8255 |
Химические свойства[править | править код]
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
1. Окисляет HI и частично HBr до свободных галогенов:
-
ΔH° = −561.9 кДж/моль (экзотермическая)[10] ΔG° = −305.4 кДж/моль (экзэргоническая)[10]
-
ΔH° = 18.14 кДж/моль (эндотермическая)[11] ΔS° = −14.95 Дж/моль (экзоэнтропическая)[11] ΔG° = 22.5 кДж/моль (эндэргоническая)[11]
Углерод до CO2, серу — до SO2.
- Окисляет угарный газ до углекислого.

2. Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta). При этом концентрированная серная кислота восстанавливается до диоксида серы, например[12]:
3. На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются, и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до серы и сероводорода. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ[12].
4. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например[12]:
5. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
6. Серная кислота реагирует с основными оксидами, образуя сульфат металла и воду:
7. На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
8. Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
9. Качественная реакция на серную кислоту и её растворимые соли — это их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например[13]:
Получение серной кислоты[править | править код]
Промышленный (контактный) способ[править | править код]
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания элементарной серы, серного колчедана или сероводород-содержащих газов, поступающих с установок гидроочистки и систем отпарки кислых стоков) до триоксида (серного ангидрида) на твёрдом ванадиевом катализаторе в четыре ступени (данная реакция экзотермична, поэтому применяется промежуточное охлаждение после первого слоя с помощью трубных пучков, через которые подаётся воздух, и после следующих двух ступеней — с помощью кольцевой трубы, имеющей большой диаметр, через которую подаётся воздух, над которой расположен дефлектор. Воздух нагнетается воздуходувками, часть горячего воздуха подаётся на горелочные устройства котлов, в которых производится сжигание сероводородсодержащих газов) последующим охлаждением и взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют «контактной» (концентрация 92-94 %).
Нитрозный (башенный) способ[править | править код]
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли «башенной» (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
Лабораторные методы[править | править код]
В лаборатории можно получить серную кислоту взаимодействием сероводорода, элементарной серы и диоксида серы с хлорной или бромной водой или пероксидом водорода:









Также её можно получить взаимодействием диоксида серы с кислородом и водой при +70 °C под давлением в присутствии сульфата меди (II):

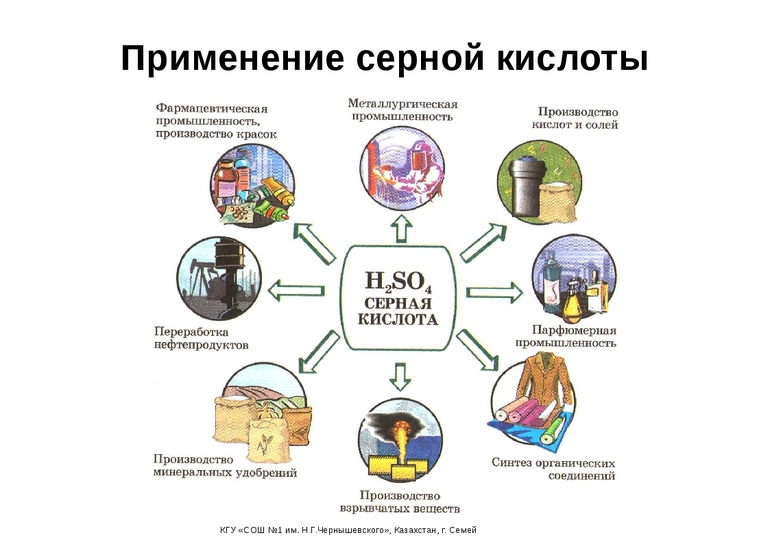
Применение[править | править код]


Серную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- в качестве электролита в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанола из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.;
- восстановления смол в фильтрах на производстве дистиллированной воды.
Мировое производство серной кислоты около 200 млн тонн в год[14]. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P2O5 фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH4)2SO4 серной кислоты 75 % от массы расходуемого (NH4)2SO4. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие[править | править код]





Серная кислота и олеум — очень едкие вещества, поражающие все ткани организма. При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Попадание кислоты на глаза в высокой концентрации может привести как к конъюнктивиту, так и к полной потере зрения[15].
Предельно допустимая концентрация (ПДК) паров серной кислоты в воздухе рабочей зоны 1 мг/м3, в атмосферном воздухе 0,3 мг/м3 (максимальная разовая) и 0,1 мг/м3 (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин).
Серная кислота — токсичное вещество. В соответствии с ГОСТ 12.1.007-76 серная кислота является токсичным высокоопасным веществом[16] по воздействию на организм, 2-го класса опасности.
Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды серы и выпадать в виде кислотных дождей.
В России оборот серной кислоты концентрации 45 % и более — законодательно ограничен[17].
Дополнительные сведения[править | править код]
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[18]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994[19].
Стандарты[править | править код]
- Кислота серная техническая ГОСТ 2184—77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667—73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262—78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204—77
Примечания[править | править код]
- ↑ Кислота серная техническая ГОСТ 2184—77
- ↑ Encyclopedia of chemical technology (англ.) / R. E. Kirk, D. Othmer
- ↑ http://www.cdc.gov/niosh/npg/npgd0577.html
- ↑ name=https://docs.cntd.ru_Серная кислота
- ↑ Ушакова Н. Н., Фигурновский Н. А. Василий Михайлович Севергин: (1765—1826) / Ред. И. И. Шафрановский. М.: Наука, 1981. C. 59.
- ↑ См. также Каменное масло
- ↑ Эпштейн, 1979, с. 40.
- ↑ Эпштейн, 1979, с. 41.
- ↑ Density-Concentration Calculator (англ.). Дата обращения: 21 декабря 2021. Архивировано 21 декабря 2021 года.
- ↑ 1 2 sulfuric acid hydrogen iodide -> iodine H2S water – Wolfram|Alpha (англ.). www.wolframalpha.com. Дата обращения: 19 мая 2022.
- ↑ 1 2 3 sulfuric acid hydrogen bromide -> bromine sulfur dioxide water – Wolfram|Alpha (англ.). www.wolframalpha.com. Дата обращения: 19 мая 2022.
- ↑ 1 2 3 Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 91. Химические свойства серной кислоты // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 209—211. — 240 с. — 1 630 000 экз.
- ↑ Ходаков Ю.В., Эпштейн Д.А., Глориозов П.А. § 92. Качественная реакция на серную кислоту и её соли // Неорганическая химия: Учебник для 7—8 классов средней школы. — 18-е изд. — М.: Просвещение, 1987. — С. 212. — 240 с. — 1 630 000 экз.
- ↑ Sulfuric acid (англ.) // «The Essential Chemical Industry — online»
- ↑ SULFURIC ACID | CAMEO Chemicals | NOAA. cameochemicals.noaa.gov. Дата обращения: 22 мая 2020.
- ↑ name=https://docs.cntd.ru_ГОСТ (недоступная ссылка) 12.1.007-76. ССБТ. Вредные вещества. Классификация и общие требования
- ↑ Постановление Правительства Российской Федерации от 3 июня 2010 года № 398. Дата обращения: 30 мая 2016. Архивировано из оригинала 30 июня 2016 года.
- ↑ см. статью «Вулканы и климат» Архивная копия от 28 сентября 2007 на Wayback Machine (рус.)
- ↑ Русский архипелаг — Виновато ли человечество в глобальном изменении климата? Архивная копия от 1 декабря 2007 на Wayback Machine (рус.)
Литература[править | править код]
- Справочник сернокислотчика [Текст] / А. С. Ленский, П. А. Семенов, Г. А. Максудов; ред. К. М. Малин. — 2 изд., перераб. и доп. — М.: Химия, 1971. — 744 с. — Библиогр. в конце разд.- Предм. указ.: с. 723—744.
- Эпштейн Д. А. Общая химическая технология. — М.: Химия, 1979. — 312 с.
Ссылки[править | править код]
- Статья «Серная кислота» (Химическая энциклопедия)
- Плотность и значение pH серной кислоты при t=20 °C
Серная кислота
Строение молекулы и физические свойства
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.

Валентность серы в серной кислоте равна VI.
Способы получения
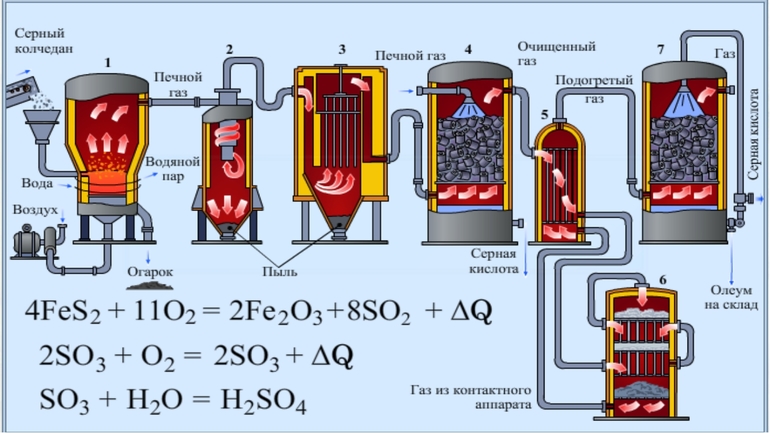
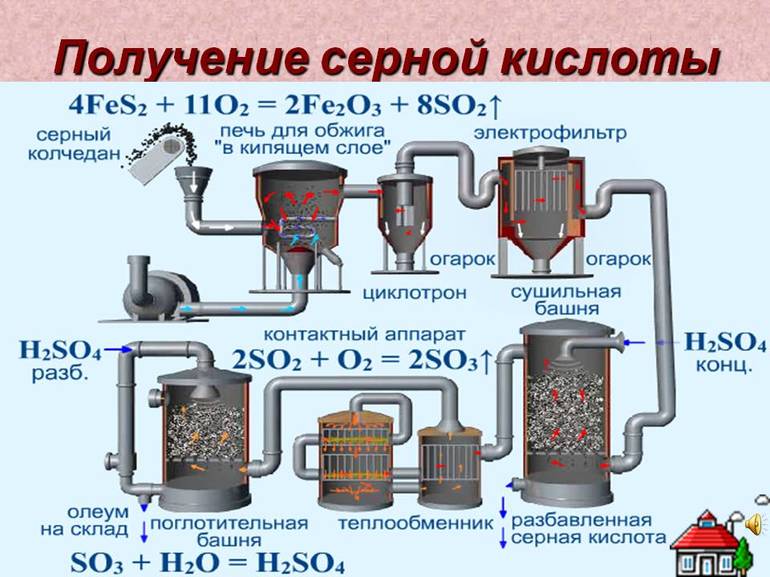
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.


Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
| Аппарат | Назначение и уравнения реакций |
| Печь для обжига | 4FeS2 + 11O2 → 2Fe2O3 + 8SO2 + Q
Измельченный очищенный пирит сверху засыпают в печь для обжига в «кипящем слое». Снизу (принцип противотока) пропускают воздух, обогащенный кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800оС |
| Циклон | Из печи выходит печной газ, который состоит из SO2, кислорода, паров воды и мельчайших частиц оксида железа. Такой печной газ очищают от примесей. Очистку печного газа проводят в два этапа. Первый этап — очистка газа в циклоне. При этом за счет центробежной силы твердые частички ссыпаются вниз. |
| Электрофильтр | Второй этап очистки газа проводится в электрофильтрах. При этом используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра). |
| Сушильная башня | Осушку печного газа проводят в сушильной башне – снизу вверх поднимается печной газ, а сверху вниз льется концентрированная серная кислота. |
| Теплообменник | Очищенный обжиговый газ перед поступлением в контактный аппарат нагревают за счет теплоты газов, выходящих из контактного аппарата. |
| Контактный аппарат | 2SO2 + O2 ↔ 2SO3 + Q
В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
Как только смесь оксида серы и кислорода достигнет слоев катализатора, начинается процесс окисления SO2 в SO3. Образовавшийся оксид серы SO3 выходит из контактного аппарата и через теплообменник попадает в поглотительную башню. |
| Поглотительная башня | Получение H2SO4 протекает в поглотительной башне.
Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
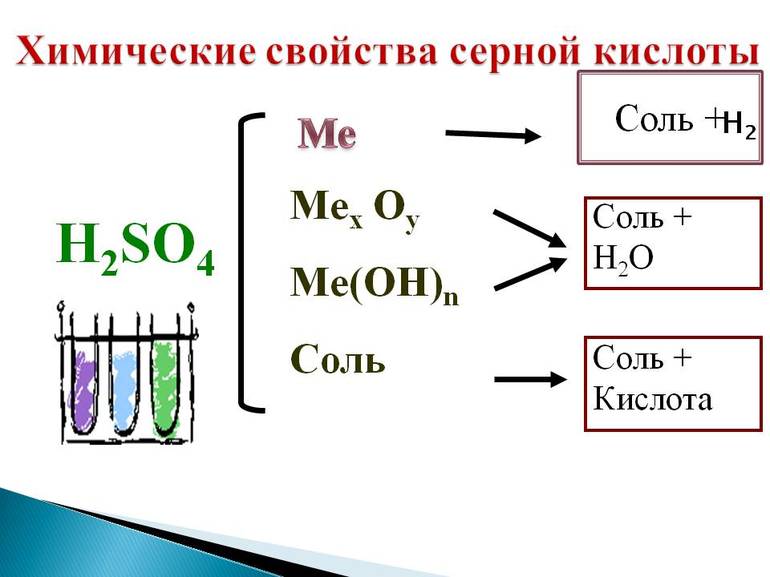
Химические свойства
Серная кислота – это сильная двухосновная кислота.
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
H2SO4 ⇄ H+ + HSO4–
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4– ⇄ H+ + SO42–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например, серная кислота взаимодействует с оксидом магния:
H2SO4 + MgO → MgSO4 + H2O
Еще пример: при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
H2SO4 + КОН → KHSО4 + H2O
H2SO4 + 2КОН → К2SО4 + 2H2O
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3H2SO4 + 2Al(OH)3 → Al2(SO4)3 + 6H2O
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например, серная кислота взаимодействует с гидрокарбонатом натрия:
Н2SO4 + 2NaHCO3 → Na2SO4 + CO2 + H2O
Или с силикатом натрия:
H2SO4 + Na2SiO3 → Na2SO4 + H2SiO3
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
NaNO3 (тв.) + H2SO4 → NaHSO4 + HNO3
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например, хлорида натрия:
NaCl(тв.) + H2SO4 → NaHSO4 + HCl
4. Также серная кислота вступает в обменные реакции с солями.
Например, серная кислота взаимодействует с хлоридом бария:
H2SO4 + BaCl2 → BaSO4 + 2HCl
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например, серная кислота реагирует с железом. При этом образуется сульфат железа (II):
H2SO4(разб.) + Fe → FeSO4 + H2
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
H2SO4 + NH3 → NH4HSO4
Концентрированная серная кислота является сильным окислителем. При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
6H2SO4(конц.) + 2Fe → Fe2(SO4)3 + 3SO2 + 6H2O
6H2SO4(конц.) + 2Al → Al2(SO4)3 + 3SO2 + 6H2O
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
2H2SO4(конц.) + Cu → CuSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + Hg → HgSO4 + SO2 ↑ + 2H2O
2H2SO4(конц.) + 2Ag → Ag2SO4 + SO2↑+ 2H2O
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
3Mg + 4H2SO4 → 3MgSO4 + S + 4H2O
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
5H2SO4(конц.) + 4Zn → 4ZnSO4 + H2S↑ + 4H2O
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например, концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
5H2SO4(конц.) + 2P → 2H3PO4 + 5SO2↑ + 2H2O
2H2SO4(конц.) + С → СО2↑ + 2SO2↑ + 2H2O
2H2SO4(конц.) + S → 3SO2 ↑ + 2H2O
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
3H2SO4(конц.) + 2KBr → Br2↓ + SO2↑ + 2KHSO4 + 2H2O
5H2SO4(конц.) + 8KI → 4I2↓ + H2S↑ + K2SO4 + 4H2O
H2SO4(конц.) + 3H2S → 4S↓ + 4H2O
Формула и физические свойства
Одно из основных соединений в промышленности — серная кислота — имеет химическую формулу H2SO4. Её молекула состоит из четырёх атомов кислорода, двух — водорода и одного — серы. Эта токсичная плотная маслянистая жидкость без запаха в очищенном состоянии не имеет цвета и обладает характерным «медным» привкусом. Плотность при нормальных условиях составляет 1,84 г/куб. см. Примеси придают неочищенному продукту желтоватую или буро-жёлтую окраску.

Соединение кипит при +296 °C, плавится при температуре +10,3 °C. Его кристаллы гигроскопичны и активно отнимают воду у всего окружающего, обугливают бумагу, древесину, сахар. Теплота гидратации при растворении столь велика, что вызывает вскипание смеси и разбрызгивание. Именно поэтому для смешения добавляют кислоту к воде, а не наоборот. Старинное название «купоросное масло» отсылает к XVIII—XIX вв. , когда серу для изготовления пороха получали разложением пирита на купоросных заводах. И до сих пор кристаллогидраты её солей именуются купоросами.
Медикам и строителям давно известен природный гипс — кристаллогидрат сульфата кальция. Садоводы и огородники любят медный купорос — ценный помощник в борьбе с различными вредителями и болезнями растений. Квасцы незаменимы в производстве красок и для дубления кожи. Десятиводный кристаллогидрат сульфата натрия — «глауберова соль» — используется в химической промышленности, деревопереработке и медицине (слабительное и желчегонное средство для людей и животных).
Сульфат бария или «бариевая каша» обладает уникальной способностью взаимодействовать с рентгеновским излучением, задерживая его, и это большой плюс при исследованиях полых органов человеческого тела.
Способы промышленного производства
В качестве сырья долгое время использовался природный минерал пирит — «серный колчедан». Сегодня ему на смену пришли элементарная сера или её соединения: сероводород, соли — сульфиты и сульфаты, а также газовые отходы теплоэлектростанций, работающих на неочищенной нефти. Производство имеет ряд последовательных стадий:
- Получение оксида серы (II), сернистого газа, путём сжигания серосодержащего сырья или его обжига в кислороде.
- Очистка газообразной фазы реагентов от твёрдых примесей.
- Окисление до оксида серы (III). Процесс описывается уравнением: 2SO2 + O2 = 2SO3.
- Поглощение водой: H2O + SO3 = H2SO4.
В общем объёме минеральных кислот, которые производятся сегодня химической промышленностью, H2SO4 занимает почётное первое место. При этом она является наиболее дешёвой, технологичной и не разрушает чёрные металлы в концентрированном состоянии.
Камерный метод получения
В эпоху средневековья алхимики синтезировали купоросное масло т. н. камерным способом. Для этого использовались специальные большие, размером с целую комнату, камеры, обложенные изнутри свинцом. Поверхности стенок в результате окисления покрывались защитным слоем сульфата свинца. При горении в присутствии воздуха смеси, состоящей из серы и калиевой селитры, образовывался твёрдый остаток оксидов азота и солей калия и выделялся газообразный оксид серы (III).
Он поглощался водой, имевшейся в камере, и позволял получить продукт малой крепости, которая требовала дальнейшей концентрации. После открытия каталитических свойств оксидов азота, камерный метод уступил место менее трудоёмким и более эффективным технологиям производства.
Современные способы синтеза
«Едва ли найдётся другое, искусственно добываемое вещество, столь часто применяемое в технике» — эти слова гениального русского учёного Д. И. Менделеева наглядно характеризуют ценность серной кислоты. Сегодня при её производстве используются две методики окисления диоксида серы:
- контактная, использующая твёрдые катализаторы;
- башенная (нитрозная), где катализаторами служат газообразные оксиды азота, а окислителем выступает кислород.
При контактном способе смесь реагентов пропускается сквозь твёрдый катализатор, расположенный слоями для увеличения поверхности. Нитрозный метод подразумевает орошение сырья водой или разбавленной кислотой в башенных реакторах. Первый способ более производителен и компактен, позволяет получать продукт большей чистоты при меньших затратах и постепенно вытесняет нитрозного конкурента.

Ускорителей процесса окисления было открыто немало. Наибольший эффект проявляют платина, оксиды ванадия V2O5 и железа Fe2O3. Но первая стоит дорого и быстро отравляется примесями мышьяка, содержащимися в газовой фазе SO2. Для поддержания каталитической активности оксида железа необходимы температуры свыше 600 °C. Наиболее экономичным признан ванадиевый катализатор — он и применяется в производстве.
При улавливании SO3 водой выделяется много тепла, и продукт закипает с образованием аэрозоля. Поэтому используется 100% концентрированная кислота, и получается олеум, который затем разбавляется до необходимых пропорций.
Химические свойства продукта
Серная кислота занимает привилегированное положение среди наиболее сильных минеральных кислот. Такую активность легко охарактеризовать высокой полярностью молекулярной связи водород — кислород, и, соответственно, лёгкостью её разрыва. Это придаёт H2SO4 не только ряд общих для всех соединений её класса свойств, например, взаимодействие кислот с металлами, но и специфические качества. Среди основных химических свойств стоит отметить:
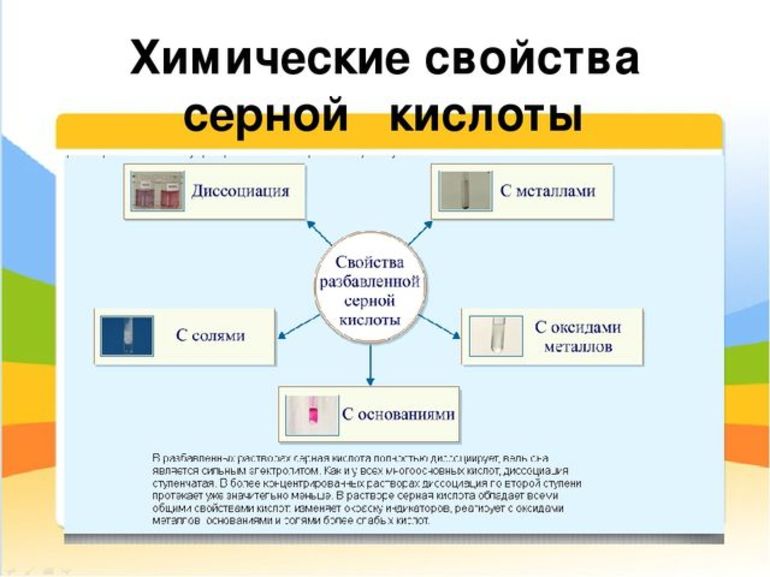
- Действие на индикаторы. Кислая среда водных растворов изменяет окраску фиолетового лакмуса, метилового оранжевого и универсального индикатора — они приобретают красный цвет.
- Реакция диссоциации. В водном растворе проявляются свойства сильного электролита, и в результате двухступенчатой диссоциации соединение распадается на два однозарядных положительных иона водорода и сульфат-ион с двойным отрицательным зарядом.
- Взаимодействие с металлами. Разбавленная серная кислота может реагировать с металлами, которые стоят в электрохимическом ряду активности левее водорода. При этом образуется сернокислая соль, которая называется сульфатом, и водород. Сульфаты не имеют цвета, хорошо растворимы в воде и легко кристаллизуются.
- Реакция нейтрализации. В результате взаимодействия с растворимыми и нерастворимыми основаниями образуется сульфатная соль и вода. Молекула H2SO4 имеет два атома водорода, поэтому кислота — двухосновная, и для полной нейтрализации требуется две молекулы основания.
- Взаимодействие с основными оксидами. Соединения с кислородом одно- и двухвалентных металлов (MgO, FeO, Li2O, Na2O) тоже участвуют в реакции нейтрализации. При этом образуется сульфат металла из состава оксида и вода.
- Обменные реакции с солями более слабых или легколетучих кислот. Происходит вытеснение и в результате образуется сульфатная соль и кислота (или выделяется летучий газ, а вода остаётся в растворе). Выпадение белого нерастворимого осадка BaSO4 — это качественная реакция на сульфат-ионы.
Специфические свойства концентрированных растворов обусловлены структурными особенностями формулы серной кислоты: в молекуле H2SO4 положительно заряженный атом серы находится в максимальной, четвёртой степени окисления. Поэтому он может только принимать электроны и сообщать соединению высокие окислительные свойства. Стоит отметить некоторые из них:
- Окисление большинства металлов, в т. ч. пассивных (цинк и медь). В этих реакциях водород уже не выделяется, а H2SO4 восстанавливается до сероводорода, серы или оксида серы (II). Это определяется концентрацией исходных компонентов и местом, которое занимает метал в электрохимическом ряду активности. Исключение составляют золото, железо, алюминий и платиноиды, поэтому для перевозки автомобильным и железнодорожным транспортом используют стальные цистерны.
- Окисление многих неметаллов. В результате реакции неметалл образует соединение с максимальным окислительным числом, а H2SO4 восстанавливается до оксида серы (IV).
- Окисление сложных соединений. При обработке калиевых солей галогеноводородных кислот (KBr или KI) образуется сульфатная соль и выделяется свободный галоген. Хлорид-ионы не окисляются до хлора и позволяют получать соляную кислоту реакцией обмена.
- Дегидратация органических веществ. Химически связанная вода легко удаляется из гидроксильных групп в присутствии концентрированной H2SO4: из этилового спирта образуется этилен. Обугливание углеводов тоже объясняется обезвоживанием.
Интересно, что в природе эта едкая кислота встречается в чистом 100%-м виде: на итальянском острове Сицилия существует уникальное Озеро смерти, к которому не приближаются даже насекомые и птицы. В этих местах дисульфид железа из земной коры выступает сырьём для синтеза H2SO4, и продукт сочится прямо из дна! Действующие вулканы тоже вносят вклад — извергают в земную атмосферу сернокислотные выбросы, которые причиняют непоправимый вред окружающей среде и становятся причиной серьёзных климатических изменений.
Применение в народном хозяйстве
Достижения химии всегда служили научно-техническому прогрессу. Высокие окислительные способности позволили H2SO4 стать важным компонентом в ряде отраслей промышленности. Её используют:
- добыча редких элементов (очистка урановых, иридиевых, циркониевых и осмиевых руд);
- производство минеральных удобрений, высокомолекулярных нитей, красок и пиротехники;
- неорганический синтез солей и кислот;
- текстильная и кожевенная отрасли;
- нефтехимия и металлообработка;
- пищевая промышленность (добавка-эмульгатор E513);
- автомобилестроение (электролит в аккумуляторах);
- дистиллирование воды (реагент для восстановления смол в фильтрах).
Отдельно стоит упомянуть промышленный органический синтез — источник эфиров и спиртов, синтетических моющих средств и искусственных волокон. Он немыслим реакций дегидратации, гидратации, сульфирования, алкилирования. Металлообрабатывающие заводы очищают поверхности изделий от окислов, образующихся при сильном нагревании. Но основным потребительским сегментом является изготовление минеральных удобрений (больше всего — фосфорных). Из-за этого сернокислотные заводы рекомендуется размещать недалеко от предприятий по производству этих ценных химических продуктов.
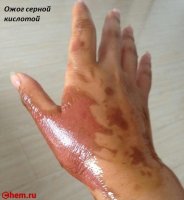
Все приведённые положительные характеристики были бы неполными, если не вспомнить, что серная кислота и олеум — опасные, чрезвычайно агрессивные продукты. Атмосферные кислотные аэрозоли периодически образуются в результате выбросов металлургических и химических заводов и выпадают в виде осадков. Они поражают кожу и слизистые, что приводит к затруднению дыхания, провоцирует кашель и бронхолёгочные заболевания с отёками гортани.

При попадании на кожные покровы возникают химические ожоги, их тяжесть напрямую зависит от концентрации и площади контакта. При проглатывании появляются резкие боли во рту и пищеводе, затем начинается рвота, кашель, затрудняется дыхание и ослабляется сердечная деятельность, а смертельной считается доза 5 мг. Первая помощь при отравлении парами заключается в обеспечении притока свежего воздуха и промывании слизистых содовым раствором. При растекании по коже поражённое место обильно орошают водой, а проглатывание требует промывания желудка и приёма известковой воды.
| Серная кислота | |
|---|---|

|
|
| Систематическое наименование |
серная кислота |
| Хим. формула | H2SO4 |
| Состояние | жидкость |
| Молярная масса | 98,078 ± 0,006 г/моль |
| Плотность | 1,8356 г/см³ |
| Динамическая вязкость |
0,027534 Па·с |
| Кинематическая вязкость |
0,1501 см²/с |
| Т. плав. | 10,38 °C |
| Т. кип. | 337 °C |
| Удельная теплота плавления | 10,73 Дж/кг |
| Давление пара | 0,001 ± 0,001 мм рт.ст. |
| pKa | -3 |
| Растворимость в воде | смешивается |
| Показатель преломления | 1.397 |
| Дипольный момент | 2.72 Д |
| ГОСТ | ГОСТ 2184-77 ГОСТ 667-73 ГОСТ 14262-78 ГОСТ 4204-77 |
| Рег. номер CAS | 7664-93-9 |
| PubChem | 1118 |
| Рег. номер EINECS | 231-639-5 |
| SMILES |
OS(O)(=O)=O |
| InChI |
1S/H2O4S/c1-5(2,3)4/h(H2,1,2,3,4) QAOWNCQODCNURD-UHFFFAOYSA-N |
| Рег. номер EC | 231-639-5 |
| Кодекс Алиментариус | E513 |
| RTECS | WS5600000 |
| ChEBI | 26836 и 45693 |
| Номер ООН | 1830 |
| ChemSpider | 1086 |
| ЛД50 | 510 мг/кг |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. |
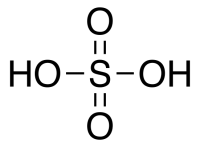
Серная кислота H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум).
Содержание
- 1 Название
- 2 Получение серной кислоты
- 2.1 Промышленный (контактный) способ
- 2.2 Нитрозный (башенный) способ
- 2.3 Другой способ
- 3 Физические и физико-химические свойства
- 3.1 Олеум
- 4 Химические свойства
- 5 Применение
- 6 Токсическое действие
- 7 Исторические сведения
- 8 Дополнительные сведения
- 9 Стандарты
Название
В XVIII—XIX веках серу для пороха производили из серного колчедана (пирит) на купоросных заводах. Серную кислоту в то время называли «купоросным маслом», очевидно отсюда происхождение названия её солей (а точнее именно кристаллогидратов) — купоросы.
Получение серной кислоты
Основная статья: Производство серной кислоты
Промышленный (контактный) способ
В промышленности серную кислоту получают окислением диоксида серы (сернистый газ, образующийся в процессе сжигания серы или серного колчедана) до триоксида (серного ангидрида) с последующим взаимодействием SO3 с водой. Получаемую данным способом серную кислоту также называют контактной (концентрация 92-94 %).
-
- 2SO2 + O2 = 2SO3
H2O + SO3 = H2SO4
Нитрозный (башенный) способ
Раньше серную кислоту получали исключительно нитрозным методом в специальных башнях, а кислоту называли башенной (концентрация 75 %). Сущность этого метода заключается в окислении диоксида серы диоксидом азота в присутствии воды. Именно таким способом произошла реакция в воздухе Лондона во время Великого смога.
-
- SO2 + NO2 + H2O = H2SO4 + NO ↑
Другой способ
В тех редких случаях, когда сероводород (H2S) вытесняет сульфат(SO4–) из соли (с металлами Cu,Ag,Pb,Hg) побочным продуктом является серная кислота
-
- H2S + CuSO4 = CuS + H2SO4
Сульфиды данных металлов обладают высочайшей прочностью, а также отличительным чёрным окрасом,
но могут быть окислены до сульфатов, например, азотной кислотой при кипении:
-
- CuS + 8HNO3 → CuSO4 + 8NO2↑ + 4H2O

Физические и физико-химические свойства
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2O с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H3O+, HSO3+, и 2HSO₄−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
Олеум
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:
-
- H2SO4 + SO3 → H2S2O7 Сульфит
-
- H2SO4 + 2SO3 → H2S3O10
Температура кипения водных растворов серной кислоты повышается с ростом её концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | – | 1,0661 | −5,5 | 102,0 |
| 20 | – | 1,1394 | −19,0 | 104,4 |
| 40 | – | 1,3028 | −65,2 | 113,9 |
| 60 | – | 1,4983 | −25,8 | 141,8 |
| 80 | – | 1,7272 | −3,0 | 210,2 |
| 98 | – | 1,8365 | 0,1 | 332,4 |
| 100 | – | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:
-
- lg p = A − B + 2,126 ,
- T
величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:
-
- H2SO4 ⟷ H2O + SO3 − Q .
При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:
-
- d = 1,851 7 − 1,1 ⋅ 10−3 t + 2 ⋅ 10−6 t2
С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO3 увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:
-
- λ = 0,518 + 0,0016t − ( 0,25 + t/1293 ) ⋅ C/100
где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H2SO4·SO3, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO3 и 92 % H2SO4 и максимально при концентрации 84 и 99,8 % H2SO4. Для олеума минимальное ρ при концентрации 10 % SO3. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
Химические свойства
Серная кислота в концентрированном виде при нагревании — довольно сильный окислитель.
Окисляет HI и частично HBr до свободных галогенов.
-
- 8HI + H2SO4 = 4I2 ↓ + H2S↑ + 4H2O
-
- 2HBr + H2SO4 = Br2↓ + SO2↑ + 2H2O
Углерод до CO2, серу — до SO2.
-
- C + 2H2SO4 = 2SO2↑ + CO2 ↑ + 2H2O
-
- S + 2H2SO4 = 3SO2↑ + 2H2O
Окисляет многие металлы (исключения: Au, Pt, Ir, Rh, Ta.). При этом концентрированная серная кислота восстанавливается до SO2, например:
-
- Cu + 2H2SO4 = CuSO4 + 2H2O + SO2
На холоде в концентрированной серной кислоте Fe, Al, Cr, Co, Ni, Ba пассивируются и реакции не протекают.
Наиболее сильными восстановителями концентрированная серная кислота восстанавливается до S и H2S. Концентрированная серная кислота поглощает водяные пары, поэтому она применяется для сушки газов, жидкостей и твёрдых тел, например, в эксикаторах. Однако концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Отщепляя воду от органических соединений и оставляя при этом чёрный углерод (уголь), концентрированная серная кислота приводит к обугливанию древесины, сахара и других веществ.
Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением, например:
-
- Fe + H2SO4 = FeSO4 + H2↑
Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.
-
- H2SO4 + 2NaOH = Na2SO4 + 2H2O
-
- H2SO4 + 2NaOH = Na2SO4 + 2H2O
Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:
-
- CuO + H2SO4 = CuSO4 + H2O
На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:
-
- Fe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2O
Концентрированная H2SO4 превращает некоторые органические вещества в другие соединения углерода:
-
- HCOOH + H2SO4(k) = CO↑ + H2SO4 ⋅ nH2O
Качественной реакцией на серную кислоту и её растворимые соли является их взаимодействие с растворимыми солями бария, при котором образуется белый осадок сульфата бария, нерастворимый в воде и кислотах, например:
-
- H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Применение


Перевозка серной кислоты железнодорожным транспортом осуществляется в специализированных вагонах-цистернах

Контейнеры-цистерны для перевозки серной кислоты погруженные на железнодорожные фитинговые платформы, станция Волковская, Санкт-Петербург
Серную кислоту применяют:
- в обработке руд, особенно при добыче редких элементов, в том числе урана, иридия, циркония, осмия и т. п.;
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513 (эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.;
- для восстановления смол в фильтрах на производстве дистиллированной воды.
Мировое производство серной кислоты около 200 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На P₂O₅ фосфорных удобрений расходуется в 2,2—3,4 раза больше по массе серной кислоты, а на (NH₄)₂SO₄ серной кислоты 75 % от массы расходуемого (NH₄)₂SO₄. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
Токсическое действие
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги). При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
В РФ оборот серной кислоты концентрации 45% и более – ограничен.
Исторические сведения
Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озёр вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
Схема получения серной кислоты из железного купороса — термическое разложение сульфата железа (II) с последующим охлаждением смеси

Молекула серной кислоты по Дальтону
-
- 2FeSO4 + 7H2O → Fe2O3 + SO2 + H2O + O2
- 2SO2 + 2H2O + O2 ⇄ 2H2SO4
В трудах алхимика Валентина (XIII в) описывается способ получения серной кислоты путём поглощения водой газа (серный ангидрид), выделяющегося при сжигании смеси порошков серы и селитры. Впоследствии этот способ лег в основу т. н. «камерного» способа, осуществляемого в небольших камерах, облицованных свинцом, который не растворяется в серной кислоте. В СССР такой способ просуществовал вплоть до 1955 г.
Алхимикам XV в известен был также способ получения серной кислоты из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. Впоследствии, в связи с развитием катализа этот метод вытеснил камерный способ синтеза серной кислоты. В настоящее время серную кислоту получают каталитическим окислением (на V2O5) оксида серы (IV) в оксид серы (VI), и последующим растворением оксида серы (VI) в 70 % серной кислоте с образованием олеума.
В России производство серной кислоты впервые было организовано в 1805 году под Москвой в Звенигородском уезде. В 1913 году Россия по производству серной кислоты занимала 13 место в мире.
Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (Полуостров Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3⋅107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994.
Стандарты
- Кислота серная техническая ГОСТ 2184-77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667-73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262-78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204-77
| Серная кислота | |
 |
|
 |
|
 |
|
| Общие | |
|---|---|
| Систематическое наименование | серная кислота |
| Химическая формула | H2SO4 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Отн. молек. масса | 98,082 а. е. м. |
| Молярная масса | 98,082 г/моль |
| Плотность | 1,8356 г/см³ |
| Термические свойства | |
| Температура плавления | -10,38 °C |
| Температура кипения | 279,6 °C |
| Температура вспышки | 561 °C |
| Температура воспламенения | 1377 °C |
| Удельная теплота плавления | 10,73 Дж/кг |
| Химические свойства | |
| pKa | -3 |
| Растворимость в воде | смешивается |
| Оптические свойства | |
| Показатель преломления | 1.397 |
| Структура | |
| Дипольный момент | 2.72 Д |
| Классификация | |
| Рег. номер CAS | 7664-93-9 |
| Регистрационный номер EC | 231-639-5 |
| RTECS | WS5600000 |
| Безопасность | |
| ЛД50 | 510 мг/кг |
| Токсичность |
0 3 2
|
Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета и запаха, с кислым «медным» вкусом. В технике серной кислотой называют её смеси как с водой, так и с серным ангидридом SO3. Если молярное отношение SO3 : H2O < 1, то это водный раствор серной кислоты, если > 1 — раствор SO3 в серной кислоте (олеум).
Содержание
- 1 Название
- 2 Физические и физико-химические свойства
- 2.1 Олеум
- 3 Химические свойства
- 4 Применение
- 5 Токсическое действие
- 6 Исторические сведения
- 7 Дополнительные сведения
- 8 Получение серной кислоты
- 9 Стандарты
- 10 Примечания
- 11 Литература
- 12 Ссылки
[править] Название
До XX века часто серную кислоту называли купоросом (как правило это был кристаллогидрат, по консистенции напоминающий масло) или купоросным маслом, очевидно отсюда происхождение названия ее солей (а точнее именно кристаллогидратов) — купоросы.
[править] Физические и физико-химические свойства
Очень сильная кислота, при 18оС pKa (1) = −2,8, pKa (2) = 1,92 (К₂ 1,2 10−2); длины связей в молекуле S=O 0,143 нм, S—OH 0,154 нм, угол HOSOH 104°, OSO 119°; кипит, образуя азеотропную смесь (98,3 % H2SO4 и 1,7 % H2О с температурой кипения 338,8оС). Серная кислота, отвечающая 100%-ному содержанию H2SO4, имеет состав (%): H2SO4 99,5, HSO4− — 0,18, H3SO4+ — 0,14, H3O+ — 0,09, H2S2O7, — 0,04, HS2O7⁻ — 0,05. Смешивается с водой и SO3, во всех соотношениях. В водных растворах серная кислота практически полностью диссоциирует на H+, HSO4−, и SO₄2−. Образует гидраты H2SO4·nH2O, где n = 1, 2, 3, 4 и 6,5.
[править] Олеум
Основная статья: Олеум
Растворы серного ангидрида SO3 в серной кислоте называются олеумом, они образуют два соединения H2SO4·SO3 и H2SO4·2SO3.
Олеум содержит также пиросерные кислоты, получающиеся по реакциям:


Температура кипения водных растворов серной кислоты повышается с ростом ее концентрации и достигает максимума при содержании 98,3 % H2SO4.
| Содержание % по массе | Плотность при 20 ℃, г/см³ | Температура плавления, ℃ | Температура кипения, ℃ | |
|---|---|---|---|---|
| H2SO4 | SO3 (свободный) | |||
| 10 | – | 1,0661 | −5,5 | 102,0 |
| 20 | – | 1,1394 | −19,0 | 104,4 |
| 40 | – | 1,3028 | −65,2 | 113,9 |
| 60 | – | 1,4983 | −25,8 | 141,8 |
| 80 | – | 1,7272 | −3,0 | 210,2 |
| 98 | – | 1,8365 | 0,1 | 332,4 |
| 100 | – | 1,8305 | 10,4 | 296,2 |
| 104,5 | 20 | 1,8968 | −11,0 | 166,6 |
| 109 | 40 | 1,9611 | 33,3 | 100,6 |
| 113,5 | 60 | 2,0012 | 7,1 | 69,8 |
| 118,0 | 80 | 1,9947 | 16,9 | 55,0 |
| 122,5 | 100 | 1,9203 | 16,8 | 44,7 |
Температура кипения олеума с увеличением содержания SO3 понижается. При увеличении концентрации водных растворов серной кислоты общее давление пара над растворами понижается и при содержании 98,3 % H2SO4 достигает минимума. С увеличением концентрации SO3 в олеуме общее давление пара над ним повышается. Давление пара над водными растворами серной кислоты и олеума можно вычислить по уравнению:

величины коэффициентов А и В зависят от концентрации серной кислоты. Пар над водными растворами серной кислоты состоит из смеси паров воды, H2SO4 и SO3, при этом состав пара отличается от состава жидкости при всех концентрациях серной кислоты, кроме соответствующей азеотропной смеси.
С повышением температуры усиливается диссоциация:

Уравнение температурной зависимости константы равновесия:

При нормальном давлении степень диссоциации: 10⁻⁵ (373 К), 2,5 (473 К), 27,1 (573 К), 69,1 (673 К).
Плотность 100%-ной серной кислоты можно определить по уравнению:

С повышением концентрации растворов серной кислоты их теплоемкость уменьшается и достигает минимума для 100%-ной серной кислоты, теплоемкость олеума с повышением содержания SO³ увеличивается.
При повышении концентрации и понижении температуры теплопроводность λ уменьшается:

где С — концентрация серной кислоты, в %.
Максимальную вязкость имеет олеум H₂SO₄·SO₃, с повышением температуры η снижается. Электрическое сопротивление серной кислоты минимально при концентрации SO₃ и 92 % H₂SO₄ и максимально при концентрации 84 и 99,8 % H₂SO₄[источник не указан 523 дня]. Для олеума минимальное ρ при концентрации 10 % SO₃. С повышением температуры ρ серной кислоты увеличивается. Диэлектрическая проницаемость 100%-ной серной кислоты 101 (298,15 К), 122 (281,15 К); криоскопическая постоянная 6,12, эбулиоскопическая постоянная 5,33; коэффициент диффузии пара серной кислоты в воздухе изменяется в зависимости от температуры; D = 1,67·10⁻⁵T3/2 см²/с.
[править] Химические свойства
Серная кислота — довольно сильный окислитель, особенно при нагревании и в концентрированном виде; окисляет HI и частично HBr до свободных галогенов, углерод до CO2, серу — до SO2, окисляет многие металлы (Cu, Hg и др.). При этом серная кислота восстанавливается до SO2, а наиболее сильными восстановителями — до S и H2S. Концентрированная H2SO4 частично восстанавливается водородом, из-за чего не может применяться для его сушки. Разбавленная H2SO4 взаимодействует со всеми металлами, находящимися в электрохимическом ряду напряжений левее водорода с его выделением. Окислительные свойства для разбавленной H2SO4 нехарактерны. Серная кислота образует два ряда солей: средние — сульфаты и кислые — гидросульфаты, а также эфиры. Известны пероксомоносерная (или кислота Каро) H2SO5 и пероксодисерная H2S2O8 кислоты.


Серная кислота реагирует также с основными оксидами, образуя сульфат и воду:

На металлообрабатывающих заводах раствор серной кислоты применяют для удаления слоя оксида металла с поверхности металлических изделий, подвергающихся в процессе изготовления сильному нагреванию. Так, оксид железа удаляется с поверхности листового железа действием нагретого раствора серной кислоты:

[править] Применение
Серную кислоту применяют:
- в производстве минеральных удобрений;
- как электролит в свинцовых аккумуляторах;
- для получения различных минеральных кислот и солей;
- в производстве химических волокон, красителей, дымообразующих и взрывчатых веществ;
- в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
- в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
- в промышленном органическом синтезе в реакциях:
- дегидратации (получение диэтилового эфира, сложных эфиров);
- гидратации (этанол из этилена);
- сульфирования (синтетические моющие средства и промежуточные продукты в производстве красителей);
- алкилирования (получение изооктана, полиэтиленгликоля, капролактама) и др.
- Для восстановления смол в фильтрах на производстве дистилированной воды.
Мировое производство серной кислоты ок. 160 млн тонн в год. Самый крупный потребитель серной кислоты — производство минеральных удобрений. На 1 т P₂O₅ фосфорных удобрений расходуется 2,2-3,4 т серной кислоты, а на 1 т (NH₄)₂SO₄ — 0,75 т серной кислоты. Поэтому сернокислотные заводы стремятся строить в комплексе с заводами по производству минеральных удобрений.
[править] Токсическое действие
Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные пути (вызывают химические ожоги)[1]. При вдыхании паров этих веществ они вызывают затруднение дыхания, кашель, нередко — ларингит, трахеит, бронхит и т. д. Предельно допустимая концентрация аэрозоля серной кислоты в воздухе рабочей зоны 1,0 мг/м³, в атмосферном воздухе 0,3 мг/м³ (максимальная разовая) и 0,1 мг/м³ (среднесуточная). Поражающая концентрация паров серной кислоты 0,008 мг/л (экспозиция 60 мин), смертельная 0,18 мг/л (60 мин). Класс опасности II. Аэрозоль серной кислоты может образовываться в атмосфере в результате выбросов химических и металлургических производств, содержащих оксиды S, и выпадать в виде кислотных дождей.
[править] Исторические сведения

Серная кислота известна с древности, встречаясь в природе в свободном виде, например, в виде озер вблизи вулканов. Возможно, первое упоминание о кислых газах, получаемых при прокаливании квасцов или железного купороса «зеленого камня», встречается в сочинениях, приписываемых арабскому алхимику Джабир ибн Хайяну.
В IX веке персидский алхимик Ар-Рази, прокаливая смесь железного и медного купороса (FeSO4•7H2O и CuSO4•5H2O), также получил раствор серной кислоты. Этот способ усовершенствовал европейский алхимик Альберт Магнус, живший в XIII веке.
В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и селитры, или из пирита — серного колчедана, более дешевого и распространенного сырья, чем сера. Таким способом получали серную кислоту на протяжении 300 лет, небольшими количествами в стеклянных ретортах. И только в середине 18 столетия, когда было установлено, что свинец не растворяется в серной кислоте, от стеклянной лабораторной посуды перешли к большим промышленным свинцовым камерам.
[править] Дополнительные сведения
Мельчайшие капельки серной кислоты могут образовываться в средних и верхних слоях атмосферы в результате реакции водяного пара и вулканического пепла, содержащего большие количества серы. Получившаяся взвесь, из-за высокого альбедо облаков серной кислоты, затрудняет доступ солнечных лучей к поверхности планеты. Поэтому (а также в результате большого количества мельчайших частиц вулканического пепла в верхних слоях атмосферы, также затрудняющих доступ солнечному свету к планете) после особо сильных вулканических извержений могут произойти значительные изменения климата. Например, в результате извержения вулкана Ксудач (п-ов Камчатка, 1907 г.) повышенная концентрация пыли в атмосфере держалась около 2 лет, а характерные серебристые облака серной кислоты наблюдались даже в Париже[2]. Взрыв вулкана Пинатубо в 1991 году, отправивший в атмосферу 3·107 тонн серы, привёл к тому, что 1992 и 1993 года были значительно холоднее, чем 1991 и 1994 [3].
[править] Получение серной кислоты
[править] Стандарты
- Кислота серная техническая ГОСТ 2184—77
- Кислота серная аккумуляторная. Технические условия ГОСТ 667—73
- Кислота серная особой чистоты. Технические условия ГОСТ 14262—78
- Реактивы. Кислота серная. Технические условия ГОСТ 4204—77
[править] Примечания
- ↑ В лицо худруку балета Большого театра Сергею Филину плеснули серной кислотой
- ↑ см. статью «Вулканы и климат» (рус.)
- ↑ Русский архипелаг — Виновато ли человечество в глобальном изменении климата? (рус.)
[править] Литература
- Справочник сернокислотчика, под ред. К. М. Малина, 2 изд., М., 1971
[править] Ссылки
- Статья «Серная кислота» (Химическая энциклопедия)
- Плотность и значение pH серной кислоты при t=20 °C
|
Растворимость кислот, оснований и солей в воде |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
Сульфаты |
|---|
|
Алюм (KAl(SO4)2•12H2O) • Аммоний сульфата алюминия ((NH4)Al(SO4)2) • Аммоний-железо сульфат (NH4Fe(SO4)2) • Аммоний-железо(II) сульфат ([NH4]2[Fe][SO4]2) • Аммоний-железо(III) сульфат (NH4Fe(SO4)2) • Аммоний-церий(IV) сульфат ((NH4)4Ce(SO4)4) • Гептагидрат сульфата магния (MgSO4) • Гидросульфат аммония ((NH4)HSO4) • Гидросульфат калия (KHSO4) • Гидросульфат натрия (NaHSO4) • Дисульфат калия (K2S2O7) • Дисульфат натрия (Na2S2O7) • Железа(III) основный сульфат ([Fe3(SO4)5](OH)2) • Квасцы • Купорос • Оксид-сульфат титана (TiOSO4) • Олеум (H2SO4•xSO3) • Пиросерная кислота (H2S2O7) • Серная кислота (H2SO4) • Соли Туттона • Сульфат актиния(III) (Ac2(SO4)3) • Сульфат алюминия (Al2(SO4)3) • Сульфат алюмонатрия (NaAl(SO4)2) • Сульфат аммония ((NH4)2SO4) • Сульфат бария (BaSO4) • Сульфат бериллия (BeSO4) • Сульфат ванадила (VOSO4) • Сульфат ванадия(III) (V2(SO4)3) • Сульфат висмута (Bi2(SO4)3) • Сульфат гидроксиаммония ((NH3OH)2SO4) • Сульфат железа(II) (FeSO4) • Сульфат железа(III) (Fe2(SO4)3) • Сульфат индия(III) (In2(SO4)3) • Сульфат иридия(III) (Ir2(SO4)3) • Сульфат кадмия (CdSO4) • Сульфат калия (K2SO4) • Сульфат кальция (CaSO4) • Сульфат кобальта(II) (CoSO4) • Сульфат кобальта(III) (Co2(SO4)3) • Сульфат лития (Li2SO4) • Сульфат магния (MgSO4) • Сульфат марганца(II) (MnSO4) • Сульфат марганца(III) (Mn2(SO4)3) • Сульфат меди(I) (Cu2SO4) • Сульфат меди(II) (CuSO4) • Сульфат натрия (Na2SO4) • Сульфат никеля(II) (NiSO4) • Сульфат олова(II) (SnSO4) • Сульфат празеодима (Pr2(SO4)3) • Сульфат ртути(I) (Hg2SO4) • Сульфат ртути(II) (HgSO4) • Сульфат свинца(II) (PbSO4) • Сульфат серебра (Ag2SO4) • Сульфат стронция (SrSO4) • Сульфат сурьмы (Sb2(SO4)3) • Сульфат таллия(I) (Tl2SO4) • Сульфат таллия(III) (Tl2(SO4)3) • Сульфат тетраамина меди (Cu(NH3)4SO4) • Сульфат титана(III) (Ti2(SO4)3) • Сульфат титана(IV) (Ti(SO4)2) • Сульфат урана (U(SO4)2) • Сульфат уранила (UO2SO4) • Сульфат хрома(III) (Cr2(SO4)3) • Сульфат хрома(III)-калия (KCr(SO4)2) Сульфат цезия (Cs2SO4) • Сульфат церия(IV) (Ce(SO4)2) • Сульфат цинка (ZnSO4) • Сульфат циркония (Zr(SO4)2) |