| Группа → | 2 | ||||
|---|---|---|---|---|---|
| ↓ Период | |||||
| 2 |
|
||||
| 3 |
|
||||
| 4 |
|
||||
| 5 |
|
||||
| 6 |
|
||||
| 7 |
|
||||
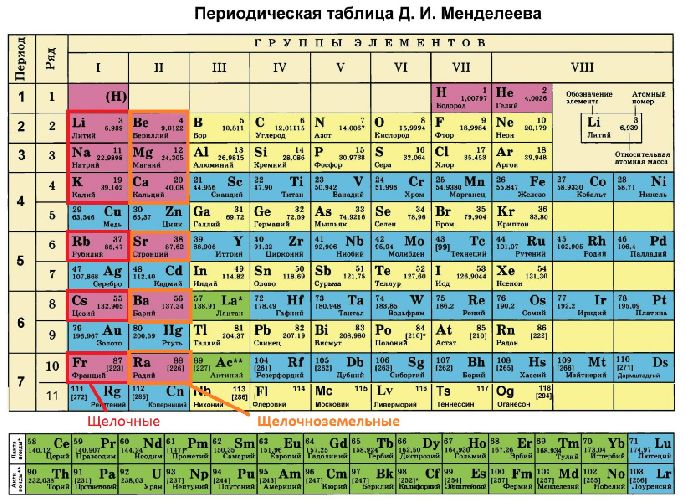
Щёлочноземе́льные мета́ллы — химические элементы 2-й группы[1] периодической таблицы элементов: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba), радий (Ra)[2]. В случае своего открытия гипотетический 120-й элемент унбинилий, согласно строению внешней электронной оболочки, также будет отнесен к щёлочноземельным металлам.

Бериллий и магний[править | править код]
Раньше Be и Mg не относили к щёлочноземельным металлам, потому что их гидроксиды не являются щелочами.
Be(OH)2 — амфотерный гидроксид.
Mg(OH)2 — малорастворимое основание, которое дает слабощелочную реакцию и окрашивает индикатор.
Be не реагирует с водой, Mg — очень медленно (при обычных условиях) в отличие от всех остальных щёлочноземельных металлов.
Однако сегодня, согласно определению ИЮПАК, бериллий и магний относят к щёлочноземельным металлам.
Физические свойства[править | править код]
К щёлочноземельным металлам часто относят только кальций, стронций, барий и радий, реже магний и бериллий. Однако согласно номенклатуре ИЮПАК щёлочноземельными металлами следует считать все элементы 2-й группы[2]. Первый элемент этой группы, бериллий, по большинству свойств гораздо ближе к алюминию, чем к высшим аналогами группы, в которую он входит (диагональное сходство). Второй элемент этой группы, магний, уже обладает некоторыми химическими свойствами, общими для щелочноземельных металлов, но в остальном заметно отличается от них, в частности, значительно меньшей активностью, и рядом свойств напоминает всё тот же алюминий.
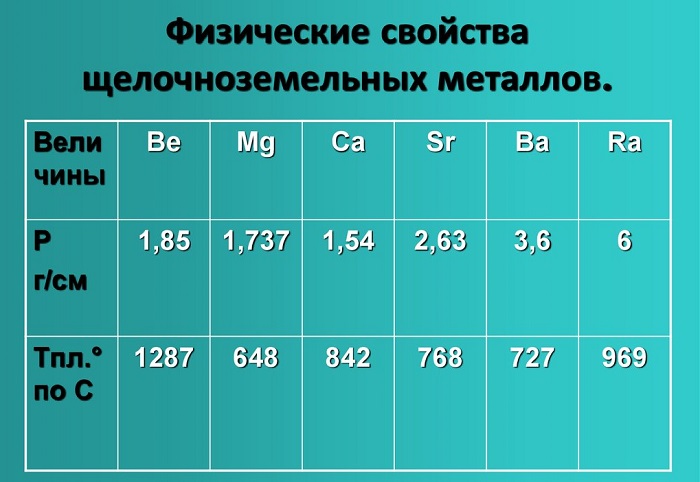
Все щёлочноземельные металлы серые, твёрдые при комнатной температуре вещества. В отличие от щелочных металлов, они существенно более твёрдые, и ножом преимущественно не режутся (исключение — стронций). Рост плотности
щёлочноземельных металлов наблюдается только начиная с кальция. Самый тяжёлый — радий, по плотности сравнимый с германием (ρ= 5,5 г/см3).
Электрическая проводимость щелочноземельных металлов примерно такая же, как и щелочных металлов.
В целом металлы второй группы по сравнению с щелочными металлами обладают большей плотностью и твердостью.
| Атомный номер |
Название, символ |
Число изотопов (природных + искусственных) | Атомная масса | Энергия ионизации, кДж·моль−1 | Сродство к электрону, кДж·моль−1 | ЭО | Металл. радиус, нм (По Полингу) | Ионный радиус, нм
(По Полингу) |
tпл, °C |
tкип, °C |
ρ, г/см³ |
ΔHпл, кДж·моль−1 | ΔHкип, кДж·моль−1 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 | Бериллий Be | 1+11а | 9,012182 | 898,8 | -50 (оценка) | 1,57 | 0,169 | 0,031 | 1278 | 2970 | 1,848 | 12,21 | 309 |
| 12 | Магний Mg | 3+19а | 24,305 | 737,3 | -40 (оценка) | 1,31 | 0,24513 | 0,065 | 650 | 1105 | 1,737 | 9,2 | 131,8 |
| 20 | Кальций Ca | 5+19а | 40,078 | 589,4 | 2,37 | 1,00 | 0,279 | 0,099 | 839 | 1484 | 1,55 | 9,20 | 153,6 |
| 38 | Стронций Sr | 4+35а | 87,62 | 549,0 | 5,02 | 0,95 | 0,304 | 0,113 | 769 | 1384 | 2,54 | 9,2 | 144 |
| 56 | Барий Ba | 7+43а | 137,327 | 502,5 | 13,95 | 0,89 | 0,251 | 0,135 | 729 | 1637 | 3,5 | 7,66 | 142 |
| 88 | Радий Ra | 46а | 226,0254 | 509,3 | 9,65 (оценка) | 0,9 | 0,2574 | 0,143 | 700 | 1737 | 5,5 | 8,5 | 113 |
а Радиоактивные изотопы
Химические свойства[править | править код]
Щёлочноземельные металлы имеют электронную конфигурацию внешнего энергетического уровня ns², и являются s-элементами, наряду с щелочными металлами, водородом и гелием. Имея два валентных электрона, щёлочноземельные металлы легко их отдают, и в большинстве соединений имеют степень окисления +2 (очень редко +1).
Химическая активность щёлочноземельных металлов растёт с ростом порядкового номера. Бериллий в компактном виде не реагирует ни с кислородом, ни с галогенами даже при температуре красного каления (до 600 °C, для реакции с кислородом и другими халькогенами нужна ещё более высокая температура, фтор — исключение). Магний защищён оксидной плёнкой при комнатной температуре и более высоких (до 650 °C) температурах и не окисляется дальше. Кальций медленно окисляется и при комнатной температуре вглубь (в присутствии водяных паров), и сгорает при небольшом нагревании в кислороде, но устойчив в сухом воздухе при комнатной температуре. Стронций, барий и радий быстро окисляются на воздухе, давая смесь оксидов и нитридов, поэтому их, подобно щелочным металлам (за исключением рубидия и цезия, для которых допустимо хранение только в атмосфере аргона, поскольку они сильно окисляются даже в керосине) и кальцию, хранят под слоем керосина, особочистые реактивы простых веществ кальция, стронция и бария хранятся в ампулах с инертной атмосферой аргона, более того, барий и его водорастворимые соединения токсичны, поэтому работа с ним требует защиты органов дыхания и кожи от возможного попадания растворов солей бария.
Озониды и надпероксиды щёлочноземельных металлов детально не изучены, они являются неустойчивыми соединениями. Они не находят широкого применения.
Оксиды и гидроксиды щёлочноземельных металлов имеют тенденцию к усилению основных свойств с ростом порядкового номера.
Простые вещества[править | править код]
Бериллий реагирует со слабыми и сильными растворами кислот с образованием солей:
однако пассивируется холодной концентрированной азотной кислотой.
Реакция бериллия с водными растворами щелочей сопровождается выделением водорода и образованием гидроксобериллатов:
При проведении реакции с расплавом щелочи при 400—500 °C образуются диоксобериллаты:
Магний, кальций, стронций, барий и радий реагируют с водой с образованием щелочей (магний с холодной водой реагирует очень медленно, но при внесении раскалённого порошка магния в воду, а также в горячей воде — бурно):
Также кальций, стронций, барий и радий реагируют с водородом, азотом, бором, углеродом и другими неметаллами с образованием соответствующих бинарных соединений:
Оксиды[править | править код]
Оксид бериллия — амфотерный оксид, растворяется в концентрированных минеральных кислотах и щелочах с образованием солей:
но с менее сильными кислотами и основаниями реакция уже не идет.
Оксид магния не реагирует с разбавленными и концентрированными основаниями, но легко реагирует с кислотами и водой:
Оксиды кальция, стронция, бария и радия — основные оксиды, реагируют с водой, сильными и слабыми растворами кислот и амфотерными оксидами и гидроксидами:
Гидроксиды[править | править код]
Гидроксид бериллия амфотерен, при реакциях с сильными основаниями образует бериллаты, с кислотами — бериллиевые соли кислот:
Гидроксиды магния, кальция, стронция, бария и радия — основания, сила увеличивается от слабого Mg(OH)2 до очень сильного Ra(OH)2, являющегося сильнейшим коррозионным веществом, по активности превышающим гидроксид калия. Хорошо растворяются в воде (кроме гидроксидов магния и кальция). Для них характерны реакции с кислотами и кислотными оксидами и с амфотерными оксидами и гидроксидами:
Нахождение в природе[править | править код]
Все щёлочноземельные металлы имеются (в разных количествах) на Земле. Ввиду своей высокой химической активности все они в свободном состоянии не встречаются. Самым распространённым щёлочноземельным металлом является кальций, содержание которого равно относительно массы земной коры оценивается по-разному: от 2 % до 13,3 %[3]. Немногим ему уступает магний, содержание которого равно 2,35 %. Распространены в природе также барий и стронций, содержание которых соответственно равно 0,039 % и 0,0384 % от массы земной коры. Бериллий является редким элементом, количество которого составляет 2⋅10−4% от массы земной коры. Радиоактивный радий — это самый редкий из всех щёлочноземельных металлов, но он в небольшом количестве всегда содержится в урановых рудах. В частности, он может быть выделен оттуда химическим путём. Его содержание равно 1⋅10−10% (от массы земной коры)[4][неавторитетный источник?][5].
Биологическая роль[править | править код]
Магний содержится в тканях животных и растений (например, в хлорофилле), является кофактором многих ферментативных реакций, необходим при синтезе АТФ, участвует в передаче нервных импульсов, активно применяется в медицине (бишофитотерапия и др.).
Кальций — распространенный макроэлемент в организме растений, животных и человека. В организме человека и других позвоночных большая его часть находится в скелете и зубах. В костях кальций содержится в виде гидроксиапатита. Из различных форм карбоната кальция состоят минеральные «скелеты» некоторых представителей многих групп беспозвоночных (губки, кишечнополостные, моллюски и др.). Ионы кальция участвуют в процессах свертывания крови, а также служат одним из универсальных вторичных посредников внутри клеток и регулируют самые разные внутриклеточные процессы: мышечное сокращение, экзоцитоз, в том числе секрецию гормонов и нейромедиаторов.
Стронций может замещать кальций в природных тканях[прояснить], так как схож с ним по свойствам. В организме человека масса стронция составляет около 1 % от массы кальция.
На данный момент о биологической роли бериллия, бария и радия ничего не известно. Все соединения бария (кроме сульфата ввиду его чрезвычайно малой растворимости) и бериллия ядовиты. Радий чрезвычайно радиотоксичен. В организме он ведёт себя подобно кальцию — около 80 % поступившего в организм радия накапливается в костной ткани. Большие концентрации радия вызывают остеопороз, самопроизвольные переломы костей и злокачественные опухоли костей и кроветворной ткани. Опасность представляет также радон — газообразный радиоактивный продукт распада радия.
Примечания[править | править код]
- ↑ По новой классификации ИЮПАК. По устаревшей классификации относятся к главной подгруппе II группы периодической таблицы.
- ↑ 1 2 Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (англ.). — International Union of Pure and Applied Chemistry, 2005. — P. 51.
- ↑ M. E. Weeks. Discovery of the elements. — 6th edn.. — Journal of Chemical Education. — P. 990.
- ↑ Золотой фонд. Школьная энциклопедия. Химия. М.: Дрофа, 2003.
- ↑ Н. Гринвуд, А. Эрншо. Химия элементов : в 2 т / пер. с англ.. — 3-е изд.. — М.: БИНОМ. Лаборатория знаний, 2015. — Т. 1. — С. 111—112. — 607 с. — (Лучший зарубежный учебник). — ISBN 978-5-9963-1733-2.
Ссылки[править | править код]
Элементы II группы главной подгруппы
1. Положение в Периодической системе химических элементов
2. Электронное строение и закономерности изменения свойств
3. Физические свойства
4. Нахождение в природе
5. Способы получения
6. Качественные реакции
7. Химические свойства
7.1. Взаимодействие с простыми веществами
7.1.1. Взаимодействие с галогенами
7.1.2. Взаимодействие с серой и фосфором
7.1.3. Взаимодействие с водородом
7.1.4. Взаимодействие с азотом
7.1.5. Взаимодействие с углеродом
7.1.6. Горение
7.2. Взаимодействие со сложными веществами
7.2.1. Взаимодействие с водой
7.2.2. Взаимодействие с минеральными кислотами
7.2.3. Взаимодействие с серной кислотой
7.2.4. Взаимодействие с азотной кислотой
7.2.5. Взаимодействие с оксидами неметаллов
7.2.6. Взаимодействие с солями и оксидами металлов
Оксиды щелочноземельных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотными и амфотерными оксидами
2.2. Взаимодействие с кислотами
2.3. Взаимодействие с водой
2.4. Амфотерные свойства оксида бериллия
Гидроксиды щелочноземельных металлов
1. Способы получения
2. Химические свойства
2.1. Взаимодействие с кислотами
2.2. Взаимодействие с кислотными оксидами
2.3. Взаимодействие с амфотерными оксидами и гидроксидами
2.4. Взаимодействие с кислыми солями
2.5. Взаимодействие с неметаллами
2.6. Взаимодействие с металлами
2.7. Взаимодействие с солями
2.8. Разложение при нагревании
2.9. Диссоциация
2.10. Амфотерные свойства гидроскида бериллия
Соли щелочноземельных металлов
Жесткость
1. Постоянная и временная жесткость
2. Способы устранения жесткости
Элементы II группы главной подгруппы
Положение в периодической системе химических элементов
Щелочноземельные металлы расположены во второй группе главной подгруппе периодической системы химических элементов Д.И. Менделеева (или просто во 2 группе в длиннопериодной форме ПСХЭ). На практике к щелочноземельным металлам относят только кальций Ca, стронций Sr, барий Ba и радий Ra. Бериллий Be по свойствам больше похож на алюминий, магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Однако, согласно номенклатуре ИЮПАК, щелочноземельными принято считать все металлы II группы главной подгруппы.
Электронное строение и закономерности изменения свойств
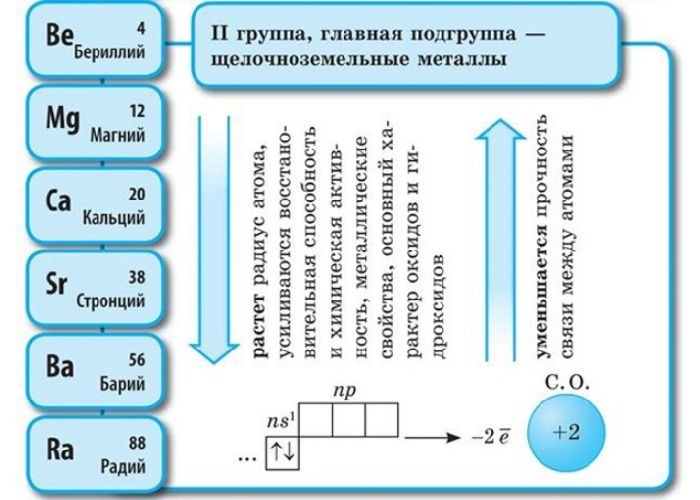
Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов: ns2, на внешнем энергетическом уровне в основном состоянии находится 2 s-электрона. Следовательно, типичная степень окисления щелочноземельных металлов в соединениях +2.
Рассмотрим некоторые закономерности изменения свойств щелочноземельных металлов.
В ряду Be—Mg—Ca—Sr—Ba—Ra, в соответствии с Периодическим законом, увеличивается атомный радиус, усиливаются металлические свойства, ослабевают неметаллические свойства, уменьшается электроотрицательность.

Физические свойства
Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы.
Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина.
Кристаллическая решетка щелочноземельных металлов в твёрдом состоянии — металлическая. Следовательно, они обладают высокой тепло- и электропроводимостью. Кипят и плавятся при высоких температурах.
Нахождение в природе
Как правило, щелочноземельные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы, в которых присутствуют щелочноземельные металлы:
Доломит — CaCO3 · MgCO3 — карбонат кальция-магния.
Магнезит MgCO3 – карбонат магния.
Кальцит CaCO3 – карбонат кальция.
Гипс CaSO4 · 2H2O – дигидрат сульфата кальция.
Барит BaSO4 — сульфат бария.
Витерит BaCO3 – карбонат бария.

Способы получения
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
или восстановлением прокаленного доломита в электропечах при 1200–1300°С:
2(CaO · MgO) + Si → 2Mg + Ca2SiO4
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
CaCl2 → Ca + Cl2
Барий получают восстановлением оксида бария алюминием в вакууме при 1200 °C:
4BaO + 2Al → 3Ba + Ba(AlO2)2
Качественные реакции
Качественная реакция на щелочноземельные металлы — окрашивание пламени солями щелочноземельных металлов.
Цвет пламени:
Ca — кирпично-красный
Sr — карминово-красный (алый)
Ba — яблочно-зеленый
Качественная реакция на ионы магния: взаимодействие с щелочами. Ионы магния осаждаются щелочами с образованием белого осадка гидроксида магния:
Mg2+ + 2OH— → Mg(OH)2↓
Качественная реакция на ионы кальция, стронция, бария: взаимодействие с карбонатами. При взаимодействии солей кальция, стронция и бария с карбонатами выпадает белый осадок карбоната кальция, стронция или бария:
Ca2+ + CO32- → CaCO3↓
Ba2+ + CO32- → BaCO3↓
Качественная реакция на ионы стронция и бария: взаимодействие с сульфатами. При взаимодействии солей стронция и бария с сульфатами выпадает белый осадок сульфата бария и сульфата стронция:
Ba2+ + SO42- → BaSO4↓
Sr2+ + SO42- → SrSO4↓
Также осадки белого цвета образуются при взаимодействии солей кальция, стронция и бария с сульфитами и фосфатами.
Например, при взаимодействии хлорида кальция с фосфатом натрия образуется белый осадок фосфата кальция:
3CaCl2 + 2Na3PO4 → 6NaCl + 2Ca3(PO4)2↓
Химические свойства
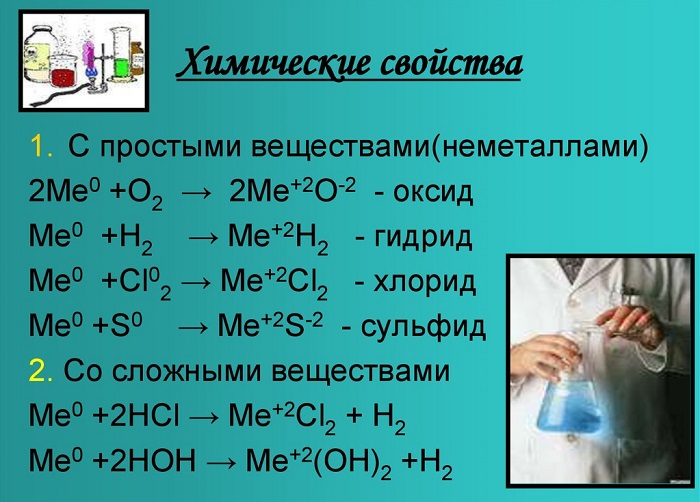
1. Щелочноземельные металлы — сильные восстановители. Поэтому они реагируют почти со всеми неметаллами.
1.1. Щелочноземельные металлы реагируют с галогенами с образованием галогенидов при нагревании.
Например, бериллий взаимодействует с хлором с образованием хлорида бериллия:
Be + Cl2 → BeCl2
1.2. Щелочноземельные металлы реагируют при нагревании с серой и фосфором с образованием сульфидов и фосфидов.
Например, кальций взаимодействует с серой при нагревании:
Ca + S → CaS
Кальций взаимодействует с фосфором с образованием фосфидов:
3Ca + 2P → Ca3P2
1.3. Щелочноземельные металлы реагируют с водородом при нагревании. При этом образуются бинарные соединения — гидриды. Бериллий с водородом не взаимодействует, магний реагирует лишь при повышенном давлении.
Mg + H2 → MgH2
1.4. С азотом магний взаимодействует при нагревании с образованием нитрида:
3Mg + N2 → Mg3N2
Остальные щелочноземельные металлы также реагируют с азотом при нагревании.
1.5. Щелочноземельные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов.
Например, кальций взаимодействует с углеродом с образованием карбида кальция:
Ca + 2C → CaC2
Бериллий реагирует с углеродом при нагревании с образованием карбида — метанида:
2Be + C → Be2C
1.6. Бериллий сгорает на воздухе при температуре около 900°С:
2Be + O2 → 2BeO
Магний горит на воздухе при 650°С с выделением большого количества света. При этом образуются оксиды и нитриды:
2Mg + O2 → 2MgO
3Mg + N2 → Mg3N2
Щелочноземельные металлы горят на воздухе при температуре около 500°С, в результате также образуются оксиды и нитриды.
Видеоопыт: горение кальция на воздухе можно посмотреть здесь.
2. Щелочноземельные металлы взаимодействуют со сложными веществами:
2.1. Щелочноземельные металлы реагируют с водой. Взаимодействие с водой приводит к образованию щелочи и водорода. Бериллий с водой не реагирует. Магний реагирует с водой при кипячении. Кальций, стронций и барий реагируют с водой при комнатной температуре.
Например, кальций реагирует с водой с образованием гидроксида кальция и водорода:
Ca0 + 2H2+O = Ca+(OH)2 + H20
2.2. Щелочноземельные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной, разбавленной серной кислотой и др.). При этом образуются соль и водород.
Например, магний реагирует с соляной кислотой:
Mg + 2HCl → MgCl2 + H2↑
2.3. При взаимодействии щелочноземельных металлов с концентрированной серной кислотой образуется сера.
Например, при взаимодействии кальция с концентрированной серной кислотой образуется сульфат кальция, сера и вода:
4Ca + 5H2SO4(конц.) → 4CaSO4 + S + 5H2O
2.4. Щелочноземельные металлы реагируют с азотной кислотой. При взаимодействии кальция и магния с концентрированной или разбавленной азотной кислотой образуется оксид азота (I):
4Ca + 10HNO3 (конц) → N2O + 4Сa(NO3)2 + 5H2O
При взаимодействии щелочноземельных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
4Ba + 10HNO3 → 4Ba(NO3)2 + NH4NO3 + 3H2O
2.5. Щелочноземельные металлы могут восстанавливать некоторые неметаллы (кремний, бор, углерод) из оксидов.
Например, при взаимодействии кальция с оксидом кремния (IV) образуются кремний и оксид кальция:
2Ca + SiO2 → 2CaO + Si
Магний горит в атмосфере углекислого газа. При этом образуется сажа и оксид магния:
2Mg + CO2 → 2MgO + C
2.6. В расплаве щелочноземельные металлы могут вытеснять менее активные металлы из солей и оксидов. Обратите внимание! В растворе щелочноземельные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например, кальций вытесняет медь из расплава хлорида меди (II):
Ca + CuCl2 → CaCl2 + Cu
Оксиды щелочноземельных металлов
Способы получения
1. Оксиды щелочноземельных металлов можно получить из простых веществ — окислением металлов кислородом:
2Ca + O2 → 2CaO
2. Оксиды щелочноземельных металлов можно получить термическим разложением некоторых кислородсодержащих солей — карбонатов, нитратов.
Например, нитрат кальция разлагается на оксид кальция, оксид азота (IV) и кислород:
2Ca(NO3)2 → 2CaO + 4NO2 + O2
MgCO3 → MgO + CO2
СаСО3 → СаО + СО2
3. Оксиды магния и бериллия можно получить термическим разложением гидроксидов:
Mg(OH)2 → MgO + H2O
Химические свойства
Оксиды кальция, стронция, бария и магния — типичные основные оксиды. Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой. Оксид бериллия — амфотерный.
1. Оксиды кальция, стронция, бария и магния взаимодействуют с кислотными и амфотерными оксидами:
Например, оксид магния взаимодействует с углекислым газом с образованием карбоната магния:
MgO + CO2 → MgCO3
2. Оксиды щелочноземельных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например, оксид кальция взаимодействует с соляной кислотой с образованием хлорида кальция и воды:
CaO + 2HCl → CaCl2 + H2O
3. Оксиды кальция, стронция и бария активно взаимодействуют с водой с образованием щелочей.
Например, оксид кальция взаимодействует с водой с образованием гидроксида кальция:
CaO + H2O → 2Ca(OH)2
Оксид магния реагирует с водой при нагревании:
MgO + H2O → Mg(OH)2
Оксид бериллия не взаимодействует с водой.
4. Оксид бериллия взаимодействует с щелочами и основными оксидами.
При взаимодействии оксида бериллия с щелочами в расплаве или с основными оксидами образуются соли-бериллаты.
Например, оксид натрия реагирует с оксидом бериллия с образованием бериллата натрия:
Na2O + BeO → Na2BeO2
Например, гидроксид натрия реагирует с оксидом бериллия в расплаве с образованием бериллата натрия:
2NaOH + BeO → Na2BeO2 + H2O
При взаимодействии оксида бериллия с щелочами в растворе образуются комплексные соли.
Например, оксид бериллия реагирует с гидроксидом калия с растворе с образованием тетрагидроксобериллата калия:
2NaOH + BeO + H2O → Na2[Be(OH)4]
Гидроксиды щелочноземельных металлов
Способы получения
1. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих оксидов с водой.
Например, оксид кальция (негашеная известь) при взаимодействии с водой образует гидроксид кальция (гашеная известь):
CaO + H2O → Ca(OH)2
Оксид магния взаимодействует с водой только при нагревании:
MgO + H2O → Mg(OH)2
2. Гидроксиды кальция, стронция и бария получают при взаимодействии соответствующих металлов с водой.
Например, кальций реагирует с водой с образованием гидроксида кальция и водорода:
2Ca + 2H2O → 2Ca(OH)2 + H2
Магний взаимодействует с водой только при кипячении:
2Mg + 2H2O → 2Mg(OH)2 + H2
3. Гидроксиды кальция и магния можно получить при взаимодействии солей кальция и магния с щелочами.
Например, нитрат кальция с гидроксидом калия образует нитрат калия и гидроксид кальция:
Ca(NO3)2 + 2KOH → Ca(OH)2↓ + 2KNO3
Химические свойства
1. Гидроксиды кальция, стронция и бария реагируют с всеми кислотами (и сильными, и слабыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Гидроксид магния взаимодействует только с сильными кислотами.
Например, гидроксид кальция с соляной кислотой реагирует с образова-нием хлорида кальция:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами. При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например, гидроксид бария с углекислым газом реагирует с образова-нием карбонатов или гидрокарбонатов:
Ba(OH)2(избыток) + CO2 → BaCO3 + H2O
Ba(OH)2 + 2CO2 (избыток) → Ba(HCO3)2
3. Гидроксиды кальция, стронция и бария реагируют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например, гидроксид бария с оксидом алюминия реагирует в расплаве с образованием алюминатов:
Ba(OH)2 + Al2O3 → Ba(AlO2)2 + H2O
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Ba(OH)2 + Al2O3 + 3H2O → Ba[Al(OH)4]2
4. Гидроксиды кальция, стронция и бария взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например: гидроксид кальция реагирует с гидрокарбонатом кальция с образованием карбоната кальция:
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
5. Гидроксиды кальция, стронция и бария взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода). Взаимодействие щелочей с неметаллами подробно рассмотрено в статье про щелочные металлы.
6. Гидроксиды кальция, стронция и бария взаимодействуют с амфотерными металлами, кроме железа и хрома. При этом в расплаве образуются соль и водород:
Ca(OH)2 + Zn → CaZnO2 + H2
В растворе образуются комплексная соль и водород:
Ca(OH)2 + 2Al + 6Н2О = Ca[Al(OH)4]2 + 3Н2
7. Гидроксиды кальция, стронция и бария вступают в обменные реакции с растворимыми солями. Как правило, с этими гидроксидами реагируют растворимые соли тяжелых металлов (в ряду активности расположены правее алюминия), а также растворимые карбонаты, сульфиты, силикаты, и, для гидроксидов стронция и бария — растворимые сульфаты.
Например, хлорид железа (II) реагирует с гидроксидом бария с образованием хлорида бария и осадка гидроксида железа (II):
Ba(OH)2 + FeCl2 = BaCl2+ Fe(OH)2↓
Также с гидроксидами кальция, стронция и бария взаимодействуют соли аммония.
Например, при взаимодействии бромида аммония и гидроксида кальция образуются бромид кальция, аммиак и вода:
2NH4Br + Ca(OH)2 = 2NH3 + 2H2O + CaBr2
8. Гидроксид кальция разлагается при нагревании до 580оС, гидроксиды магния и бериллия разлагаются при нагревании:
Mg(OH)2 → MgO + H2O
9. Гидроксиды кальция, стронция и бария проявляют свойства сильных оснований. В воде практически полностью диссоциируют, образуя щелочную среду и меняя окраску индикаторов.
Ba(OH)2 ↔ Ba2+ + 2OH—
Гидроксид магния — нерастворимое основание. Гидроксид бериллия проявляет амфотерные свойства.
10. Гидроксид и бериллия взаимодействует с щелочами. В расплаве образуются соли бериллаты, а в растворе щелочей — комплексные соли.
Например, гидроксид бериллия реагирует с расплавом гидроксида натрия:
Be(OH)2 + 2NaOH → Na2BeO2 + 2H2O
При взаимодействии гидроксида бериллия с избытком раствора щелочи образуется комплексная соль:
Be(OH)2 + 2NaOH → Na2[Be(OH)4]
Соли щелочноземельных металлов
Нитраты щелочноземельных металлов
Нитраты кальция, стронция и бария при нагревании разлагаются на нитриты и кислород. Исключение — нитрат магния. Он разлагается на оксид магния, оксид азота (IV) и кислород.
Например, нитрат кальция разлагается при нагревании на нитрит кальция и молекулярный кислород:
Ca(NO3)2 → Ca(NO2)2 + O2
Карбонаты щелочноземельных металлов
1. Карбонаты щелочноземельных металлов при нагревании разлагаются на оксид и углекислый газ.
Например, карбонат кальция разлагается при температуре 1200оС на оксид кальция и углекислый газ:
CaCO3 → CaO + CO2
2. Карбонаты щелочноземельных металлов под действием воды и углекислого газа превращаются в растворимые в воде гидрокарбонаты.
Например, карбонат кальция взаимодействует с углекислым газом и водой с образованием гидрокарбоната кальция:
CaCO3 + H2O + CO2 → Ca(HCO3)2
3. Карбонаты щелочноземельных металлов взаимодействуют с более сильными кислотами с образованием новой соли, углекислого газа и воды.
Более сильные кислоты вытесняют менее сильные из солей.
Например, карбонат магния взаимодействует с соляной кислотой:
CaCO3 + 2HCl → CaCl2 + CO2↑+ H2O
4. Менее летучие оксиды вытесняют углекислый газ из карбонатов при сплавлении. К менее летучим, чем углекислый газ, оксидам относятся твердые оксиды — оксид кремния (IV), оксиды амфотерных металлов.
Менее летучие оксиды вытесняют более летучие оксиды из солей при сплавлении.
Например, карбонат кальция взаимодействует с оксидом алюминия при сплавлении:
CaCO3 + Al2O3 → Ca(AlO2)2 + CO2↑
Жесткость воды
Постоянная и временная жесткость
Жесткость воды — это характеристика воды, обусловленная содержанием в ней растворенных солей щелочноземельных металлов, в основном кальция и магния (солей жесткости).
Временная (карбонатная) жесткость обусловлена присутствием гидрокарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2 в воде.
Постоянная (некарбонатная) жесткость обусловлена присутствием солей, не выделяющихся при кипячении из раствора: хлоридов (CaCl2) и сульфатов (MgSO4) кальция и магния.
Способы устранения жесткости
Существуют химические и физические способы устранения жесткости. Химические способы устранения временной жесткости:
1. Кипячение. При кипячении гидрокарбонаты кальция и магния распадаются на нерастворимые карбонаты, углекислый газ и воду:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
2. Добавление извести (гидроксида кальция). При добавлении щелочи растворимые гидрокарбонаты переходят в нерастворимые карбонаты:
Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O
Химические способы устранения постоянной жесткости — реакции ионного обмена, которые позволяют осадить ионы кальция и магния из раствора:
1. Добавление соды (карбоната натрия). Карбонат натрия связывает ионы кальция и магния в нерастворимые карбонаты:
CaCl2 + Na2CO3 → CaCO3↓+ 2NaCl
2. Добавление фосфатов. Фосфаты также связывают ионы кальция и магния:
3CaCl2 + 2Na3PO4 → Ca3(PO4)2↓ + 6NaCl
Щелочные и щелочноземельные металлы

4.6
Средняя оценка: 4.6
Всего получено оценок: 1653.
4.6
Средняя оценка: 4.6
Всего получено оценок: 1653.
Наиболее активными среди металлической группы являются щелочные и щелочноземельные металлы. Это мягкие лёгкие металлы, вступающие в реакции с простыми и сложными веществами.
Общее описание
Активные металлы занимают первую и вторую группы периодической таблицы Менделеева. Полный список щелочных и щелочноземельных металлов:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr);
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).
Электронная конфигурация щелочных металлов – ns1, щелочноземельных металлов – ns2.
Соответственно, постоянная валентность щелочных металлов – I, щелочноземельных – II. За счёт небольшого количества валентных электронов на внешнем энергетическом уровне активные металлы проявляют мощные свойства восстановителя, отдавая внешние электроны в реакциях. Чем больше энергетических уровней, тем меньше связь с внешних электронов с ядром атома. Поэтому металлические свойства возрастают в группах сверху вниз.
Из-за активности металлы I и II групп находятся в природе только в составе горных пород. Чистые металлы выделяют с помощью электролиза, прокаливания, реакции замещения.
Физические свойства
Щелочные металлы имеют серебристо-белый цвет с металлическим блеском. Цезий – серебристо-жёлтый металл. Это наиболее активные и мягкие металлы. Натрий, калий, рубидий, цезий режутся ножом. По мягкости напоминают воск.
Щелочноземельные металлы имеют серый цвет. По сравнению со щелочными металлами являются более твёрдыми, плотными веществами. Ножом можно разрезать только стронций. Самый плотный металл – радий (5,5 г/см3).
Наиболее лёгкими металлами являются литий, натрий и калий. Они плавают на поверхности воды.
Химические свойства
Щелочные и щелочноземельные металлы реагируют с простыми веществами и сложными соединениями, образуя соли, оксиды, щёлочи. Основные свойства активных металлов описаны в таблице.
|
Взаимодействие |
Щелочные металлы |
Щелочноземельные металлы |
|
С кислородом |
Самовоспламеняются на воздухе. Образуют надпероксиды (RO2), кроме лития и натрия. Литий образует оксид при нагревании выше 200°C. Натрий образует смесь пероксида и оксида. Примеры: – 4Li + O2 → 2Li2O; – 2Na + О2 → Na2O2; – Rb + O2 → RbO2 |
На воздухе быстро образуются защитные оксидные плёнки. При нагревании до 500°С самовоспламеняются. Примеры: – 2Mg + O2 → 2MgO; – 2Ca + O2 → 2CaO |
|
С неметаллами |
Реагируют при нагревании с серой, водородом, фосфором: – 2K + S → K2S; – 2Na + H2 → 2NaH; – 2Cs + 5P → Cs2P5. С азотом реагирует только литий, с углеродом – литий и натрий: – 6Li + N2 → 2Li3N; – 2Na + 2C → Li2C2 |
Реагируют при нагревании: – Ca + Br2 → CaBr2; – Be + Cl2 → BeCl2; – Mg + S → MgS; – 3Ca + 2P → Ca3P2; – Sr + H2 → SrH2 |
|
С галогенами |
Бурно реагируют с образованием галогенидов: 2Na + Cl2→ 2NaCl |
|
|
С водой |
Образуются щёлочи. Чем ниже металл расположен в группе, тем более активно протекает реакция. Литий взаимодействует спокойно, натрий горит жёлтым пламенем, калий – со вспышкой, цезий и рубидий взрываются. Примеры: – 2Na + 2H2O → 2NaOH + H2↑; – 2Li + 2H2O → 2LiOH + H2↑ |
Менее активно, чем щелочные металлы, реагируют при комнатной температуре: – Mg + 2H2O → Mg(OH)2 + H2; – Ca + 2H2O → Ca(OH)2 + H2 |
|
С кислотами |
Со слабыми и разбавленными кислотами реагируют с взрывом. С органическими кислотами образуют соли. Примеры: – 8K + 10HNO3 (конц) → 8KNO3 + N2O + 5H2O; – 8Na + 5H2SO4 (конц) → 4Na2SO4 + H2S↑ + 4H2O; – 10Na + 12HNO3 (разб) → N2 + 10NaNO3 + 6H2O; – 2Na + 2CH3COOH → 2CH3COONa + H2↑ |
Образуют соли: – 4Sr + 5HNO3 (конц) → 4Sr(NO3)2 + N2O +4H2O; – 4Ca + 10H2SO4 (конц) → 4CaSO4 + H2S↑ + 5H2O |
|
Со щелочами |
– |
Из всех металлов реагирует только бериллий: Be + 2NaOH + 2H2O → Na2[Be(OH)4] + H2 |
|
С оксидами |
– |
Вступают в реакцию все металлы, кроме бериллия. Замещают менее активные металлы: 2Mg + ZrO2 → Zr + 2MgO |
Щелочные и щелочноземельные металлы можно обнаружить с помощью качественной реакции. При горении металлы окрашиваются в определённый цвет. Например, натрий горит жёлтым пламенем, калий – фиолетовым, барий – светло-зелёным, кальций – тёмно-оранжевым.
Что мы узнали?
Щелочные и щелочноземельные – наиболее активные металлы. Это мягкие простые вещества серого или серебристого цвета с небольшой плотностью. Литий, натрий, калий плавают на поверхности воды. Щелочноземельные металлы более твёрдые и плотные, чем щелочные. На воздухе быстро окисляются. Щелочные металлы образуют надпероксиды и пероксиды, оксид образует только литий. Бурно реагируют с водой при комнатной температуре. С неметаллами реагируют при нагревании. Щелочноземельные металлы вступают в реакцию с оксидами, вытесняя менее активные металлы. Со щелочами реагирует только бериллий .
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Светлана-Анатольевна Мамахай
9/10
-
Ахмед Магомедов
7/10
-
Veronika Nechaeva
9/10
-
Лидия Маслова
10/10
-
Сергей Ефремов
8/10
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 1653.
А какая ваша оценка?
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
-
бериллий Be;
-
магний Mg;
-
кальций Ca;
-
стронций Sr;
-
барий Ba;
-
радий Ra.
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
Общая конфигурация внешнего энергетического уровня nS2:
В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
Физические свойства щелочноземельных металлов
Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
Показатели плотности и температуры плавления представлены в таблице:
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
4Ca + 5H2SO4 (конц) = 4CaSO4 + H2S + 4H2O.
С кислородом образуют реакцию горения и оксид:
2Mg + O2 = 2MgO.
Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
Mg + 2H2O = Mg(OH)2
+ H2,
Вa + 2H2O = Вa(OH)2
+ H2.
Также реагируют с неметаллами:
Bа + Cl2 = BаCl2
— хлорид бериллия;
Ca + Br2 = CaBr2
— бромид кальция;
Sr + H2 = SrH2
— гидрид стронция.
Химические свойства щелочноземельных металлов показаны на картинке:
Нахождение в природе
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.
Способ получения
Магний, кальций и стронций получают электролизом расплавов солей.
Барий получают с помощью восстановления оксида.
При нагревании фторида бария получают сам металл.
Качественные реакции
Одна из качественных реакций-окрашивание пламени.
Список возможных цветов пламени при нагревании данных элементов:
Ca — темно-оранжевый;
Sr — насыщенный красный;
Ba – светло-зеленый или классический зеленый.
Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
Применение щелочноземельных металлов
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Щелочноземельными металлами называют (4) химических элемента (I)(I)(A) группы Периодической системы Д. И. Менделеева.
Электронное строение атомов
На внешнем энергетическом уровне атомы металлов (IIA) группы имеют два электрона.
Поэтому для всех щелочноземельных металлов характерна степень окисления (+2).
Этим объясняется сходство их свойств.
Для металлов (I)(I)(A) группы (сверху вниз) характерно:
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Из щелочноземельных металлов кальций наиболее широко распространён в природе, а радиоактивный радий — менее всего.
Все щелочноземельные металлы обладают высокой химической активностью, поэтому встречаются в природе только в виде соединений.
Основными источниками кальция являются его карбонаты
CaCO3
(мел, мрамор, известняк).
В свободном виде простые вещества представляют собой типичные металлы от серого до серебристого цвета.
Физические свойства простых веществ
В твёрдом агрегатном состоянии атомы связаны металлической связью. Это обусловливает общие физические свойства простых веществ металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
Тем не менее, металлы (I)(I)(A) группы имеют разные значения температуры плавления, плотности и других физических свойств.
Щелочноземельные металлы обладают высокой химической активностью, реагируют с кислородом, водородом, другими неметаллами, оксидами, кислотами, солями.
Они являются сильными восстановителями.
Щелочноземельные металлы активно реагируют с:
водой, образуя соответствующие гидроксиды и выделяя водород:
кислотами, легко растворяясь в их растворах с образованием соответствующих солей:
с неметаллами, образуя оксиды или соответствующие соли (гидриды, галогениды, сульфиды и др.):
Щелочноземельные металлы получают в основном электролизом расплавов галогенидов. Чаще используются хлориды металлов.
При этом на катоде восстанавливаются катионы, а на аноде окисляются анионы.
Суммарное уравнение реакции электролиза расплава хлорида кальция:

![{mathsf {Be+2OH^{-}+2H_{2}Orightarrow [Be(OH)_{4}]^{{2-}}+H_{2}uparrow }}](https://wikimedia.org/api/rest_v1/media/math/render/svg/73ca4bd64e34fb71f93cb1a4146c83f887726af6)




![{displaystyle {mathsf {BeO+2NaOH+H_{2}Olongrightarrow Na_{2}[Be(OH)_{4}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/010487de23e1f10ba7c633706113d05ba82e4358)












![{mathsf {Ba(OH)_{2}+Zn(OH)_{2}longrightarrow Ba[Zn(OH)_{4}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e188e6bfb7f55a0c1f331ca23ea59ab624b2d853)