- 09.09.2012
Подрборка шпаргалок по ХИМИИ.
Дата обновления: 01.11.2022
Полный набор теоретического материала для подготовки к ЕГЭ. Таблицы, схемы, формулы, теория. Всё, что необходимо для самостоятельной работы по химии.
- Тренировочные варианты ЕГЭ по химии
Что содержите в себе сборник шпаргалок по химии
- Все темы по химии в таблицах и схемах
- Полезности для ЕГЭ по химии
- Вся химия на 3 листах – краткий курс
- Теория по химии в картинках
- Шпаргалки по химииОгромная шпаргалка по химии
Для чтения шпаргалок необходимы бесплатные программы: WinDJView и Adobe Reader
СКАЧАТЬ
https://down.ctege.info/ege/obshee/shpory/himiya-ege-shpora.zip

Таблицы DPVA.ru – Инженерный Справочник
Адрес этой страницы (вложенность) в справочнике dpva.ru: 
Шпаргалки по химии.
Шпаргалки по химии Шпаргалки по физике / Шпаргалки по математике, алгебре, геометрииХимия неметаллов. Галогены. Сера. Азот. Углерод. Инертные газы
|
||||||||||||||||||||||||||||||||||||||||||||||||
|
Поиск в инженерном справочнике DPVA. Введите свой запрос: |
Поиск в инженерном справочнике DPVA. Введите свой запрос:
Если Вы не обнаружили себя в списке поставщиков, заметили ошибку, или у Вас есть дополнительные численные данные для коллег по теме, сообщите , пожалуйста.
Вложите в письмо ссылку на страницу с ошибкой, пожалуйста.
Коды баннеров проекта DPVA.ru
Начинка: KJR Publisiers
Консультации и техническая
поддержка сайта: Zavarka Team
Free xml sitemap generator
Алгоритм решения задач по расчётным уравнениям
- Составить уравнение реакции: в левой части записать вещества,
вступающие в реакцию(реагенты), в правой – получающиеся(продукты
реакции). Уравнять. - Над формулами записать все известные данные и через х обозначить
неизвестное, которое надо найти. Под формулами записать количество
веществ по уравнению – оно численно равно коэффициентам этих веществ. - Если в задаче идёт речь о примесях или концентрации раствора, то над
уравнением укажите массовую ( или объёмную долю) чистого
вещества. Если речь шла о примесях: то отнимите от 100 % процент примесей. Если была дана концентрация раствора, то берётся цифра концентрации.Проценты переведите в доли – разделите % на 100. Первым действием найдите массу ( или объём) чистого вещества: тв-ва =ω* тсмеси Vв-ва =φ * Vсмеси - Массу (объём) чистого вещества переведите в моли ( киломоли, милимоли) по формуле: n = m / M n = V / Vm
- Составьте и решите пропорцию – найдёте количество неизвестного вещества.
- Если требуется определить массу или объём неизвестного вещества, то
количество вещества переведите в граммы ( килограммы,
миллиграммы) или литры ( кубометры, миллилитры) по формуле: m = n * M V = n * Vm - Если искомое вещество входило в состав смеси и надо определить её массу или объём, то найдите их по формуле тсмеси = тв-ва / ω Vсмеси =Vв-ва / φ
- Если дан выход продукта реакции W, то надо найти практический выход по формуле:
Vпракт = V теорет * W W = Vпракт V теорет
Алгоритм решения задач по расчётным уравнениям
- Составить уравнение реакции: в левой части записать вещества,
вступающие в реакцию(реагенты), в правой – получающиеся(продукты
реакции). Уравнять. - Над формулами записать все известные данные и через х обозначить
неизвестное, которое надо найти. Под формулами записать количество
веществ по уравнению – оно численно равно коэффициентам этих веществ. - Если в задаче идёт речь о примесях или концентрации раствора, то над
уравнением укажите массовую ( или объёмную долю) чистого
вещества. Если речь шла о примесях: то отнимите от 100 % процент примесей. Если была дана концентрация раствора, то берётся цифра концентрации.Проценты переведите в доли – разделите % на 100. Первым действием найдите массу ( или объём) чистого вещества: тв-ва =ω* тсмеси Vв-ва =φ * Vсмеси - Массу (объём) чистого вещества переведите в моли ( киломоли, милимоли) по формуле: n = m / M n = V / Vm
- Составьте и решите пропорцию – найдёте количество неизвестного вещества.
- Если требуется определить массу или объём неизвестного вещества, то
количество вещества переведите в граммы ( килограммы,
миллиграммы) или литры ( кубометры, миллилитры) по формуле: m = n * M V = n * Vm - Если искомое вещество входило в состав смеси и надо определить её массу или объём, то найдите их по формуле тсмеси = тв-ва / ω Vсмеси =Vв-ва / φ
- Если дан выход продукта реакции W, то надо найти практический выход по формуле:
Vпракт = V теорет * W W = Vпракт V теорет
Фамилия____________________________
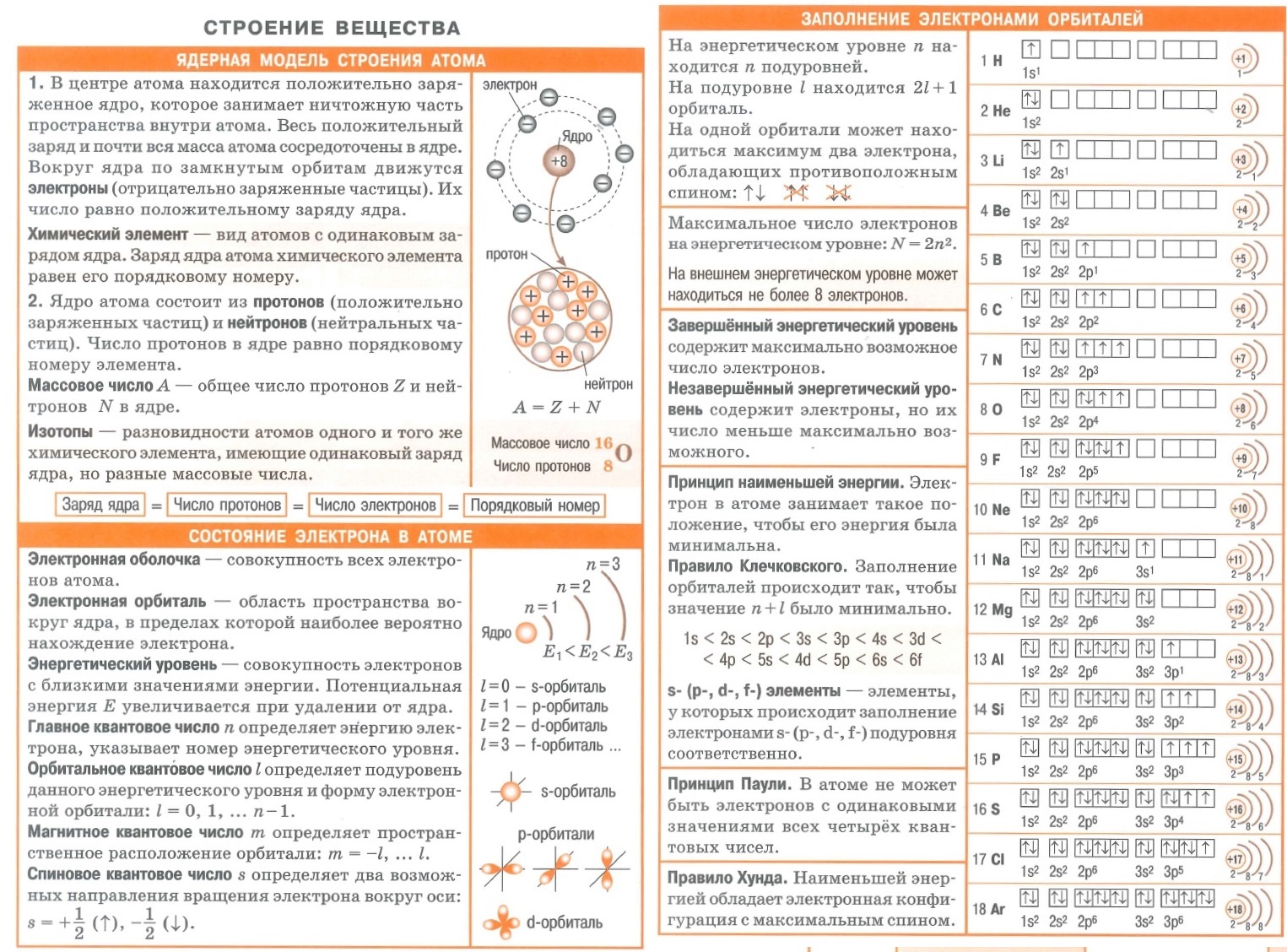
Шпаргалка по теме Строение атома
1. Атом – _______________________________________частица
Атом состоит из _________________________________ и
2. Ядро атома состоит из ______________________________________________
Протоны имеют заряд _________________ и массу_____________________, их число равно______________________________________________________
Нейтроны имеют заряд __________и массу_____________________, их число равно_____________________________________________
3. Электронная оболочка состоит из ________________________________, которые имеют заряд _______________ и массу_______________________. Их число равно________________________________
4. Электроны в атоме располагаются на энергетических ( электронных уровнях), число которых равно__________________________________________
Максимально возможное число электронов на первом энергетическом уровне равно числу химических элементов 1 периода, т.е. _________, на втором уровне _________, на третьем уровне________________.
5. Число электронов на внешнем ( последнем) энергетическом уровне равно _____________________________________________________________, т.е. для элементов 1 группы равно__________, второй __________ и т.д.
6. Последний ( внешний) уровень будет завершён, если на нём будет максимально возможное число электронов, например, на первом_____________, на втором ___________, на третьем_____________.
Фамилия____________________________
Шпаргалка по теме Строение атома
1. Атом – _______________________________________частица
Атом состоит из _________________________________ и
2. Ядро атома состоит из ______________________________________________
Протоны имеют заряд _________________ и массу_____________________, их число равно______________________________________________________
Нейтроны имеют заряд __________и массу_____________________, их число равно_____________________________________________
3. Электронная оболочка состоит из ________________________________, кторые имеют заряд _______________ и массу_______________________. Их число равно________________________________
4. Электроны в атоме располагаются на энергетических ( электронных уровнях), число которых равно__________________________________________
Максимально возможное число электронов на первом энергетическом уровне равно числу химических элементов 1 периода, т.е. _________, на втором уровне _________, на третьем уровне________________.
5. Число электронов на внешнем ( последнем) энергетическом уровне равно _____________________________________________________________, т.е. для элементов 1 группы равно__________, второй __________ и т.д.
6. Последний ( внешний) уровень будет завершён, если на нём будет максимально возможное число электронов, например, на первом_____________, на втором ___________, на третьем_____________.
Распределение электронов по энергетическим уровням можно представить в виде графических формул и электронных.
Графическая формула атома водорода:
Лития:
Аргона:
Электронная формула атома водорода:
Лития:
Аргона
Распределение электронов по энергетическим уровням можно представить в виде графических формул и электронных.
Графическая формула атома водорода:
Лития:
Аргона:
Электронная формула атома водорода:
Лития:
Аргона
Фамилия____________________________
Шпаргалка по теме «Количество вещества»
1. Количество вещества обозначается буквой_________
и измеряется в ______________________________
1 моль – это такое количество вещества, в котором содержится __________________молекул, или атомов, или ионов.
Это число_____________называется______________________
и обозначается __________
Просто любое число частиц (____________________________) обозначается буквой ______________
2. Масса обозначается буквой__________________ и измеряется в __________________
3. Масса 1 моля любого вещества называется молярная масса, обозначается буквой________________ и измеряется в
______________________________.
Чтобы определить молярную массу, надо по формуле вещества рассчитать его молекулярную массу, пользуясь ПСХЭ.
4. Для газообразных веществ объём 1 моля любого газа величина постоянная, он равен 22, 4 л моль (только для газов!)
5. Существуют три формулы для расчёта количество вещества:
Через число частиц:
Через массу:
Через объём ( для газов)
Фамилия____________________________
Шпаргалка по теме «Количество вещества»
1. Количество вещества обозначается буквой_________
и измеряется в ______________________________
1 моль – это такое количество вещества, в котором содержится __________________молекул, или атомов, или ионов.
Это число_____________называется______________________
и обозначается __________
Просто любое число частиц (____________________________) обозначается буквой ______________
2. Масса обозначается буквой__________________ и измеряется в __________________
3. Масса 1 моля любого вещества называется молярная масса, обозначается буквой________________ и измеряется в
______________________________.
Чтобы определить молярную массу, надо по формуле вещества рассчитать его молекулярную массу, пользуясь ПСХЭ.
4. Для газообразных веществ объём 1 моля любого газа величина постоянная, он равен 22, 4 л моль (только для газов!)
5. Существуют три формулы для расчёта количество вещества:
Через число частиц:
Через массу:
Через объём ( для газов)
- Если известно количество вещества, но надо определить:
– общее число частиц
– массу вещества
– объём газообразного вещества
- Если известно общее число частиц, но надо определить:
– массу вещества
– объём вещества
- Если известна масса вещества, но надо определить:
– число частиц вещества
– объём вещества
- Если известен объём газообразного вещества, но надо определить:
– число частиц вещества
– массу вещества
- Если известно количество вещества, но надо определить:
– общее число частиц
– массу вещества
– объём газообразного вещества
- Если известно общее число частиц, но надо определить:
– массу вещества
– объём вещества
- Если известна масса вещества, но надо определить:
– число частиц вещества
– объём вещества
- Если известен объём газообразного вещества, но надо определить:
– число частиц вещества
– массу вещества
Фамилия____________________________
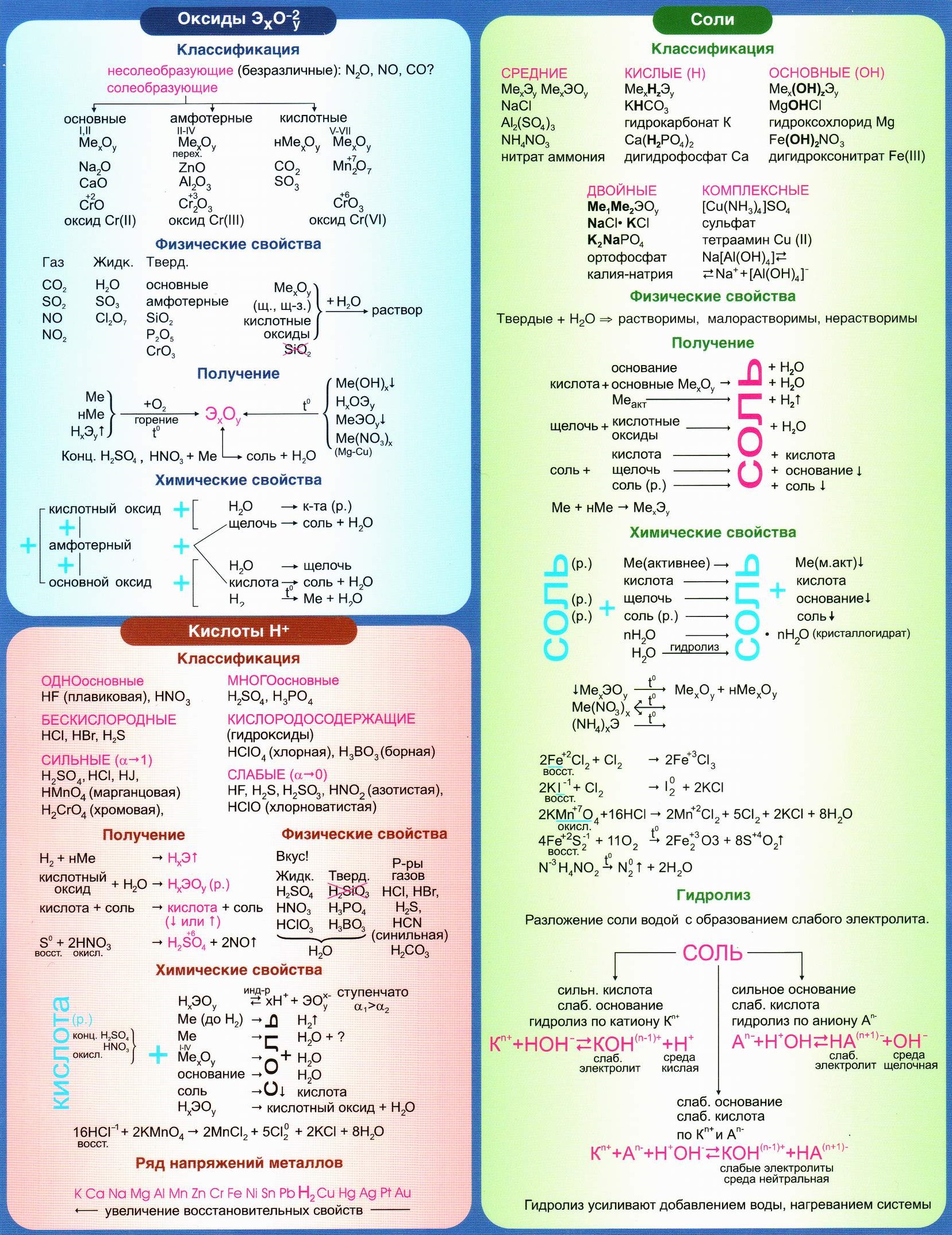
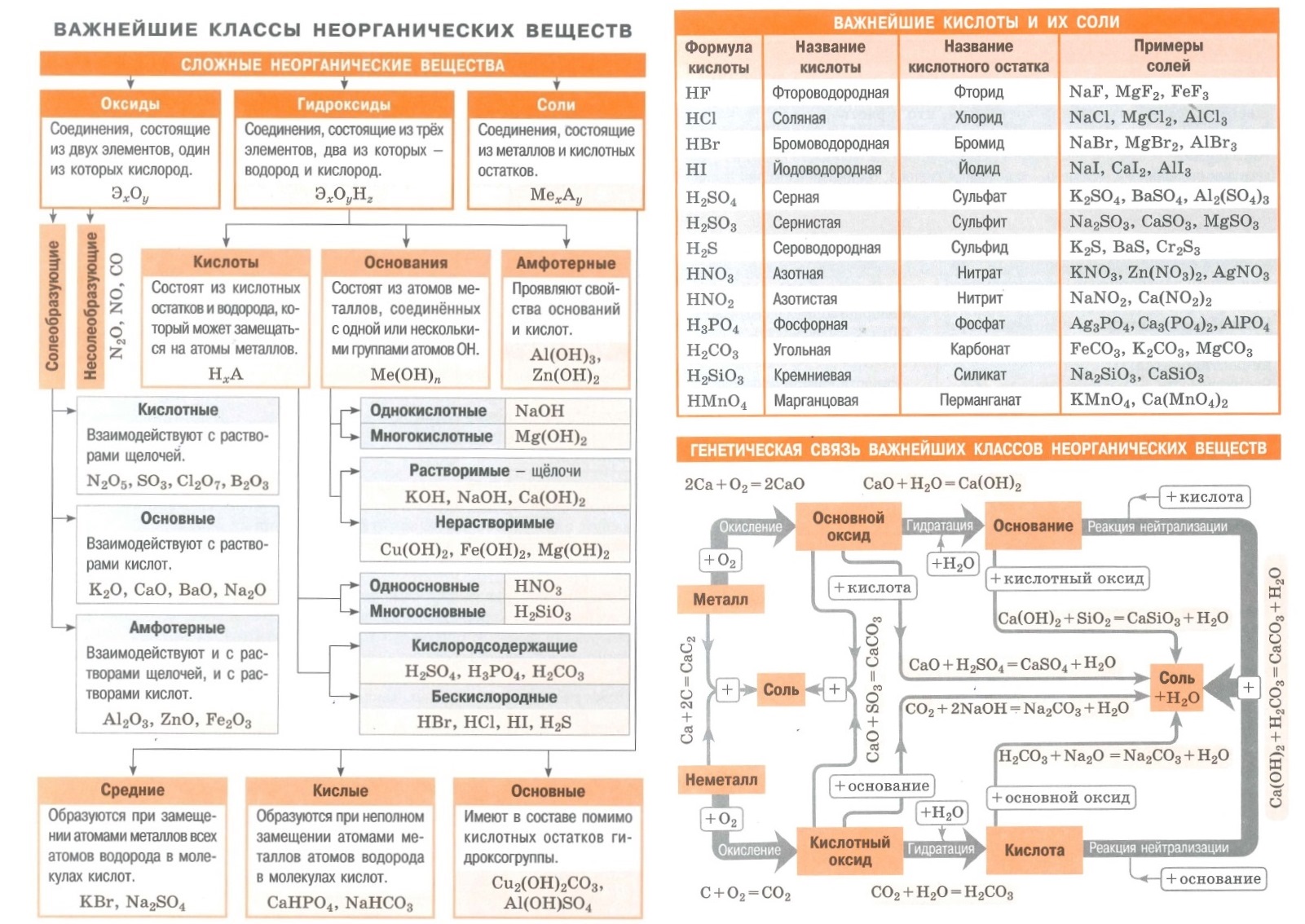
Основные классы неорганических соединений.
1. Оксиды.
Закончи определение: Оксиды – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы оксидов:
AuNO2 H2SO4 NaOH KF Na2O CaO H2CO3
H2SiO3 HNO2 HI AlPO4 Fe(NO3 )3 SO3
Выпиши эти формулы и дай название каждому оксиду: название начинается со слова оксид + название первого элемента в формуле в родительном падеже + степень окисления этого элемента. ( степень окисления не надо указывать только у металлов 1, 2, 3 группы главной подгруппы – у всех остальных надо. Для этого поставь сначала степень окисления кислорода – она всегда = – 2. Подсчитай, сколько всего в молекуле отрицательных зарядов – умножь -2 на количество атомов кислорода в формуле(индекс кислорода). Столько же у тебя должно быть и положительных зарядов. Раздели полученное число на индекс другого элемента – и ты получишь его степень окисления со знаком +).
Составь формулу оксида по названию: на первом месте запиши символ элемента, который стоит вторым в названии, рядом запиши кислород. Поставь степень окисления кислорода -2, а у элемента или та цифра, которая указана в названии римской или № группы, где он находится со знаком +. Теперь подумай, какие индексы поставить и элементу и кислороду, чтобы суммарное количество положительных и отрицательных зарядов было равно 0, т.е. количество (+) и (-) должно быть одинаковым. При этом степень окисления умножается на индекс, т.е. количество атомов.
Оксид азота (V) оксид кальция
Оксид железа (II) оксид кремния (IV)
Оксид калия оксид магния
2. Основания.
Закончи определение: Основания –это_____________________
______________________________________________________
В приведённом списке подчеркни формулы оснований:
AuNO2 H2SO4 NaOH KF Na2O Cа(OH)2 H2CO3
H2SiO3 HNO2 HI AlPO4 Fe(OH)3 SO3
Выпиши эти формулы и дай название каждому основанию: название начинается со слова гидроксид + название металла в родительном падеже + степень окисления металла. ( степень окисления не надо указывать только у металлов 1, 2, 3 группы главной подгруппы – у всех остальных надо. Для этого поставь сначала заряд гидроксид – иона ОН, он всегда равен -1 или просто (-). Тогда сколько гидроксид – ионов в формуле, такая и степень окисления (заряд иона) металла со знаком +).
Составь формулу основания по названию: на первом месте запиши символ элемента, который стоит вторым в названии, рядом запиши гидроксид – ион ОН. Поставь заряд гидроксид – иона -1, а у металла или та цифра, которая указана в названии римской или № группы, где он находится со знаком +. Теперь поставь всему гидроксид – иону такой индекс, чему равна степень окисления (заряд иона) металла. Если степень окисления равна +1, то никаких индексов гидроксид – иону не ставь.)
Гидроксид натрия гидроксид бария
Гидроксид железа(III) гидроксид меди(II) Гидроксид цинка гидроксид марганца(II)
3. Кислоты.
Закончи определение: Кислоты – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы кислот:
AuNO2 H2SO4 NaOH KF Na2O CaO H2CO3
H2SiO3 HNO2 HI AlPO4 Fe(NO3 )3
Выпиши эти формулы и дай название каждой кислоте. Воспользуйся информацией п.20, 21, заданиями рабочей тетради.
____________________________________________________________
Запиши формулы следующих кислот, укажи заряд кислотного остатка:
Серная кислота
Азотная кислота
Сероводородная кислота
Фосфорная кислота
Перепиши ещё раз формулы этих кислот и рассчитай для каждой кислоты степень окисления каждого атома в формуле: степень окисления водорода +1, кислорода -2, обозначь степень окисления неизвестного элемента за х и приравняй общее число зарядов к 0. найди х. ( см. задания в тетради по теме кислоты)
4. Соли.
Закончи определение: Соли – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы солей:
AuNO2 H2SO4 NaOH KF Na2O CaO H2CO3
H2SiO3 HNO2 HI AlPO4 Fe(NO3 )3
Выпиши эти формулы и дай название каждой соли. Воспользуйся информацией п. 21, таблица 5, заданиями рабочей тетради.
В названии соли на первом месте стоит название кислотного остатка + название металла в родительном падеже + степень окисления металла ( если надо).
Запиши формулы солей по названию: на первое место запиши символ металла, на второе кислотный остаток, название которого стоит первым ( см. таблицу 5 учебника). Поставь степень окисления металла( римская цифра в названии или № группы, где он стоит), поставь заряд иона кислотного остатка ( найди в таблице растворимости). Теперь подумай, какие индексы надо поставить металлу и всему кислотному остатку, чтобы суммарное количество (=) и (-) зарядов было равно 0, т.е. количество (+) должно равняться количеству (-). При подсчёте общего количества зарядо степень окисления (заряд иона) умножается на индекс ( количество атомов или ионов)
Сульфат натрия нитрат железа (III)
Хлорид серебра (I ) сульфид кальция
Нитрит меди (II) карбонат магния
Фамилия____________________________
Основные классы неорганических соединений.
1. Оксиды.
Закончи определение: Оксиды – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы оксидов:
LiOH Na2SiO3 K2S Li2O N2O5 SnF 2
CO Ca(OH)2 Li2CO3 CuSiO3 P2O3 CaCO3
Выпиши эти формулы и дай название каждому оксиду: название начинается со слова оксид + название первого элемента в формуле в родительном падеже + степень окисления этого элемента. ( степень окисления не надо указывать только у металлов 1, 2, 3 группы главной подгруппы – у всех остальных надо. Для этого поставь сначала степень окисления кислорода – она всегда = – 2. Подсчитай, сколько всего в молекуле отрицательных зарядов – умножь -2 на количество атомов кислорода в формуле(индекс кислорода). Столько же у тебя должно быть и положительных зарядов. Раздели полученное число на индекс другого элемента – и ты получишь его степень окисления со знаком +).
Составь формулу оксида по названию: на первом месте запиши символ элемента, который стоит вторым в названии, рядом запиши кислород. Поставь степень окисления кислорода -2, а у элемента или та цифра, которая указана в названии римской или № группы, где он находится со знаком +. Теперь подумай, какие индексы поставить и элементу и кислороду, чтобы суммарное количество положительных и отрицательных зарядов было равно 0, т.е. количество (+) и (-) должно быть одинаковым. При этом степень окисления умножается на индекс, т.е. количество атомов.
Оксид фосфора (V) оксид натрия
Оксид меди (II) оксид кремния (IV)
Оксид кальция оксид магния
2. Основания.
Закончи определение: Основания – это_____________________
______________________________________________________
В приведённом списке подчеркни формулы оснований:
LiOH Na2SiO3 KОН Li2O N2O5 SnF 2
CO Ca(OH)2 Li2CO3 CuSiO3 P2O3 CaCO3
Выпиши эти формулы и дай название каждому основанию: название начинается со слова гидроксид + название металла в родительном падеже + степень окисления металла. ( степень окисления не надо указывать только у металлов 1, 2, 3 группы главной подгруппы – у всех остальных надо. Для этого поставь сначала заряд гидроксид – иона ОН, он всегда равен -1 или просто (-). Тогда сколько гидроксид – ионов в формуле, такая и степень окисления (заряд иона) металла со знаком +).
Составь формулу основания по названию: на первом месте запиши символ элемента, который стоит вторым в названии, рядом запиши гидроксид – ион ОН. Поставь заряд гидроксид – иона -1, а у металла или та цифра, которая указана в названии римской или № группы, где он находится со знаком +. Теперь поставь всему гидроксид – иону такой индекс, чему равна степень окисления (заряд иона) металла. Если степень окисления равна +1, то никаких индексов гидроксид – иону не ставь.)
Гидроксид лития гидроксид калия
Гидроксид хрома (III) гидроксид железа (II) Гидроксид бария гидроксид кобальта (II)
3. Кислоты.
Закончи определение: Кислоты – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы кислот:
LiOH Na2SiO3 Н2S Li2O N2O5 SnF 2
CO Ca(OH)2 Н2CO3 CuSiO3 Н 3PO4 CaCO3
Выпиши эти формулы и дай название каждой кислоте. Воспользуйся информацией п.20, 21, заданиями рабочей тетради.
____________________________________________________________
Запиши формулы следующих кислот, укажи заряд кислотного остатка:
Сернистая кислота
Азотная кислота
фтороводородная кислота
кремниевая кислота
Перепиши ещё раз формулы этих кислот и рассчитай для каждой кислоты степень окисления каждого атома в формуле: степень окисления водорода +1, кислорода -2, обозначь степень окисления неизвестного элемента за х и приравняй общее число зарядов к 0. найди х. ( см. задания в тетради по теме кислоты)
4. Соли.
Закончи определение: Соли – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы солей:
LiOH Na2SiO3 K2S Li2O N2O5 SnF 2
CO Ca(OH)2 Li2CO3 CuSiO3 P2O3 CaCO3
Выпиши эти формулы и дай название каждой соли. Воспользуйся информацией п. 21, таблица 5, заданиями рабочей тетради.
В названии соли на первом месте стоит название кислотного остатка + название металла в родительном падеже + степень окисления металла ( если надо).
Запиши формулы солей по названию: на первое место запиши символ металла, на второе кислотный остаток, название которого стоит первым ( см. таблицу 5 учебника). Поставь степень окисления металла( римская цифра в названии или № группы, где он стоит), поставь заряд иона кислотного остатка ( найди в таблице растворимости). Теперь подумай, какие индексы надо поставить металлу и всему кислотному остатку, чтобы суммарное количество (=) и (-) зарядов было равно 0, т.е. количество (+) должно равняться количеству (-). При подсчёте общего количества зарядо степень окисления (заряд иона) умножается на индекс ( количество атомов или ионов)
Сульфат кальция нитрат хрома (III)
Хлорид золота (I) сульфид алюминия
Нитрат меди (II) карбонат калия
Фамилия____________________________
Основные классы неорганических соединений.
1. Оксиды.
Закончи определение: Оксиды – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы оксидов:
PbCl4 HF K2SO4 NaI Fe(OH)2 AlBr3
HgО Cu(OH)2 CO2 SO3 AgNO3 H2SO3
Выпиши эти формулы и дай название каждому оксиду: название начинается со слова оксид + название первого элемента в формуле в родительном падеже + степень окисления этого элемента. ( степень окисления не надо указывать только у металлов 1, 2, 3 группы главной подгруппы – у всех остальных надо. Для этого поставь сначала степень окисления кислорода – она всегда = – 2. Подсчитай, сколько всего в молекуле отрицательных зарядов – умножь -2 на количество атомов кислорода в формуле(индекс кислорода). Столько же у тебя должно быть и положительных зарядов. Раздели полученное число на индекс другого элемента – и ты получишь его степень окисления со знаком +).
Составь формулу оксида по названию: на первом месте запиши символ элемента, который стоит вторым в названии, рядом запиши кислород. Поставь степень окисления кислорода -2, а у элемента или та цифра, которая указана в названии римской или № группы, где он находится со знаком +. Теперь подумай, какие индексы поставить и элементу и кислороду, чтобы суммарное количество положительных и отрицательных зарядов было равно 0, т.е. количество (+) и (-) должно быть одинаковым. При этом степень окисления умножается на индекс, т.е. количество атомов.
Оксид мышьяка (V) оксид стронция
Оксид марганца (II) оксид углерода (IV)
Оксид лития оксид алюминия
2. Основания.
Закончи определение: Основания – это_____________________
______________________________________________________
В приведённом списке подчеркни формулы оснований:
PbCl4 HF K2SO4 NaI Fe(OH)2 AlBr3
HgI 2 Cu(OH)2 CO2 SO3 AgОН H2SO3
Выпиши эти формулы и дай название каждому основанию: название начинается со слова гидроксид + название металла в родительном падеже + степень окисления металла. ( степень окисления не надо указывать только у металлов 1, 2, 3 группы главной подгруппы – у всех остальных надо. Для этого поставь сначала заряд гидроксид – иона ОН, он всегда равен -1 или просто (-). Тогда сколько гидроксид – ионов в формуле, такая и степень окисления (заряд иона) металла со знаком +).
Составь формулу основания по названию: на первом месте запиши символ элемента, который стоит вторым в названии, рядом запиши гидроксид – ион ОН. Поставь заряд гидроксид – иона -1, а у металла или та цифра, которая указана в названии римской или № группы, где он находится со знаком +. Теперь поставь всему гидроксид – иону такой индекс, чему равна степень окисления (заряд иона) металла. Если степень окисления равна +1, то никаких индексов гидроксид – иону не ставь.)
Гидроксид цинка гидроксид цезия
Гидроксид железа (III) гидроксид железа (II) Гидроксид кальция гидроксид титана (II)
3. Кислоты.
Закончи определение: Кислоты – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы кислот:
PbCl4 HF K2SO4 NaI Fe(OH)2 AlBr3
HgI 2 Cu(OH)2 Н 2CO3 SO3 AgNO3 H2SO3
Выпиши эти формулы и дай название каждой кислоте. Воспользуйся информацией п.20, 21, заданиями рабочей тетради.
____________________________________________________________
Запиши формулы следующих кислот, укажи заряд кислотного остатка:
Сероводородная кислота
Азотистая кислота
бромоводородная кислота
угольная кислота
Перепиши ещё раз формулы этих кислот и рассчитай для каждой кислоты степень окисления каждого атома в формуле: степень окисления водорода +1, кислорода -2, обозначь степень окисления неизвестного элемента за х и приравняй общее число зарядов к 0. найди х. ( см. задания в тетради по теме кислоты)
4. Соли.
Закончи определение: Соли – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы солей:
PbCl4 HF K2SO4 NaI Fe(OH)2 AlBr3
HgI 2 Cu(OH)2 CO2 SO3 AgNO3 H2SO3
Выпиши эти формулы и дай название каждой соли. Воспользуйся информацией п. 21, таблица 5, заданиями рабочей тетради.
В названии соли на первом месте стоит название кислотного остатка + название металла в родительном падеже + степень окисления металла ( если надо).
Запиши формулы солей по названию: на первое место запиши символ металла, на второе кислотный остаток, название которого стоит первым ( см. таблицу 5 учебника). Поставь степень окисления металла( римская цифра в названии или № группы, где он стоит), поставь заряд иона кислотного остатка ( найди в таблице растворимости). Теперь подумай, какие индексы надо поставить металлу и всему кислотному остатку, чтобы суммарное количество (=) и (-) зарядов было равно 0, т.е. количество (+) должно равняться количеству (-). При подсчёте общего количества зарядо степень окисления (заряд иона) умножается на индекс ( количество атомов или ионов)
Фосфат кальция сульфит хрома (III)
Нитрат золота (I) хлорид алюминия
Бромид меди (II) силикат калия
Фамилия____________________________
Основные классы неорганических соединений.
1. Оксиды.
Закончи определение: Оксиды – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы оксидов:
FeO SO3 KOH BaO H2S Ba(OH)2
HCl K2O Fe2O3 K3PO4 H3PO4 CaS
Выпиши эти формулы и дай название каждому оксиду: название начинается со слова оксид + название первого элемента в формуле в родительном падеже + степень окисления этого элемента. ( степень окисления не надо указывать только у металлов 1, 2, 3 группы главной подгруппы – у всех остальных надо. Для этого поставь сначала степень окисления кислорода – она всегда = – 2. Подсчитай, сколько всего в молекуле отрицательных зарядов – умножь -2 на количество атомов кислорода в формуле(индекс кислорода). Столько же у тебя должно быть и положительных зарядов. Раздели полученное число на индекс другого элемента – и ты получишь его степень окисления со знаком +).
Составь формулу оксида по названию: на первом месте запиши символ элемента, который стоит вторым в названии, рядом запиши кислород. Поставь степень окисления кислорода -2, а у элемента или та цифра, которая указана в названии римской или № группы, где он находится со знаком +. Теперь подумай, какие индексы поставить и элементу и кислороду, чтобы суммарное количество положительных и отрицательных зарядов было равно 0, т.е. количество (+) и (-) должно быть одинаковым. При этом степень окисления умножается на индекс, т.е. количество атомов.
Оксид бериллия оксид свинца (IV)
Оксид рубидия оксид золота(III)
Оксид лития оксид серы (VI)
2. Основания.
Закончи определение: Основания – это_____________________
______________________________________________________
В приведённом списке подчеркни формулы оснований:
Fe(OН)2 SO3 KOH BaO H2S Ba(OH)2
HCl K2O Fe2O3 K3PO4 H3PO4 CaS
Выпиши эти формулы и дай название каждому основанию: название начинается со слова гидроксид + название металла в родительном падеже + степень окисления металла. ( степень окисления не надо указывать только у металлов 1, 2, 3 группы главной подгруппы – у всех остальных надо. Для этого поставь сначала заряд гидроксид – иона ОН, он всегда равен -1 или просто (-). Тогда сколько гидроксид – ионов в формуле, такая и степень окисления (заряд иона) металла со знаком +).
Составь формулу основания по названию: на первом месте запиши символ элемента, который стоит вторым в названии, рядом запиши гидроксид – ион ОН. Поставь заряд гидроксид – иона -1, а у металла или та цифра, которая указана в названии римской или № группы, где он находится со знаком +. Теперь поставь всему гидроксид – иону такой индекс, чему равна степень окисления (заряд иона) металла. Если степень окисления равна +1, то никаких индексов гидроксид – иону не ставь.)
Гидроксид калия гидроксид бария
Гидроксид железа (III) гидроксид олова (II) Гидроксид алюминия гидроксид ртути (II)
3. Кислоты.
Закончи определение: Кислоты – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы кислот:
FeO SO3 KOH BaO H2S Ba(OH)2
HCl K2O Fe2O3 K3PO4 H3PO4 CaS
Выпиши эти формулы и дай название каждой кислоте. Воспользуйся информацией п.20, 21, заданиями рабочей тетради.
____________________________________________________________
Запиши формулы следующих кислот, укажи заряд кислотного остатка:
Серная кислота
Азотистая кислота
Иодоводородная кислота
Азотная кислота
Перепиши ещё раз формулы этих кислот и рассчитай для каждой кислоты степень окисления каждого атома в формуле: степень окисления водорода +1, кислорода -2, обозначь степень окисления неизвестного элемента за х и приравняй общее число зарядов к 0. найди х. ( см. задания в тетради по теме кислоты)
4. Соли.
Закончи определение: Соли – это____________________________
___________________________________________________________
В приведённом списке подчеркни формулы солей:
FeO SO3 KOH BaO H2S Ba(OH)2
HCl K2O Fe2O3 K3PO4 H3PO4 CaS
Выпиши эти формулы и дай название каждой соли. Воспользуйся информацией п. 21, таблица 5, заданиями рабочей тетради.
В названии соли на первом месте стоит название кислотного остатка + название металла в родительном падеже + степень окисления металла ( если надо).
Запиши формулы солей по названию: на первое место запиши символ металла, на второе кислотный остаток, название которого стоит первым ( см. таблицу 5 учебника). Поставь степень окисления металла( римская цифра в названии или № группы, где он стоит), поставь заряд иона кислотного остатка ( найди в таблице растворимости). Теперь подумай, какие индексы надо поставить металлу и всему кислотному остатку, чтобы суммарное количество (=) и (-) зарядов было равно 0, т.е. количество (+) должно равняться количеству (-). При подсчёте общего количества зарядо степень окисления (заряд иона) умножается на индекс ( количество атомов или ионов)
Фосфат алюминия сульфат хрома (III)
Нитрат серебра (I) хлорид калия
Бромид железа (II) силикат алюминия
Химия представляет собой совокупность знаний о химических элементах, веществах, их ключевых характеристиках, строении и превращениях. Все в природе состоит из мельчайших частиц – атомов. Атомы имеют свойство объединяться в молекулы, поэтому химия занимается изучением особенностей взаимодействия атомов и молекул между собой.
Химия считается древней наукой. Зачатками практической химии можно считать эксперименты с огнем, приготовлением еды, дублением шкур и т.п. Наблюдение за процессами гниения, распада, брожения, плавления, появление первых лекарств, ядов, красок – все это относится к химии. Шпаргалки по химии содержат сведенья о том, что химия на достойном уровне была развита в Древнем Египте. Жрецы свято хранили химические тайны из области металлургии, керамики, стеклоделия, но все равно знания утекали в европейские страны. Учеными доказано, что в Древнем Египте путем восстановительно-окислительных реакций добывали медь, бронзу, железо.
Алхимия также сыграла большую роль в накоплении и сохранении химических знаний. Зародилась она в Азии, но потом набрала популярность в других странах. Алхимия строилась на накопленном ремесленном опыте и мистических представлениях. В поисках философского камня знаменитые алхимики попутно открывали новые химические элементы (сера, ртуть и др.), давали характеристики солям, проводили превращения различных веществ друг с другом. Интерес к алхимии постепенно угас, на его место встали исследования о получении золота из других металлов.
Химия как наука оформилась лишь в XVI-XVII веке в связи с громкими химическими открытиями, развитием фабрик и мануфактур. Но тогда она считалась описательной, а не количественной наукой. Только в 1869 году после открытия Д.И. Менделеевым периодического закона химических элементов и периодической таблицы химия стала считаться количественной наукой.
.
К основным терминам химии относят понятия атома, молекулы, элементарной частицы, вещество. Атомом считается мельчайшая частица химического элемента, которая имеет все его характеристики. Два и более соединившихся атома, которые могут самостоятельно существовать, представляют собой молекулы. Свойства молекул зависят от характеристик атомов, типа связи между ними и взаимного расположения. Вещество представляет собой форму материи, обладающую массой покоя. Химическая связь – это связь, которая удерживает атомы рядом друг с другом.
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Ой, как это мы позабыли о 9-х классах! Завтра уже ОГЭ по химии, а мы все ЕГЭ никак не выкашляем. Вот так всегда – ставка на сильного, впередиидущего, а все остальные просто подтягиваются.
Не торопитесь соглашаться и поддакивать. Задайтесь вопросом, как нужно изучать химию? Ежегодными кусками с повышением уровня сложности? Ребята дорогие, при таком подходе (методике) вы даже не поймете, какой предмет изучаете! Есть определенная структура (система) предмета. Ее и нужно изучать!
Я работаю репетитором более 30 лет и никогда не делила учеников на классы. Мы просто поднимаемся по ступеням системы химии или биологии. Скорость подъема (изучения предмета) определяется временем, которое имеется до защиты знаний (экзамена) – год, два или три (я не работаю с более ранним возрастом). В минигруппах учатся ребята из разных классов. Девятые и десятые классы тянутся за одиннадцатыми. Часто бывает наоборот, когда рулят девятые классы. Тогда у одиннадцатиклассников формируется стойкая мотивация на учебу – стыдно быть лузером среди мелких. Совместное участие в процессе изучения предмета и обмена опытом объединяет ребят (я бы даже сказала, духовно роднит), они начинают общаться и после занятий. Дружба продолжается во время учебы в ВУЗе, где более старшие опекают тех, кто поступил позже. Это замечательно! Ребенок, взрослея, не только изучает биологию и химию, адаптируясь к учебе в высшей школ, но и проходит стадию социализации среди более опытных сотоварищей.
Однако, я отвлеклась. Сегодня, за сутки до ОГЭ по химии, я хочу подарить своим ученикам и всем моим любимым читателям замечательную шпаргалку, которую легко можно пронести на экзамен!
– Как так?! – возмутятся в Рособрнадзоре!
– А вот так! – отвечу я.
Во-первых, это не обычная шпаргалка, а логическая схема, которая очень легко запоминается. Во-вторых, такую схему легко пронести в голове (здесь, уж точно, никакой детектор не обнаружит и камеры не просекут).
В качестве подарка хочу предложить схему изменения свойств элементов (и, соответственно, веществ) по Периодической Системе.
Основные понятия
1) Неметаллы (Н на схеме) – на внешнем (валентном) электронном уровне имеют 4-7 электронов, легко принимают электроны
С неметаллическими свойствами связаны кислотные свойства оксидов и кислородсодержащих кислот: чем активней неметалл, тем сильнее кислота (при одинаковой степени окисления элемента)
2) Металлы (М на схеме) – на внешнем (валентном) электронном уровне имеют 1-3 электрона, легко отдают электроны
С металлическими свойствами связаны основные свойства оксидов и гидроксидов: чем активней металл, тем сильнее основание.
3) Электроотрицательность (ЭО на схеме) – способность атома притягивать к себе электроны (и свои, и чужие).
Электроотрицательность тесно коррелирует (соотносится) с неметаллическими свойствами и окислительной активностью. Это хорошо видно на схеме.
4) Радиус атома (РА на схеме) – расстояние между атомным ядром и самой дальней орбитой электронов в электронной оболочке атома.
Радиус атома тесно коррелирует (соотносится) с металлическими свойствами и восстановительной активностью. Это видно на схеме.
С радиусом атома связаны кислотные свойства бескислородных кислот: чем больше радиус атома, тем сильнее бескислородная кислота (HF<HCl<HBr<HI)
5) Энергия ионизации (ЭИ на схеме) – количество энергии, которое атом должен поглотить для освобождения электрона; образуется ион-катион (+ заряжен положительно).
Энергия ионизации коррелирует с электроотрицательностью: чем больше электроотрицательность, тем больше энергия ионизации.
Энергия ионизации и радиус атома связаны обратной зависимостью: чем больше радиус атома, тем меньше энергия ионизации.
6) Сродство к электрону (СЭ на схеме) – энергия, которая выделяется или поглощается в процессе присоединения электрона к свободному атому; образуется ион-анион (- заряжен отрицательно).
Сродство к электрону численно равно, но противоположно по знаку энергии ионизации: чем выше энергия ионизации, тем ниже энергия сродства к электрону (и наоборот).
7) Окислительная активность (О на схеме) – способность отбирать электроны у других атомов.
Окислительная активность коррелирует с неметаллическими свойствами и электроотрицательностью. Это видно на схеме.
8) Восстановительная активность (В на схеме) – способность отдавать валентные электроны (электроны внешнего уровня) другим атомам.
Восстановительная активность коррелирует с металлическими свойствами и радиусом атома. Это хорошо видно на схеме.
Схема изменения свойств по ПСЭ
NB! Схема касается только элементов главных подгрупп!!!
Для желторотиков – смотрим только элементы, расположенные в розовых и желтых клеточках
Все, о чем было сказано в сегодняшней статье, относится к важнейшим понятиям химии. В ОГЭ это представлено в заданиях 2 и 16.
Вы хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий, теоретического материала и познакомитесь с моими учениками, многие из которых уже давно закончили ВУЗы и, работая врачами, спасают наши с вами жизни.
На странице ВК я анонсирую свои публикации, вебинары, уроки, рассказываю и показываю решение задач и заданий, выкладываю новинки теоретического материала, конспекты и лекции (бесплатно). Добавляйтесь ко мне в друзья, и вы всегда будете в курсе всех событий, связанных с подготовкой к ЕГЭ, ДВИ, олимпиадам!
Полный каталог статей репетитора Богуновой В.Г. вы найдете на странице сайта Статьи репетитора
Подписывайтесь на YouTube-канал Репетитор по химии и биологии. Здесь ежедневно появляются новые вебинары, видео-уроки, видео-консультации, видео-решения.
Репетитор по химии и биологии кбн В.Богунова